№1. Общая характеристика строительных материалов
| Вид материала | Документы |
- Экзаменационные вопросы «материаловедение», 44.6kb.
- Наименование предприятия, местонахождение,, 82.32kb.
- Aging under artifical climatic factors, 175.45kb.
- Публичный отчет об образовательной и финансово-хозяйственной деятельности за 2006-2007, 450.4kb.
- Промышленность строительных материалов Производство строительных материалов и конструкций, 43.6kb.
- Конкурс Руководителям строительных, проектных, изыскательских организаций и предприятий, 21.12kb.
- Квалификационная характеристика бакалавра специальности, 82.77kb.
- Сводный нормативный правовой акт отраслевое тарифное соглашение по строительству, 401.11kb.
- Метод применяют для однородных строительных материалов, 132.18kb.
- Технический регламент Евразийского экономического сообщества «О безопасности зданий, 586.42kb.
рАЗДЕЛ №1. Общая характеристика строительных материалов
1. Состав и строение материалов
Вещества, из которых состоят материалы, обладающие формой и размерами, состоят из молекул наименьших частиц данного вещества, сохраняющих его состав. Молекулы, в свою очередь, состоят из атомов. Атомы различаются между собой по массе, способности соединяться с другими атомами, а также определенными качественными характеристиками, которые принято называть их химическими свойствами. Они остаются электрически нейтральными, но в центре атома находится ядро, в котором сосредотачивается его основная масса. Ядро имеет положительный заряд, в то время как окружающие его электроны отрицательный. Электроны вращаются вокруг ядра по своим орбитам.
Отдельные виды атомов с одинаковыми химическими свойствами называются химическими элементами. Они могут быть как свободными, так и соединенными в молекулах.
Хим. элементы могут образовывать простые вещества (металлы и металлоиды), если их молекулы состоят из атомов одного химического элемента, и сложные вещества, если их молекулы состоят из атомов разных химических элементов. Среди сложных веществ, встречающихся при образовании строительных материалов, наиболее распространены оксиды (молекулы состоят из атомов кислорода и другого элемента), основания (молекулы состоят из атома металла и связанных с ним гидроксильных групп ОН), кислоты (в молекулах содержатся атомы водорода, способные замещаться атомами металлов) и соли (молекулы состоят из атомов металла и кислотных остатков).
Различные атомы и их скопления (ансамбли) под влиянием действия разных типов связей ионных, ковалентных, молекулярных, водородных и металлических образуют различные материалы. В чистом виде эти связи встречаются редко, как правило, налагается от двух и более видов.
В результате таких объединений образуется либо упорядоченная структура кристалла, либо неупорядоченная структура аморфного тела.
Кристаллическими называют тела, в которых атомы (или молекулы) расположены в правильном геометрическом порядке, причем этот общий порядок соблюдается как для атомов, расположенных в непосредственной близости друг от друга, так и на значительном расстоянии (дальний порядок).
Каждому типу связи соответствует свой характерный тип кристаллической решетки: ионная; молекулярная, или поляризационная, формирующаяся с помощью сил Ван-дер-Ваальса; атомная с резко выраженной в решетке ковалентной связью; металлическая или решетка с водородными связями.
Особенностью твердых тел является взаимозависимость положений соседних атомов с ближним и дальним порядками. В кристаллических решетках дальний порядок распространяется на большие области, а ближний порядок на окружение данного атома. Атомы и молекулы вещества стремятся занять такое положение относительно друг друга, чтобы силы их взаимодействия оказались максимально уравновешены. Такой геометрически правильный и повторяющийся в пространстве порядок расположения атомов (молекул) называют кристаллической решеткой. Атомы в кристалле располагаются так, что одна и та же конфигурация повторяется через равные интервалы во всех трех измерениях. Такая повторяющаяся конфигурация образует элементарную ячейку кристалла, совокупность которых в свою очередь создает пространственную решетку.
У твердых тел имеются значимые признаки их кристалличности: определенная температура плавления; определенная геометрическая форма кристаллов, которая остается характерной для данного вещества; анизотропия, т.е. неодинаковость свойств в различных направлениях.
Одно и то же кристаллическое вещество может находиться в различных формах (модификациях) существования кристаллов т.н. полиморфизм. Полиморфизм вызывает изменение свойств при сохранении состава вещества, что лишний раз указывает на важнейшую роль структур в становлении качества материалов (например, алмаз и графит).
Аморфными называют тела, в которых только ближайшие друг к другу атомы находятся в более или менее упорядоченном расположении; дальний же порядок отсутствует.
Беспорядочное расположение атомов и молекул в аморфных телах усложняет изучение их структуры. О ней нередко судят по косвенным показателям. Так, например, аморфные вещества при нагревании способны плавиться постепенно, не имея определенной температуры плавления; они обладают изотропностью, т.е. одинаковыми свойствами во всех направлениях.
Различие в строении кристаллических и аморфных веществ определяет различие в их свойствах. Так, аморфные вещества, обладая нерастраченной внутренней энергией кристаллизации, химически более активны, чем кристаллические такого же состава. Аморфное строение имеют также горные породы, применяемые в качестве активных минеральных добавок к цементам (туфы, пемзы и т.д.).
Кристаллическое и аморфное строение нередко может быть присуще одному и тому же веществу, например кристаллический кварц (кристобалит) и кварцевое стекло имеют общий химический состав SiO2. При быстром охлаждении расплавленного кварца затвердевание происходит без кристаллизации с сохранением хаотического расположения атомов и некоторого запаса внутренней энергии. В результате образуется аморфное вещество кварцевое стекло.
На качественные характеристики материала, именуемые его свойствами, оказывают влияние его вещественный состав и особенности строения структуры. Знание закономерностей их взаимосвязи со свойствами позволяет обеспечить получение необходимых показателей качества строительных материалов.
Структурой, или внутренним строением строительных материалов называют пространственное расположение частиц различной степени дисперсности с совокупностью устойчивых взаимных связей и порядком сцепления их между собой. Кроме того, в понятие структуры входит расположение пор, капилляров, микротрещин и других структурных элементов.
Под микроструктурой подразумеваются расположение, взаимоотношение и взаимосвязь различных по размеру атомов, ионов и молекул, из совокупности которых слагаются различные вещества в твердом, жидком и газообразном состояниях.
В зависимости от характера связей контактируемых частиц однородные микроструктуры делят на коагуляционные, конденсационные и кристаллизационные.
Коагуляционными называют структуры, в образовании которых участвуют сравнительно слабые силы молекулярного взаимодействия между частицами ван-дер-ваальсовы силы сцепления, действующие через прослойки жидкой среды.
Конденсационными называются структуры, возникающие при непосредственном взаимодействии частиц, или под влиянием химических соединений в соответствии с валентностью контактирующих атомов, или под влиянием ионных и ковалентных связей.
Кристаллизационными (или кристаллическими) называют структуры, образовавшиеся путем выкристаллизовывания твердой фазы из расплава или раствора и последующего прямого срастания отдельных кристаллов в прочный их агрегат, в том числе под влиянием химических связей.
Микроструктура и кинетика ее изменения изучаются с помощью оптических методов, электронной микроскопии, дифференциально-термического анализа, рентгенографии и др.
Определенный объем в микроструктуре занимают поры: замкнутые или сообщающиеся, либо и те и другие вместе. По своему размеру они бывают мелкими, до 1-210-7 см и, как правило, замкнутыми, но могут быть и более крупными после, например, испарения капиллярной влаги с размером в до 5 мкм.
Макроструктура различима невооруженным глазом. Для наиболее распространенных строительных материалов с конгломератным типом структуры она образована совмещением микроструктуры и грубодисперсных частиц заполнителя, а также в ней содержится капиллярно-поровая часть.
Структурные характеристики получаемого материала, например толщины пленок среды, содержание пор и их размер и др., изменяются при разных технологиях. Так, макроструктура прессованных изделий отличается от получаемых при литьевой технологии из одинаковых по качеству компонентов; микроструктура вяжущей части изделий после твердения в обычных условиях на воздухе отличается от образующейся при твердении в условиях повышенных давлений и температур.
Существенным является разделение структур строительных материалов на оптимальные и неоптимальные.
Оптимальной называют структуру, если
1) частицы в ней распределены равномерно по объему (фазы, компоненты, поры и др.);
2) отсутствуют или содержится мало дефектов как концентраторов напряжений или аккумуляторов агрессивной среды;
3) имеется непрерывная прослойка вяжущего вещества в виде пространственной сетки, или матрицы при минимальном отношении с/ф, именуемым условно фазовым. Последнее выражает усредненную толщину прослойки или пленки среды (с), распределенной по поверхности (S) частиц твердой фазы (ф), имеющей определенную удельную поверхность (Sуд).
В тех случаях, когда в материале нет вяжущей прослойки, условием оптимальности структуры служит наибольшая поверхность контактирования частиц твердой фазы.
Желательным, является признак оптимальности по наибольшей плотности упаковки твердых частиц. Последнее условие предопределяет наибольшую экономичность материала оптимальной структуры. Не всегда изделие обладает одинаковой оптимальной структурой материала во всех частях, например, поверхностный слой может отличаться от внутренней части по своей структуре (и по качеству).
Неоптимальными называют структуры, которые не удовлетворяют хотя бы одному из вышеуказанных обязательных условий оптимальности.
Оптимальным структурам соответствуют улучшенные показатели качества материалов по сравнению с неоптимальными. Это улучшенное качество обусловлено повышенной плотностью, минимальным количеством жидкой среды, повышенной концентрацией твердой, например, кристаллической фазы, минимумом объема пор в контактных зонах и рядом других причин, особенно энергетического характера, поскольку при оптимальных структурах свободная энергия Гиббса и энергия Гельмгольца становятся минимальными.
Экономически целесообразно получать такое строение материала, при котором структура оказывается не только оптимальной, но и рациональной. К последним относят оптимальные структуры, при которых материал в полной мере соответствует заданным показателям качества в реальных условиях производства.
В зависимости от химического состава различают органические и неорганические вещества.
Органические вещества представляют собой соединения углерода с другими элементами (преимущественно водородом, кислородом и азотом). Можно считать, что все органические вещества ведут свое начало от продуктов фотосинтеза растений (глюкозы, крахмала и т.д.), т.е. все органические вещества представляют собой не окисленные как минеральные (каменные) вещества, а восстановленные вещества, аккумулировавшие энергию солнца и отдающие ее при окислении (горении либо гниении).
Среди строительных материалов из органических веществ чаще всего применяется древесина и битум. В XX в. появились и быстро завоевали прочные позиции полимерные материалы, синтезируемые из продуктов переработки нефти, угля и т.п.
Недостатки органических веществ:
под действием ультрафиолетовых лучей они
способны окисляться кислородом воздуха;
большинство органических соединений горючи при температурах выше 200...300°С;
при развитии на них грибов или микроорганизмов происходит гниение этих материалов.
Положительные свойства органических материалов:
невысокая плотность;
относительно высокая прочность;
легкость обработки.
Неорганические вещества, применяемые в строительстве (керамика, природный камень и т.д.), представляют собой соединения уже окисленных химических элементов в основном оксидов кремния и алюминия с оксидами металлов. Будучи уже в окисленном состоянии, они не способны окисляться, т.е. гнить и гореть. В этом отношении они устойчивее (долговечнее) органических веществ. Однако их переработка в изделия, как правило, более трудоемка и энергоемка, чем переработка органических материалов.
2. Силикаты. Диаграммы состояния
основных силикатных систем
Около четверти всех минералов относится к силикатам. Земная кора на девять десятых состоит из силикатов. На основании многочисленных рентгено-структурных исследований установлено, что основу структуры силикатов составляет скелет из кремнекислородных групп тетраэдров с очень сильными связями SiO (рис. 1).

Рис. 1. Кристаллическая структура силикатов
Почти во всех изученных структурах кремний окружен четырьмя атомами кислорода. Форма и размеры кремнекислородного многогранника фактически постоянны в различных структурах.
Сила связей SiO настолько велика, что четыре атома кислорода, окружающих кремний, располагаются в вершинах тетраэдра. Расстояние между атомами кремния и кислорода составляет около 1,6 , а между атомами кислорода, образующими один тетраэдр 2,7 . (1 = 10-10 м).
Во многих силикатах кремний в той или иной степени может замещаться алюминием либо другими элементами. При этом в минерале изменяется соотношение между кремнием и кислородом. Наиболее часто помимо кремния в силикатах встречаются следующие химические элементы: Li, Na, K, Be, Mg, Ti, Ca, Zr, Mn, Fe, Zn, B, Al, F и группы ОН.
Широко распространены силикаты как технические продукты: керамика, огнеупоры, стекло, цемент, ситаллы.
Природные и технические силикаты в основном находятся в двух агрегатных состояниях твердом (кристаллическом или аморфном) и жидком. В обычных условиях силикаты находятся в твердом состоянии.
Жидкое состояние возникает в процессе синтеза технических продуктов в условиях высоких температур и при вулканической деятельности.
При обычных условиях (рис. 2) наиболее устойчивой формой силикатов является -кварц, который при 573С быстро переходит в -кварц. Переход -кварца в тридимит совершается очень медленно с применением минерализаторов. Для перехода от структуры кварца к структуре тридимита необходимо выпрямление связи SiOSi до 180и поворот одного тетраэдра относительно другого при котором разрывается ¾ связей SiO. -тридимит устойчив в интервале 870-1470С. При 1470С -тридимит переходит в -кристобалит, который устойчив в и интервале 1470-1728С. -тридимит имеет наименьший КЛТР (3010-7 град-1) по сравнению с другими модификациями.
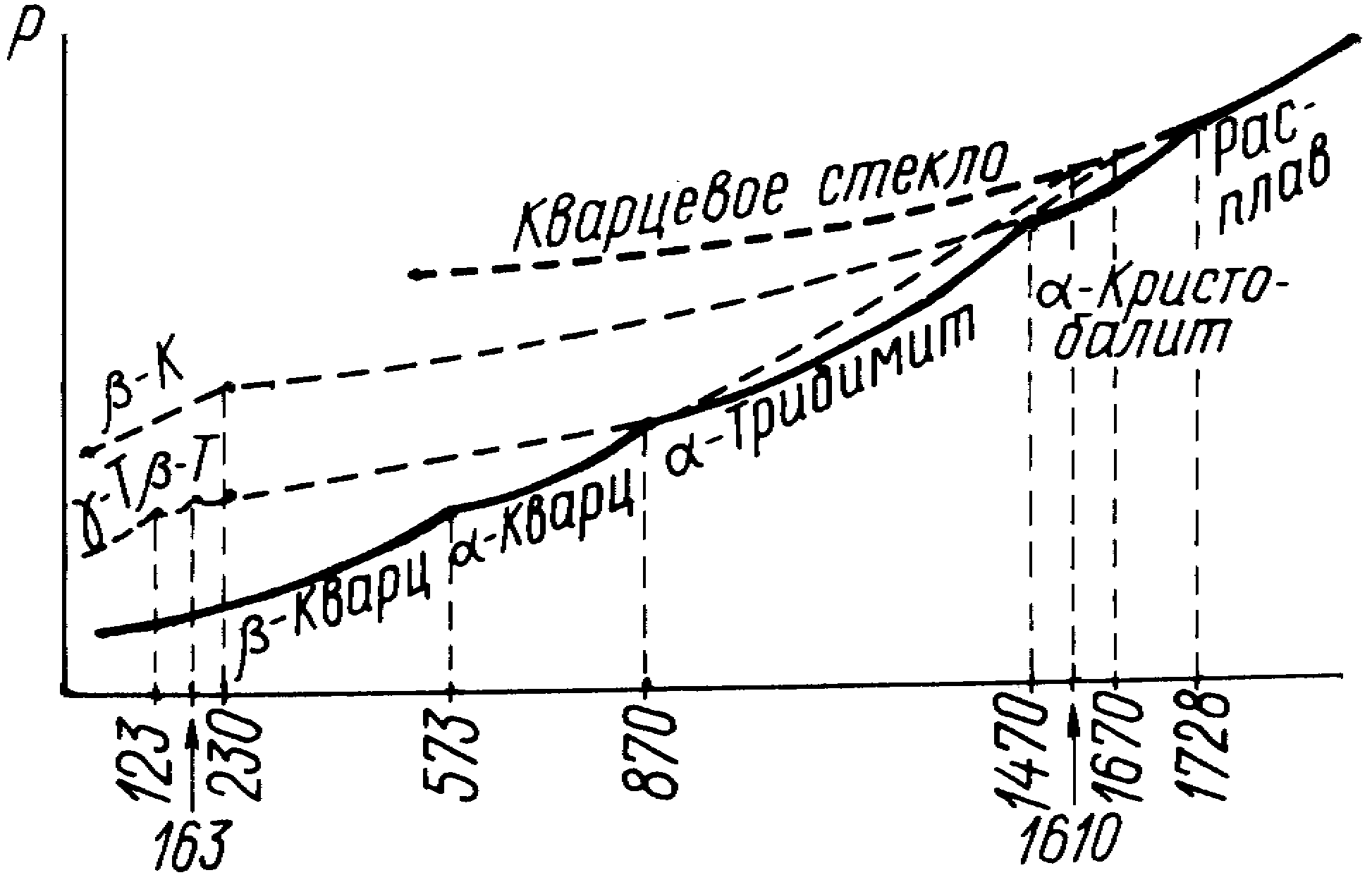
Рис. 2. Схематическая диаграмма состояния SiO2 для основных модификаций
Система Na2OSiO2 (рис. 3) играет важную роль в технологии получения натриевосиликатных стекол и в производстве натриевого растворимого стекла. В системе образуются три химических соединения:
- дисиликат натрия Na2O2SiO2;
- метасиликат натрия Na2OSiO2;
- ортосиликат 2Na2OSiO2.
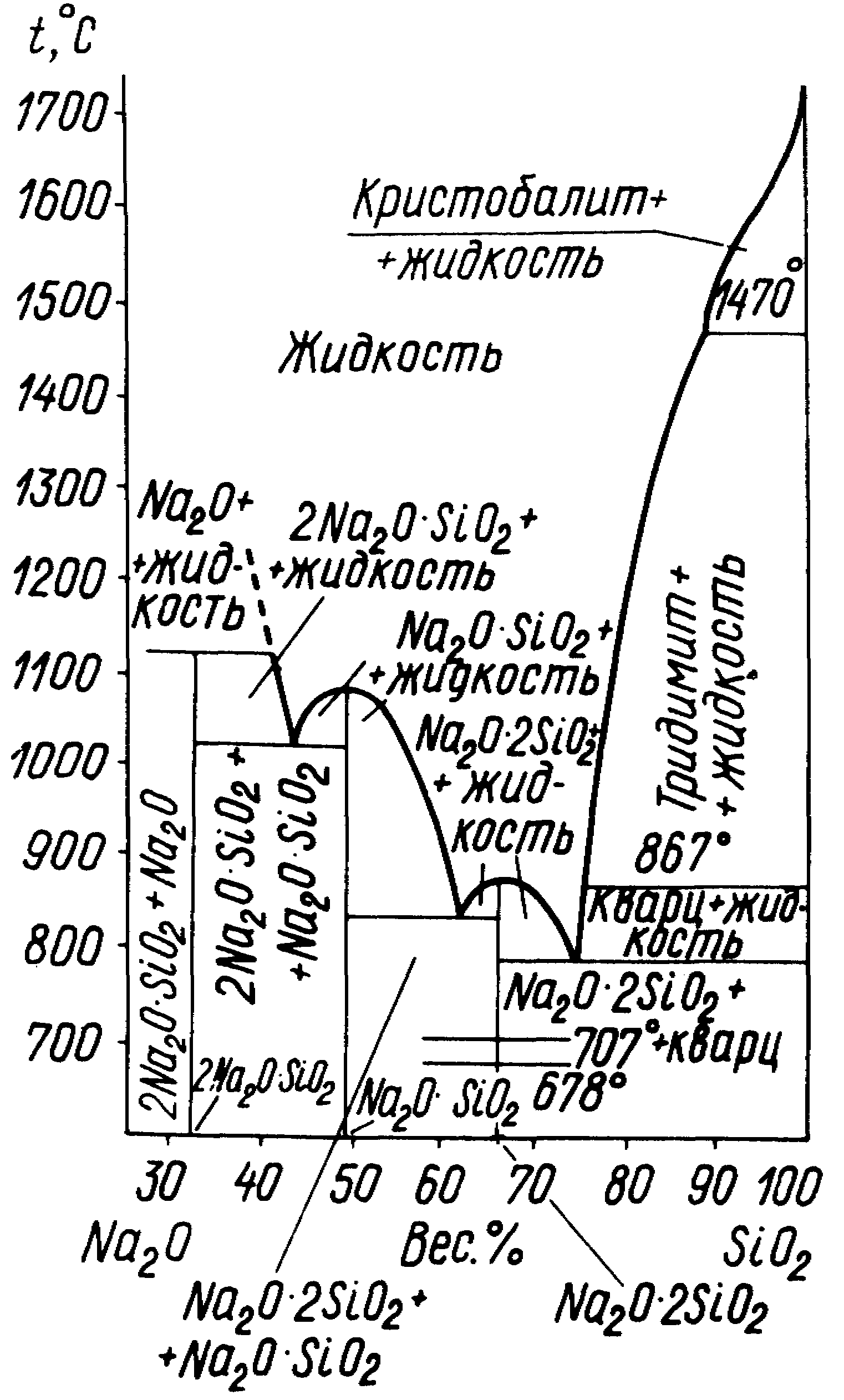
Рис. 3. Диаграмма состояния системы Na2OSiO2
Натриевое растворимое стекло стеклообразный силикат натрия переменного состава Na2OnSiO2, где n модуль растворимого стекла. Он изменяется от 1 до 3,5-4. Получают в виде прозрачных стеклообразных кусков (силикат-глыба) или в виде водного раствора жидкого стекла. Растворимость жидкого стекла зависит от величины модуля. Чем выше модуль, тем труднее стекло растворяется в воде, но тем выше вязкость раствора. Силикат-глыбу растворяют в автоклавах под давлением 0,3-0,8 МПа.
Жидкое стекло используют в качестве связующего при изготовлении жаро- и кислотостойких замазок, цементов, бетонов, быстросохнущих формовочных смесей в литейном производстве и как разжижитель в керамической промышленности при помоле шликерных масс.
Система MgOSiO2 (рис. 4) имеет большое значение для производства магнезиальных огнеупоров, а также в технологии радиокерамических изделий.
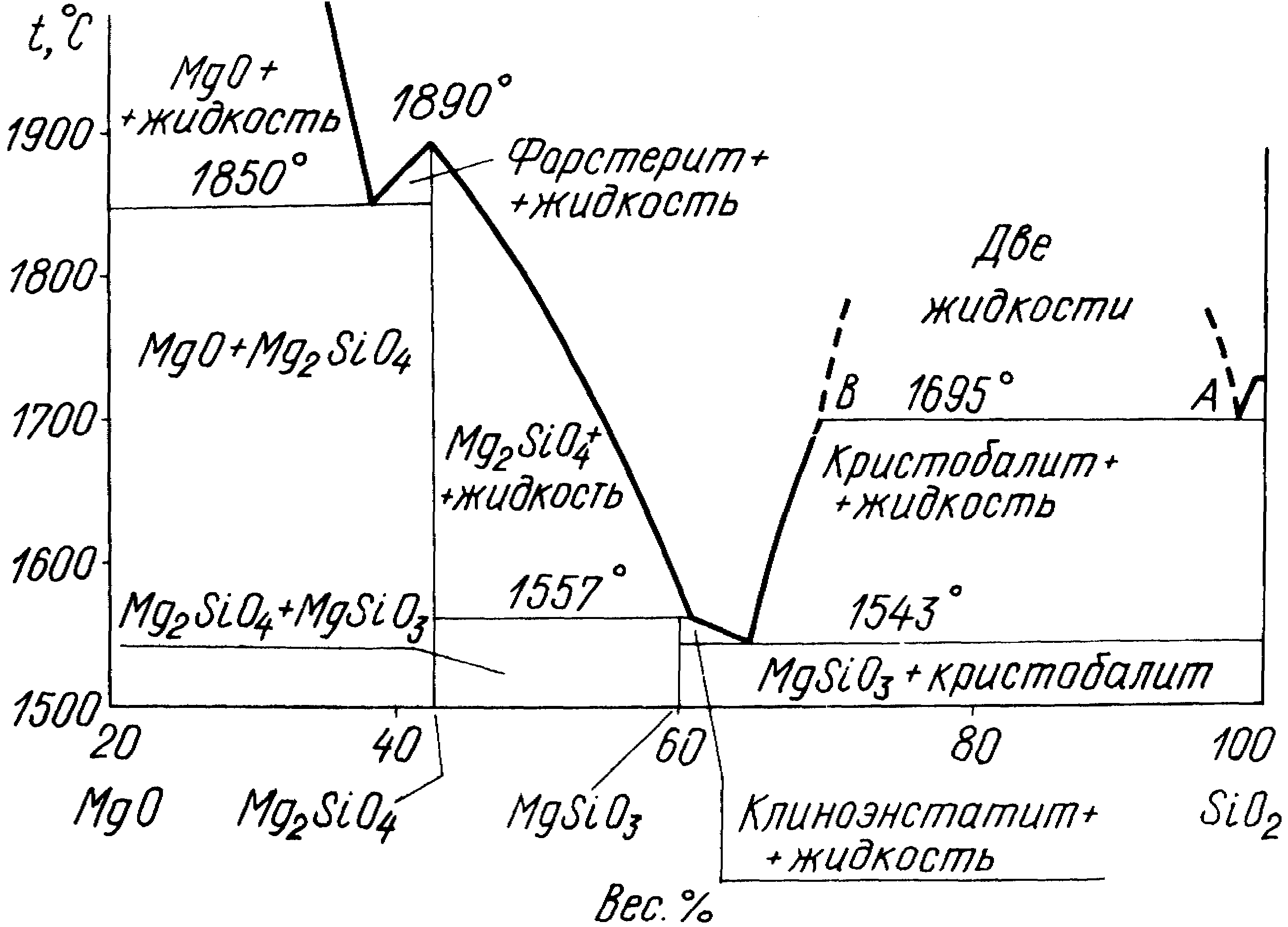
Рис. 4. Диаграмма состояния системы MgOSiO2
В системе образуется два соединения: метасиликат Mg2OSiO2 и ортосиликат магния 2MgSiO2. Смеси системы чрезвычайно огнеупорны. Ликвидус не опускается ниже 1543С, а в высокомагниевой части 1860С. На основе этой системы производятся огнеупорные и диэлектрические материалы (форстериты и т.д.).
Система CaOSiO2 (рис. 5) имеет исключительное значение для технологии цемента, а также доломитовых огнеупоров. Могут образовываться четыре химических соединения: CaОSiO2; 3CaО2SiO2; 2CaОSiO2 белит и 3CaОSiO2 алит.
Двухкальциевый силикат белит и трехкальциевый силикат алит важнейшие минералогические составляющие цементного клинкера. Алит обладает высокой гидравлической активностью. Его химическая активность повышается с увеличением дефектов структуры, обусловленных наличием примесей. Белит является важной составляющей водоустойчивых доломитовых и магнезиально-доломитовых огнеупоров.
Существует три модификации 2CaОSiO2 , и . 2CaОSiO2 практически не обладает вяжущими свойствами. Поэтому необходимо быстрое охлаждение клинкера для сохранения 2CaОSiO2 в -модификации без перехода в -форму.
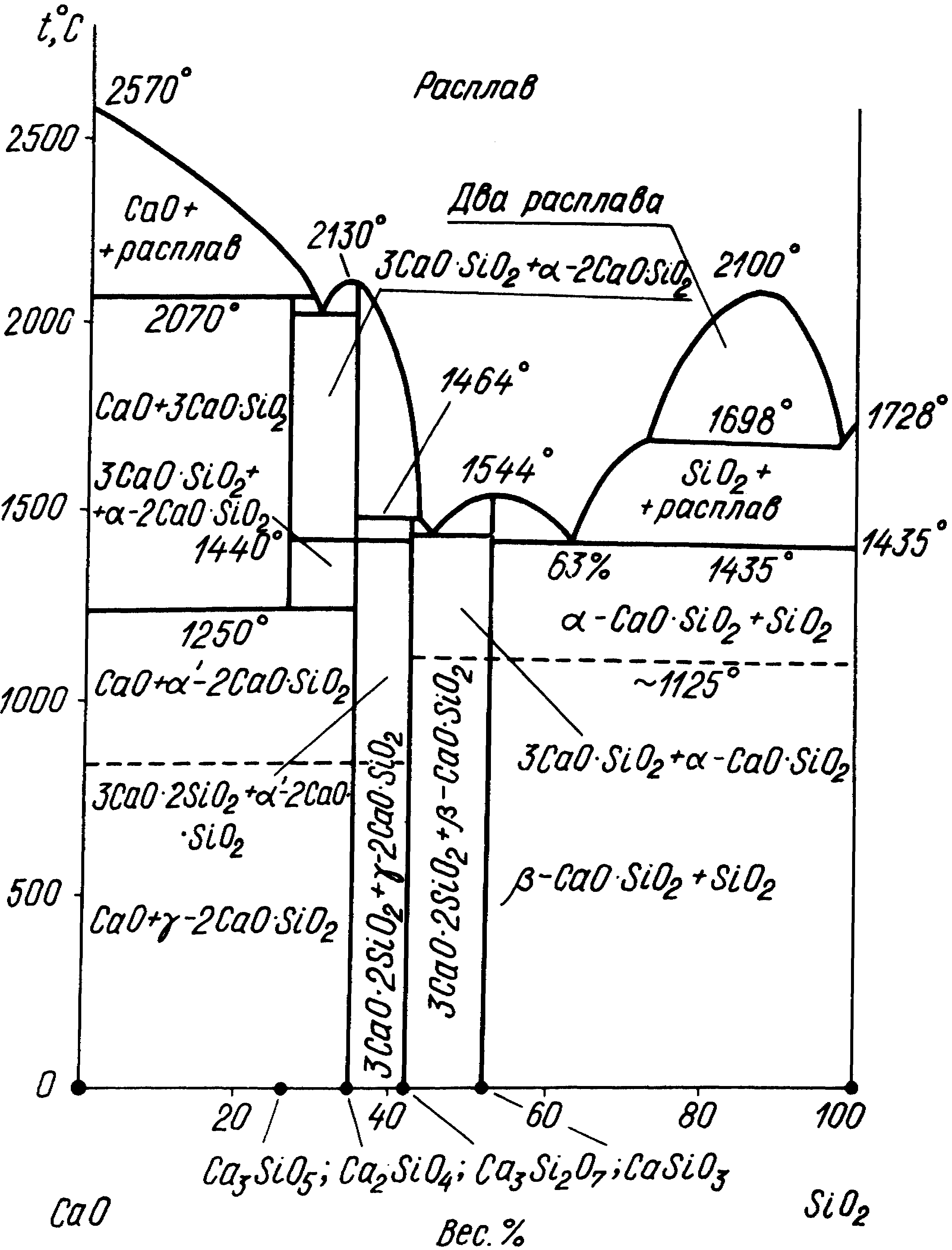
Рис. 5. Диаграмма состояния системы СаOSiO2
Алит основной носитель прочности. Он схватывается в течение скольких часов и довольно быстро наращивает прочность. Через месяц алит гидратируется примерно на 70-80 %. Белит не имеет определенных сроков схватывания и при затворении водой твердеет очень медленно. Через 1-2 года гидротированый белит становится прочнее алита.
Система Al2O3SiO2 (рис. 6) играет большую роль в производстве наиболее широко используемых огнеупоров различного состава и назначения. В системе образуется только одно химическое соединение муллит 3Al2O3SiO2. Муллит плавится при температуре 1850С. В системе образуется две эвтектики: между муллитом и оксидом кремния (92,5 % SiO2) с температурой плавления 1595С и между муллитом и оксидом алюминия (22,5 % SiO2) с температурой плавления 1840С.
В смесях, содержащих менее 72 % Al2O3 устойчивыми твердыми фазами являются муллит и кремнезем, а выше 72 % Al2O3 муллит и корунд.
Муллит характеризуется высокой огнеупорностью, механической прочностью и химической устойчивостью по отношению к кислотам и щелочам. На его основе получают плавленнолитые муллитовые огнеупоры. Их производят из глинозема с добавлением каолина, огнеупорной глины и кварцевого песка. Содержание SiO2 составляет 25-27 %. Широкое применение находят муллитовая и муллитокорундовая электроизоляционная керамика. Она имеет одну кристаллическую фазу муллит. Муллит входит в состав изделий тонкой керамики фарфора и фаянса.
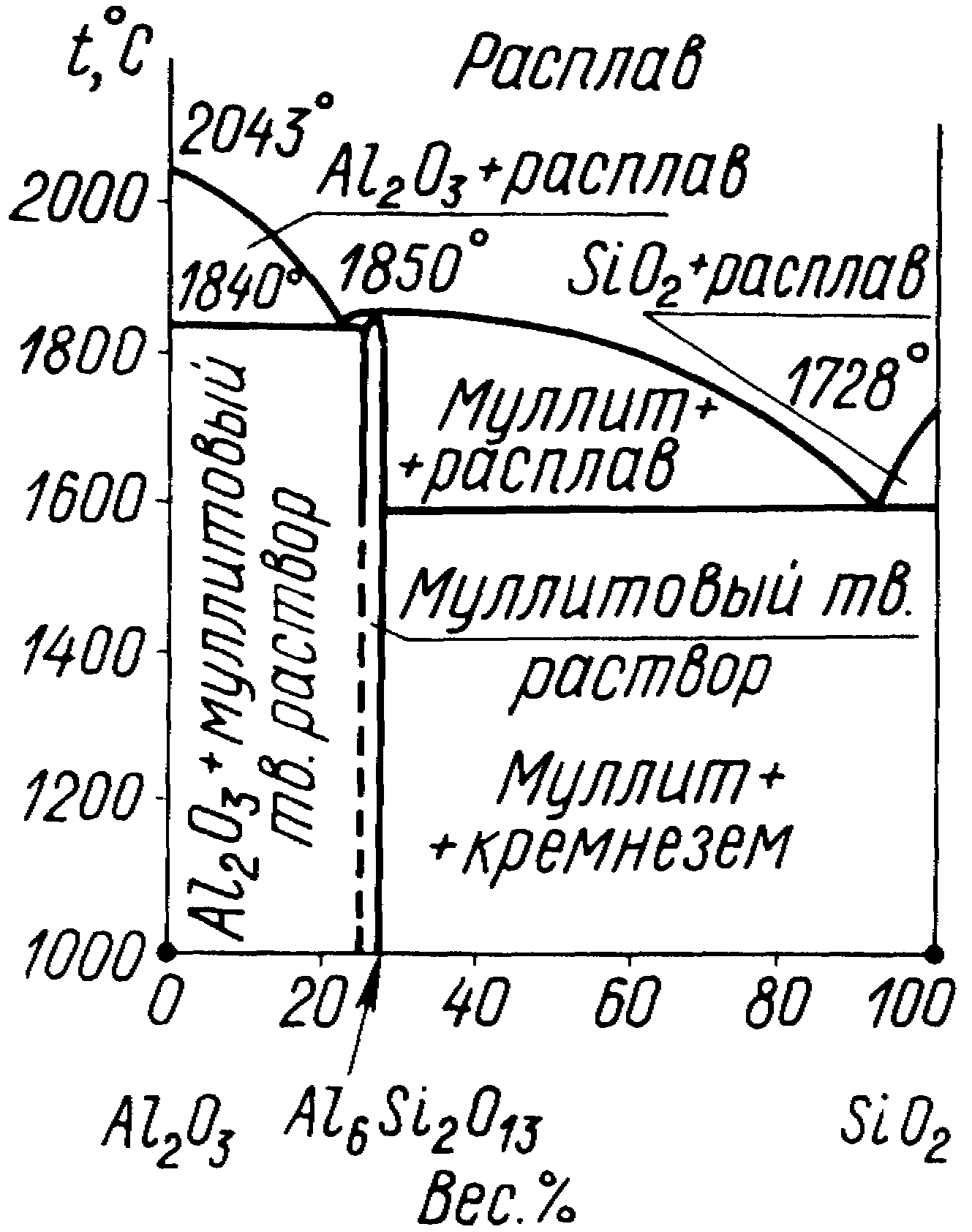
Рис. 6. Диаграмма состояния системы Al2O3SiO2
Система ZrO2SiO2 (рис. 7) имеет большое значение в производстве цирконий содержащих огнеупоров и эмалей.
В системе образуется одно химическое соединение метилсиликат циркония ZrSiO4 (циркон). Его плотность составляет 5700 кг/м3.
При изготовлении изделий для образования твердых растворов вводят добавки CaO в количестве 0,005-0,007 массовой доли. До 200С ZrO2 не реагирует с металлами, на него не действуют едкие щелочи и кислоты (за исключением серной и фторной).
Из диоксида циркония изготавливают цирконевую керамику. Изделия обжигают при температуре 1700-2500С. Температура использования цирконевой керамики 2300-2500С. Она используется в основном в стекольной промышленности.
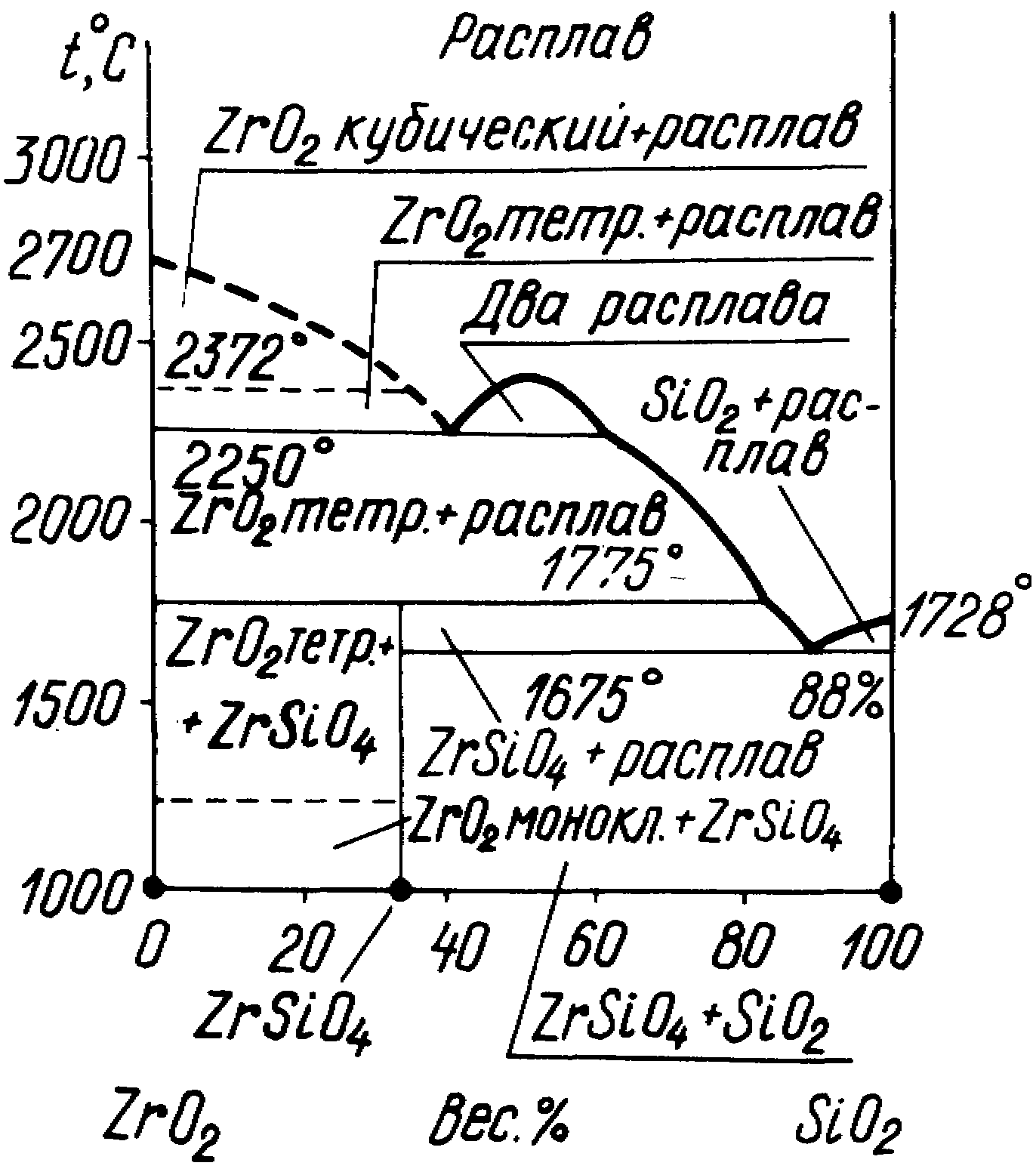
Рис. 7. Диаграмма состояния системы ZrO2SiO2
3. Дефекты кристаллической решетки
Отклонения в строении реальных кристаллов по сравнению с идеальными называются дефектами кристаллической решетки. Они оказывают большое влияние на свойства веществ и во многих случаях обуславливают проявление особых свойств не присущих кристаллам со структурой близкой к идеальной.
Различают дефекты грубого и тонкого строения кристаллов.
На молекулярном уровне различают дефекты по Шоттки, Френелю и т.н. твердые растворы (рис. 8 и 9).

Рис. 8. Дефекты кристаллической решетки по Френкелю (а) и Шоттки (б)
Дефекты по Шоттки (рис. 8а) образуются при перемещении отдельных ионов на поверхность кристалла и возникновения незанятого узла-вакании. При этом электронейтральность решетки в целом сохраняется (концентрации анионных и катионных вакансий в кристалле примерно одинакова).
Дефекты по Френкелю (рис. 8б) создаются при перемещении ионов из узла кристаллической решетки в междуузлие. Такие дефекты создаются в основном катионами, т.к. они по размеру меньше анионов и легче перемещаются. Дефекты по Френкелю состоят из равного количества вакантных узлов решетки и атомов в междуузлиях. При образовании дефектов этого типа энергия кристаллической решетки возрастает, но в тоже время увеличивается и энтропия (т.е. степень беспорядка).
В реальном кристалле сосуществуют дефекты обоих типов. Поэтому замещение вакансий и перескоки атомов по междуузлиям могут осуществляться параллельно. Повышение температуры приводит к увеличению числа дефектов.
Твердые растворы (рис. 9) образуются при наличии в основном веществе примесей.
Различают три типа твердых растворов:
- замещения (рис. 9а) ионы основного вещества замещаются ионами примесей;
- внедрения (рис. 9б) атомы или ионы примеси внедряются в междуузлия кристаллической решетки основного вещества;
- вычитания (вакантнсий) (рис. 9в) узлы кристаллической решетки не заняты ионами основного вещества.

Рис. 9. Твердые растворы
Наиболее распространенными в технологии стройматериалов являются растворы замещения. Наличие дефектов имеет исключительное значение для таких процессов, как реакции в твердом состоянии, спекание, механоактивационные процессы и т.д.
4. Основные свойства строительных
материалов
4.1. Механические свойства
Характеризуют способность материала сопротивляться действию внешних сил или других факторов, вызывающих в нем внутренние напряжения.
Определяются следующими факторами:
- веществом, его структурой и свойствами;
- конструкционными особенностями элемента размерами, формой, наличием концентраторов, состоянием поверхности;
- условиями при нагружении температурой, скоростью, повторяемостью нагрузки и т.д.
Прочность способность материала противостоять разрушению под воздействием внешних сил, вызывающих в нем внутренние напряжения. Прочность материала характеризуется пределом прочности (напряжением в образце в момент разрушения) при трех видах воздействия: сжатии, изгибе и растяжении.
Предел прочности материала определяют на образцах, форму и размеры которых установлены стандартами на этот материал.
Упругость способность материала после деформирования под воздействием каких-либо нагрузок принимать после их снятия первоначальную форму и размеры.
Наибольшее напряжение, при котором материал еще обладает упругостью, называется пределом упругости.
Пластичность свойство материала изменять под нагрузкой форму и размеры без образования разрывов и трещин и сохранять изменившиеся форму и размеры после снятия нагрузки. Это свойство противоположно упругости.
Твердость способность материала сопротивляться проникновению в него другого, более твердого тела.
Хрупкость свойство материала мгновенно разрушаться под действием внешних сил без заметной пластичной деформации. Хрупкие материалы: кирпич, природные камни, бетон, стекло и т.д.
Сопротивление удару способность материала противостоять разрушению под действием ударных нагрузок.
Истираемость свойство материала сопротивляться истирающим воздействиям. Истираемость материала характеризуется величиной потери первоначальной массы, отнесенной к 1 м2 площади истирания.
Одновременное воздействие истирания и удара характеризует износостойкость материала.
4.2. Физические свойства
Характеризуют особенности физического состояния материалов.
Плотность степень заполнения твердым веществом единицы объема материала, кг/м3.
Различают истинную и кажущуюся (среднюю) плотности.
Истинная () масса единицы объема материала в абсолютно плотном состоянии (без пор и пустот). Постоянная характеристика (физическая константа), которая не может быть изменена, как средняя плотность материала, без изменения его химического состава или молекулярной структуры.
Средняя плотность (т) (удельный вес) вес единицы материала в его естественном состоянии или в том виде, в каком он будет применяться в строительстве (вместе с порами и пустотами, при определенной влажности).
Насыпная плотность отношение массы материала в насыпном состоянии к его объему. Насыпную плотность определяют для сыпучих материалов (песка, щебня, цемента и т.д.). В ее величине отражается не только влияние пор в каждом зерне или куске, но и межзерновых пустот в рыхлонасыпном объеме материала.
Для ряда простых технических расчетов определяют коэффициент плотности kпл, характеризующий степень заполнения объема материала веществом:
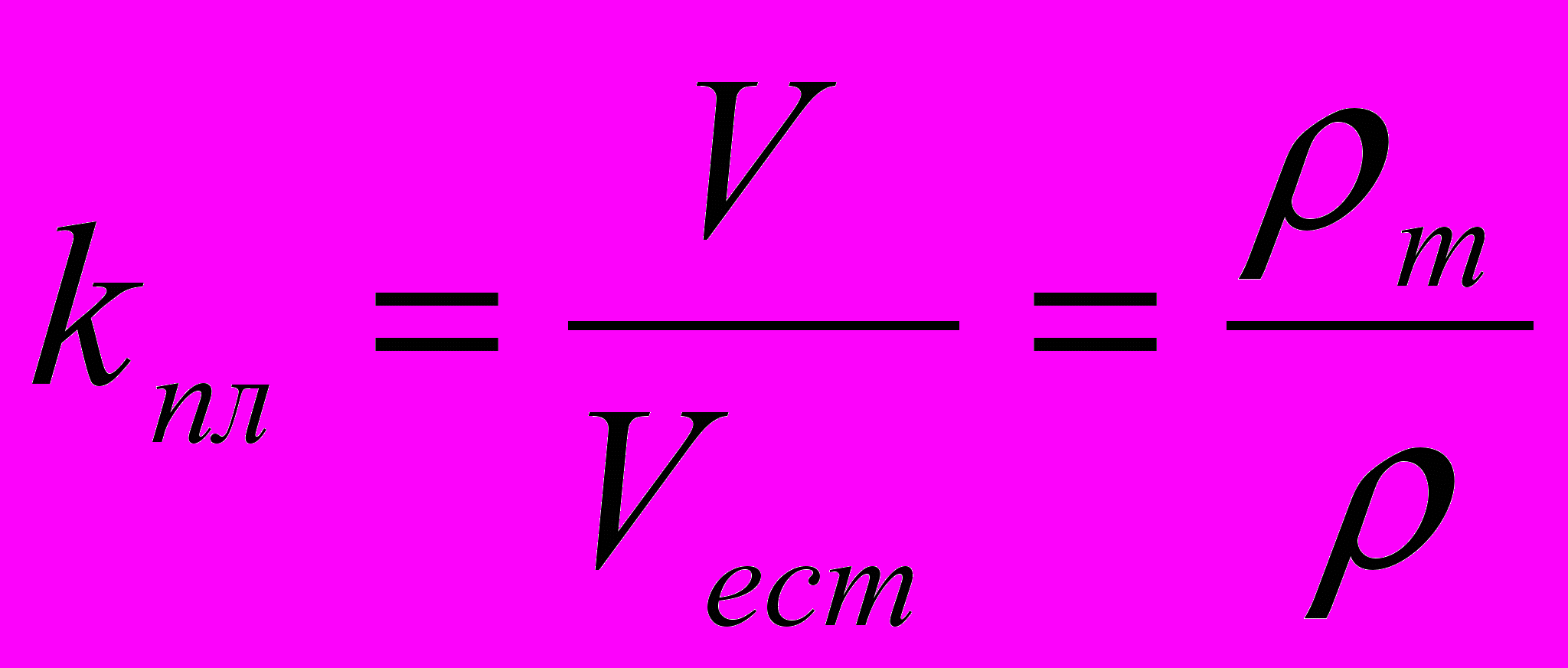 , массовые доли, или
, массовые доли, или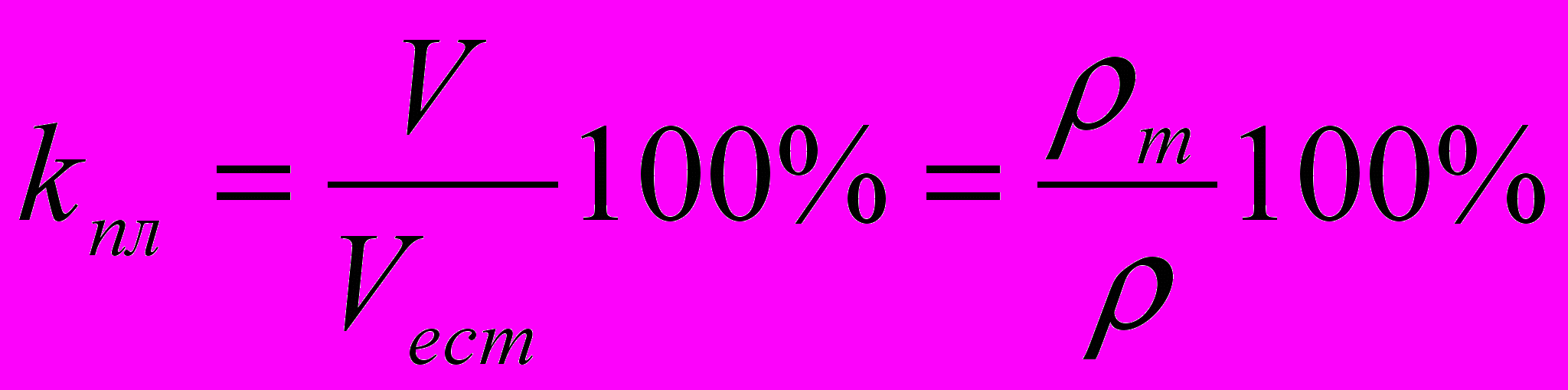 , %.
, %.Пористость объем содержащихся в материале пор (мелких ячеек, заполненных воздухом или газом), выраженный в процентах к общему объему материала. Например, пористость гранита составляет 1 %, пористость минеральной ваты 90%.
Пористость и плотность взаимосвязанные понятия. Их величины, выраженные в процентах, суммарно составляют для каждого материала 100 %.
Пустотность наличие воздушных полостей в материале (например, в пустотелом кирпиче). Пустотность песка и щебня составляет 35-45 %, пустотелого кирпича - 15-50%.
Водопоглащение свойство материала поглощать и удерживать воду при непосредственном с ней соприкосновении. Характеризуется количеством воды, поглощаемой сухим материалом, погруженным полностью в воду, и выражается в процентах от массы (водопоглощение по массе) или отнесенное к его объему водопоглощением по объему.
Влагоотдача свойство, характеризующее скорость высыхания материала при наличии условий в окружающей среде (понижение влажности, нагрев, движение воздуха). Влагоотдача характеризуется количеством воды, которое материал теряет за сутки при относительной влажности воздуха 60 % и температуре 20°С. В естественных условиях вследствие влагоотдачи, через некоторое время после окончания строительных работ, устанавливается равновесие между влажностью строительных конструкций и окружающей средой. Такое состояние равновесия называют воздушно-сухим или воздушно-влажным равновесием.
Влажность содержание влаги в материале в данный конкретный момент, отнесенное к единице массы материала в сухом состоянии.
Морозостойкость способность насыщенного водой материала выдерживать многократное попеременное замораживание и оттаивание без признаков разрушения и значительного снижения плотности.
