Экотоксикологическая оценка действия производных акридонового ряда на живые системы 03. 02. 08 экология (биология)
| Вид материала | Автореферат диссертации |
- 1. Биология как наука, ее достижения, связи с другими науками. Методы изучения живых, 864.83kb.
- Программа вступительного испытания по биологии I. Общая биология Биология наука о жизни, 106.26kb.
- Биология и экология газета «Биология» и сайт для учителя «Я иду на урок биологии», 162.29kb.
- Лекция 1 Предмет и структура естествознания Естествознание, 74.75kb.
- Фауна, биология и экология рода anopheles mg. (Сем. Culicidae) в прибрежных экосистемах, 1214.31kb.
- Программа вступительного экзамена в аспирантуру по специальной дисциплине 03. 02., 89.09kb.
- Обжд, экология, с/х, биология, география, 828.92kb.
- Программа вступительного экзамена по магистерской программе 020400. 68 «Биология», 279.78kb.
- Программа проведения вступительного испытания по предмету «биология» На экзамене, 800.29kb.
- Задачи дисциплины: выяснить экономическую сущность производных финансовых инструментов,, 15.58kb.
На правах рукописи
Горшенина Надежда Сергеевна
ЭКОТОКСИКОЛОГИЧЕСКАЯ ОЦЕНКА ДЕЙСТВИЯ ПРОИЗВОДНЫХ АКРИДОНОВОГО РЯДА НА ЖИВЫЕ СИСТЕМЫ
03.02.08 – экология (биология)
Автореферат диссертации на соискание ученой степени
кандидата биологических наук
Ульяновск 2011
Работа выполнена на кафедре экологии в Федеральном государственном бюджетном образовательном учреждении высшего профессионального образования «Саратовский государственный технический университет имени Гагарина Ю.А.»
| Научный руководитель: | доктор химических наук, профессор Губина Тамара Ивановна |
| Официальные оппоненты: | доктор биологических наук, профессор Шустов Михаил Викторович |
| | доктор биологических наук Антонюк Людмила Петровна |
| | |
| Ведущая организация: | Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Волгоградский государственный технический университет» |
Защита состоится « 24 » декабря 2011 г. в «10.00» часов на заседании диссертационного совета Д 212.278.07 при Федеральном государственном бюджетном образовательном учреждении высшего профессионального образования «Ульяновский государственный университет» по адресу: Набережная реки Свияги, 106, корп.1, ауд.703.
С диссертацией можно ознакомиться в библиотеке Ульяновского государственного университета, а с авторефератом: на сайте ВУЗа – http://ссылка скрыта и на сайте Высшей аттестационной комиссии при Министерстве образования и науки Российской Федерации – ссылка скрыта.
Отзывы на автореферат направлять по адресу: 432017, г. Ульяновск, ул. Л. Толстого, 42, Ульяновский государственный университет, Отдел послевузовского и профессионального образования.
Автореферат разослан «_____» _____________ 2011 г.
Ученый секретарь
диссертационного совета,
кандидат биологических наук С.В. Пантелеев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. В результате антропогенного воздействия биосфера загрязняется большим количеством химикатов, которые дестабилизируют экосистемы, влияют на здоровье человека. Это обуславливает необходимость постоянного экологического контроля объектов окружающей среды и экотоксикологической оценки вновь синтезированных химических соединений. Последняя включает в себя изучение, во-первых, эффектов воздействия вещества на биосистемы различных уровней организации (биологический аспект), во-вторых, химических превращений их в объектах окружающей среды (химический аспект).
Проведение экотоксикологических исследований особенно актуально в отношении веществ, предполагаемых к использованию в качестве пестицидов, которые, как известно, должны удовлетворять следующим требованиям (Мельников, Мельникова, 1997):
- обладать высокой эффективностью в борьбе с вредными организмами;
- проявлять низкую острую токсичность для человека, полезных животных и других организмов;
- при длительном воздействии не оказывать мутагенного, канцерогенного и тератогенного действия;
- обладать низкой персистентностью.
На практике немногие пестициды удовлетворяют всем вышеперечисленным требованиям, поэтому, активно ведется поиск новых средств защиты сельскохозяйственных культур. В последние годы выявлена высокая биологическая активность соединений акридинового ряда, на основе которых синтезированы эффективные антибактериальные, антигрибковые, противоопухолевые и другие препараты (Долгушин и др., 2009; Семениченко и др., 2005; Носков, 2002; Ляхова и др, 2003). Поскольку соединения названного ряда можно легко получить из доступного сырья, представляет научный и практический интерес исследовать возможность их применения в качестве средств защиты растений. Для этого необходимо определить спектр их биологического действия и экологическую безопасность.
Как известно, мишенью действия пестицидов могут быть растения (гербицидное или росторегулирующее действие) и фитопатогенные микроорганизмы (бактерицидное, фунгицидное действие) (Федоров, Яблоков, 1999). Оценку их опасности химикатов для экосистем обычно проводят с помощью биологических тест-объектов, как правило, инфузорий (Виноходов, 1995) и дафний (Филенко, 1998). Для определения острой токсичности традиционно используют лабораторных животных.
Поэтому, исследование характера воздействия соединений акридинового ряда, в частности, акридонов на представителей различных таксономических групп - растений, микроорганизмов, простейших, гидробионтов, млекопитающих и определения безопасности их применения для экосистем представляет важную и актуальную задачу экологии.
Цель и задачи исследования.
Целью исследования является определить характер биологического действия производных акридонового ряда на живые объекты различных таксономических групп и оценить безопасность их применения для экосистем.
В ходе реализации цели решались следующие задачи:
- Провести скрининг производных акридона в отношении ряда фитопатогенных микроорганизмов, и выявить наиболее перспективное для дальнейших исследований соединение.
- Исследовать росторегулирующее действие акридон-2-сульфокислоты и установить характер её воздействия на однодольные и двудольные культурные растения.
- С помощью экспериментальных данных и квантово-химических расчетов установить связь между биологической активностью и строением молекулы акридон-2-сульфокислоты.
- Определить токсическое действие акридон-2-сульфокислоты в действующих и сверхнизких концентрациях на тест-объекты: инфузории и дафнии.
- Определить острую токсичность акридон-2-сульфокислоты на белых беспородных крысах.
- Дать предварительную оценку мутагенной активности изучаемого соединения с помощью «ядрышкового теста».
Научная новизна. Проведен скрининг десяти соединений акридонового ряда и установлено, что акридон-2-сульфокислота (АСК) обладает высоким бактериостатическим, бактерицидным (относительно фитопатогенов) действием. Молекулу АСК отличает от остальных соединений этого ряда только высокое значение дипольного момента. Возможно, это обстоятельство предопределяет электростатическое удерживание молекулы вблизи рецептора, активного центра фермента и т.п., что обуславливает ее сравнительно высокую биологическую активность. Показано, что АСК в концентрациях меньше 8·10-3 г/л не оказывает токсического действия на инфузории, дафнии и млекопитающих. С помощью ядрышкого теста установлено, что АСК не обладает мутагенной активностью. Исследовано воздействие сверхнизких концентраций АСК на рост корней проростков одно- и двудольных растений. Показан немонотонный дозо-зависимый характер воздействия АСК и определены концентрации (8·1014 и 8·1016 г/л), оказывающие стимулирующее действие на ростовые показатели.
Научно-практическая значимость работы. Проведенные исследования показали, что АСК обладает высоким бактериостатическим, бактерицидным и росторегулирующим действием. При этом она не проявляет мутагенных свойств и обладает низкой токсичностью в отношении организмов различного уровня организации, что свидетельствует о возможности и перспективности ее практического использования при создании средств защиты растений. Изучение корреляции между биологической активностью и строением соединений акридонового ряда важно в плане направленного синтеза биологически активных веществ.
Работа выполнена на кафедре экологии Саратовского государственного технического университета имени Гагарина Ю.А.
Апробация работы. Основные результаты и положения работы представлены на конференциях: Международной школе-конференции «Актуальные аспекты современной микробиологии» (Москва, 2006), 3-й и 4-й Всероссийской научно-практической конференции «Экологические проблемы промышленных городов» (Саратов, 2007, 2009), Международной научной конференции «Актуальные проблемы экологической физиологии, биохимии и генетики животных» (Саранск, 2009), Международной научно-практической конференции «Вавиловские чтения - 2009», Всероссийской научно-практической конференции «Экология: синтез естественнонаучного, технического и гуманитарного знания» (Саратов, 2010), 1-й Всероссийской научно-практической конференции «Техногенная и природная безопасность» (Саратов 2011).
Публикации. По теме диссертации опубликовано 10 работ, из них 2 в изданиях, рекомендованных ВАК.
Личный вклад автора. Диссертантом выполнен весь объем экспериментальных работ, проведены обработка и анализ результатов, сформулированы положения, выносимые на защиту и выводы.
Структура и объём работы. Диссертация состоит из введения, 4 глав, выводов. Работа изложена на 128 страницах, содержит 16 рисунков, 27 таблиц и список литературы, включающий 176 источников, из которых 44 на иностранных языках.
Положения, выносимые на защиту:
1. Из десяти протестированных производных акридона максимальной бактериостатической и бактерицидной активностью в отношении фитопатогенных микроорганизмов обладает акридон-2-сульфокислота.
2. Акридон-2-сульфокислота оказывает ростостимулирующее действие в отношении однодольных и двудольных растений – под действием вещества в концентрациях 8·10-2-8·10-6 г/л рост корней проростков увеличивается в 1,5-2 раза.
3. Высокая бактерицидная и росторегулирующая активность акридон-2-сульфокислоты обусловлены наличием акридонового кольца, кислотными свойствами этого соединения и высоким дипольным моментом (полярностью) молекулы.
4. Акридон-2-сульфокислота в действующих (8·10-3 - 8·10-6 г/л) и сверхнизких (8·10-13- 8·10-17 г/л) концентрациях не оказывает токсического действия на инфузории и дафнии. LD50 вещества для белых беспородных крыс составляет 1800 мг/кг.
5 Акридон-2-сульфокислота в концентрациях 8·10-2-8·10-6 г/л не проявляет мутагенной активности.
СОДЕРЖАНИЕ РАБОТЫ
Во введении обосновывается актуальность исследования, его практическая и теоретическая значимость, формулируются основная цель и задачи исследования.
Глава 1. Воздействие пестицидов на окружающую среду и живые организмы. Перспективы использования производных акридона в качестве пестицидов (обзор литературы)
В данной главе на основании анализа отечественных и зарубежных источников литературы показано, что среди токсикантов наибольшую опасность представляют пестициды. Обсуждены основные классы используемых пестицидов, их трансформация в окружающей среде и организме человека. Приводится перечень требований к современным пестицидам в отношении их безопасности для человека и окружающей среды.
Обоснована возможность применения в качестве пестицидов соединений акридонового ряда, на основе которых синтезирован ряд практически полезных веществ, а также лекарственных препаратов, обладающих широким спектром действия. Соединения получают на основе доступного сырья, в результате простых и малостадийных методов синтеза. Все это указывает на перспективность их использования в качестве средств защиты растений.
Дана характеристика живых организмов, используемых в качестве тест-объектов для экологического контроля используемых соединений.
Глава 2. Материалы и методы
Исследования проводились с 2005 по 2010 гг. на кафедре экологии Саратовского государственного технического университета имени Гагарина Ю.А В работе использовались: растительные культуры (пшеница сорта «Алейская» (Triticum durum Desf), овес посевной (Avena sativa) , рожь посевная (Secale cereale), огурцы сорта «Парад» (Cucumis sativus L.), кабачки сорта «Ролик» (Cucurbita pepo var. giromontina), горох сорта «Глориоза» (Pisum sativum), лук репчатый (Allium cepa Liliaceae); культуры микроорганизмов: Xanthomonas campestris B-610, Pseudomonas syringae B-1546 и Erwinia carotovora subsp. atrullis – 603. Эксперименты по биотестированию проводились на тест-объектах инфузориях Stilonichia mytilus (Виноходов, 1995), дафниях Daphnia magna (Филенко, 1998). Острая токсичность определялась на белых беспородных крысах (Трахтенберг, 1991). Мутагенная активность - на клетках апикальной меристемы корней лука (Федоров и др., 2004).
Проведен скрининг десяти производных акридона для выявления их бактериостатического действия. Апробированы следующие соединения: акридон, акридон-2-сульфокислота (АСК), акридон-N-уксусная кислота (АУК), бутиловый эфир АУК, этиловый эфир АУК, сложный эфир АУК и полиэтиленгликоля, 1-карбоксиакридон, 3-карбоксиакридон, 4-карбокси-акридон, смесь изомеров 1- и 3-карбоксиакридонов.
Бактериостатическая активность акридона и его производных исследовалась на вышеперечисленных культурах фитопатогенных микроорганизмов. Опыты проведены с помощью метода диффузии в агар. Использовались водные растворы веществ в концентрации 0,01 моль/л. В качестве контроля был выбран антибиотик широкого спектра действия – офлоксацин. Бактериостатическая активность оценивалась через сутки по диаметру зоны, свободной от роста микроорганизмов. Бактериостатическая активность растворов АСК, натриевой соли АСК и сульфаниламида в концентрации 0,01 моль/л проверялась на культуре микроорганизмов X. campestris B-610.
Бактерицидная активность изучалась с помощью метода серийных разведений (Дзержинская, 2005; Навашин С.М., Фомина И.П., 1982). Готовились двукратно убывающие концентрации АСК (1·10-1; 5·10-2; 2,5·10-2; 13·10-4; 6·10-3; 3·10-3; 8·10-4; 4·10-4; 2·10-4 г/л) в питательном бульоне. Бактерицидная активность оценивалась на 1-ые и 2-ые сутки. Определялась минимальная концентрация акридон-2-сульфокислоты, задерживающая видимый рост микроорганизмов. Для дополнительного контроля полученных результатов производился высев микробного материала из пробирок с прозрачной средой на плотные питательные среды, не содержащие АСК. При этом устанавливалось отсутствие вторичного роста микроорганизмов.
Росторегулирующая активность АСК оценивалась по длине корней проростков семян различных культур. Использовались водные растворы соединения в концентрациях: 8·10-2, 8·10-3, 8·10-4, 8·10-5, 8·10-6 г/л и 8·10-13, 8·10-14, 8·10-15, 8·10-16, 8·10-17 г/л, которые готовились последовательным разбавлением начальных растворов. В качестве контроля использовали стерильную воду. Результаты экспериментов определяли на 1-ые, 2-ые и 3-и сутки.
Изучение влияния рН среды на длину корней проростков семян пшеницы, ржи, огурцов и кабачков проводилось с использованием водных растворов АСК, серной, азотной и уксусной кислот. С помощью рН-метра «Анион-7000» определяли значения рН АСК в концентрациях 8·10-2 - 8·10-6 г/л (2,7·10-4 , 2,7·10-5, 2,7·10-6, 2,7·10-7 моль/л), готовили растворы остальных кислот с теми же значениями рН. Рассчитывали молярные концентрации этих растворов, которые составили: 1,75·10-4; 0,8·10-5; 4·10-6; 4·10-7 моль/л (для Н2SO4), 3,5·10-4; 1,6·10-5; 8·10-6; 8·10-7 моль/л (для HNO3 и CH3COOH). В качестве контроля использовали стерильную дистиллированную воду. Измерения длины корней проростков семян проводили на 1-ые, 2-ые и 3-ьи сутки.
Для биотестирования использовались тест-объекты: инфузории Stilonichia mytilus и дафнии Daphnia magna. Определялась острая токсичность растворов акридон-2-сульфокислоты в следующих концентрациях: 8·10-2, 8·10-3 , 8·10-4, 8·10-5, 8·10-6 г/л и 8·10-13, 8·10-14 , 8·10-15, 8·10-16, 8·10-17 г/л. Хроническая токсичность водных растворов АСК (8·10-2, 8·10-3 , 8·10-4, 8·10-5, 8·10-6 г/л) изучалась в течение двух недель на дафниях Daphnia magna. Градацию степени токсичности АСК для инфузорий Stilonichia mytilus проводили по данным работы (Виноходов, 1995), для дафний по данным работы (Филенко, 1998).
Опыты по изучению токсического действия растворов АСК и определение её LD50 проводились на белых беспородных крысах-самцах. Водные растворы АСК вводили перорально. Срок наблюдения составлял 14 суток, в течение которых учитывались характер и длительность симптомов интоксикации, сроки гибели и количество павших животных от каждой введенной дозы.
Мутагенная активность АСК определялась с помощью «ядрышкового теста» на клетках апикальной меристемы корней лука репчатого (Федорова и др, 2004). Тест основан на подсчёте общего количества проанализированных клеток с различным числом ядрышек (1,2,3... n) в ядре. На основании полученных данных определяли ядрышковую активность, под которой понимают долю клеток (%) с 1,2,3... n ядрышками в ядре. Использовались водные растворы АСК в концентрациях 8·10-2, 8·10-3, 8·10-4, 8·10-5, 8·10-6 г/л.
Статистическую обработку полученных результатов проводили по методике (Кармолиев, 1971 Боровиков, 2003).
Квантово-химические расчеты проводили методом теории функционала плотности (DFT) на уровне B3LYP/6-311++G(d,p), осуществляли анализ натуральных связевых орбиталей (NBO-анализ) и по атомно-связево-аддитивным схемам вычисляли QSAR-свойства. Расчеты проводили, используя пакет программ CHEMOFFICE/CHEM3D.
Глава 3. Биологическая активность производных акридона
При изучении бактериостатической активности акридона и его производных в отношении фитопатогенных бактерий X. campestris B-610, Ps. syringae B-1546 и E. carotovora subsp. atrullis – 603 установлено, что из всех протестированных соединений, АСК оказалась единственным веществом, обладающим бактериостатическим действием. 4-Карбоксиакридон проявил антимикробное действие только в отношении культуры X. campestris B-610. Поэтому АСК, как наиболее перспективное, было отобрано для дальнейших исследований.
Исследовалась бактерицидная активность водных растворов АСК (1·10-1; 5·10-2; 2,5·10-2; 1,3·10-2; 6·10-3; 3·10-3; 1,6·10-3, 8·10-4; 4·10-4; 2·10-4 г/л) в отношении указанных выше фитопатогенов. Определялась минимальная концентрация, задерживающая рост микроорганизмов. В растворах АСК с концентрациями от 1·10-1 - 8·10-4 г/л наблюдалось отсутствие видимого роста микроорганизмов (табл. 1).
Таблица 1
Влияние концентрации АСК на рост фитопатогенных бактерий
| Концентрация АСК (г/л) | Рост микроорганизмов | ||
| Xanthomonas campestris B-610 | Pseudomonas syringae B-1546 | Erwinia carotovora subsp. atrullis – 603 | |
| 8·10-4 | - | - | - |
| 4·10-4 | + | + | + |
| 2·10-4 | + | + | + |
| К «+» | + | + | + |
| К «-» | - | - | - |
«+» видимый рост микроорганизмов; «-» отсутствие видимого роста микроорганизмов
Для дополнительного контроля полученных результатов производился высев из пробирок с прозрачной средой на соответствующие плотные питательные среды, не содержащие АСК. Через двое суток инкубирования на поверхности агара роста микроорганизмов не наблюдалось, что подтверждает достоверность полученных выше результатов.
Таким образом, АСК в концентрациях от 1·10-1 до 8·10-4 г/л оказывает бактерицидное действие в отношении фитопатогенов. Минимальная концентрация АСК, задерживающая видимый рост микроорганизмов составила 8·10-4 г/л, поэтому для дальнейших исследований использовались
водные растворы АСК в концентрациях 8·10-2, 8·10-3 , 8·10-4, 8·10-5, 8·10-6 г/л.
Известно, что соединения, обладающие антимикробной активностью, часто проявляют росторегулирующее действие (Макарова и др., 2006). Нами изучено влияние АСК в концентрациях 8·10-2 - 8·10-6 г/л на прорастание семян однодольных и двудольных растений: пшеницы, овса, ржи, огурцов, кабачков и гороха. Оценивалась длина корня проростков семян на 2-е и 3-е сутки. Результаты исследований представлены в табл. 2, 3.
На третьи сутки длина корней проростков однодольных растений оказалась выше контрольных в 1,5-2 раза, что свидетельствует о выраженном действии АСК на прорастание их семян. Максимальные значения длины корней наблюдались в присутствии следующих концентраций АСК: для пшеницы - 8·10-2 г/л, ржи - 8·10-4 г/л, овса - 8·10-2 г/л.
Наименьшая длина корней у большинства проростков этих растений (пшеница, рожь, овес) отмечена при концентрации АСК 8·10-5 г/л.
Длина корней проростков двудольных растений (табл. 3), помещенных в водные растворы АСК, для большинства концентраций также превышала контрольные показатели.
Таблица 2
Влияние концентрации АСК на прорастание семян однодольных растений
| Вид растения | Концентрация АСК, г/л | 2 сутки Длина корня (мм) | 3 сутки Длина корня (мм) |
| Пшеница Triticum durum Desf | 8·10-2 | 9,6±1,0 | 19,6±2,0 |
| 8·10-3 | 8,3±1,2 | 16,9±1,1 | |
| 8·10-4 | 8,4±1,2 | 18,3±2,0 | |
| 8·10-5 | 5,8±1,4 | 12,1±2,3 | |
| 8·10-6 | 7,8±1,1 | 21,4±2,0 | |
| Контроль | 5,2±1,1 | 9,3±1,2 | |
| Рожь Secale cereale | 8·10-2 | 23,1±2,0 | 46,0±2,6 |
| 8·10-3 | 26,4±2,5 | 54,1±2,0 | |
| 8·10-4 | 32,1±2,5 | 65,2±2,9 | |
| 8·10-5 | 21,4±3,2 | 47,3±2,1 | |
| 8·10-6 | 24,3±1,5 | 55,1±3,0 | |
| Контроль | 11,7±1,5 | 29,8±2,6 | |
| Овес Avena sativa | 8·10-2 | 5,7±1,0 | 22,3±1,7 |
| 8·10-3 | 6,1±1,2 | 20,6±1,4 | |
| 8·10-4 | 5,3±0,8 | 19,8±1,0 | |
| 8·10-5 | 2,1±0,9 | 10,9±1,3 | |
| 8·10-6 | 2,5±1,0 | 20,1±1,0 | |
| Контроль | 3,1±1,0 | 15,6±1,3 |
Таблица 3
Влияние концентрации АСК на прорастание семян двудольных растений
| Вид растения | Концентрация АСК, г/л | 2 сутки Длина корня (мм) | 3 сутки Длина корня (мм) |
| Огурцы Cucumis sativus L. | 8·10-2 | 34,9±1,2 | 43,9±1,4 |
| 8·10-3 | 27,1±2,0 | 34,3±2,4 | |
| 8·10-4 | 35,2±1,1 | 43,8±1,3 | |
| 8·10-5 | 37,2±2,3 | 42,9±1,1 | |
| 8·10-6 | 36,6±1,8 | 43,7±2,0 | |
| Контроль | 30,7±1,5 | 39,0±1,2 | |
| Горох Pisum sativum | 8·10-2 | 7,4±0,9 | 18,6±1,7 |
| 8·10-3 | 7,2±1,0 | 17,3±2,4 | |
| 8·10-4 | 8,4±1,4 | 17,3±2,0 | |
| 8·10-5 | 6,6±1,2 | 16,9±1,6 | |
| 8·10-6 | 6,8±1,0 | 16,5±1,8 | |
| Контроль | 5±0,5 | 11,6±1,4 | |
| Кабачки Cucurbita pepo var. giromontina | 8·10-2 | 12,7±2,3 | 33,3±1,6 |
| 8·10-3 | 6,0±2,0 | 10,5±2,0 | |
| 8·10-4 | 8,1±2,1 | 13,8±2,6 | |
| 8·10-5 | 12,0±1,3 | 27,0±1,5 | |
| 8·10-6 | 13,0±2,8 | 33,0±2,7 | |
| Контроль | 10,2±2,0 | 23,5±2,2 |
Максимальные значения длины корней этих растений наблюдались в присутствии следующих концентраций АСК: 8·10-2 г/л (горох, кабачки) и 8·10-6 г/л (огурцы). При концентрации исследуемого вещества 8·10-3 г/л (огурцы, кабачки), 8·10-4 г/л (кабачки) длина корней проростков была ниже контрольных показателей. Т.е., для семян кабачков и огурцов выявлен двухфазный характер действия АСК. Обобщая полученные данные, можно заключить, что исследуемое вещество обладает росторегулирующим действием.
Известно, что существуют оптимальные значения рН почвы, при которых наблюдается максимальный рост растений (Смирнов, Муравин, 1984). Чтобы выяснить, чем обусловлено росторегулирующая активность АСК, проведена серия опытов по изучению влияния кислотности среды на длину корней проростков семян одно- и двудольных растений.
Устанавливали зависимость роста корней однодольных (рожь, пшеница) и двудольных растений (кабачки, огурцы) от одних и тех же значений рН водных растворов АСК, серной, азотной и уксусной кислот.
При изученных значениях рН все кислоты стимулируют рост корней проростков однодольных растений (рис.1,2). Лучшие результаты получены при более низких значениях рН. Минеральные кислоты и уксусная кислота наибольший эффект проявляют при рН среды 5,06. Действие АСК оказалось наиболее выраженным для пшеницы при двух значениях рН 4,77 и 6,16, а для ржи при одном - 4,77.
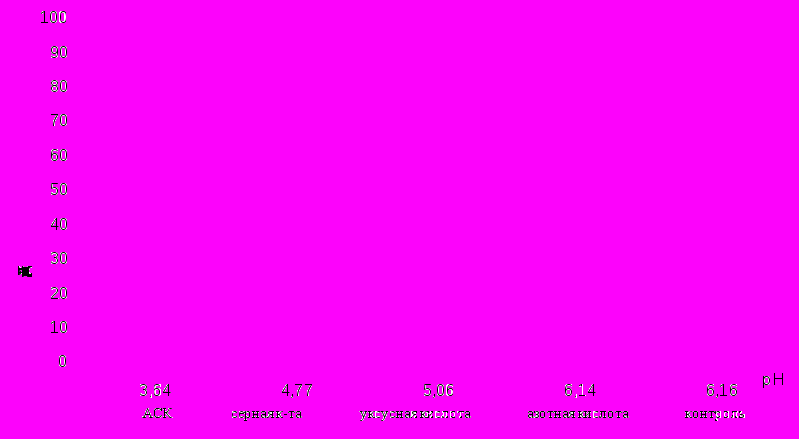
Рис. 1. Зависимость длины корней проростков пшеницы (Triticum durum Desf) от рН среды (на третьи сутки выращивания)
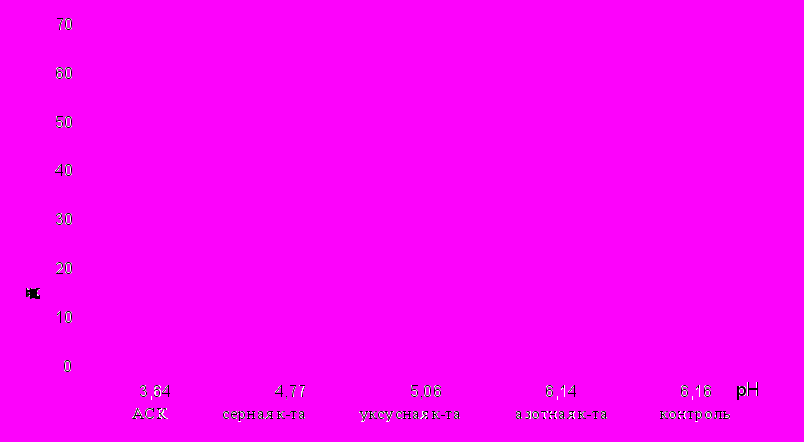
Рис. 2. Зависимость длины корней проростков ржи (Secale cereale)от рН среды (на третьи сутки выращивания)
Полученные нами результаты для зерновых культур полностью совпадают с литературными данными (Бурлакова и др, 1996).
Показано, что семена двудольных растений в растворах неорганических кислот и уксусной кислоты не прорастают. АСК является единственным соединением, которое стимулирует рост корней проростков семян как однодольных, так и двудольных растений. Это не противоречит литературным данным о различном характере действия биостимуляторов на рост корней однодольных и двудольных растений (Макарова и др., 2006; Бурлакова и др, 1996).
Итак, установлено, что неорганические и уксусная кислоты стимулируют рост корней проростков семян однодольных растений и ингибируют его у двудольных растений. Это позволяет нам предположить, что стимулирование роста корней растений в большей степени зависит от химического строения используемых соединений, чем от кислотности среды.
Далее изучалось действие вышеперечисленных кислот и АСК в отношении фитопатогенных микроорганизмов (табл. 4).
Таблица 4
Влияние водных растворов различных кислот на фитопатогенные бактерии
| Раствор кислоты, рН=3,2 | Диаметр зоны отсутствия роста, мм | ||
| Xanthomonas cam. B-610 | Pseudomonas syr. B-1546 | Erwinia car. sub. аtr. 603 | |
| АСК | 14 | 8 | 10 |
| Н2SO4 | 0 | 0 | 0 |
| Уксус. к-та | 2 | 0 | 2 |
| HNO3 | 0 | 0 | 0 |
| контроль | 0 | 0 | 0 |
Как видно из данных табл. 4, только присутствие АСК подавляет рост всех используемых в эксперименте микроорганизмов, минеральные кислоты не проявляют бактериостатической активности, уксусная кислота оказывает слабое действие на микроорганизмы. Т.е., полученные результаты позволяют заключить, что бактериостатическая активность изучаемого соединения обусловлена структурой используемого субстрата, а именно, наличием акридонового кольца и сульфогруппы.
С целью определения механизма росторегулирующей активности АСК проведены исследования по установлению зон роста корня, ответственных за его прирост. Как известно (Макарова и др., 2006), рост корней осуществляется за счет роста клеток, находящихся в различных фазах роста: (1 зона роста - 0-2 мм от кончика корня) - зона меристематических клеток, (2 зона - 2-4мм от кончика корня) - зона клеток, перешедших к растяжению.
Изучалось влияние АСК в концентрациях (8·10-2 - 8·10-6 г/л) на прорастание семян пшеницы и гороха. Опыт проводился по методике, описанной в работе (Макарова и др., 2006). Результаты представлены в таблицах 5 и 6.
Таблица 5
Влияние концентрации АСК на зоны роста корня пшеницы
( Triticum durum Desf)
| Концентрация АСК, г/л | 1-ая зона*, мм | 2-я зона**, мм |
| 8·10-2 | 4,8±0,1 | 6,9±0,2 |
| 8·10-3 | 4,0±0,3 | 7,9±0,2 |
| 8·10-4 | 4,1±0,1 | 8,8±0,1 |
| 8·10-5 | 4,2±0,1 | 6,0±0,3 |
| 8·10-6 | 4,4±0,2 | 8,9±0,1 |
| контроль | 4,1±0,1 | 3,2±0,3 |
*- зона меристематических клеток; **- зона клеток, перешедших к растяжению
Таблица 6
Влияние концентрации АСК на зоны роста корня гороха ( Pisum sativum)
| Концентрация АСК, г/л | 1-ая зона, мм | 2-я зона, мм |
| 8·10-2 | 6,2±0,3 | 3,2±0,2 |
| 8·10-3 | 7,2±0,1 | 3,8±0,1 |
| 8·10-4 | 6,2±0,3 | 3,3±0,2 |
| 8·10-5 | 7,1±0,1 | 3,0±0,3 |
| 8·10-6 | 7,4±0,2 | 4,1±0,1 |
| контроль | 2,9±0,1 | 3,1±0,1 |
Как следует из данных таблиц 5 и 6, растворы АСК активизируют разные зоны роста корней однодольных и двудольных растений. Так, в случае с пшеницей рост корня осуществляется в большей степени за счет роста клеток, перешедших к растяжению, рост корней проростков гороха обусловлен ростом меристематических клеток.
Результаты, полученные для пшеницы, согласуются с литературными данными, где отмечается (Макарова и др., 2006), что подкисление среды способствует активизации данной зоны однодольных растений. Что касается двудольных растений, то в литературе отсутствуют сведения по эффекту на них кислых сред.
Далее были проведены квантово-химические расчеты и определение QSAR-свойств молекул АСК, её аналогов (акридона, акридон-N-уксусной кислоты) и общеизвестного стимулятора роста - индолил-3-уксусной кислоты (ИУК) с целью установления связи между их биологической активностью и строением (рис. 5 и табл. 7).
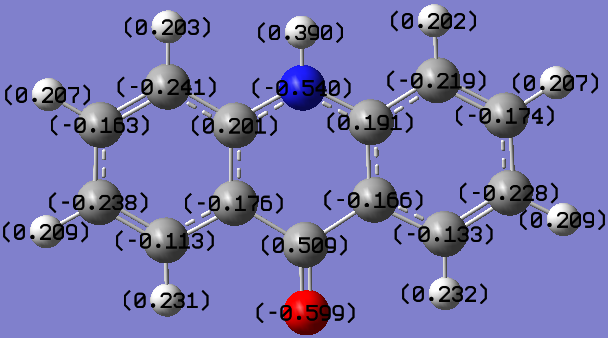 Акридон | 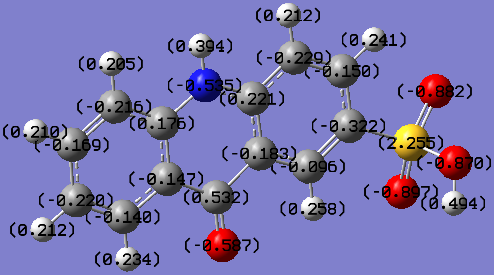 Акридон-2-сульфокислота |
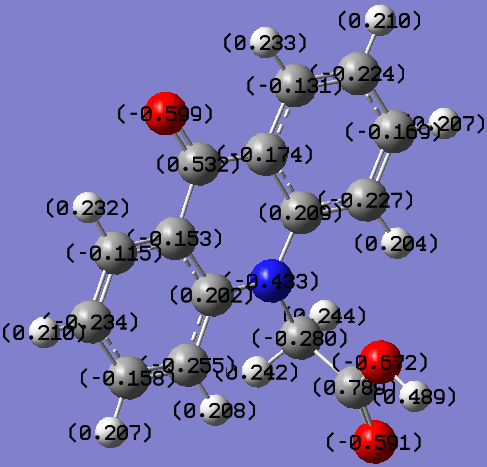 Акридон-N-уксусная кислота | 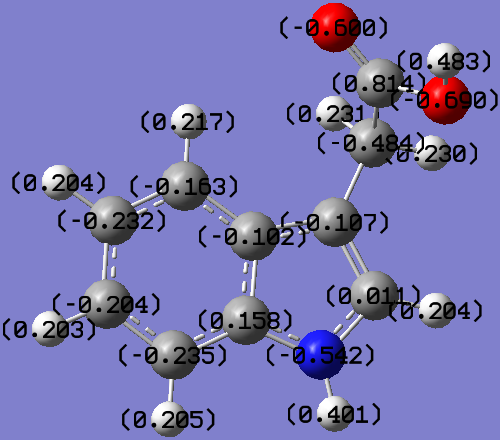 Индолил-3-уксусная кислота |
Рис. 5. Распределение зарядов на атомах в молекулах исследованных соединений
Таблица 7
Данные квантово-химических расчетов
| Соединение | Ван-дер-ваальсова поверхность, Å2 | Объем, Å3 | lgP | Рефрак- ция, Å3 | Поляри-зуемость, Å3 | , D |
| Акридон | 374,32 | 589,36 | 2,47 | 59,06 | 22,59 | 5,21 |
| Акридон-N-уксусная кислота | 427,89 | 703,65 | 2,26 | 70,04 | 26,98 | 3,41 |
| Акридон-2-сульфокислота | 437,96 | 706,36 | 1,86 | 69,40 | 24,37 | 8,54 |
| Индолил-3-уксусная кислота | 357,67 | 545,88 | 0,58 | 48,75 | 18,88 | 3,67 |
Для АСК и ИУК структурного подобия не найдено, что позволяет предположить о существовании другого механизма росторегулирующего действия у АСК.
Глава 4. Оценка токсического действия растворов АСК на биологические объекты различных таксономических групп
Для установления возможности использования АСК в качестве пестицида, представляло интерес оценить ее токсическое действие на тест-объекты различных таксономических групп: а, именно, инфузорий, дафний и крыс.
Проведено биотестирование водных растворов АСК на инфузориях S. mytilus. Использовались водные растворы АСК в действующих концентрациях (8·10-2 - 8·10-6 г/л) и в малых дозах (8·10-13 - 8·10-17 г/л).
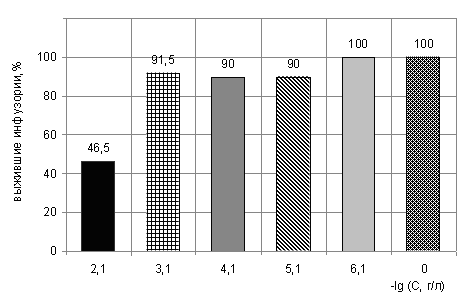
Рис. 6. Зависимость выживаемости инфузорий от концентрации АСК
Изучение действия АСК в водных растворах показало, что вещество в концентрации (8·10-2 г/л) вызывало гибель инфузорий, в остальных действующих концентрациях (8·10-3 , 8·10-4, 8·10-5, 8·10-6 г/л) оно оказалось не токсичным (рис.6). АСК в малых дозах (8·10-13 - 8·10-17 г/л) не оказывало действия на инфузорий. При выдерживании биообъекта в данной среде в течение 24 ч наблюдалось размножение инфузорий на уровне контроля.
В соответствии с данными работы (Виноходов, 1995) концентрация АСК (8·10-2 г/л) определена как среднетоксичная.
На следующем этапе работы изучалось влияние водных растворов АСК в действующих концентрациях (8·10-2 - 8·10-6 г/л) и в малых дозах (8·10-13 - 8·10-17 г/л) на численность дафний. Опыт проводился в течение 48 часов. Установлено, что водные растворы АСК во всех концентрациях в остром опыте не вызывали гибели рачков. Численность дафний составила 100%.
Проведены исследования хронического действия изучаемого соединения на рачков. Исследовались растворы АСК в действующих концентрациях (8·10-2 - 8·10-6 г/л). Опыт длился 14 суток. Оценивали выживаемость и плодовитость дафний. Результаты эксперимента представлены в табл.7.
Таблица 7
Влияние водных растворов АСК различных концентраций на
выживаемость и плодовитость дафний
| Концентрация АСК, г/л | Количество выживших дафний, % | Количество родившейся молоди, шт |
| М ± m | ||
| 8·10-2 | 66 | 7,2 ± 0,58 |
| 8·10-3 | 76 | 11,0 ± 0,52 |
| 8·10-4 | 92 | 12,0 ± 0,02 |
| 8·10-5 | 100 | 14,8 ± 0,42 |
| 8·10-6 | 100 | 15,0 ± 0,52 |
| контроль | 100 | 15,8 ± 0,2 |
Установлено, что водные растворы АСК в концентрациях 8·10-5 и 8·10-6 г/л не вызывали гибели дафний. В концентрациях 8·10-2, 8·10-3, 8·10-4 г/л смертность дафний составила 34, 24 и 8%, соответственно. По данным работы (Филенко, 1998) снижение плодовитости дафний при концентрации АСК 8·10-2 г/л, достоверно по сравнению с контролем, что свидетельствует о проявлении хронической токсичности соединения. Снижение плодовитости рачков в остальных исследуемых концентрациях в сравнении с контролем носило случайный характер.
Проведены исследования по определению острой токсичности растворов АСК на белых беспородных крысах. Каждую дозу в острых опытах испытывали на 10 животных. Срок наблюдения составлял 14 суток, в течение которых учитывались характер и длительность симптомов интоксикации, сроки гибели и количество павших животных от каждой введенной дозы.
Количественные параметры острой токсичности рассчитывали пробит-анализом по методу Литчфилда и Уилкоксона в изложении М.Л.Беленького (Беленький, 1963). Результаты представлены в табл. 8.
Таблица 8
Влияние различных концентраций растворов АСК на выживаемость крыс
| Доза АСК, мг/кг (D) | lg D | Средняя гибель, % | Значение пробит* |
| 600 | 2,78 | 0 | - |
| 1200 | 3,08 | 12 | 3,82 |
| 1500 | 3,18 | 33 | 4,56 |
| 2000 | 3,30 | 63 | 5,31 |
* процентное выражение гибели подопытных особей, трансформированное в пробиты
Получено значение LD50, равное 1800 мг/кг (lg D = 3,26), которое свидетельствует о малой токсичности вещества (Пурмаль, 1998).
С целью установления генетической опасности соединения для жизнедеятельности организма определена мутагенная активность АСК с помощью «ядрышкового теста» на клетках апикальной меристемы корней лука.
Изучено действие водных растворов АСК в концентрациях (8·10-2 - 8·10-6 г/л). Проведен подсчет общего количества проанализированных клеток с различным числом ядрышек (1,2,3... n) в ядре. Определено среднее число ядрышек на клетку (сумма всех обнаруженных на микропрепарате ядрышек к общему числу проанализированных клеток). На основании полученных данных установлена ядрышковая активность, т.е. доля клеток (%) с 1,2,3... n ядрышками в ядре.
Во всех пробах лука не обнаружено ядер с количеством ядрышек более двух (табл. 9). Среднее число ядрышек в клетке растительного материала, выращенного в водных растворах АСК, составило 1,6 - 1,7, а в контроле 1,6.
Таблица 9
Ядрышковая активность в клетках апикальной меристемы
корней лука репчатого, выращенного на растворах АСК
| Концентрации АСК, г/л | Доля клеток с n ядрышками в ядре, % | |
| n =1 | n =2 | |
| 8·10-2 | 37,1±0,7 | 62,9±1,1 |
| 8·10-3 | 30,9.±1,1 | 69,1±1,4 |
| 8·10-4 | 32,4±0,7 | 67,6±1,3 |
| 8·10-5 | 33,5±0,6 | 66,5±0,8 |
| 8·10-6 | 28,6.±1,1 | 71,4±1,3 |
| Контроль | 34,3±0,2 | 65,7±0,4 |
Таким образом, проведенные нами исследования показали, что исследуемое соединение не проявляет мутагенной активности.
ВЫВОДЫ
1. Из 10-ти соединений акридонового ряда бактериостатическую и бактерицидную активность относительно фитопатогенных микроорганизмов Xanthomonas campestris B-610, Pseudomonas syringae В-1546, Erwinia carotovora subsp. atrullis 603 проявляет только акридон-2-сульфокислота.
2. Водные растворы акридон-2-сульфокислоты в концентрациях 8·10-2-8·10-6 г/л увеличивают рост корней проростков одно- и двудольных растений. У однодольных рост обусловлен стимулированием зоны растяжения корней растений, а у двудольных – зоны меристематических клеток.
3. Бактерицидная активность акридон-2-сульфокислоты обусловлена в большей степени структурой соединения, ростостимулирующая зависит также от кислотных свойств вещества. Молекулу АСК от других соединений ряда акридона отличает высокое значение дипольного момента.
4. Акридон-2-сульфокислота в концентрации 8·10-2 г/л проявляет среднетоксическое действие на инфузории и хроническое на дафнии. Остальные действующие (8·10-3, 8·10-4, 8·10-5, 8·10-6 г/л) и низкие (8·10-13, 8·10-14, 8·10-15, 8·10-16, 8·10-17 г/л) концентрации АСК не вызывают гибели простейших и рачков.
5. Определена LD50 акридон-2-сульфокислоты на белых беспородных крысах, равная 1800 мг/кг.
6. Акридон-2-сульфокислота в действующих концентрациях не проявляет мутагенной активности.
7. Акридон-2-сульфокислота является перспективным соединением для дальнейших исследований и использования его в качестве пестицида.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи в ведущих журналах, рекомендуемых ВАК
- Горшенина, Н.С., Губина, Т.И. Возможность использования производных акридона в качестве химических средств защиты растений / Т.И. Губина, Н.С. Горшенина // Вестник Саратовского госагроуниверситета им. Н.И. Вавилова. – 2009. – № 3. – С. 11-13.
- Горшенина, Н.С., Губина, Т.И. Экотоксикологическая оценка действия акридон-2-сульфокислоты на живой организм / Н.С. Горшенина, Т.И. Губина // Проблемы региональной экологии. – 2009. – № 4. – С. 212-114.
Публикации в периодических изданиях, сборниках и материалах конференций
- Акимова, Н. С. (Горшенина, Н.С.), Губина, Т.И., Мухачева, Е.С., Маркович, Ю.Д., Кудрявцева, Т.Н., Пелевин, Н.А. Влияние производных акридона на бактерии и растения / Н.С.Акимова, Т.И. Губина, Е.С. Мухачева, Ю.Д. Маркович, Т.Н.Кудрявцева, Н.А. Пелевин // Тезисы II Международной школы-конференции «Актуальные аспекты современной микробиологии». – М.: МАКС Пресс, – 2006. – С.108.
- Маркович, Ю.Д., Пелевин, Н.А., Акимова, Н. С. (Горшенина, Н. С.) Получение акридон-2-сульфокислоты и изучение её антимикробной активности / Ю.Д. Маркович, Н.А.Пелевин, Н.С. Акимова // Известия Курского государственного технического университета. – 2007. – № 1. – С. 35-39.
- Акимова, Н.С. (Горшенина, Н.С.), Губина, Т.И. Влияние акридонсульфокислоты на растения / Н.С. Акимова, Т.И. Губина // Сборник научных трудов: Материалы 3-й Всесоюзной научно-практической конференции «Экологические проблемы промышленных городов». – Саратов, – 2007. – С. 3-5.
- Акимова, Н.С. (Горшенина, Н.С.), Губина, Т.И. Определение токсичности акридон-2-сульфокислоты с помощью различных тест-организмов / Н.С. Акимова, Т.И. Губина // Сборник научных трудов: Материалы 4-й Всесоюзной научно-практической конференции «Экологические проблемы промышленных городов». – Саратов, 2009. – С. 122-124.
- Акимова, Н.С. (Горшенина, Н.С.), Губина, Т.И. Токсичное действие акридон-2-сульфокислоты на белых беспородных крыс / Н.С. Акимова, Т.И. Губина // Материалы II Международной научной конференции «Актуальные проблемы экологической физиологии, биохимии и генетики животных» - Саранск: ООО «Мордовия-ЭКСПО», – 2009. –С.147-148.
- Горшенина, Н.С., Губина, Т.И. Поиск средств защиты растений среди соединений акридонового ряда / Н.С Горшенина, Т.И. Губина // Материалы Международной научно-практической конференции «Вавиловские чтения». – Саратов, 2009. – С. 112-113.
- Горшенина, Н.С, Губина, Т.И. Действие производных акридонового ряда на живые системы / Н.С Горшенина, Т.И. Губина // Экология: синтез естественнонаучного, технического и гуманитарного знания: материалы Всероссийская научно-практическая конференция, г. Саратов, 19-22 окт. 2010 г. / СГТУ. – Саратов, 2010. – С. 192-193.
- Горшенина, Н.С., Учаева, И.М., Панкратов, А.М., Маркович, Ю.Д., Губина, Т.И. Биологическая активность соединений ряда акридона: эксперимент и квантовохимическое рассмотрение / Н.С. Горшенина, И.М. Учаева, А.М. Панкратов, Ю.Д. Маркович, Т.И. Губина // Сборник научных трудов Первой Всероссийской научно-практической конференции «Техносферная и природная безопасность – ТПБ-2011. – Саратов: из-во Наука, 2011. – С. 38-42.
Автор благодарит зав. кафедрой органической и аналитической химии ФГБОУ ВПО «Юго-Западный государственный университет» профессора, д.х.н. Марковича Ю.Д. и его сотрудников за предоставленные на испытания химические соединения, а также профессора кафедры аналитической и экологической химии ФГБОУ ВПО «Саратовский государственный национальный университет им. Н.Г.Чернышевского» д.х.н. Панкратова А.А., доцента кафедры природной и техносферной безопасности ФГБОУ ВПО «Саратовский государственный технический университет имени Гагарина Ю.А.» к.х.н. Учаеву И.М. за помощь в проведении и интерпретации квантово-химических расчетов.
