Российской Академии Наук, профессор, начальник кафедры гистологии и эмбриологии Военно-медицинской академии, основоположник унитарной теории кроветворения, который в 1908 году сделал доклад
| Вид материала | Доклад |
- Омской государственной медицинской академии, 900.55kb.
- Рекомендации для врачей Санкт-Петербург 2000, 1226.62kb.
- СоставителИ, 328.8kb.
- Сергей Эдмундович Качан, д м. н профессор заведующий кафедрой неонатологии и медицинской, 561.5kb.
- Программа по гистологии, цитологии и эмбриологии для студентов дневного и вечернего, 616.32kb.
- Владимира Яковлевича Рушанина доклад, 348.1kb.
- Анатолий Анатольевич Толкаченко, профессор кафедры уголовного права и криминологии, 365.15kb.
- А. А. Басалай Доктор философских наук, профессор кафедры философии Российской экономической, 4604.53kb.
- В. А. Ацюковский вековой блеф, 590.48kb.
- Совершенная математическая модель действия закона стоимости Маркса, 795.7kb.
Стволовые клетки как объект изучения и медицинского применения
- История открытия, изучения и применения стволовых клеток
Честь открытия стволовых клеток принадлежит русскому ученому-гистологу Александру Александровичу Максимову (1874 – 1928 гг.; член-корреспондент Российской Академии Наук, профессор, начальник кафедры гистологии и эмбриологии Военно-медицинской академии, основоположник унитарной теории кроветворения), который в 1908 году сделал доклад на съезде Немецкого гематологического общества в Берлине о том, что в нашем организме пожизненно сохраняются недифференцированные клетки, которые могут превращаться в специализированные клетки крови и соединительной ткани. Позднее, А.А.Максимов назвал эти клетки «стволовыми», имея в виду, что они находятся в «стволе» - основе кроветворного древа.
Первая попытка медицинского применения стволовых клеток костного мозга была сделана в 1891 году двумя известными французскими учеными: Шарлем Броун-Секар (1817 - 1894 гг.; физиолог и невропатолог, член-корреспондент французской Академии наук) и Жаком д,Арсонваль (1851 – 1940 гг.; физиолог и физик основоположник биофизики, член Французской Академии), которые попытались излечить больного лейкемией путем приема вытяжки костного мозга внутрь («per os»). Естественно, попытка успеха не имела. При этом ученые, конечно, не пытались использовать стволовые клетки костного мозга, о которых они еще ничего не знали, но рассчитывали на лечебный кроветворный эффект самого костного мозга.
Первая успешная пересадка костного мозга была сделана в 1940 году Моррисом и Самваком (Morrison, Samwach), которые произвели трансплантацию 13 мл костного мозга больному апластической анемией от его брата. Можно предположить, что успешность операции объяснялась тем обстоятельством, что донором был однояйцовый близнец.
Значительный вклад в изучение стволовых клеток был внесен российскими учеными Александром Яковлевичем Фриденштейном (1924 – 1998) и Иосифом Львовичем Чертковым, которые открыли, что в костном мозге существуют два вида мультипотентных стволовых клеток: гемопоэтические стволовые клетки (предшественники всех типов клеток крови) и стромальные (мезенхимальные) стволовые клетки – долгоживущие и редко делящиеся стволовые клетки. Оба типа стволовых клеток постоянно циркулируют в кровотоке. Свои исследования А.Я.Фриденштейн и И.Л.Чертков обобщили в монографии «Клеточные основы кроветворения (кроветворные клетки предшественники» (М.Медицина, 1977).
В 1998 году Джеймс Томсон (Висконсинский университет, США) опубликовал в журнале Science статью о выделении эмбриональных стволовых клеток из бластоцисты человека. Одновременно с ним Джон Герхарт (Университет Джона Гопкинса, США) опубликовал в Анналах национальной академии США статью на эту же тему.
По утверждению журнала Science выделение и размножение в питательной среде эмбриональных стволовых клеток является третьим по значимости открытии в биологии (после расшифровки двойной спирали ДНК и завершении научной программы «Геном человека»).
2. Классификация и свойства стволовых клеток
Как известно, через 12 часов после оплодотворения образуется одноклеточный зародыш – зигота. Дробление зиготы приводит к тому, что на 4 сутки зародыш состоит из 7 – 12 клеток – бластомеров (тотипотентных стволовых клеток). Так образуется морула, из которой формируется бластоциста – полый пузырек, содержащий узелок зародышевых клеток – эмбриобластов (плюрипотентных стволовых клеток). Далее начинается гаструляция, в процессе которой происходят изменения эмбриона, характеризующиеся направленным перемещением и дифференцировкой клеток, в результате чего образуются зародышевые листки (эктодерма, мезодерма и энтодерма) – источники зачатков тканей и органов.
Гистогенетические процессы начинаются в эмбриональном периоде и заканчиваются после рождения. Основой, базисом дифференцировки клеток организма являются стволовые клетки, которые, собственно говоря, были названы А.А.Макси-
мовым именно благодаря тому обстоятельству, что они в основе (в стволе) клеточного развития и дифференцировки.
В настоящее время чаще всего можно встретиться с двумя классификациями стволовых клеток: по источнику их происхождения и по способности к дифференцировке.
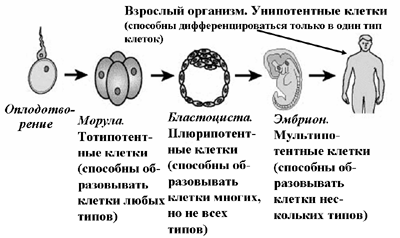
Рис. 1. Классификация стволовых клеток по способности дифференцироваться
По первой классификации (Рис. 1) различают эмбриональные стволовые клетки (получаются из эмбрионов, находящихся на стадии бластоцисты), фетальные стволовые клетки (получаются из остатков абортивных тканей), стволовые клетки, получаемые из плацентарной или пуповинной крови, и стволовые клетки взрослого организма (так называемые «взрослые» стволовые клетки). Количество стволовых клеток во взрослом организме очень мало. Для сравнения укажем, что при рождении у ребенка одна стволовая клетка приходится на 10000 обычных клеток (т.е. в организме ребенка присутствует 50 млрд. стволовых клеток). У людей в возрасте 60 лет и старше одна стволовая клетка приходится на один миллион обычных клеток.
Способность стволовых клеток к большей или меньшей (по «широте») дифференцировке меняется по мере роста и развития эмбриона. Так стволовые клетки морулы (тотипотентные стволовые клетки) способны образовывать клетки любых типов, стволовые клетки бластоцисты (бластомеры, плюрипотентные стволовые клетки) способны образовывать клетки многих, но не всех типов, стволовые клетки эмбриона, находящегося на стадии развития более поздней, чем бластоциста (мультипотентные стволовые клетки), способны образовывать клетки нескольких определенных типов. Стволовые клетки взрослого организма унипотентны, то есть, способны образовывать клетки только определенных тканей (крови, нервной системы и т.п.). Однако, в последнее время в научной печати стали появляться сообщения о так называемой «направленной дифференцировке» стволовых клеток взрослого организма. Так, якобы, из взрослых стволовых клеток костного мозга удалось в результате генетического перепрограммирования получать нервные и мышечные клетки. Эти сообщения требуют тщательной проверки. О некоторых результатах направленной дифференцировки взрослых стволовых клеток будет сказано в дальнейшем.
Остановимся кратко на основных свойствах стволовых клеток.
- Стволовые клетки неспециализированы, то есть не могут выполнять функции клеток соответствующих тканей без дифференцировки в эти клетки.
- Стволовые клетки способны к пролиферации, то есть к длительному (возможно, больше продолжительности жизни человека) размножению и продукции большого количества себе подобных клеток. С этой точки зрения стволовые клетки, хранящиеся и размножающиеся в культуре ткани можно условно называть «бессмертными».
- Стволовые клетки способны к дифференцировке, то есть к процессу специализации клеток. Процесс дифференцировки запускается с прикрепления стволовых клеток друг к другу или к подложке (если речь идет о выращивании стволовых клеток в культуре ткани), так как рецепторы адгезии и цитоскелет клеток играет большую роль в передаче сигнала к началу дифференцировки из внеклеточной среды в клеточное ядро. В настоящее время изучено ограниченное число факторов, обеспечивающих направленную селективную дифференцировку эмбриональных стволовых клеток. Так, например, ретиновая кислота индуцирует нейрогенез, - TGF (трансформирующий фактор роста) стимулирует образование мышечных клеток, IL-6 (интерлейкин-6) и IL-3 (интерлейкин-3) – образование элементов крови, BMP-2 (морфогенетический протеин кости – Bone Morphogenetic Protein) – образование эпителиальных клеток. Ведутся эксперименты по применению комбинаций ростовых факторов для направленной селективной дифференцировки стволовых клеток.
- Одной из важных особенностей эмбриональных стволовых клеток является их способность к так называемому «асимметричному делению». В случае такого типа клеточного деления одна стволовая клетка, делясь, превращается в две, а из них одна продолжает делиться и производить аналогичные стволовые клетки, а другая вступает на путь дифференцироки. (Рис. 2). Если бы дело обстояло иначе, организм достаточно быстро израсходовал бы весь запас стволовых клеток, и обновление тканей стало бы невозможным (в данном случае речь идет о стволовых клетках взрослого организма).
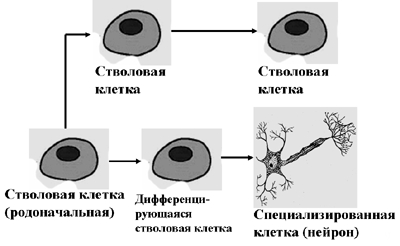
Рис. 2. Асимметричное деление стволовых клеток
- Предполагается, что стволовые клетки взрослого организма из мест своего постоянного нахождения (костный мозг, нервная система, печень, жировая ткань, мышцы) могут выходить в периферическую кровь и, циркулируя по организму, участвовать в регенерации соответствующих тканей. Это предположение пока не подкреплено достаточным количеством фактов и, скорее всего, справедливо только по отношению к гемопоэтическим и мехенхимальным стволовым клеткам костного мозга. Сомнительно, в частности, чтобы стволовые клетки могли бы, например, покидать центральную нервную систему и выходить в кровоток, минуя гематоэнцефалический барьер.
- Методы выделения и культивирования стволовых клеток
После оплодотворения яйцеклетки in vitro и развития зародыша до уровня бластоцисты из последней выделяются плюрипотентные стволовые клетки (эмбриобласты), которые переносят в питательную среду для размножения. Для стимуляции этого процесса применяют цитокины – стимуляторы роста, например, такие как -FGF (фактор роста фибробластов), LIF (Leukemia Inhibitory Factor) и некоторые другие. В течение нескольких дней стволовые клетки пролиферируют, после чего клеточную массу разделяют на несколько частей и переносят в другие емкости с питательной средой. В результате многих пассажей такого рода за 6 месяцев из несколько десятков клеток образуется 5 – 10 млн. стволовых клеток, которые можно использовать для немедленной трансплантации, селективной дифференцировки и последующей трансплантации, или хранить в замореженном виде (в жидком азоте) для их дальнейшего использования.
Получение стволовых клеток путем терапевтического клонирования, в значительной части этого процесса мало, чем отличается от выше описанной процедуры. Существенная разница состоит только в том, что при терапевтическом клонировании в яйцеклетку внедряется ядро одной из соматических клеток будущего реципиента, содержащее присущую только ему генетическую информацию. С этой точки зрения при трансплантации реципиенту селективно дифференцированных стволовых клеток ожидать каких либо проявлений иммунного конфликта не приходиться.
Возможность получения стволовых клеток из плацентарной или пуповинной крови (судя по всему – мультипотентных стволовых клеток) осложняется необходимостью выделять именно стволовые клетки из получаемой таким образом клеточной массы.
Фетальные стволовые клетки (судя по всему это смесь мультипотентных и унипотентных стволовых клеток) можно получать из абортивного материала. Чаще всего полученную клеточную массу используют целиком, без выделения и клонирования стволовых клеток, так как считается, что она сама по себе может способствовать «омоложению» организма и стимуляции регенеративных процессов в нем (очевидно, за счет выделения фетальными клетками некоторых биологически активных веществ). Доказательность результатов таких процедур оставляет желать лучшего.
В последние 1 – 2 года в научной печати стали появляться сообщения о возможности выделения и терапевтического использования стволовых клеток взрослого организма. Количество таких клеток в организме крайне мало, а методы их селекции технологически очень сложны. Кроме того, доказательность позитивных результатов их терапевтического применения весьма сомнительна.
Как правило, стволовые клетки, выделяемые из пуповинной и плацентарной крови, а также стволовые клетки взрослого организма получаются в смеси с уже дифференцированными клетками. Для выделения стволовых клеток могут применяться методы уничтожения в культуре ткани дифференцированных клеток за счет индукции в них апоптоза, либо благодаря их уничтожения моноклональными антителами.
Одним из способов определения и выделения стволовых клеток является метод флуоресцентной микроскопии и метод проточной цитофлуориметрии, использование которых основано на свойстве стволовых клеток связываться с соответствующими флуоресцентными красителями. Однако, эти методы более подходят для определения стволовых клеток в культуре тканей и в тканях организма, нежели для их выделения.
Для выделения и концентрирования стволовых клеток применяется метод рефрижераторного центрифугирования (центрифугирование клеточной смеси при температуре +40 С).
Для выделения стволовых клеток из костного мозга и крови в последнее время стал применяться метод иммуномагнитной сепарации. Метод основан на внесении в культуру клеток взвеси магнитных микросфер (диаметром 1 – 3 микрона), покрытых синтетической оболочкой (полистерол, полиакриламид и др. синтетические вещества) для обеспечения избирательной абсорбции микросфер на стволовых клетках. В дальнейшем стволовые клетки с апплицированными микросферами осаждались на постоянном магните. Пока этот метод в основном применяется при соответствующих лабораторных исследованиях.
4. Трансплантация стволовых клеток в лечебных целях
4.1. Трансплантация стволовых клеток с целью лечения лейкозов
В ходе осуществления этого лечебного мероприятия проводятся следующие операции:
- выделение стволовых клеток из костного мозга больного лейкозом;
- размножение стволовых клеток в культуре ткани;
- консервация стволовых клеток в жидком азоте;
- уничтожение опухолевых (лейкозных) клеток костного мозга облучением или цитостатиками;
- трансплантация сохраненных стволовых клеток в костный мозг пациента.
Положительный исход трансплантации зависит от того, насколько успешно будут выделены именно стволовые клетки, а не бластомные клетки костного мозга. С целью очищения пунктата костного мозга от бластомных клеток применяются метод индукции апоптоза в бластомных клетках, киллинг этих клеток моноклональными антителами и некоторые другие методы.
Следует иметь в виду, что таким же способом пробуют бороться и со злокачественными опухолями других локализаций путем введения в пораженный опухолью орган, подвергшийся облучению и (или) лечению цитостатиками, культуры стволовых клеток больного, полученных из его костного мозга.
4.2. Трансплантация препаратов стволовых клеток при массивных ожогах.
Ожоги являются одной из наиболее распространенных травм человека. В настоящее время в России больные с ожогами составляют 20% от всех травмированных больных. Летальность от ожоговой болезни доходит до 11%. Суспензия или пласты кожи человека, состоящие из фибробластов, получаются в лабораторных условиях из абортивного материала (фетальные фибробласты) или из мезенхимальных стволовых клеток костного мозга пациента. Помимо закрытия ожоговых кожных дефектов, данная методика может применяться при лечении трофических язв, в косметологии, а также для тестирования медицинских и косметических препаратов при проведении испытаний внешних воздействий на кожу. Следует иметь в виду, что в России (Институт хирургии им. А.В.Вишневского РАМН) лечение ожогов при помощи культивированных фибробластных трансплантатов ведется с 1989 года.
4.3. Трансплантация препаратов стволовых клеток при ожогах и травмах роговицы
В последнее время в научной литературе появились сообщения о возможности восстановления поврежденной роговицы глаза ожогом или травмой за счет применения стволовых клеток пациента, полученных из слизистой ротовой полости. Отдаленные результаты таких операции пока не ясны.
4.4. Трансплантация клеток фетальной печени при циррозах печени
Имеются данные экспериментальных исследований, посвященных возможности лечения цирроза печени при помощи трансплантации в печень мезенхимальных стволовых клеток костного мозга. Результаты экспериментов противоречивы: с одной стороны, якобы, зарегистрированы случаи трансформации стволовых клеток в гепатоциты, а с другой – трансплантация стволовых клеток приводила к развитию аутоиммунного гепатита или к их трансформации в фибробласты и прогрессированию цирроза.
4.5. Трансплантация стволовых клеток (эмбриональных, фетальных, собственных стволовых клеток пациента) при инфаркте миокарда
Результаты применения стволовых клеток или их производных для лечения последствий инфаркта миокарда и хронической сердечной недостаточности, полученные в результате экспериментальных исследований и клинических испытаний, в последнее время неоднократно публиковались в научной печати. С целью регенерации кардиомиоцитов, а также для стимуляции ангиогенеза в миокарде больных применялись эмбриональные стволовые клетки и мезенхимальные клетки костного мозга пациента. Результаты экспериментов и клинических испытаний весьма противоречивы. Возможные проблемы, возникающие в результате таких экспериментов, будут обсуждены позднее, в соответствующем разделе лекции.
4.6. Трансплантация стволовых клеток при заболеваниях головного мозга (инсульты, травмы, болезнь Альцгеймера)
В экспериментах и, в редких случаях, при клинических испытаниях, предпринимались попытки трансплантации стволовых клеток или их производных в головной мозг для лечения последствий инсультов, болезни Альцгеймера, болезни Паркинсона. Результаты экспериментов и клинических испытаний крайне противоречивы и требуют проведения дальнейших исследований и клинических наблюдений.
4.7. Трансплантация остеобластов, полученных из стволовых клеток, в зону перелома кости
В последние годы разработано несколько экспериментальных методик по применению стромальных стволовых клеток костного мозга для лечения переломов костей с замедленной консолидацией. Стволовые клетки применяют в комбинациях с органическими и минеральными матрицами, а также с использованием факторов роста в качестве стимуляторов остеорепарации.
4.8. Трансплантация стволовых клеток с целью «ревитализации» (омоложения) организма
Попытки применить стволовые клетки (эмбриональные и фетальные) для оздоровления организма, а также в гериатрии предпринимаются уже достаточно давно в большом количестве клиник во многих странах мира. Однако, кроме рекламы этих клиник, обещающих «сказочные» результаты омоложения и оздоровления организма, серьезных научных разработок в этой области практически не имеется. В некоторых клиниках, например, в Швейцарии (клиника ревитализации Лемана) в целях омоложения организма пациентов применяют эмбриональные клетки животных (овец). Стоимость одной операции по ревитализации (трехдневный курс, 4 инъекции стволовых клеток) обходится пациенту в 8 – 10 тыс. долларов.
- Проблемы, возникающие при получении, выделении и трансплантации стволовых клеток
Существует достаточно много проблем технического и этического характера, возникающих при получении и выделении стволовых клеток. Перечислим некоторые из них:
- терапевтическое и репродуктивное клонирование запрещено законом во многих странах мира. Из европейских стран терапевтическое клонирование разрешено только в Великобритании;
- получение фетальных стволовых клеток вызывает много этических вопросов. В ряде стран запрещено использование абортивного материала для медицинских целей;
- получение «пуповинных» стволовых клеток может быть связано с ранним пережатием пуповины, что наносит ущерб родившемуся ребенку;
- применение колониестимулирующих факторов для массивного выброса в периферическую кровь гемопоэтических и мезенхимальных стволовых клеток может вызывать излишнюю пролиферацию костного мозга, что может быть чревато его малегнизацией.
Трансплантация стволовых клеток в качестве лечебного мероприятия при ряде заболеваний человека пока еще недостаточно изученный метод, отдаленные результаты которого могут иметь весьма негативные последствия. Это, конечно, не означает, что исследования лечебных эффектов трансплантации стволовых клеток не должны производиться. В лечебную практику трансплантация стволовых клеток может войти только после ее тщательного лабораторного изучения, исключающего все возможные негативные последствия этой процедуры для здоровья людей. Остановимся кратко на тех серьезных проблемах трансплантации стволовых клеток, с которыми приходится сталкиваться экспериментаторам и клиницистам.
Значительное число публикаций в научной прессе в последние годы было посвящено аутотрансплантации стволовых клеток (гемопоэтических стволовых клеток костного мозга) в миокард больных, перенесших инфаркт миокарда или страдающих хронической сердечной недостаточностью. В целях доказательства позитивных результатов таких экспериментов (трансформация стволовых клеток в кардиомиоциты) применялись флюоресцентные моноклональные антитела, которые, благодаря способности связываться с рецепторном аппаратом кардиомиоцитов, якобы показывали, что в зоне инфаркта появляются новые кардиомиоциты, образовавшиеся из трансплантированных стволовых клеток.
Более тонкие эксперименты, проведенные учеными Университета имени Вашингтона в Сиэтле и Стэнфордского университета (США), в которых применялись генетические маркеры стволовых клеток, показали, что стволовые клетки только в течение 10 дней после трансплантации оставались в неизменном виде, но к 30 дню полностью исчезали из зоны трансплантации. Трансформация их в кардиомиоциты не обнаруживалась, а идентифицированные с помощью флюорересцентных моноклональных антител кардиомиоциты никакого отношения к трансформации стволовых клеток не имели и были нативными клетками сердца. Незначительный ангиогенез в зоне трансплантации
объяснялся результатом обкалывания зоны инфаркта, что и до этих экспериментов было уже хорошо известно. Благодаря работам ученых этих университетов США, а также в результате того, что трансплантация стволовых клеток постинфарктным больным в ряде случаев только ухудшало их положение, клинические испытания по трансплантации стволовых клеток в кардиологических клиниках США практически прекращены.
Представления о том, что трансплантируемые стволовые клетки не вызывают иммунного ответа организма не соответствуют действительности. Дело в том, что стволовые клетки действительно не экспрессируют на своей клеточной мембране молекул главного комплекса гистосовместимости. Благодаря этому обстоятельству они не подвергаются атакам Т-киллеров. Однако, клетки, не имеющие рецепторного аппарата главного комплекса гистосовместимости, подвергаются разрушению со стороны других иммунных клеток – клеток – естественных киллеров (NK-клеток), которые играют ведущую роль в противоопухолевой защите организма и реагируют именно на клетки, лишенные рецепторов главного комплекса гистосовместимости. Поэтому, при трансплантации стволовых клеток приходиться нейтрализовывать NK-клетки некоторыми химическими веществами, в частности, индометацином.
Многие исследователи и патологи высказывают опасения о том, что в некоторых случаях трансплантируемые стволовые клетки могут дать толчок малегнизации организма. В их опасениях есть рациональное зерно, особенно если рассматривать процесс малегнизации с точки зрения тканевой теории канцерогенеза.
Тканевая теория канцерогенеза является альтернативной к господствующей в настоящее время мутационной (клонально-селекционной) концепции рака, согласно которой опухолевые клетки – это результат мутаций и последующей селекции и клонирования клеток, имеющих кардинальные отличия не только от клетки-предшественника, но и от стволовой клетки, входящей в состав данной ткани. С точки зрения «мутационной» теории сложно объяснить такие явления как длительный период, требующийся для возникновения экспериментального рака, а также механизм развития злокачественной опухоли из клеток ткани, находящейся в предраковом состоянии, например, при хроническом воспалении и пролиферации.
С другой стороны, есть достаточно много данных о том, что стволовые клетки и клетки-предшественники («коммитированные» клетки) сами по себе обладают определенной степенью «злокачественности» даже в отсутствие канцерогенного воздействия на ткань.
Суммарно основные положения тканевой теории канцерогенеза выглядят следующим образом. Канцерогенное (повреждающее) воздействие на ткань вызывает с одной стороны гибель определенного количества клеток, а с другой – стимулирует компенсаторную хроническую пролиферацию. В ткани резко увеличивается концентрация факторов роста и снижается концентрация кейлонов, контролирующих деление стволовых клеток. Количество стволовых и коммитированных клеток в ткани возрастает. Возникает так называемая «эмбрионализация» ткани, клетки теряют трансмембранные рецепторы и молекулы адгезии, а «злокачественность» стволовых и коммитированных клеток проявляется в полной мере в отсутствие тканевого контроля над митотическим циклом. Возникает злокачественная опухоль, развивается процесс метастазирования.
Тканевая теория канцерогенеза, логично обосновывая происхождение опухолей на фоне некоторых предраковых состояний, вряд ли может быть в полной мере привлечена для объяснения вирусного канцерогенеза и опухолевых трансформаций клеток в результате достоверных мутаций ДНК под влиянием, например, радиационных факторов. Как это чаще всего бывает, истина, очевидно, лежит по середине: мутационная и тканевая теории канцерогенеза дополняют одна другую и могут быть использованы для создания единой теории происхождения злокачественных опухолей. С точки зрения этой теории, пересадки стволовых клеток собственного организма и, в особенности, эмбриональных стволовых клеток и стволовых клеток животных, может угрожать малегнизацией.
Особенно осторожно нужно подходить к попыткам трансплантации человеку стволовых клеток животных. Существует реальная опасность переноса в организм человека некоторых болезнетворных вирусов и онковирусов, не свойственных человеку.
Таковы основные сведения о свойствах стволовых клеток и возможности их применения в медицинских целях.
