«Фармзащита»
| Вид материала | Автореферат |
На правах рукописи
ВЛАСЕНКО
Татьяна Николаевна
ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ
ЭФФЕКТИВНОСТИ СОВМЕСТНОГО ПРИМЕНЕНИЯ
ПРЕПАРАТА Б-190 И ИНТЕРЛЕЙКИНА-1β
ПРИ ОСТРОМ ВНЕШНЕМ РАДИАЦИОННОМ ВОЗДЕЙСТВИИ
14.03.06 – фармакология, клиническая фармакология
03.01.01 радиобиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Санкт-Петербург
2011
Работа выполнена в ФГУП НПЦ «Фармзащита» ФМБА России, ФГВОУ ВПО «Военно-медицинская академия им. С.М.Кирова» МО РФ.
Научные руководители:
доктор биологических наук Назаров Виктор Борисович
доктор медицинских наук профессор Гребенюк Александр Николаевич
Официальные оппоненты:
доктор медицинских наук профессор Лесиовская Елена Евгеньевна
доктор биологических наук Чигарева Наталия Григорьевна
Ведущая организация: Учреждение Российской академии медицинских наук Научно-исследовательский институт фармакологии имени В.В. Закусова РАМН.
Защита диссертации состоится “ 19 ” апреля 2011 года в 12 часов на заседании диссертационного совета Д 208.030.01 при ФГУН «ИНСТИТУТ ТОКСИКОЛОГИИ» ФМБА России (192019, г. Санкт-Петербург, ул. Бехтерева, д. 1)
С диссертацией можно ознакомиться в фундаментальной библиотеке ФГУН «ИНСТИТУТ ТОКСИКОЛОГИИ» ФМБА России.
Автореферат разослан “ 15” марта 2011 года
Ученый секретарь диссертационного совета
доктор медицинских наук профессор
Луковникова Любовь Владимировна
Актуальность. Важными задачами современной фармакологии являются поиск и разработка новых эффективных лекарственных средств для
профилактики и лечения различных заболеваний, изучение механизмов их действия в экспериментах на животных и научное обоснование рациональных схем их применения. Для решения этих задач проводится поиск новых биологически активных фармакологических веществ среди природных и синтетических соединений, продуктов биотехнологии, генной инженерии, на экспериментальных моделях патологических состояний осуществляется оценка их эффективности и безопасности, изучается индивидуальная чувствительность к существующим и разрабатываемым лекарственным средствам [Середенин С.Б., Вальдман Е.А., 2003; Гуськова Т.А., 2010; Лесиовская Е.Е., 2010].
Одной из наиболее тяжелых патологий, требующей интенсивной фармакотерапии и профилактики, являются лучевые поражения, возникающие при остром внешнем радиационном воздействии [Бушманов А.Ю. и др., 2006; Гуськова А.К., 2008; Pellmar T.C., Rockwell S., 2005]. Возникновение таких поражений возможно при авариях и катастрофах на объектах атомной энергетики, в медицинских учреждениях, использующих источники ионизирующих излучений в диагностических или терапевтических целях, при диверсионном или террористическом применении радионуклидов [Аветисов Г.М., Гончаров С.Ф., 2002; Гребенюк А.Н. и др., 2009; Cirincione J. et al., 2002; Egger E., Münger K., 2004; Kuna P. et al., 2009]. Нельзя забывать и о необходимости предотвращения и лечения лучевых поражений у экипажей длительных пилотируемых космических экспедиций [Ушаков И.Б. и др., 2010; Seed T. et al., 2002]. Исходя из этого, одной из приоритетных задач современной фармакологии и радиобиологии становится разработка новых и совершенствование известных радиозащитных лекарственных препаратов, а также экспериментальное обоснование новых схем их применения.
В настоящее время наиболее изученными и высокоэффективными медицинскими средствами противорадиационной защиты являются радиопротекторы [Бутомо Н.В. и др., 2004; Васин М.В., 2006; Bump E., Malaker K., 1997; Seed Т., 2005]. Но их применение ограничено сроками использования (исключительно до радиационного воздействия), часто – малой терапевтической широтой и, как следствие, достаточно высокой токсичностью в оптимальных радиозащитных дозах. В качестве наиболее перспективных фармакологических средств для ранней терапии лучевой патологии рассматриваются препараты цитокинов и ростовых факторов [Чигарева Н.Г. и др., 2000; Легеза В.И. и др., 2001, 2010; Иванов А.А. и др., 2004; Neta R., 1997].
Цистамин, гаммафос и препарат Б-190 считают наиболее эффективными препаратами из группы радиопротекторов [Ильин Л.А. и др., 1994; Giambarresi L.J., Walker R.J., 1989; Kuna P. et al., 2004]. В ходе ликвидации последствий аварии на Чернобыльской атомной электростанции для профилактики радиационных поражений использовался препарат Б-190 – радиопротектор из группы биогенных аминов, реализующий свой эффект за счет прямого действия на α1-адренорецепторы [Ильин Л.А. и др., 2001; Васин М.В., 2010]. К числу наиболее перспективных противолучевых средств из группы цитокинов относят рекомбинантный интерлейкин-1β, в экспериментальных исследованиях показавший высокую эффективность как для профилактики, так и для ранней терапии лучевых поражений [Рождественский Л.М., 2001; Симбирцев А.С., 2008; Neta R., 1997; Grebenyuk A. et al., 2010].
Однако до настоящего времени остается нерешенным вопрос о сохранении радиопротекторной эффективности препарата Б-190 при последующем введении интерлейкина-1β, не изучены эффекты комбинированного применения этих лекарственных препаратов на состояние костномозгового кроветворения, количественный состав и функционально-метаболическое состояние лейкоцитов периферической крови. Вместе с тем, решение этих вопросов необходимо для создания новых высокоэффективных схем фармакологической профилактики и терапии радиационных поражений.
Целью исследования явилось экспериментальное обоснование схемы фармакологической профилактики и терапии острых радиационных поражений, включающей комбинированное применение препарата Б-190 до облучения и интерлейкина-1β в ранние сроки после радиационного воздействия.
Для реализации поставленной цели предстояло решить следующие основные задачи исследования:
1. Оценить радиозащитную эффективность последовательного профилактического применения препарата Б-190 и раннего лечебного использования интерлейкина-1β по показателям выживаемости и средней продолжительности жизни облученных в дозах СД50-100/30 мышей.
2. Изучить состояние костномозгового кроветворения у мышей, подвергнутых острому внешнему облучению без фармакологической защиты и в условиях последовательного применения препарата Б-190 до облучения и интерлейкина-1β после радиационного воздействия.
3. Определить модифицирующее влияние последовательного применения препарата Б-190 и интерлейкина-1β на динамику общего числа лейкоцитов, лимфоцитов и нейтрофилов в периферической крови мышей после радиационного воздействия.
4. Установить динамику содержания гликогена, активности миелопероксидазы и щелочной фосфатазы в нейтрофилах периферической крови мышей, подвергнутых облучению без фармакологической защиты и на фоне профилактического введения препарата Б-190 и раннего лечебного применения интерлейкина-1β.
Научная новизна. Впервые проведена комплексная оценка схемы фармакологической профилактики и терапии острых радиационных поражений, основанной на последовательном применении препарата Б-190 до облучения и интерлейкина-1β после острого внешнего радиационного воздействия.
Показано, что комбинированное применение препарата Б-190 и интерлейкина-1β позволяет увеличить число выживших после острого внешнего радиационного воздействия мышей в большей степени, чем изолированное введение этих фармакологических средств. Выявлено, что использование данной лечебно-профилактическая схемы позволяет снизить выраженность постлучевых нарушений костномозгового кроветворения, уменьшить глубину ранней постлучевой лейко-, лимфо- и нейтрофилопении, ускорить восстановление абсолютного содержания этих клеток в периферической крови. Установлен стимулирующий эффект комбинированного применения препарата Б-190 и интерлейкина-1 в отношении функционально-метаболического статуса нейтрофилов, измененного в результате облучения, который проявляется в поддержании более высокого уровня гликогена, уменьшении степени снижения активности миелопероксидазы и щелочной фосфатазы.
Практическая значимость. Экспериментально обоснован новый подход к повышению эффективности медицинской противорадиационной защиты посредством последовательного применения фармакологических средств радиопротектора препарата Б-190 за 15 мин до облучения и рекомбинантного интерлейкина-1β (беталейкина) через 15 мин после радиационного воздействия. В условиях острого внешнего радиационного воздействия комбинация этих фармакологических препаратов позволяет снизить глубину постлучевых нарушений гемопоэза, уменьшить выраженность лейкопении, ускорить восстановление основных субпопуляций лейкоцитов, нормализовать функционально-метаболический статус нейтрофилов, что, в конечном счете, приводит к увеличению выживаемости облученных в дозах СД50-100/30 мышей.
Основные положения, выносимые на защиту
1. Последовательное введение препарата Б-190 до радиационного воздействия и интерлейкина-1β в ранние сроки после облучения позволяет увеличить выживаемость лабораторных животных, подвергнутых внешнему острому относительно равномерному облучению, в большей степени, чем их изолированное применение.
2. Механизм фармакодинамического взаимодействия лекарственных средств препарата Б-190 и интерлейкина-1β при их комбинированном применении для профилактики и терапии радиационных поражений реализуется снижением глубины постлучевых нарушений гемопоэза, уменьшением выраженности ранней постлучевой лейко-, лимфо- и нейтрофилопении, ускорением восстановления абсолютного числа лейкоцитов в периферической крови, стимуляцией функционально-метаболического статуса нейтрофилов.
Реализация результатов исследования. Результаты, полученные в ходе диссертационного исследования, используются в научно-исследовательской работе Научно-производственного центра «Фармзащита» ФМБА России, учебном процессе на кафедрах военной токсикологии и медицинской защиты Государственного института усовершенствования врачей МО РФ и Военно-медицинской академии им. С.М. Кирова.
Апробация работы. Результаты исследования доложены на 3-й международной научной конференции «Экспериментальная и клиническая фармакология» (Минск, 2009), Международной научно-практической конференции «Актуальные вопросы взаимодействия медицинских служб Вооруженных Сил в условиях современных вызовов и угроз» (Светлогорск, 2009), международной научной конференции «Медико-биологические последствия Чернобыльской катастрофы» (Гомель, 2009), 5 съезде радиобиологического товарищества Украины (Ужгород, 2009), I Европейском конгрессе по военной медицине (Светлогорск, 2010), Third European International Radiation Protection Association Congress (Helsinki, 2010), VI съезде по радиационным исследованиям (Москва, 2010).
Связь темы диссертации с плановой тематикой научно-исследовательской работы учреждений. Исследование выполнялось в соответствии с плановой тематикой научно-исследовательских работ НПЦ «Фармзащита» ФМБА России (тема НИР №Р-167 шифр «Букашка», тема НИР №169 шифр «Комплекс», тема НИР №170 шифр «Синтетика») и Военно-медицинской академии им. С.М. Кирова (тема НИР № VMA.03.02.01.0808/0292 шифр «Гемопоэз», тема НИР № VMA.02.02.02.0810/0192 шифр «Цитокин»).
Личное участие автора. Автор принимала личное участие в планировании, организации и выполнении экспериментальных исследований, проводила учет и оценку их результатов, статистическую обработку, обобщение и анализ полученных данных.
Публикации. По теме диссертации опубликовано 17 научных работ, в том числе 5 статей в научных журналах, рекомендованных ВАК для публикации основных научных результатов диссертации на соискание ученой степени кандидата наук.
Объем и структура диссертации. Диссертация изложена на 150 страницах машинописного текста, состоит из введения, обзора литературы, описания материалов и методов исследования, главы собственных результатов, обсуждения, выводов, практических рекомендаций и списка литературы. В диссертации представлены 7 таблиц и 10 рисунков. Список литературы содержит 200 библиографических источников, из них 135 отечественных и 65 иностранных публикаций.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные исследования выполнены на 160 самцах белых беспородных мышей и 556 самцах гибридах F1 мышей линий (СВА х С57Вl) разводки питомника РАМН «Рапполово» (Ленинградская область).
Животных содержали в условиях вивария, не более чем по 20 мышей в клетке. Стандартный гранулированный корм они получали 1 раз в сутки с 10.00 до 13.00, воду – ad libitum. Перед проведением каждого эксперимента животные находились под наблюдением (в карантине) в течение не менее 14 сут. После окончания карантина мышей распределяли на группы методом рандомизации, больных и ослабленных животных в эксперимент не брали. При проведении исследования выполняли требования нормативно-правовых актов о порядке экспериментальной работы с применением животных, в том числе – по гуманному отношению к ним.
В работе использовали препарат Б-190 производства НПЦ «Фармзащита» ФМБА России (г. Химки, Московской обл.) и препарат рекомбинантного интерлейкина-1β человека, созданный методами генной инженерии в НИИ особо чистых биопрепаратов ФМБА России (г. Санкт-Петербург). Радиопротектор Б-190 мышам вводили однократно внутрибрюшинно в дозе 50 мг/кг в 0,2 мл 0,25% раствора винной кислоты за 15 мин до облучения. Интерлейкин-1, растворенный в 0,2 мл физиологического раствора, мышам вводили внутрибрюшинно в дозе 50 мкг/кг через 15 мин после облучения. Животным контрольных групп в те же сроки внутрибрюшинно вводили растворители в том же объеме.
Для экспериментального моделирования острых радиационных поражений животных подвергали общему внешнему однократному γ- или рентгеновскому облучению. Общее равномерное воздействие γ-излучением 137Cs на животных с 4 сторон осуществляли на установке ИГУР-1 с мощностью экспозиционной дозы 0,703 мА/кг (130 Р/мин), кожно-фокусное расстояние 1 м. Общее относительно равномерное рентгеновское облучение мышей осуществляли на рентгенотерапевтической установке РУМ-17 при следующих условиях: напряжение 180 кВ, сила тока 15 мА, фильтр 0,5 мм Cu + 1,0 мм Al, мощность экспозиционной дозы 0,292 мА/кг (52,2 Р/мин), кожно-фокусное расстояние 50 см, облучение одностороннее в направлении спина-грудь. Дозиметрический контроль γ-излучения и рентгеновского воздействия осуществляли с помощью индивидуального дозиметра ИД-11 с последующей оценкой показаний прибора на аппарате ГО-32.
Оценка радиозащитной и лечебной эффективности препаратов проводилась путем последовательного изучения 30-суточной выживаемости, средней продолжительности жизни погибших животных и динамики их гибели; количества сохранивших жизнеспособность гемопоэтических клеток костного мозга; абсолютного числа лейкоцитов, содержания нейтрофилов и лимфоцитов в циркулирующем пуле крови; постлучевых изменений функционально-метаболического статуса нейтрофилов периферической крови.
Оценка параметров выживаемости мышей, облученных без применения препарата Б-190, интерлейкина-1β или их комбинации и на фоне их введения, осуществлялась в ходе 30-суточного наблюдения за белыми беспородными мышами-самцами и самцами мышей-гибридов F1 (CBA x C57Bl).
В методиках эндогенного и экзогенного кроветворения [Till J.E., McCulloch E.A., 1961; Бутомо Н.В., 1992] по числу колоний, выросших в селезенках облученных мышей-гибридов F1 (CBA x С57В1) на 9-е сут после радиационного воздействия, анализировали состояние гемопоэза у животных, подвергнутых острому внешнему облучению без фармакологической защиты и в условиях применения препарата Б-190 и/или интерлейкина-1β. В ходе определения числа экзогенных колониеобразующих единиц на селезенке (КОЕ-С9) реципиентов облучали в дозе 8,5 Гр, доноров – в дозе 4,0 Гр. Через 60 мин после окончания введения препаратов доноров подвергали эвтаназии, извлекали по одной бедренной кости и готовили суспензию костного мозга. Содержание миелокариоцитов (мкц) во взвеси определяли в камере Горяева после разведения исходной суспензии костного мозга от необлученных мышей в 100 раз, от облученных в дозе 4,0 Гр – в 40 раз. Реципиентам опытных групп через 1 сут после их облучения в хвостовую вену вводили по 0,5 мл суспензии костного мозга от облученных или необлученных доноров, получавших Б-190, интерлейкин-1β, оба препарата или растворитель (физиологический раствор), мышам контрольной группы (эндогенный фон) – 0,5 мл раствора Хэнкса.
Определение общего количества лейкоцитов осуществляли меланжерным методом с последующим подсчетом клеток в камере Горяева. Для исследования лейкоцитарной формулы использовали способ быстрой окраски мазков крови краской Романовского [Альтгаузен А.Я., 1964]. Подсчет абсолютного количества нейтрофилов и лимфоцитов осуществляли на основании данных о числе лейкоцитов в периферической крови и относительного содержания нейтрофилов и лимфоцитов в лейкоцитарной формуле.
Оценку ключевых показателей функционально-метаболического статуса нейтрофилов периферической крови проводили путем цитохимического определения содержания гликогена, активности миелопероксидазы и щелочной фосфатазы при помощи соответствующих наборов реагентов «Диахим-ЦитоСтейн» производства НПФ «Абрис+» (г. Санкт-Петербург).
Полученные в ходе экспериментальных исследований данные подвергали стандартной статистической обработке с вычислением среднего значения показателя и его ошибки с помощью компьютерной программы «Statistica 6». Достоверность различий средних значений оценивали с использованием точного метода Фишера и t-критерия Стьюдента. Вероятность ошибки p < 0,05 и менее считали достаточной для вывода о статистической значимости различий полученных данных. ФИД под влиянием введения препаратов рассчитывали методом пробит-анализа по Финни с помощью компьютерной программы «StatPlus». Данные в таблицах представлены в виде М mx.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
В результате проведенных исследований установлено, что последовательное применение препарата Б-190 за 15 мин до облучения и интерлейкина-1β через 15 мин после радиационного воздействия позволяет увеличить выживаемость облученных мышей и сохранить в системе кроветворения у них больше клеток-предшественников, чем при изолированном использовании каждого из этих препаратов.
Эксперименты, направленные на определение показателей выживаемости и средней продолжительности жизни облученных животных, проводили на белых беспородных мышах-самцах, которых подвергали воздействию γ-излучения в дозах 6,3; 6,8 и 7,3 Гр. Профилактическое применение препарата Б-190 позволяло защитить часть мышей, подвергнутых действию γ-излучения, от лучевой гибели (рис. 1). Так, при дозе 6,3 Гр выживаемость мышей, которым за 15 мин до облучения вводили препарат Б-190, увеличилась на 10%, а при облучении в дозе 6,8 Гр – на 15% по сравнению с контролем. При радиационном воздействии в дозе 7,3 Гр использование Б-190 позволяло спасти от лучевой гибели более 30% облученных животных, в то время как в контрольной группе погибали все мыши.
Раннее терапевтическое применение интерлейкина-1β по этому критерию было одинаково или менее эффективно, чем профилактическое введение препарата Б-190: при облучении в дозе 6,3 Гр выживаемость леченных животных выросла на 10%, при облучении в дозе 6,8 Гр – на 8,3%, а при облучении в дозе 7,3 Гр интерлейкин-1β повышал выживаемость облученных животных на 20%.
При последовательном применении препарата Б-190 и интерлейкина-1β число выживших после радиационного воздействия мышей по сравнению с облученным контролем значительно увеличивалось: при облучении в дозе 6,3 Гр – на 40%, при облучении в дозе 6,8 Гр – почти на 60%, при облучении в дозе 7,3 Гр – более чем на 45%.
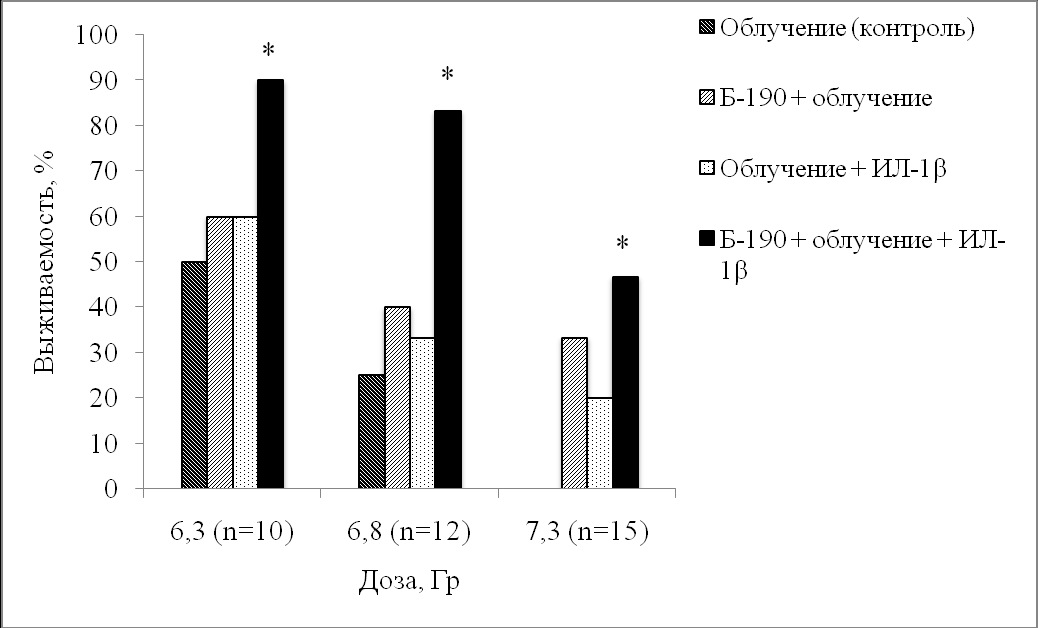
Рисунок 1 – Влияние препарата Б-190 и интерлейкина-1β (ИЛ-1β) на 30-суточную выживаемость белых беспородных мышей-самцов, подвергнутых острому γ-облучению в дозах 6,3; 6,8 и 7,3 Гр
* отличие от группы «Облучение (контроль)» достоверно, p < 0,05.
Следует также отметить, что ни одна из изученных схем профилактики и терапии радиационных поражений не оказала существенного влияния на среднюю продолжительность жизни погибших от облучения животных. Большая часть мышей погибала на 10–14-е сут после облучения, что соответствует типичным срокам гибели мелких лабораторных животных при костномозговой форме острой лучевой болезни.
Эффективность совместного применения препарата Б-190 и интерлейкина-1β была подтверждена экспериментальными исследованиями на мышах-самцах гибридах F1 (CBA x C57Bl), подвергнутых рентгеновскому облучению в дозе 8,0 Гр. В частности, при изолированном профилактическом введении препарата Б-190 выживаемость облученных мышей увеличилась на 26,7%, раннее терапевтическое использование интерлейкина-1β позволило повысить выживаемость на 40%. В то же время, профилактическое введение Б-190 за 15 мин до облучения и лечебное введение интерлейкина-1β через 15 мин после радиационного воздействия увеличивало выживаемость облученных в дозе СД80/30 мышей-гибридов на 53,3% по сравнению с контролем (табл. 1).
Таблица 1 – Влияние препарата Б-190 и интерлейкина-1β на 30-суточную выживаемость и среднюю продолжительность жизни мышей-самцов гибридов F1 (CBA x C57Bl), подвергнутых рентгеновскому облучению в дозе 8 Гр
| Условия эксперимента | Число животных в группе | Выжива-емость, % | Средняя продолжительность жизни погибших животных, сут |
| Биологический контроль | 15 | 100 | – |
| Облучение (контроль) | 15 | 20,0 | 9,4 ± 2,4 |
| Б-190 + облучение | 15 | 46,7 | 9,9 ± 3,9 |
| Облучение + ИЛ-1β | 15 | 60,0 | 13,5 ± 4,3 |
| Б-190 + облучение + ИЛ-1β | 15 | 73,3 * | 9,5 ± 3,5 |
| * отличие от группы «Облучение (контроль)» достоверно, p < 0,05. | |||
Оценку радиозащитной и лечебной эффективности изолированного и комбинированного применения данных препаратов в методиках эндогенного и экзогенного колониеобразования проводили на мышах-гибридах.
В результате этого этапа работы установлено, что препарат Б-190, интерлейкин-1β и их комбинация частично предотвращали постлучевую депрессию кроветворения. При этом число колоний в селезенках мышей-гибридов, оцененных в методике эндогенного колониеобразования (рис. 2), было выше в группе мышей, которым вводили комбинацию препаратов, по сравнению с группами животных, получавших только Б-190 или только интерлейкин-1β.
Как видно из рисунка 2, радиационное воздействие вызывало зависимое от дозы облучения понижение количества эндогенных колоний, выросших в селезенках облученных мышей-гибридов. Профилактическое применение препарата Б-190 за 15 мин до облучения позволяло сохранить в 3,1-3,5 раза больше колоний, чем у мышей контрольных групп (облучение). Использование интерлейкина-1β через 15 мин после радиационного воздействия было менее эффективно, чем применение Б-190, но, тем не менее, также позволяло сохранять в 2,5-3,1 раза больше колоний, чем у животных контрольных групп.

Рисунок 2 – Влияние препарата Б-190 и интерлейкина-1β (ИЛ-1β) на количество 9-суточных эндогенных колоний в селезенках мышей-самцов гибридов F1 (CBA x C57Bl), подвергнутых рентгеновскому облучению в дозах 6,5; 7 и 7,5 Гр
* отличие от группы «Облучение (контроль)» достоверно, p < 0,05;
# отличие от группы «Б-190 + облучение» достоверно, p < 0,05;
" отличие от группы «Облучение + ИЛ-1β» достоверно, p < 0,05.
Наибольшее число колоний, выросших в селезенках облученных мышей (то есть наибольшее число сохранивших жизнеспособность стволовых кроветворных клеток) было зарегистрировано у животных, получавших оба препарата. Так, последовательное профилактическое применение Б-190 и раннее лечебное применение интерлейкина-1β позволило сохранить в селезенках у мышей-гибридов, облученных в дозе 6,5 Гр, в 4 раза больше колоний. Количество эндогенных колоний у мышей-гибридов, облученных в дозах 6,5 и 7,0 Гр, получавших комбинированную фармакологическую защиту путем введения радиопротектора и стимулятора гемопоэза, было в 1,2-1,3 раза выше, чем после профилактического применения одного препарата Б-190, и в 1,3-1,7 раза выше, чем при лечебном введении интерлейкина-1β. При облучении в дозе 7,5 Гр последовательное введение Б-190 и интерлейкина-1β позволило увеличить количество эндогенных колоний более чем в 5 раз по сравнению с животными контрольной группы (облученные мыши без фармакологической защиты), и в 1,5 раза по сравнению с введением только Б-190 или только интерлейкина-1β.
Таким образом, последовательное профилактическое применение Б-190 за 15 мин до облучения и раннее лечебное применение интерлейкина-1β через 15 мин после облучения позволяет эффективно уменьшить постлучевое снижение количества колоний, выросших в селезенках облученных мышей на 9 сут после облучения в методике эндогенного колониеобразования.
Установлено также, что изолированное применение препарата Б-190 или ИЛ-1β не оказывало существенного влияния на количество 9-суточных колониеобразующих единиц (КОЕ-С9) в селезенках мышей-самцов F1 (CBA x C57Bl), выявленных в методике экзогенного колониеобразования (табл. 2).
Таблица 2 – Влияние препарата Б-190 и интерлейкина-1β (ИЛ-1β) на число миелокариоцитов (мкц) и количество КОЕ-С9, выявленных в методике экзогенного колониеобразования у мышей-самцов гибридов F1 (CBA x C57Bl), подвергнутых рентгеновскому облучению в дозе 4,0 Гр
| Условия эксперимента | Число МКЦ, х 106/бедро | Количество КОЕ-С9 | |
| в 1 бедре | на 106 мкц | ||
| Облучение | 18,3 | 64 ± 16 | 3,5 ± 0,9 |
| Б-190 + облучение | 20,0 | 88 ± 24 | 4,4 ± 1,2 |
| Облучение + ИЛ-1β | 20,8 | 72 ± 16 | 3,5 ± 0,8 |
| Б-190 + облучение + ИЛ-1β | 22,3 | 136 ± 8 * | 6,1 ± 0,4 * |
| Физиологический раствор | 23,8 | 320 ± 100 | 13,4 ± 4,2 |
| Б-190 | 25,3 | 400 ± 140 | 15,8 ± 5,5 |
| ИЛ-1β | 22,8 | 380 ± 40 | 14,9 ± 1,8 |
| Б-190 + ИЛ-1β | 20,8 | 520 ± 60 | 25 ± 2,9 |
| *отличие от группы «Облучение» достоверно, p < 0,05. | |||
В то же время у облученных мышей-гибридов, которым вводили препарат Б-190 и интерлейкин-1β, число КОЕ-С9 было в 2 раза выше, чем у животных контрольной группы (облучение), в 1,4 раза выше, чем у животных, получавших только Б-190, и в 1,7 раз выше, чем у животных, леченных только интерлейкином-1β. Полученные в ходе этого эксперимента данные также свидетельствуют о том, что последовательное введение препарата Б-190 за 15 мин до облучения и интерлейкина-1β через 15 мин после облучения способствует более выраженному уменьшению постлучевых нарушений костномозгового кроветворения, чем изолированное применение препаратов.
На следующем этапе наших исследований было установлено, что последовательное введение препарата Б-190 и интерлейкина-1β предотвращало снижение общего числа лейкоцитов, нейтрофилов и лимфоцитов периферической крови у облученных в дозе 8,0 Гр мышей в ранние сроки после облучения и ускоряло темп их восстановления. К 30 сут наблюдения уровень лейкоцитов в периферической крови облученных мышей, получавших препарат Б-190 и интерлейкин-1β, практически не отличался от аналогичного показателя фона (табл. 3).
Как видно из данных, представленных в таблице 4, как изолированное, так и последовательное применение препаратов Б-190 и интерлейкина-1β оказывало стимулирующее влияние на нейтрофилы периферической крови облученных животных, что проявлялось в достоверном увеличении содержания гликогена, повышении активности миелопероксидазы и щелочной фосфатазы в этих клетках по сравнению с аналогичными показателями контрольных групп.
Так, острое внешнее радиационное воздействие в дозе 8,0 Гр вызывало снижение содержания гликогена в нейтрофилах с 1 по 9 сут наблюдения, с последующей тенденцией к восстановлению данного показателя. Профилактическое применение препарата Б-190, как и раннее терапевтическое использование интерлейкина-1β практически полностью повторяло динамику содержания гликогена в нейтрофилах облученных мышей. Изучаемая схема профилактики и ранней терапии радиационных поражений по этому критерию оказалась более эффективной: через 4 сут и 9 сут после облучения содержание гликогена в нейтрофилах мышей, получавших комбинацию двух препаратов, достоверно (p < 0,05) превышало соответствующие показатели групп контроля (облучения) и изолированного применения препарата Б-190 или интерлейкина-1β.
Применение препарата Б-190, интерлейкина-1β и их комбинации способствовало также снижению глубины раннего постлучевого ингибирования миелопероксидазы и более быстрой нормализации активности данного фермента. При этом статистически значимых различий в выраженности эффекта изучаемых препаратов при их изолированном применении по сравнению с их последовательным введением ни в один из сроков исследования не выявлялось.
Кроме того, применение изучаемых фармакологических препаратов позволяло уменьшить глубину снижения активности щелочной фосфатазы и ускорить темп ее восстановления. Однако статистически значимые отличия по сравнению с контролем (облучением) регистрировались только при использовании схемы фармакологической профилактики и терапии радиационных поражений, включающей последовательное применение препарата Б-190 до облучения и интерлейкина-1β после радиационного воздействия.
Таблица 3 – Влияние препарата Б-190 и интерлейкина-1β (ИЛ-1β) на абсолютное количество лейкоцитов, нейтрофилов и лимфоцитов в периферической крови у мышей-самцов гибридов F1 (CBA x C57Bl), подвергнутых рентгеновскому облучению в дозе 8,0 Гр (n = 6)
| Показатель | Условия облучения | Сроки исследования, сут | |||||
| До облучения | После облучения | ||||||
| 1 | 4 | 9 | 18 | 30 | |||
| Лейко-циты, х 109/л | Облучение (контроль) | 5,53±0,08 | 1,48±0,06 | 0,82±0,04 | 0,39±0,07 | 1,17±0,05 | 3,40±0,13 |
| Б-190 + облучение | 5,48±0,07 | 2,12±0,06* | 1,65±0,06*“ | 0,61±0,01* | 2,42±0,06*" | 4,35±0,07* | |
| Облучение + ИЛ-1β | 5,46±0,07 | 2,10±0,08* | 1,38±0,06* | 0,57±0,04* | 2,13±0,06* | 4,40±0,12* | |
| Б-190 + облучение +ИЛ-1β | 5,56±0,08 | 2,29±0,09*#“ | 1,76±0,05*#“ | 0,60±0,03* | 2,82±0,02*#“ | 5,16±0,16*#“ | |
| Нейтрофилы, х 109/л | Облучение (контроль) | 1,46±0,19 | 1,19±0,12 | 0,58±0,02 | 0,14±0,01 | 0,66±0,11 | 1,29±0,19 |
| Б-190 + облучение | 1,40±0,12 | 1,77±0,12* | 1,00±0,13*“ | 0,17±0,02 | 1,23±0,13* | 1,81±0,27 | |
| Облучение + ИЛ-1β | 1,41±0,15 | 1,53±0,20* | 0,62±0,13 | 0,15±0,01 | 1,24±0,26* | 2,28±0,22* | |
| Б-190 + облучение +ИЛ-1β | 1,49±0,21 | 1,71±0,11* | 0,91±0,11“ | 0,16±0,02 | 1,38±0,35* | 2,23±0,34* | |
| Лимфо-циты, х 109/л | Облучение (контроль) | 4,06±0,24 | 0,18±0,05 | 0,18±0,06 | 0,14±0,03 | 0,51±0,16 | 2,11±0,13 |
| Б-190 + облучение | 4,08±0,19 | 0,35±0,10 | 0,44±0,09* | 0,25±0,06 | 1,19±0,21* | 2,54±0,29 | |
| Облучение + ИЛ-1β | 4,05±0,21 | 0,61±0,14*# | 0,70±0,07* | 0,20±0,04 | 0,89±0,20* | 2,12±0,33 | |
| Б-190 + облучение +ИЛ-1β | 4,07±0,20 | 0,58±0,14*# | 0,84±0,08* | 0,19±0,03 | 1,43±0,33* | 2,93±0,27*“ | |
| * отличие от группы «Облучение (контроль)» достоверно, p < 0,05; # отличие от группы «Б-190+облучение» достоверно, p < 0,05; “ отличие от группы «Облучение+ИЛ-1β» достоверно, p < 0,05 | |||||||
Таблица 4 – Влияние препарата Б-190 и интерлейкина-1β (ИЛ-1β) на содержание гликогена, активность миелопероксидазы и щелочной фосфатазы в нейтрофилах периферической крови мышей-самцов гибридов F1 (CBA x C57Bl), подвергнутых рентгеновскому облучению в дозе 8,0 Гр (n = 6)
| Показатель | Условия облучения | Сроки исследования, сут | |||||
| До облучения | После облучения | ||||||
| 1 | 4 | 9 | 18 | 30 | |||
| Гликоген, усл. ед. | Облучение (контроль) | 1,92 ± 0,09 | 1,37 ± 0,07 | 1,24 ± 0,06 | 1,20 ± 0,05 | 1,30 ± 0,06 | 1,42 ± 0,06 |
| Б-190 + облучение | 1,90 ± 0,07 | 1,41 ± 0,05 | 1,32 ± 0,09 | 1,24 ± 0,06 | 1,37 ± 0,09 | 1,48 ± 0,08 | |
| Облучение + ИЛ-1β | 1,94 ± 0,07 | 1,43 ± 0,08 | 1,35 ± 0,10 | 1,28 ± 0,05 | 1,40 ± 0,10 | 1,51 ± 0,05 | |
| Б-190 + облучение +ИЛ-1β | 1,91 ± 0,08 | 1,45 ± 0,07 | 1,40 ± 0,07* | 1,35±0,07* | 1,42 ± 0,08 | 1,52 ± 0,07 | |
| Миелопероксидаза, усл. ед. | Облучение (контроль) | 1,36 ± 0,08 | 1,11 ± 0,04 | 1,18 ± 0,05 | 0,74 ± 0,05 | 1,25 ± 0,05 | 1,35 ± 0,05 |
| Б-190 + облучение | 1,34 ± 0,09 | 1,24 ± 0,06* | 1,27 ± 0,05 | 0,98 ± 0,08* | 1,32 ± 0,04 | 1,43 ± 0,09 | |
| Облучение + ИЛ-1β | 1,37 ± 0,07 | 1,26 ± 0,05* | 1,29 ± 0,06 | 1,01 ± 0,07* | 1,34 ± 0,07 | 1,44 ± 0,08 | |
| Б-190 + облучение +ИЛ-1β | 1,35 ± 0,10 | 1,31 ± 0,08* | 1,31 ± 0,04* | 1,05± 0,09* | 1,36 ± 0,06 | 1,44 ± 0,06 | |
| Щелочная фосфатаза, усл. ед. | Облучение (контроль) | 1,77 ± 0,08 | 1,55 ± 0,05 | 1,54 ± 0,07 | 1,51 ± 0,07 | 1,60 ± 0,06 | 1,72 ± 0,05 |
| Б-190 + облучение | 1,74 ± 0,05 | 1,61 ± 0,08 | 1,60 ± 0,09 | 1,61 ± 0,08 | 1,68 ± 0,09 | 1,77 ± 0,09 | |
| Облучение + ИЛ-1β | 1,75 ± 0,07 | 1,62 ± 0,07 | 1,61 ± 0,08 | 1,64 ± 0,09 | 1,68 ± 0,08 | 1,77 ± 0,08 | |
| Б-190 + облучение +ИЛ-1β | 1,76 ± 0,06 | 1,66 ± 0,04* | 1,64 ± 0,08 | 1,67 ± 0,07* | 1,72 ± 0,07* | 1,81 ± 0,07 | |
| * отличие от группы «Облучение (контроль)» достоверно, p < 0,05 | |||||||
Полученные нами данные о радиопротекторной эффективности препарата Б-190 и ранней терапевтической активности интерлейкина-1β совпадают с результатами ранее проведенных исследований [Васин М.В., 2006; Рождественский Л.М., 2007; Тимошевский А.А., 2009; Neta R., 1997] и дополняют их, расширяя представления о механизмах действия этих препаратов.
Ранее высокая степень противолучевой защиты при применении препарата Б-190 была установлена в экспериментальных исследованиях на многих видах лабораторных животных: мыши, крысы, сирийские хомячки, морские свинки, кролики, собаки и обезьяны [Васин М.В., 2006]. Противолучевые свойства Б-190 связаны с прямым действием этого препарата на α1-адренорецепторы, развитием вазоконстрикторного эффекта, снижением напряжения кислорода в подкожной клетчатке и костном мозге. Возможным механизмом является также усиление потребления кислорода, что при наличии фармакологической циркуляторной гипоксии может существенно усилить гипоксию в клетках и тем самым резко повысить их радиорезистентность [Васин М.В., 2008]. Для стимулятора гемопоэза интерлейкина-1β этот механизм не является существенным. Однако его введение мышам после облучения позволяет увеличить радиопротекторную эффективность препарата Б-190, оцененную по критериям выживаемости облученных мышей. В ходе нашего исследования было показано, что последовательное профилактическое применение препарата Б-190 и раннее терапевтическое введение интерлейкина-1β позволяет увеличить выживаемость мышей, облученных в дозах СД50-100/30, на 40–60%, хотя и не оказывает существенного влияния на среднюю продолжительность жизни погибших животных.
Одним из наиболее важных механизмов, лежащих в основе радиозащитного эффекта последовательного применения данных препаратов, по нашему мнению, является активация под влиянием интерлейкина-1β пролиферации и дифференцировки стволовых кроветворных клеток, в большем числе сохранившихся в костном мозге облученных мышей вследствие протекторного действия препарата Б-190, а также стимуляция функционального потенциала клеток периферической крови. Подтверждением справедливости этого суждения является тот факт, что как изолированное применение интерлейкина-1β, так и его совместное применение с препаратом Б-190 способствует снижению выраженности постлучевых нарушений костномозгового кроветворения. То, что интерлейкин-1β действует, преимущественно, на стволовой кроветворный пул, сохраняя часть клеток от гибели и/или интенсифицируя его пролиферацию, было показано и ранее [Рождественский Л.М. и др., 2002; Neta R., 1997]. Однако в ходе наших исследований было выявлено, что наибольшее количество КОЕ-С9 у облученных мышей определялось при последовательном применении препарата Б-190 до облучения и интерлейкина-1β после радиационного воздействия.
Таким образом, в результате проведенных нами исследований установлено, что последовательное профилактическое введение препарата Б-190 до лучевого воздействия и раннее терапевтическое применение интерлейкина-1β после облучения может рассматриваться в качестве новой высокоэффективной схемы фармакологической профилактики и лечения радиационных поражений от острого внешнего относительно равномерного облучения.
ВЫВОДЫ
1. В условиях острого внешнего радиационного воздействия лечебно-профилактическая схема противорадиационной защиты, включающая применение за 15 мин до радиационного воздействия препарата Б-190 в дозе 50 мг/кг и раннее (через 15 мин после радиационного воздействия) лечебное использование интерлейкина-1β в дозе 50 мкг/кг, позволяет увеличить выживаемость облученных в дозах СД50-100/30 мышей, подвергнутых γ- или рентгеновскому облучению, на 40–60%, не оказывая существенного влияния на среднюю продолжительность жизни погибших животных.
2. Как изолированное, так и комбинированное применение препарата Б-190 и интерлейкина-1 способствует снижению выраженности постлучевых нарушений костномозгового кроветворения у мышей, подвергнутых рентгеновскому облучению в дозах СД70-90/30. Наибольшее количество колониеобразующих единиц на селезенках облученных мышей в методиках эндогенного и экзогенного колониеобразования определяется при последовательном введении препарата Б-190 до облучения и интерлейкина-1 после радиационного воздействия.
3. При рентгеновском облучении мышей в дозе 8,0 Гр последовательное применение препарата Б-190 и интерлейкина-1β позволяет уменьшить выраженность ранней постлучевой лейко-, лимфо- и нейтрофилопении и ускорить восстановление абсолютного содержания лейкоцитов, нейтрофилов и лимфоцитов в периферической крови мышей после радиационного воздействия.
4. Стимулирующий эффект комбинированного применения препарата Б-190 и интерлейкина-1 в отношении показателей функционально-метаболического статуса нейтрофилов, измененных в результате облучения, проявляется в поддержании более высокого уровня гликогена, предотвращении постлучевого снижения активности миелопероксидазы и щелочной фосфатазы.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Результаты проведенных исследований позволяют рекомендовать дальнейшее изучение эффективности схемы фармакологической профилактики и терапии радиационных поражений, включающей последовательное применение препарата Б-190 до облучения и интерлейкина-1 после радиационного воздействия в экспериментах на крупных лабораторных животных (собаки, обезьяны).
2. Алгоритм, включающий последовательное изучение выживаемости, средней продолжительности жизни и динамики гибели облученных лабораторных животных, состояния их костномозгового кроветворения, количества лейкоцитов, нейтрофилов и лимфоцитов циркулирующего пула, содержания гликогена, активности миелопероксидазы и щелочной фосфатазы в нейтрофилах периферической крови, может быть рекомендован для оценки эффективности новых схем фармакологической профилактики и терапии радиационных поражений, формирующихся при остром внешнем облучении.
СПИСОК РАБОТ,
ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи в научных изданиях, рекомендованных ВАК:
- Гребенюк А.Н. Влияние последовательного применения препарата Б-190 и интерлейкина-1β на выживаемость и костномозговое кроветворение облученных мышей / А.Н. Гребенюк, В.В. Зацепин, Т.Н. Власенко и др. // Радиационная биология. Радиоэкология. – 2010. – Т. 50, № 4. – С. 475-480.
- Зацепин В.В. Экспериментальное обоснование комплексного применения препарата Б-190 и интерлейкина-1β при остром облучении / В.В. Зацепин, Т.Н. Власенко, В.Б. Назаров, А.Н. Гребенюк // Военно-медицинский журнал. – 2010. – Т. 331, № 8. – С. 48-49.
- Власенко Т.Н. Современные подходы к фармакологической профилактике радиационных поражений / Т.Н. Власенко, В.Б. Назаров, А.Н. Гребенюк // Биомедицинский журнал «Medline.Ru». – 2010. – Т. 11. – С. 230-253. (режим доступа – ne.ru, доступ свободный).
- Власенко Т.Н. Современные подходы к ранней фармакотерапии радиационных поражений / Т.Н. Власенко, В.Б. Назаров, А.Н. Гребенюк // Биомедицинский журнал «Medline.Ru». – 2010. – Т. 11. – С. 503-517. (режим доступа ne.ru, доступ свободный).
- Гребенюк А.Н. Современные возможности медикаментозной профилактики и ранней терапии радиационных поражений / А.Н. Гребенюк, В.В. Зацепин, В.Б. Назаров, Т.Н. Власенко // Военно-медицинский журнал. – 2011. – Т. 332, № 2. – С. 13-17.
Статьи в журналах, сборниках трудов, тезисы докладов:
- Власенко Т.Н. Экспериментальная фармакология современных противолучевых средств / Т.Н. Власенко, В.Б. Назаров, А.Н. Гребенюк и др. // Экспериментальная и клиническая фармакология: Тез. докл. III междунар. науч. конф. – Минск, 2009. – С. 24-25.
- Власенко Т.Н. Перспективные направления совершенствования схемы комплексной профилактики и терапии лучевых поражений / Т.Н. Власенко, А.Н. Гребенюк, В.В. Зацепин и др. // Актуальные вопросы взаимодействия медицинских служб Вооруженных Сил в условиях современных вызовов и угроз: Тез. докл. междунар. науч.-практ. конф. – М., 2009. – С. 37-38.
- Гребенюк А.Н. Новые подходы к фармакологическому обеспечению противорадиационной защиты / А.Н. Гребенюк, Н.В. Аксенова, Т.Н. Власенко и др. // Медико-биологические последствия Чернобыльской катастрофы: Материалы междунар. науч. конф. – Гомель, 2009. – С. 27-29.
- Власенко Т.Н. Экспериментальная оценка радиозащитной эффективности индралина и интерлейкина-1β по критерию выживаемости облученных животных / Т.Н. Власенко, А.Н. Гребенюк, В.Б. Назаров и др. // VI Съезд радиобиологического товарищества Украины: Тез. докл. – Ужгород, 2009. – С. 156.
- Grebenyuk A. Radioprotective efficiency from consecutive application of indralin and interleukin-1β at the acute irradiation / A. Grebenyuk, V. Nazarov, T. Vlasenko et al. // Third European International Radiation Protection Association Congress: Abstracts. – Helsinki, 2010. – P. 221.
- Grebenyuk A. Radioprotective efficiency from consecutive application of indralin and interleukin-1β at the acute irradiation / A. Grebenyuk, V. Nazarov, T. Vlasenko et al. // Third European International Radiation Protection Association Congress: – Helsinki, 2010. – 7 p. (Full papers of poster presentations; режим доступа ссылка скрыта, доступ свободный).
- Гребенюк А.Н. Особенности медицинской защиты при ликвидации последствий химических и радиационных аварий / А.Н. Гребенюк, Д.Ю. Минаев, Т.Н. Власенко // I Европейский конгресс по военной медицине: Тез. докл. – М., 2010. – С. 43.
- Гребенюк А.Н. Стратегия принятия решений по медицинской защите лиц, привлекаемых к ликвидации радиационных аварий / А.Н. Гребенюк, В.В. Зацепин, Д.Ю. Минаев, Т.Н. Власенко // Актуальные вопросы радиационной гигиены: Материалы науч.-практ. конф. с междунар. участием. – СПб., 2010. – С. 31-33.
- Зацепин В.В. Оценка радиозащитного эффекта комплексного применения радиопротекторов и стимуляторов гемопоэза / В.В. Зацепин, А.Н. Гребенюк, В.Б. Назаров, Т.Н. Власенко // Современные проблемы радиобиологии: Материалы междунар. науч. конф. – Минск, 2010. – С. 57-58.
- Власенко Т.Н. Радиопротекторный эффект препарата Б-190 при его комбинации с интерлейкином-1 и лакоцином / Т.Н. Власенко, Н.В. Аксенова, В.В. Зацепин и др. // VI Съезд по радиационным исследованиям: Тез. докл. – М., 2010. – Т. 1. – С. 179.
- Власенко Т.Н. Сравнительная оценка эффективности изолированного и совместного применения препарата Б-190 и интерлейкина-1 для защиты мышей при остром облучении / Т.Н. Власенко // VI Съезд по радиационным исследованиям: Тез. докл. – М., 2010. – Т. 1. – С. 180.
- Гребенюк А.Н. Интерлейкин-1 в системе медицинской противорадиационной защиты / А.Н. Гребенюк, А.А. Тимошевский, Т.Н. Власенко и др. // VI Съезд по радиационным исследованиям: Тез. докл. – М., 2010. – Т. 1. – С. 182.
