Правила техніки безпеки. Класи неорганічних сполук (2год.) Правила техніки безпеки при роботі в хімічній лабораторії
| Вид материала | Закон |
- Календарно-тематичне планування з інформатики, 39.19kb.
- Тема. Правила техніки безпеки І поведінки при роботі з комп’ютером, 398.78kb.
- Забезпечення використання бюджетних асигнувань за цільовим призначенням, 21.64kb.
- Правила безпечної експлуатації електроустановок споживачів київ 1998, 4342.02kb.
- Правила безпеки при виробництві солоду, пива та безалкогольних напов київ 1997 передмов, 5024.56kb.
- Правила безпеки систем газопостачання України, 2071.23kb.
- Правила будови, виготовлення, монтажу, ремонту І безпечної експлуатації вибухозахищених, 744.53kb.
- Правила техніки безпеки під час роботи в комп’ютерному класі. Урок, 489.45kb.
- Правила внутрішнього трудового розпорядку фінансового управління Недригайлівської районної, 75.92kb.
- Тема уроку, 27kb.
ПИТАННЯ
ДЛЯ ПІДГОТОВКИ ДО ЛАБОРАТОРНИХ ЗАНЯТЬ З ‘‘ ХІМІЇ З ОСНОВАМИ БІОГЕОХІМІЇ ’’
ДЛЯ СТУДЕНТІВ 1-го КУРСУ, ГРУП ЕКО (НА 1-ий ТА 2-ий ТРИМЕСТР)
ПЕРШИЙ ТРИМЕСТР
МОДУЛЬ-1
1. ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ. КЛАСИ НЕОРГАНІЧНИХ СПОЛУК (2год.)
- Правила техніки безпеки при роботі в хімічній лабораторії.
- Методи отримання, класифікація і хімічні властивості оксидів.
- Методи отримання і хімічні властивості основ.
- Добування і хімічні властивості кислот.
- Класифікація, добування і хімічні властивості солей.
2. ОСНОВНІ ЗАКОНИ ХІМІЇ. ВИЗНАЧЕННЯ ЕКВІВАЛЕНТА РЕЧОВИНИ. (2год.)
- Закон збереження матерії. Закон сталості складу і кратних відношень.
- Закон еквівалентів. Обчислення еквівалентних мас простих та складних речовин.
- Закон Авогадро і наслідки з нього.
- Закони ідеальних газів. Рівняння Менделєєва-Клапейрона.
3. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. (2год.)
- Теорія окисно-відновних реакцій. Ступінь окиснення. Окисники і відновники.
- Типи окисно-відновних реакцій. Приклади.
- Метод електронного балансу.
- Складання рівнянь окисно-відновних реакцій.
4. ХІМІЧНА ТЕРМОДИНАМІКА. (4год.)
- Основні поняття термодинаміки: система, фаза, внутрішня енергія, ентальпія. Перший закон термодинаміки.
- Термохімія. Закон Гесса і наслідки з нього. Теплота утворення речовини.
- Другий закон термодинаміки. Ентропія і її зміст. Рівняння Больцмана.
- Вільна енергія Гіббса. Основне рівняння термодинаміки. Визначення напрямку хімічних процесів. Приклади.
5. ХІМІЧНА КІНЕТИКА. (2год.)
- Кінетика. Швидкість хімічних реакцій, її залежність від концентрації. Закон діючих мас в гомогенних та гетерогенних системах.
- Вплив температури на швидкість хімічних реакцій. Правило Вант-Гоффа. Рівняння Арреніуса. Енергія активації і її фізичний зміст. Поняття про каталіз.
МОДУЛЬ-2
6. ХІМІЧНА РІВНОВАГА. (2год.)
1. Хімічна рівновага. Константа рівноваги. Рівноважні концентрації речовин.
2. Принцип Ле-Шательє. Приклади зрушення рівноваги в гомогенних та гетерогенних системах під дією різних факторів.
7. РОЗЧИНИ НЕЕЛЕКТРОЛІТІВ. СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РОЗЧИНІВ. (2год.)
- Класифікація дисперсних систем. Істинні розчини. Способи вираження концентрації розчинів. Приклади.
- Осмос. Закон осмотичного тиску Вант-Гоффа.
- Тиск насиченого пару над розчином. Закон Рауля.
- Пониження температури замерзання і підвищення температури кипіння розчинів.
8. РОЗЧИНИ ЕЛЕКТРОЛІТІВ. ВОДНЕВИЙ ПОКАЗНИК, ГІДРОЛІЗ СОЛЕЙ. (4год.)
- Теорія електролітичної дисоціації розчинів. Дисоціація кислот, основ, солей.
- Слабкі і сильні електроліти. Ступінь і константа електролітичної дисоціації, їх зв’язок.
- Дисоціація води. Іонний добуток води. Водневий показник рН.
- Індикатори середовища, механізм їх дії.
- Гідроліз солей (Na
 CO
CO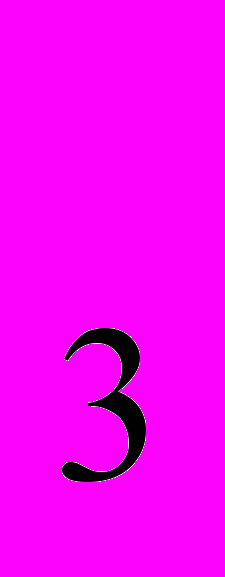 , AlCl
, AlCl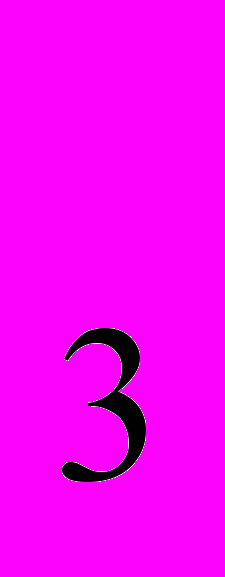 , CH
, CH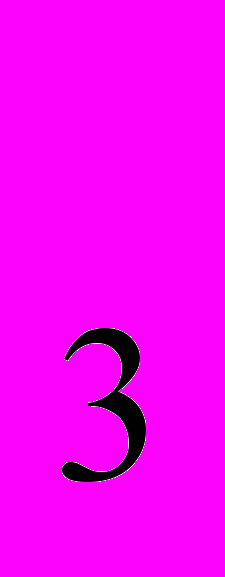 COONH
COONH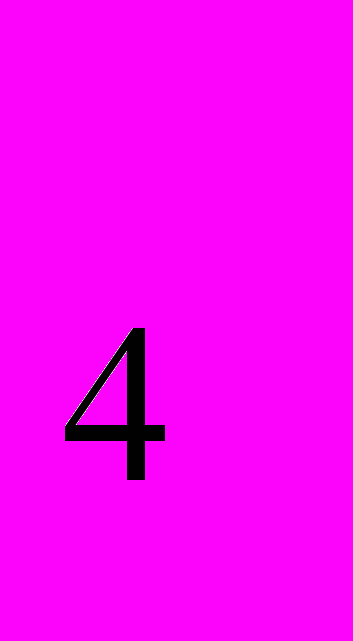 ). Записати рівняння реакцій в молекулярному та йонному вигляді. Вказати рН середовища в розчинах цих солей.
). Записати рівняння реакцій в молекулярному та йонному вигляді. Вказати рН середовища в розчинах цих солей.
- АНАЛІЗ ЯКОСТІ ВОДИ. ТВЕРДІСТЬ ВОДИ. (2год.)
- Молекула води. Будова води в рідкому і твердому стані. Водневі зв’язки.
- Фізичні та хімічні властивості води.
- Тимчасова і постійна твердість води. Солевміст, окиснюваність води.
- Методи пом’якшення води. Методи видалення кисню з води. Основні етапи очистки води.
- ВЛАСТИВОСТІ КОМПЛЕКСНИХ СПОЛУК МЕТАЛІВ. (4год.)
- Структура комплексних сполук. Координаційна теорія А.Вернера. Комплексоутворювачі і ліганди, координаційні числа.
- Номенклатура комплексних сполук та їх класифікація.
- Ізомерія комплексних сполук. Приклади.
- Стійкість комплексних сполук. Константа нестійкості. Застосування комплексних сполук.
ДРУГИЙ ТРИМЕСТР
МОДУЛЬ-3
11. ХІМІЧНІ ВЛАСТИВОСТІ ГАЛОГЕНІВ ТА ЇХ СПОЛУК. (2год.)
- Знаходження в природі, добування, фізичні та хімічні властивості галогенів. Застосування галогенів.
- Гідрогенгалогени та їх властивості. Гідрогенгалогенові кислоти та їх солі.
- Сполуки галогенів з Оксисеном та їх похідні.
- Біологічна функція і токсична дія галогенів та їх сполук.
- ХІМІЧНІ ВЛАСТИВОСТІ СПОЛУК СУЛЬФУРУ. ОКСИДИ І КИСЛОТИ СУЛЬФУРУ. (4год.)
- Сірка в природі. Отримання сірки. Властивості та застосування сірки.
- Сполуки Сульфуру з Гідрогеном і металами, їх коротка характеристика.
- Сполуки Сульфуру з Оксигеном. Сірчистий газ і сірчиста кислота та її солі.
- Сульфуртриоксид (SO
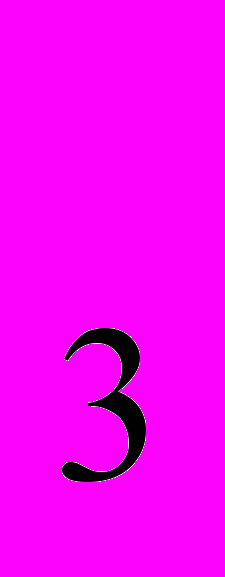 ). Сульфатна кислота її властивості, добування і використання. Сульфати.
). Сульфатна кислота її властивості, добування і використання. Сульфати.
- Колообіг Сульфуру в природі. Біологічна функція і токсична дія сполук Сульфуру.
- ХІМІЧНІ ВЛАСТИВОСТІ НІТРОГЕНУ ТА ЙОГО СПОЛУК З ГІДРОГЕНОМ ТА ОКСИГЕНОМ. (4год.)
- Азот в природі. Його властивості і застосування.
- Сполуки Нітрогену з Гідрогеном, їх властивості, добування і застосування.
- Оксиди Нітрогену та їх властивості.
- Методи отримання, властивості і застосування кислот HNO
 та HNO
та HNO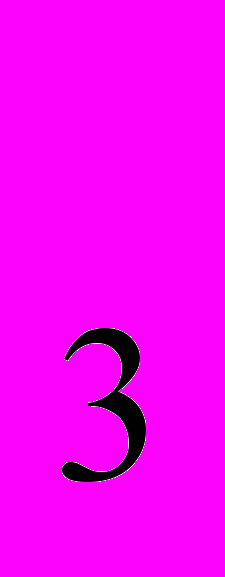 .
.
- Біологічна функція Нітрогену та токсична дія його сполук.
14.ХІМІЧНІ ВЛАСТИВОСТІ ФОСФОРУ ТА ЙОГО СПОЛУК. (2год.)
- Поширення Фосфору в природі, його добування, фізичні та хімічні властивості і застосування.
- Сполуки Фосфору з Гідрогеном і галогенами.
- Сполуки Фосфору з Оксигеном та їх похідні.
- Біологічна функція Фосфору і токсична дія його сполук.
МОДУЛЬ-4
15. ВЛАСТИВОСТІ КАРБОНУ, СИЛІЦІЮ ТА ЇХ СПОЛУК. (2год.)
- Карбон в природі. Його фізичні властивості та застосування. Адсорбція на вугіллі. Алмаз, графіт та карбон їх властивості. Хімічні властивості Карбону.
- Сполуки Карбону з Нітрогеном та їх дія на стан довкілля.
- Сполуки Карбону з Оксигеном. Оксиди СО, СО
 . Карбонатна кислота та її солі.
. Карбонатна кислота та її солі.
- Добування, фізичні властивості та застосування Силіцію. Хімічні властивості Силіцію.
- Сполуки Силіцію з Оксигеном та їх похідні.
- Біологічна функція та токсична дія сполук Карбону та Силіцію.
16. ПОВЕРХНЕВІ ЯВИЩА ТА СОРБЦІЯ. (2год.)
- Поверхневі явища, поверхнева енергія, поверхневий натяг. Сорбція та її види.
- Адсорбція на поверхні твердих тіл. Ізотерми адсорбції. Рівняння Ленгмюра.
- Поверхнево активні речовини (ПАР). Рівняння Гіббса. Застосування ПАР на практиці та його екологічні наслідки.
17. ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ, ЕЛЕКТРОРУШІЙНА СИЛА ГАЛЬВАНІЧНОГО ЕЛЕМЕНТА. (2год.)
- Подвійний електричний шар. Електродний потенціал. Формула Нернста.
- Гальванічні елементи. Елемент Даніеля-Якобі. Обчислення електрорушійної сили гальванічного елементу.
- Водневий електрод. Вимірювання електродних потенціалів. Ряд напруг металів.
- Кислотні і лужні акумулятори, їх типи, процеси розрядки і зарядки. Поняття про паливні елементи і принцип їх дії.
18.ЕЛЕКТРОЛІЗ. ЗАКОНИ ЕЛЕКТРОЛІЗУ. (2год.)
- Поняття електролізу. Закони Фарадея. Вихід за струмом.
- Послідовність розряду молекул та іонів на електродах в водних розчинах.
- Приклади електролізу розплавів і розчинів з активним і пасивним анодом.
- Застосування електролізу в промисловості. Добування алюмінію.
19. ХІМІЧНІ ВЛАСТИВОСТІ МАГНІЮ І АЛЮМІНІЮ. (2год.)
- Знаходження в природі, добування, фізичні властивості і застосування алюмінію.
- Хімічні властивості алюмінію, його оксиди і гідроксиди.
- Фізичні та хімічні властивості магнію і його сполук. Застосування магнію та алюмінію.
- Біологічна функція та токсична дія легких металів. Колообіг металів в природі.
- ХІМІЧНІ ВЛАСТИВОСТІ Cu i Zn ТА ЇХ СПОЛУК. (2год.)
- Положення в періодичній системі купруму і цинку. Знаходження в природі. Добування.
- Фізичні та хімічні властивості Cu i Zn (відношення до кисню, води, кислот і лугів).
- Застосування даних металів і їх сплавів на практиці.
- Біологічна функція та токсична дія важких металів. Колообіг металів в природі.
- КОРОЗІЯ МЕТАЛІВ І СПЛАВІВ. МЕТОДИ ЗАХИСТУ ВІД КОРОЗІЇ. (2год.)
- Поняття корозії. Класифікація корозійних процесів. Хімічна корозія, методи захисту від неї.
- Електрохімічна корозія з кисневою і водневою деполяризацією. Навести конкретні приклади, записати рівняння корозійних процесів. Активатори корозії.
- Методи захисту металів і сплавів від корозії: неметалічні, металічні, катодні й анодні покриття; протекторний, катодний і анодний захист; інгібітори корозії.
