Общая характеристика работы Актуальность работы
| Вид материала | Документы |
- Общая характеристика работы актуальность работы, 227.87kb.
- Общая характеристика работы актуальность работы, 227.87kb.
- Общая характеристика работы актуальность работы, 336.09kb.
- Общая характеристика работы актуальность работы, 236.99kb.
- Общая характеристика работы актуальность, 242.28kb.
- Общая характеристика работы актуальность работы, 487.01kb.
- Общая характеристика работы. Актуальность работы, 1103.53kb.
- Общая характеристика работы актуальность проблемы, 254.34kb.
- Московская Городская Педагогическая Гимназия-Лаборатория №1505 исследовательская работа, 410.27kb.
- I. общая характеристика работы актуальность темы исследования, 263.23kb.
Общая характеристика работы
Актуальность работы
Состояние инфекционной заболеваемости по медицинской и социально-экономической значимости остается актуальной проблемой и в настоящее время. В 2008 г в Российской Федерации зарегистрировано почти 750 тыс. заболеваний острыми кишечными инфекциями, среди которых почти половину составляет кишечные заболевания неустановленной этиологии [Онищенко Г.Г., 2009]. Возникновение очагов холеры, угроза появления и распространения опасных кишечных инфекций вследствие ухудшения экологического состояния поверхностных вод, возможности возникновения в любом регионе эпидемической ситуации и по другим инфекциям, таким как псевдотуберкулез, кишечный иерсиниоз – все это определяет необходимость контроля качества объектов внешней среды, пищевых продуктов, причем не только в отношении санитарно-показательных микроорганизмов, но и условно-патогенных энтеробактерий (УПЭ). Выявление и ускоренная идентификация УПЭ – E. coli и других колиформ – имеет большое значение, как для эпидемиологии, так и при проведении санитарно-микробиологического контроля объектов внешней среды, пищевых продуктов, а также для предупреждения внутрибольничных инфекций [Меджидов М.М. и др., 2007]. Обнаружение E. coli в воде является сигналом об опасности, которое связано с самим фактом попадания в неё фекальных масс, являющихся местом обитания болезнетворных микробов кишечно-тифозной и дизентерийной групп.
Одной из основных и актуальных проблем клинических лабораторий и практических служб Роспотребнадзора является правильная и своевременная диагностика инфекций, вызываемых санитарно-значимыми микроорганизмами и, как следствие, обеспечение поддержания благополучной санитарно-эпидемической обстановки.
В настоящее время реально существует угроза появления и распространения опасных социально-значимых инфекций, которая находит отражение в современных понятиях «новые и возвращающиеся» инфекционные болезни. На саммите «Группы восьми» в Санкт-Петербурге 15 - 17 июля 2006 г по предложению России рассматривались вопросы, связанные с противодействием угрозе инфекционных заболеваний, возможностью проявления биотерроризма и биогенными катастрофами [Онищенко Г.Г., 2006]. В этой связи повышается роль обеспечения противоэпидемических мероприятий новыми высококачественными и стабильными диагностическими препаратами, создание которых основано на использовании методов современной биотехнологии. В то же время, надежным «золотым стандартом» при диагностике большинства современных инфекционных заболеваний остается классический бактериологический метод. Наиболее важным этапом микробиологического исследования является выделение и идентификация возбудителей, определение их родовой и видовой принадлежности с использованием питательных сред, что, в свою очередь, поможет решить сложные и ответственные задачи микробиологической диагностики заболеваний и санитарно-эпидемиологического благополучия. Вопросы расширения номенклатуры производства питательных сред, улучшения их ростовых и дифференциально-диагностических свойств, внедрение в лабораторную практику методик, позволяющих сократить время исследования, не теряют значимости.
Принимая во внимание указанное выше, остаётся актуальной задача создания эффективных, стандартных, дающих стабильные результаты бактериологических питательных сред для выделения энтеробактерий, позволяющих повысить надежность санитарно-бактериологического мониторинга.
Цель
Научно-экспериментальная разработка прописей бактериологических питательных сред, оценка качества и усовершенствование методов их применения для индикации возбудителей кишечных инфекций.
Задачи исследований
- Обоснование разработки составов питательных сред для дифференциации коли-бактерий по признакам ферментации глюкозы и лактозы, образования сероводорода, гидролиза мочевины.
- Оценка диагностической ценности новых питательных сред с препаратами сравнения в лабораторных условиях.
- Обоснование разработки состава флюорогенного селективного бульона (ФСБ) для определения колиформных бактерий и E.coli с использованием гидролизата желатина в качестве белковой основы.
- Определение алгоритма использования питательных сред Эйкмана с лактозой и глюкозой в одноразовой индивидуальной упаковке, простерилизованных γ-облучением, для оценки наличия бактерий группы кишечной палочки в модельных исследованиях водных объектов.
- Определение возможности использования прибора «Бак Трак 4100» для экспресс-исследования показателей качества разработанных накопительных питательных сред.
- Изучение биологических свойств питательных сред на широком наборе музейных штаммов и клиническом материале для определения их диагностической ценности.
Научная новизна
1. Впервые на основе экспериментальных данных о характере роста возбудителей кишечных инфекций разработана промышленная технология производства усовершенствованных питательных сред Эйкмана с лактозой (глюкозой), Кесслера-ГРМ, SDS-бульона, железо-глюкозо-лактозного агара с мочевиной с использованием отечественных белковых основ: панкреатического гидролизата рыбной муки, пептонов, гидролизата желатина.
2. Разработаны и экспериментально обоснованы требования к основным показателям качества питательных сред при их серийных выпусках, доказана их высокая диагностическая ценность, стандартизованы методы контроля и сформулированы требования к чувствительности, ингибирующим и дифференцирующим свойствам, определены области их применения в лабораторной практике.
3. Впервые предложена современная методология контроля водоисточников с использованием сухих расфасованных, готовых к употреблению, стерильных сред Эйкмана для применения в полевых условиях. Для стерилизации сред Эйкмана адаптирован метод радиационной стерилизации γ-облучением с целью упрощения их использования.
4. Разработана питательная среда нового поколения - флюорогенный селективный бульон (ФСБ). Получены новые данные о ее преимуществе по чувствительности, скорости роста, интенсивности свечения.
5. Впервые обосновано использование железо-глюкозо-лактозного агара с мочевиной для проведения первичной идентификации представителей родов Yersinia и Vibrio по отношению к углеводам и мочевине.
Практическая значимость
1. Разработаны и внедрены в производство в ФГУН ГНЦ ПМБ питательные среды Эйкмана с лактозой и глюкозой, среда Кесслера-ГРМ, SDS-бульон, железо-глюкозо-лактозный агар с мочевиной.
2. Внедрение в производство и в практику здравоохранения разработанных и усовершенствованных стандартных сухих питательных сред для дифференциации энтеробактерий (с 2007 по 2009 гг выпущено около 20 тонн) повысило стабильность микробиологических исследований, а также эффективность эпидемиологического мониторинга объектов внешней среды (почвы, воды), пищевых продуктов и др.
3. Предполагаемый промышленный выпуск и внедрение в практику здравоохранения флюорогенного бульона (ФСБ) существенно сократит время исследования по сравнению с классическим методом, обеспечивая высокую точность результатов в условиях чрезвычайных ситуаций и сложной эпидобстановки.
4. Применение готовых расфасованных сред Эйкмана с лактозой (глюкозой) в одноразовой индивидуальной упаковке, простерилизованных γ-излучением, позволяет получать быстрые и надежные результаты в стационарных и передвижных лабораториях.
5. По результатам проведенных исследований разработаны методические рекомендации «Обнаружение колиформных бактерий и E. coli при санитарно – микробиологическом анализе питьевой воды с использованием питательной среды Эйкмана с лактозой».
Внедрение результатов работы
Разработаны, утверждены и согласованы ТУ, регламенты производства, инструкции по применению, зарегистрированы в установленном порядке и разрешены к применению питательные среды Эйкмана с лактозой (глюкозой), Кесслера-ГРМ, SDS-бульона (регистрационные удостоверения № ФСР 2007/00971, № ФСР 2007/00969, № ФСР 2008/03656, № ФСР 2008/03655).
Получено положительное решение о выдаче патента на изобретение по заявке от 18 августа 2009 г, № 2008125457/13 (030956) на № 12-05/838), «Питательная среда для определения общих колиформных бактерий и Е. coli в исследуемых образцах».
Материалы диссертации используются преподавателями в лекциях для магистрантов и аспирантов ФГУН ГНЦ ПМБ, на курсах повышения квалификации Россельхозакадемии (ГНУ ВНИИ мясной промышленности им. В.М. Горбатова) и Роспотребнадзора (ФГУЗ «Федеральный Центр гигиены и эпидемиологии»).
Разработаны методические рекомендации по применению среды Эйкмана с лактозой.
Положения, выносимые на защиту
1. Составы отечественных питательных сред промышленного производства для дифференциации коли-бактерий по признаку ферментации глюкозы и лактозы, а также возможность их использования в лабораторной практике.
2. Железо-глюкозо-лактозный агар с мочевиной - эффективная диагностическая среда для дифференциации и идентификации энтеробактарий, в том числе иерсиний и возбудителя холеры.
3. Компонентный состав флюорогенного селективного бульона (ФСБ), содержащий в качестве источника азота панкреатический гидролизат желатина, селективные агенты и флюоресцирующую добавку.
4. Алгоритм подготовки сред Эйкмана для эпидемиологического мониторинга, включающий стадию расфасовки среды в одноразовую индивидуальную упаковку, с последующей стерилизацией γ-облучением.
5. Возможность использования прибора «Бак Трак 4100» для экспресс-исследования показателей качества разработанных накопительных питательных сред Эйкмана в сравнении с аналогами.
6. Изучение биологических свойств питательных сред с использованием широкого набора музейных тест-штаммов, образцов продуктов питания, клинического материала и объектов окружающей среды для определения диагностической ценности разработанных сред.
Апробация результатов исследований
Основные материалы по теме диссертационной работы доложены на
3-ей Международной научно-практической конференции «Актуальные вопросы разработки и производства диагностических питательных сред и тест-систем», Махачкала 2001; VII межгосударственной научно-практической конференции «Чрезвычайные ситуации международного значения в общественном здравоохранении в решениях Санкт-Петербургского саммита «Группы восьми» и санитарная охрана территорий государств-участников Содружества Независимых Государств» Оболенск 2006; ІХ Съезде Всероссийского научно-практического общества эпидемиологов, микробиологов и паразитологов, Москва 2007; Х съезде гигиенистов и санитарных врачей Москва 2007; 9-ой Межгосударственной научно-практической конференции «Современные технологии в реализации глобальной стратегии борьбы с инфекционными болезнями на территории государств-участников СНГ», Волгоград 2008; Всероссийской научно-практической конференции «Вакцинология 2008. Совершенствование иммунобиологических средств профилактики, диагностики и лечения инфекционных болезней», Москва 2008.
Публикации
Основное содержание работы отражено в 9 научных работах, включая статью Разработка и использование новой питательной среды для выявления и идентификации санитарно-показательных микроорганизмов.// Журн. Микробиол. Эпидемиол. Иммунобиол. М.: 2008. - №6 - С. 70-72.
Объем и структура диссертации
Диссертация изложена на 141 страницах машинописного текста и состоит из следующих разделов: введение, обзор литературы, материалы и методы исследований, результаты исследований, выводы и указатель литературы, включающий 84 работы (отечественных и зарубежных авторов). Работа иллюстрирована 3 рисунками и 34 таблицами.
Содержание работы
Организация эксперимента
Работа выполнена в ФГУН ГНЦ ПМБ в рамках отраслевой программы «Научные аспекты обеспечения санэпидблагополучия в Российской Федерации» по договору № 74-Д от 31.12.2005 г и в рамках программы «Национальная система химической и биологической безопасности Российской Федерации (2009-2013 гг.) Госконтракт № 128-Д» «Проведение проблемно-ориентированных исследований и разработка комплектов питательных сред для диагностики чумы, сибирской язвы и туляремии».
Материалы исследований
Штаммы микроорганизмов, используемые для определения специфической активности разработанных питательных сред: 14 родов 147 видов возбудителей кишечных инфекций полученные из ГИСК им. Л.А. Тарасевича, отдела коллекционных культур ФГУН ГНЦ ПМБ, Государственной коллекции патогенных микроорганизмов ФГУЗ РосНИПЧИ «Микроб», а также свежевыделенные штаммы, полученные из Центров гигиены и эпидемиологии.
Зарубежные и отечественные аналоги питательных сред: Eijkman Lactose Broth (HiMedia), [HiMedia Laboratories Pvt Limited 1993], Fluorocult Laurylsulfat Bouillon, Fluorocult BRILA – Bouillon (Merck) [Каталог 2004/2005 (MERCK)], питательная среда для выделения и дифференциации энтеробактерий (среда Кода) ФГУП «НПО «Микроген»,
г. Махачкала, питательная среда № 13 ГРМ по [ГФ ХI], агар Клиглера-ГРМ – ТУ 9398-030-780953226-2007, (ФГУН ГНЦ ПМБ).
Объекты внешней среды: (вода поверхностных водоемов, сточные воды, смывы на предприятиях общественного питания (столовых, кафе), магазинах, школах, детских садах, детских молочных кухнях и др.).
Биологический материал от больных, шовный и перевязочный материал при исследовании его на стерильность, испражнениях от больных острыми кишечными заболеваниями и контактных с ними, а также биологический материал от больных и трупного материала из г. Абакана (2008 г.).
Методы исследований
Использовали общепринятые физико-химические и микробиологические методы в соответствии с методическими указаниями «Методы контроля бактериологических питательных сред» МУК 4.2.2316-08, а также Инструкциями по применению на коммерческие питательные среды, проектами Инструкций по применению и утвержденными программами по испытанию питательных сред.
Биохимические характеристики и стабильность сохранения основных биологических свойств микроорганизмов определяли с использованием тест-систем (системы индикаторные бумажные для идентификации микроорганизмов (СИБ), производства ФГУП НПО «Микроген» МЗ РФ, «ПБДЭ» – пластины биохимические, дифференцирующие энтеробактерии производства «НПО «Диагностические системы»»), а также биохимического анализатора «Multiscan assent» (Финляндия).
Сравнительный анализ интенсивности флюоресценции флюорогенных питательных сред проводили с помощью многофункционального планшетного анализатора VICTOR³ (Wallac 1420).
Взятие и посев исследуемого материала производили в соответствии с «Методическими указаниями по микробиологической диагностике заболеваний, вызываемых энтеробактериями» (М.: 1984) и приказом Минздрава СССР от 22.04.85 г., № 535 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений».
Натурные испытания на наличие колиформ в сточных и речных водах, других биологических объектах были проведены на базах микробиологической лаборатории ФГУЗ «Центр гигиены и эпидемиологии в Тульской области», ФГУЗ «Центр гигиены и эпидемиологии в Калужской области», ФГУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора, в филиале ФГУЗ «Центр гигиены и эпидемиологии в Московской области в г.г. Пущино, Серпухов, Серпуховском и Чеховском районах», а также в бактериологической лаборатории ПЧС МСЧ-164 Федерального медико-биологического агентства.
Математическую обработку результатов проводили с помощью программы Microsoft Exсel 5,0.
Результаты исследований и их обсуждение
Определение и обоснование составляющих компонентов питательных сред для индикации санитарно–показательных микроорганизмов
В ФГУН ГНЦПМБ при производстве сухих питательных сред используют сухие питательные основы, приготовленные из различных видов сырья - мяса, рыбы, рыбной муки, казеина и др. [Артюхин И.И., Шепелин А.П. и др., 1990].
Первоначальный этап работы по разработке составов питательных сред для обнаружения бактерий группы кишечной палочки: Эйкмана с лактозой и глюкозой, среды Кесслера-ГРМ, SDS-бульона, заключался в оптимизации составов с использованием панкреатического гидролизата рыбной муки (ПГРМ) и мясного ферментативного пептона Было доказано, что в составе питательных сред предпочтительно использовать смесь пептона и ПГРМ.
Ведущими зарубежными производителями, согласно Фармакопеи США (USP XXIII 1995) и Европейской фармакопеи (ЕР II) в качестве компонента питательных сред используется гидролизат желатина, по своему химическому составу представляющий соединение белковых веществ сложного строения, поэтому одной из задач нашей работы была разработка технологии получения сухого гидролизата желатина, конструирование на его основе питательных сред с последующим изучением биологических свойств на расширенных наборах музейных тест-штаммов.
В результате проведенных исследований показано, что среды Эйкмана с лактозой и глюкозой, среда Кесслера-ГРМ, SDS-бульон на основе панкреатического гидролизата желатина (ПГЖ), не уступают ранее отработанным составам на основе ПГРМ, пептонов мясных ферментативных в качестве белковых компонентов для эффективного роста энтеробактерий при их культивировании. Кроме того, было доказано, что в составе флюорогенного селективного бульона (ФСБ) использование ПГЖ в качестве питательной основы обеспечивает лучшие ростовые свойства среды, чем аналог.
После проведенных исследований по подбору белковой основы исследования по оптимизации компонентного состава питательных сред Кесслера-ГРМ и SDS-бульона (на основе ПГРМ) продолжили с использованием метода полного факторного эксперимента с приемом построения матрицы планирования эксперимента [Адлер Ю.П. 1976, Ашмарин И.П., 1962]. Таким образом, матрицы планирования полных факторных экспериментов с факторами в двух уровнях позволили получить модели питательных сред, обладающие оптимальными свойствами.
При выборе белковой основы для железо–глюкозо–лактозного агара с мочевиной было доказано, что внесение тиосульфата натрия перед высушиванием основы существенно улучшает стабильность и сроки хранения данной среды. Внесение предварительно высушенного до определенной влажности агара в сухую основу в процессе смешивания также увеличивает сроки хранения препарата. Для анализа критической влажности и состояния молекул воды в частицах препарата (свободная вода) был использован метод импульсного ядерного магнитного резонанса (ЯМР) [Храмов М.В. и др. 2001].
Исходя из проведенных исследований, нами разработаны и оптимизированы составы исследуемых питательных сред:
- Питательная среда для обнаружения E. сoli и колиформных бактерий по признаку ферментации лактозы (среда Эйкмана с лактозой), г/л: ПГРМ и/или пептон сухой ферментативный – 10.0, лактоза – 5.0, натрия хлорид – 5.0, натрия карбонат – 0.05-0.25, бромтимоловый синий – 0.06.
- Питательная среда для обнаружения E. сoli и колиформных бактерий по признаку ферментации глюкозы (среда Эйкмана с глюкозой), г/л: ПГРМ и/или пептон сухой ферментативный – 10.0, глюкоза – 5.0, натрия хлорид – 5.0, натрия карбонат – 0.05-0.25, бромтимоловый синий – 0.06.
- Питательная среда для первичного обнаружения бактерий группы кишечной палочки (среда Кесслера–ГРМ), г/л: ПГРМ – 3.0, пептон сухой ферментативный – 7.0, лактоза – 10.0, желчь очищенная, сухая – 3.0, кристаллический фиолетовый – 0.04, натрия карбонат – 0.01–0.25.
- Питательная среда для выделения и дифференциации энтеробактерий (SDS-бульон), г/л: SDS (натрий додецилсульфат) – 0.5, пептон сухой ферментативный 7.5, ПГРМ – 7.5, натрия хлорид – 6.0, лактоза – 10.0, бромтимоловый синий - 0.05, натрия карбонат – 0.3±0.05.
- Питательная среда для идентификации энтеробактерий (железо–глюкозо–лактозный агар с мочевиной), г/л: ПГРМ с тиосульфатом натрия – 20.5, лактоза – 20.0, глюкоза – 1.0, натрия фосфат двузамещенный – 1.0, калия фосфат однозамещенный – 1.3, натрия хлорид – 5.0, железа окисного цитрат – 0.3, натрия сульфит – 0.6, мочевина – 10.0, феноловый красный – 0.05, агар микробиологический – 10.0 ± 3.0.
- Питательная среда для определения общих колиформных бактерий и Е. coli в исследуемых образцах – флюорогенный селективный бульон (ФСБ) г/л: ПГЖ - 10.0, лактоза - 10.0, желчь очищенная - 20.0, бриллиантовый зеленый - 0.0133, L - триптофан - 1.0, 4-метилумбеллиферил-β-D-глюкуронид (MUG) - 0.1.
Выбор штаммов для контроля питательных сред
Ведущими зарубежными и отечественными фирмами используется общепринятый набор тест-штаммов, необходимый для биологического контроля питательных сред для анализа воды, продуктов и др., состоящий из следующих культур микроорганизмов: Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048, Streptococcus faecalis ATCC 29212. Поэтому при конструировании питательных сред в набор штаммов для контроля также входили бактерии группы кишечной палочки (БГКП), энтерококки и дополнительно ряд микроорганизмов других таксономических групп (таблица 1).
Таблица 1 - Тест-штаммы для биологического контроля питательных сред
| Тест-штаммы | Разработанные питательные среды | |||||
| Эйкмана с глюкозой | Эйкмана с лактозой | Кесслера-ГРМ | SDS-бульон | железо–глюкозо–лактозный агар с мочевиной | ФСБ | |
| E.coli 3912/41 (055:K59) | + | + | | | + | |
| E.coli Ewing(O124K72) 227 | | | | + | | + |
| E.coli ATCC 25922 | + | + | | | | + |
| E. coli 4 (О157:Н7) | + | + | | | | |
| E. coli 675 | | | + | + | | + |
| P. aeruginosa 27/99 | + | + | + | | | |
| P. vulgaris HX 19 222 | + | + | + | + | + | |
| S. aureus Wood- 46 | | | + | + | | + |
| E.aerogenes 10006 | + | + | + | + | | + |
| K. pneumoniae 418 | | | + | | | |
| C. freundii 101/57 | | | + | + | + | |
| K. pneumoniae 3534/51 | | | | + | | |
| Serratia marcescens 1 | | | | + | | |
| S. flexneri 1a 8516 | | | | + | | |
| Y. pestis EV | | | | | + | |
| Y. enterocolitica 287 II | | | | | + | |
| Y. pseudotuberculosis III | | | | | + | |
| S. sonnei «S form» | | | | | + | |
| E. faecalis 775 | | | | | | + |
| V/cholerae non 01 | | | | | + | |
Изучение специфической активности питательных сред
Для получения сведений о специфической активности разработанных питательных сред для индикации санитарно-показательных микроорганизмов были проведены контрольные испытания на средах с использованием музейных тест штаммов. При культивировании колиформных бактерий и E.coli в исследуемых жидких питательных средах установлено наличие характерного визуально видимого роста микроорганизмов (диффузное помутнение, изменение цвета среды и газообразование) через 18 – 48 ч при температуре 37 С из разведений 10-6 и 10-7 , что подтверждает высокую чувствительность.
Способность термотолерантных колиформных бактерий (ТКБ) ферментировать лактозу до кислоты и газа при температуре (441) С в течение 24-48 ч, определяли на средах Эйкмана и Кесслера-ГРМ.
Кроме того, в отличие от контрольной среды Эйкмана Eijkman Lactose Broth (HiMedia), разработанные среды Эйкмана с глюкозой и лактозой содержат индикатор бромтимоловый синий, что дает возможность более правильно интерпретировать результаты анализа.
Ингибирующие свойства питательных сред Кесслера-ГРМ, SDS-бульона проверяли на музейных тест-штаммах: S. aureus Wood-46, P. vulgaris НХ 19 222. Анализ результатов подтвердил ингибицию при всех испытанных концентрациях (10-1 , 10-4, соответственно).
Исследования, касающиеся железо-глюкозо-лактозного агара с мочевиной, показали, что железо–глюкозо–лактозный агар, содержащий в своем составе мочевину, позволяет различать иерсинии вследствие неодинаковой способности её расщеплять. Нами была исследована возможность использования железо–глюкозо–лактозного агара с мочевиной для дифференциации Y. pseudotuberculosis и Y. enterocolitica от Y. pestis.
Большое значение для санитарной оценки внешней среды (воды, пищевых продуктов) имеет обнаружение возбудителя холеры ( Vibrio cholerae). При лабораторной диагностике отобранные подозрительные на холерный вибрион колонии, выросшие после сред накопления на дифференциально-диагностических питательных средах, отсевают на лактозно-сахарозную среду, среду Клиглера или среду Кристенсена. Нами была исследована возможность использования железо–глюкозо–лактозного агара с мочевиной для дифференциации типового вида рода V. cholerae по признаку ферментации глюкозы без образования газа.
Было доказано, что питательная среда обеспечивает во всех засеянных пробирках рост каждого штамма с проявлением типичных биохимических свойств: утилизацию мочевины, ферментацию лактозы и глюкозы, газообразование, образование сероводорода.
Принцип действия флюорогенного селективного бульона (ФСБ) основан на выявлении специфических ферментов β-глюкуронидазы и триптофаназы E.coli. Кишечная палочка расщепляет флюорогенный субстрат 4-метилумбеллиферил -β-Д- глюкуронид (МУГ), в результате образуется флюоресцирующий в УФ-свете (366 нм) продукт реакции, а обнаружение индола, (вследствие расщепления триптофана) при добавлении реактива Ковача позволяет выявить E.coli с надежностью 99,9 %.
При исследовании ростовых свойств E. coli и колиформных микроорганизмов из разведения 10-7 через 18 ч инкубации при температуре 37 С наблюдалось диффузное помутнение, газообразование, наличие флюоресценции в УФ-свете (366 нм). Рост грамположительных микроорганизмов подавлен.
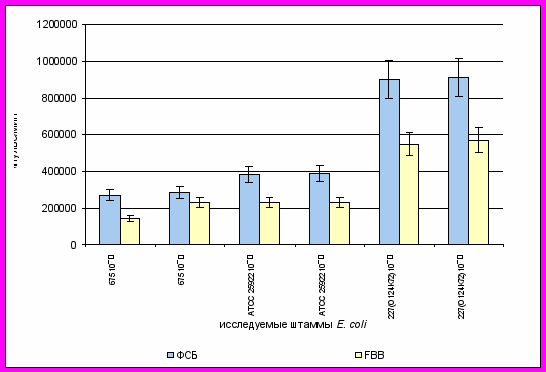
Степень интенсивности голубой флюоресценции, характерной для E.coli при ультрафиолетовом облучении микробного роста визуально ярче выражена на предлагаемой среде ФСБ, чем на среде Fluorocult BRILA Broth (FBB). Данный факт подтвердился и в результате сравнения интенсивности флюоресценции с помощью многофункционального планшетного анализатора VICTOR³ (Wallac 1420), производящим измерения с использованием флуориметрии со следующими режимами: umbelliferone; CW-lamp filter name F355; Emission filter name F460; Measurement time 0.1s.(рисунок 1).