Методические указания по выполнению практических/лабораторных работ для студентов по специальности 050731 «Безопасность жизнедеятельности и защита окружающей среды» очного и заочного форм обучения
| Вид материала | Методические указания |
- Методические указания к выполнению практических занятий по курсу "Мониторинг и контроль, 263.92kb.
- Богданова Эмма Васильевна Гронь Вера Александровна Максименко Людмила Семеновна Степанов, 554.03kb.
- И. И. Ползунова Кафедра «Безопасность жизнедеятельности» Гергерт В. Р., Стуров, 299.13kb.
- Методические указания по выполнению курсовых работ для студентов очного и заочного, 372.65kb.
- Программа и методические указания к выполнению курсовой работы и контрольных работ, 146.23kb.
- Методические указания к выполнению лабораторных работ для студентов, обучающихся, 99.32kb.
- Методические указания по выполнению курсовых работ для студентов заочной форм обучения, 117.01kb.
- Методические указания к выполнению лабораторных работ по курсу «вычислительная техника, 640.55kb.
- Методические указания к выполнению лабораторных работ по дисциплине информатика для, 1065.17kb.
- Методические указания к лабораторным работам для студентов строительных специальностей, 619.38kb.
Основной закон светопоглощения. Если световой поток пропустить через кювету с раствором, поглощающим свет, то выходящий световой поток будет менее интенсивным, чем входящий. Ослабление светового потока связано с частичным поглощением его и частичным отражением.
Соотношение между интенсивностями падающего светового потока I0 светового потока, прошедшего через раствор I, поглощенного Iп и отраженного Iотр можно выразить следующим образом
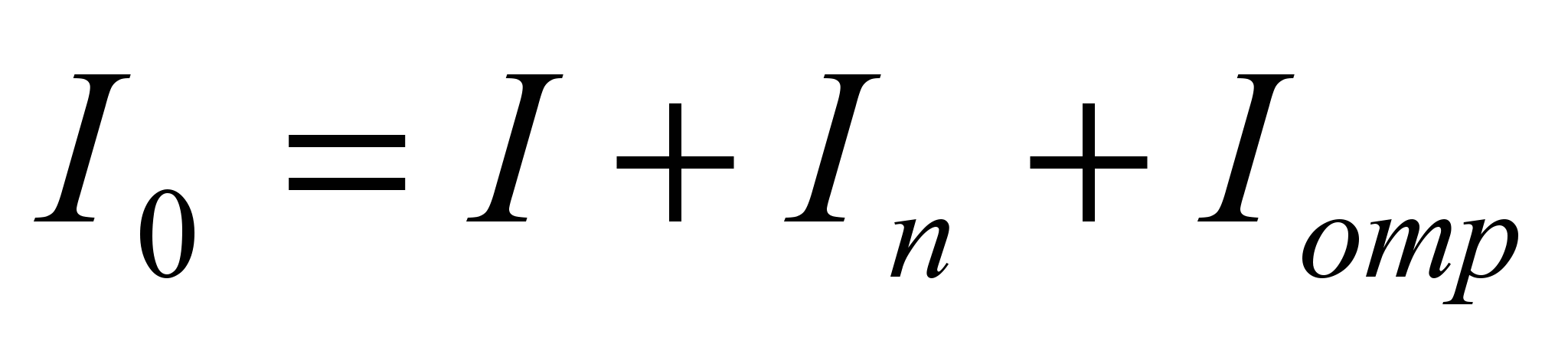
Интенсивность отраженной части светового потока невелика и ею можно пренебречь. Тогда,
 . Непосредственно можно измерить интенсивность падающего светового потока и светового потока, прошедшего через раствор. Интенсивность поглощенного светового потока непосредственному измерению не поддается. Ее принято выражать величиной
. Непосредственно можно измерить интенсивность падающего светового потока и светового потока, прошедшего через раствор. Интенсивность поглощенного светового потока непосредственному измерению не поддается. Ее принято выражать величиной 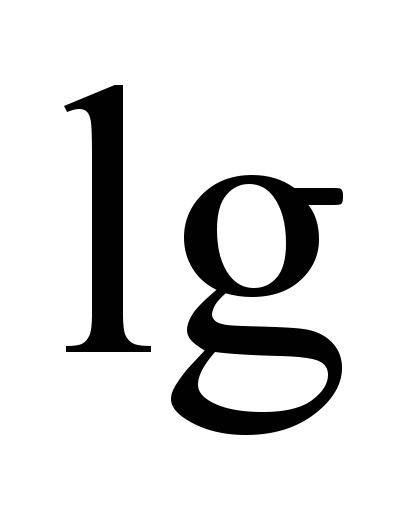 I0/I. Эта величина называется оптической плотностью и обозначается А. Существует определенная зависимость между оптической плотностью, толщиной слоя и концентрацией вещества, выражаемая законом Бугера - Ламберта - Бера:
I0/I. Эта величина называется оптической плотностью и обозначается А. Существует определенная зависимость между оптической плотностью, толщиной слоя и концентрацией вещества, выражаемая законом Бугера - Ламберта - Бера:
где К - молярный коэффициент светопоглощения;
с - концентрация раствора, моль/дм3;
l - толщина слоя раствора, через который проходит световой поток, см.
Молярный коэффициент светопоглощения К зависит от длины волны, температуры растворителя и не зависит от толщины поглощающего слоя и концентрации растворенного вещества. Он отражает индивидуальные свойства вещества, для разных веществ он имеет различное значение. Величина молярного коэффициента светопоглощения является наиболее важной и объективной характеристикой чувствительности фотометрического метода. Чем выше величина коэффициента, тем чувствительнее метод.
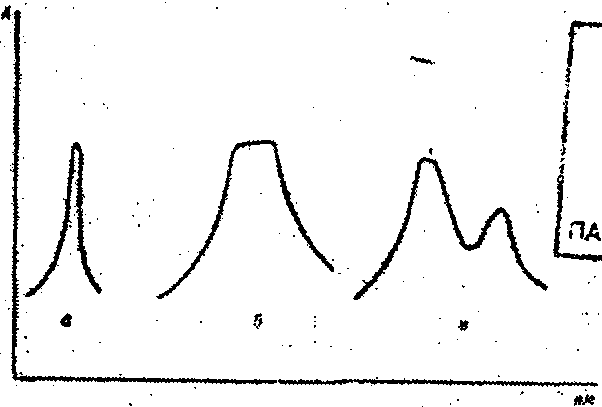
Рисунок 12 - Спектры поглощения
Величина оптической плотности зависит от длины волны и концентрации раствора. Поглощение света зависит при разных длинах волн неодинаково, оно носит избирательный характер. Если измерить максимальное значение оптической плотности какого-либо раствора при разных длинах волн и выразить это графически, то можно получить спектр поглощения данного вещества (рисунок 12): при определенной длине волны (а); на определенном участке длин волны (6); при двух значениях длин волны (в). Спектр поглощения является индивидуальной характеристикой данного вещества, он используется для идентификации веществ. Если получить спектры поглощения растворов исследуемого вещества, имеющих различную концентрацию, то кривые спектров поглощения будут иметь одну и ту же форму, положение максимума поглощения сохранится на всех спектрах при одной и той же длине волны.
Как уже было сказано, величина оптической плотности зависит от концентрации раствора. Чем больше концентрация раствора, тем больше величина оптической плотности.
Построение калибровочного графика
Предварительно необходимо подготовить посуду - мерные колбы, пробирки, пипетки, реактивы и растворы.
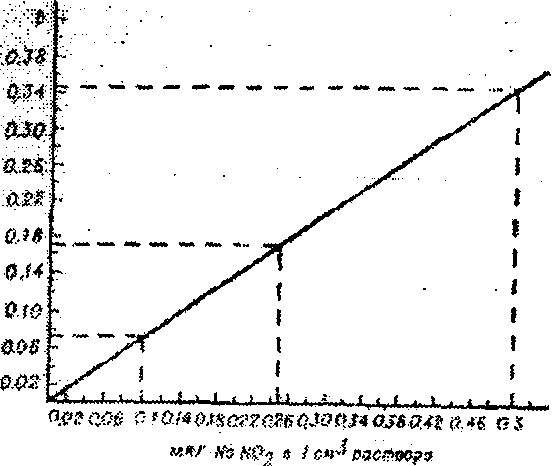
Рисунок 13 - График определения нитритов
Для построения калибровочного графика готовят серию стандартных растворов, охватывающих диапазон измеряемых концентраций исследуемого вещества согласно методике.
Калибровочный график строят по 5-6 сериям шкал; количество концентраций в каждой шкале должно быть не мене 5. Резко отличающиеся значения оптической плотности не учитывают. Из остальных рассчитывают среднее арифметическое значение для каждой концентрации и строят график зависимости оптической плотности от концентрации вещества (рисунок 13).
Примерный размер графика 20-25x30 см; прямая должна проходить через начало координат под углом приблизительно 45°. В идеальном случае все точки располагаются на прямой, обычно часть точек располагается на прямой, часть выше и ниже ее, точки как бы чередуются.
На графике должны быть указаны условия фотометрирования: номер светофильтра или длины волны (нм); размер кюветы (мм); время фотометрирования. Кроме того, должна быть указана дата построения калибровочного графика. Калибровочный график необходимо периодически проверять по 2-3 концентрациям.
Рисунок 14 - КФК-2
Наиболее распространенными приборами являются фотоэлектроколориметр ФЭК-56М, колориметр фотоэлектрический однолучевой КФО, колориметр фотоэлектрический концентрационный КФК-2 (рисунок 14), КФК-2МП с микропроцессорной системой «Электроника» и спектрофотометр СФ-46 (таблица 2).
Таблица 2 - Технические данные фотометрических приборов
| Марка прибора | Спектральный диапазон, нм | Число светофильтров |
| ФЭК-56М | 315-630 | 8 |
| КФО | 400-700 | 5 |
| КФК-2 (КФК-2МП) | 315-980 | И |
| СФ-46 | 190-1100 | - |
Надежность результатов измерений при работе на фотоэлектроколориметрах и спектрофотометрах обеспечивается, правильной установкой и эксплуатацией приборов. Поэтому приступать к измерениям можно только после тщательного ознакомления с описанием устройства прибора и правил его эксплуатации.
Методика работы на колориметре фотоэлектрическом концентрационном КФК-2 [4].
Подготовка к работе. Прибор включают в сеть за 15 мин до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемниками перекрывает световой пучок). Затем устанавливают необходимый цветной светофильтр и устанавливают ручку «чувствительность» в положение «1» (при измерении со светофильтрами 315, 364, 400, 440, 490, 540 нм, обозначенными на лицевой панели прибора цифрами черного цвета, ручку «чувствительность» устанавливают в положение «1», «2», «3», обозначенных на лицевой панели также цифрами черного цвета). При измерении со светофильтрами 590, 670, 750, 870, 980 нм, обозначенными на лицевой панели прибора цифрами красного цвета, ручку «чувствительность» устанавливают в одно из положений «1», «2», «3», обозначенных на лицевой стороне панели также цифрами красного цвета. Ручку «установка 100 грубо» переводят в крайнее левое положение [4].
Пред измерениями и при переключении фотоприемников необходимо проверить установку стрелки прибора на «О» по шкале коэффициентов пропускания «Т» при открытом кюветном отделении. При перемещении стрелки от нулевого положения ее подводят к нулю с помощью потенциометра «нуль», выведенного под шлиц.
Определение оптической плотности. В кюветное отделение устанавливают кюветы с растворителем (или контрольным раствором) и исследуемыми растворами. Сначала световой пучок пропускают через кювету с растворителем (или контрольным раствором). Закрывают крышку кюветного отделения. Ручками «чувствительность» и «установка 100 грубо» и «точно» устанавливают отсчет 100 по шкале прибора. Затем поворотом ручки заменяют кювету с растворителем (или контрольным раствором) на кювету с исследуемым раствором. Снимают показания по шкале прибора в единицах оптической плотности. Измерение проводят 3-5 раз, и окончательное значение оптической плотности определяют как среднее арифметическое.
Методика работы на спектрофотометре СФ-46 [4].
Подготовка к работе. Прибор включается в сеть за 30 мин до начала измерений, нажав на кнопку «сеть» и клавишу «пуск». Устанавливают требуемую длину волны, фотоэлемент и источник излучения, соответствующие выбранному спектральному диапазону измерений. Перед каждым новым измерением устанавливают ширину щели 0,15 им во избежание засвечивания фотоэлементов.
Определение оптической плотности. Рукоятка переключения шторки светового потока должна быть закрыта. Устанавливают в кюветное отделение держатель кювет с кюветами, заполненными следующим образом: первая – растворителем или контрольным раствором; вторая, третья, четвертая – исследуемыми растворами. Нажимают клавишу «Ш(0)», и устанавливают рукояткой «нуль» на фотометрическом табло числовое значение в диапазоне от 0,05 до 0,1. Открывают шторку светового потока и на пути его устанавливают кювету с растворителем или контрольным раствором. Нажимают клавишу «К(1)», показание табло должно быть в пределах от 0,5 до 5,0. При показании меньше 0,5 следует увеличить ширину щели, при показании больше 5,0 следует уменьшить ширину щели. Нажимают клавишу «Д(5)», при этом на фотометрическом табло должно появиться показание 0,000±0,001. Устанавливают поочередно на пути светового потока исследуемые растворы, перемещая каретку рукояткой. Нажимают клавишу «Д(5)» при появлении показания, отличающегося от предыдущего не более чем на 0,1, снимают показание с фотометрического табло.
13 Полярографический метод
Полярографический метод анализа является одним из электрохимических методов. Он основан на расшифровке вольтамперных кривых, называемых полярограммами, которые получаются при электролизе исследуемого раствора в специальной электрополярографической ячейке. В этой ячейке в качестве одного электрода, называемого рабочим, используют ртуть, вытекающую из тонкого капилляра – катода с периодом капания 2-7 с и диаметром примерно 1 мм. Второй электрод – анод, является электродом сравнения. Он представляет собой слой ртути с большой поверхностью на дне сосуда [4].
От внешнего источника тока на электроды подается постепенно увеличивающееся напряжение. При наличии в анализируемом растворе веществ, способных окисляться или восстанавливаться, сила тока возрастает после достижения определенной величины приложенного напряжения, называемой потенциалом полуволны. Эта зависимость силы тока от приложенного напряжения выражается полярографической волной и регистрируется на самописце полярографа Для количественного определения вещества используют прямо пропорциональную зависимость между силой предельного тока, выраженной высотой полярографической волны и концентрацией вещества в растворе. Для получения строго количественных закономерностей в анализируемый раствор вводят избыток постороннего электролита – фон. В качестве фона применяют соли лития и другие разбавленные соли, кислоты, щелочи. Присутствие кислорода в анализируемом растворе мешает проведению анализа, поэтому его удаляют, пропуская через раствор инертный газ.
Рисунок 15 - ПолярографПУ-1
Для полярографии используют полярографы различных марок (рисунок 15). Полярографированию поддаются практически все катионы металлов, многие анионы, неорганические и органические вещества, способные к электрохимическому окислению или восстановлению. Высокая чувствительность метода сочетается с достаточной точностью. Быстрота выполнения анализа, объективность получаемых результатов в сочетании с хорошей воспроизводимостью, выгодно выделяет полярографический метод среди других физико-химических методов исследования. Этот метод нашел широкое применение в санитарно-химическом анализе для исследования пищевых продуктов на содержание солей тяжелых металлов, а также питьевых вод, поверхностных водоемов и сточных вод на содержание солей хрома, свинца, цинка, меди. В воздухе полярографическим методом определяют свинец, хром, марганец, цинк, кадмий, медь, формальдегид и другие токсичные вещества.
14 Люминесцентный метод
Люминесцентный метод основан на переводе молекул или атомов вещества в энергетическое возбужденное состояние и измерении интенсивности свечения, возникающего при возвращении молекул в состояние равновесия. Основным методом количественного химического люминесцентного анализа является флюориметрия - метод установления количества люминесцирующего вещества по интенсивности возникающей люминесценции. При этом существует определенная зависимость между интенсивностью люминесценции и концентрацией вещества. Флюориметрические методы принципиально ничем не отличаются от фотометрических и представляют лишь разновидность оптических методов, однако, имеют и свои специфические особенности [4].
Наиболее простыми являются приборы, применяемые при выполнении качественного анализа визуальной флюориметрии (рисунок 16). Для количественного анализа существуют более сложные приборы - флюориметры (рисунок 17).

Рисунок 16 – Люминоскоп
Рисунок 17 - Флюориметр для определения концентраций в окрашенных растворах
Поглощая свет соответствующей энергии, атом вещества переходит из нормального состояния Е0 в возбужденное Е1 при этом наблюдается свечение. Частоты поглощенного и излученного света равны (резонансное излучение). Во всех видах люминесценции проявляются характерные свойства веществ, что может служить основой для их распознавания и изучения.
Флюориметрические измерения выполнят визуально и с помощью объективных методов регистрации возникающею излучения.
Основными узлами любой флюориметрической установки является источник возбуждающей реакции: первичное монохроматическое устройство и приемник лучистой энергии.
Люминесцентный анализ обладает исключительной чувствительностью: люминесценцию можно наблюдать при исследовании очень малых концентраций люминесцирующих веществ. Этот метод успешно конкурирует с большинством физико-химических методов.
Метод применяют для определения нефтепродуктов в воде, смолистых веществ в воздухе рабочей зоны, бензилового спирта в атмосферном воздухе.
15 Метод газовой хроматографии
Газовая хроматография – это физико-химический метод разделения смеси веществ, основанный на распределении компонентов между несмешивающимися фазами. Подвижной фазой является инертный газ, неподвижной – жидкость или твердое тело.
Анализ смесей исследуемых компонентов выполняют на специальных приборах – хроматографах (рисунок 18).
Рисунок 18 - Хроматограф марки «Цвет»
Различают два варианта газовой хроматографии – газоадсорбционную и газожидкостную. В газоадсорбционной хроматографии неподвижной фазой служит твердый адсорбент. В газожидкостной хроматографии такой фазой служит жидкость, нанесенная тонким слоем на инертный носитель. Сами носители не должны взаимодействовать с анализируемыми веществами.
Оба варианта газовой хроматографии применяются для анализа как газов, так и жидкостей [7].
Разделение компонентов смеси происходит вследствие разности в скоростях адсорбции или растворения. Газ-носитель (гелий, азот, аргон) переносит анализируемую пробу через хроматографическую колонку [4].
Метод газовой хроматографии позволяет определять ничтожно малые количества веществ, не обладающих специфическими реакциями и анализировать смеси десятков и сотен компонентов с близкими свойствами. Разделенные вещества фиксируются в виде пиков на хроматограмме. Местоположение пика на хроматограмме характеризуется временем удерживания. Время удерживания компонента – это период от момента ввода в колонку анализируемой пробы до момента выхода (максимум пика). Размер пика на хроматограмме прямо пропорционален количеству анализируемого вещества, что позволяет проводить количественный анализ (рисунок 19, 20).
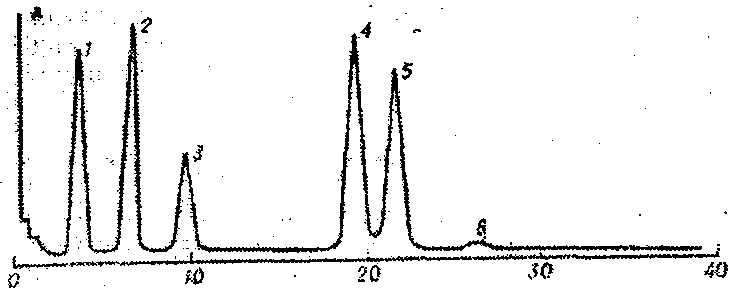
Рисунок 19 - Газохроматографическое разделение пестицидов
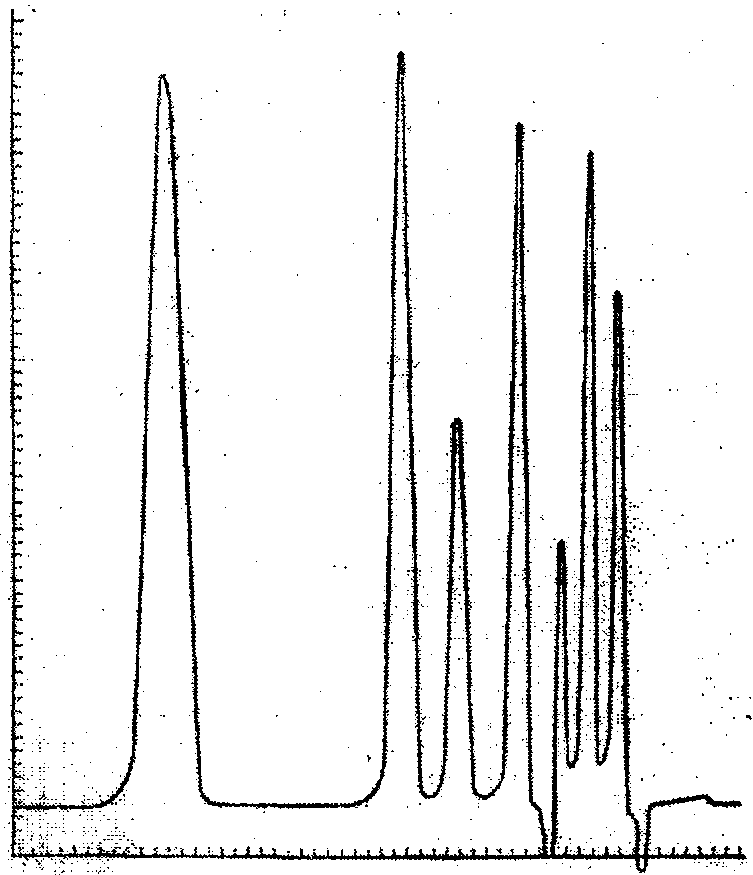
Рисунок 20 – Хроматограмма разделения группы органических веществ ароматического и алифатического рядов
Хроматографы состоят из регулятора расхода газов, системы ввода проб, термостатирующей колонки детектора и регистрирующего устройства. Современные хроматографы построены по принципу блочной конструкции, включают набор детекторов и вычислительную технику для обработки хроматограмм.
Детектор регистрирует присутствие каждого компонента в пробе и позволяет измерить его количество. Детектор определяет его точность и чувствительность метода. Регистрация вещества осуществляется за счет изменения свойства газового потока, выходящего из хроматографической колонки и преобразующегося в электрический сигнал.
Центральной частью хроматографа является колонка, т.к. именно в ней происходит разделение компонентов смеси. Все остальные устройства в хроматографе предназначены для создания стабильных условий работы колонки и регистрации разделенных компонентов.
Колонки представляют собой трубки длиной от 1 до 10 м с внутренним диаметром 2-6 мм, изготовленные из стали, меди, стекла [7].
Метод газовой хроматографии является высокочувствительным, точным, универсальным, имеет большие преимущества по сравнению с другими методами; используется для определения токсичных веществ в воздухе, продуктах, воде и др. [4].
16 Экспресс-методы определения токсичных веществ
При необходимости срочного определения концентрации токсичного вещества в воздухе рабочей зоны рекомендуется использовать экспресс – методы, которые дают возможность (за короткое время) в течение технологического процесса или одной рабочей смены проанализировать большое число проб воздуха на одном или нескольких рабочих местах.
Недостатком их является то, что отдельные линейно-колористические показания имеют приближенно количественный характер и в концентрациях, близких к ПДК их следует проверять лабораторными методами.
В настоящее время наиболее распространены методы с использованием следующих приборов.
«УГ-2» (универсальный газоанализатор). Прибор предназначен для определения в воздухе рабочей зоны концентрации оксида серы, ацетилена, этилового эфира, бензина, бензола, толуола, ксилола, ацетона, углеводородов нефти (рисунок 21).

Рисунок 21 - Универсальный газоанализатор УГ-2
Газоанализатор обеспечивает определение концентрации вредных газов в воздухе с содержанием пыли не боле 40 мг/м3; относительной влажностью не более 90%, при температуре 10-30 градусов и давлении 740-780 мм. рт. ст.
Определение основано на аспирации исследуемого воздуха с помощью воздухозаборного устройства через стеклянную трубку, наполненную индикаторным порошком.
В результате реакции, возникающей между анализируемым газом и реактивом-наполнителем индикаторной трубки, происходит выделение цветного продукта, отличающегося от исходного по цвету. Длина окрашенного столбика индикаторного порошка, находящегося в трубке, пропорциональна содержанию искомого вещества в воздухе и измеряется по шкале, приложенной в миллиграммах в 1 куб. м (линейно- колористический метод).
На неподвижном плато прибора имеются гнезда для хранения штока. Во внутренней части футляра помещается воздухозаборное устройство для просасывания исследуемого воздуха через индикаторные трубки.
Основной частью воздухозаборного устройства является резиновый сильфон с расположенной внутри него пружиной, которая удерживает сильфон в растянутом положении. Просасывание исследуемого воздуха через индикаторную трубку производится после предварительного сжатия штоком, снабженным головкой.
На грани головки штока обозначены объемы просасываемого при анализе воздуха. На цилиндрической поверхности штока имеется продольная канавка с двумя углублениями, служащими для фиксации объема просасываемого воздуха. Расстояние между углублениями в канавке рассчитано таким образом, чтобы при ходе штока от одного углубления до другого прибор забирал определенное количество исследуемого воздуха (см. цифры под головой штока).
При переноске прибора из одного помещения в другое (с другой температурой воздуха) необходимо, чтобы индикаторные трубки приняли температуру окружающего воздуха, лишь после этого приступать к анализу.
17 Исследование воды
Гидросфера служит естественным аккумулятором большинства загрязняющих веществ, поступающих в атмосферу или литосферу. Это связано с большой растворяющей способностью воды, с круговоротом воды в природе, а также с тем, что водоемы являются конечным пунктом на пути движения различных сточных вод.
Присутствие загрязняющих веществ в водной среде оказывает влияние на жизнедеятельность отдельных живых организмов и на функционирование всей водной системы.
Природная вода является неоднородной средой, в ней присутствуют взвешенные частицы и микро пузырьки газа. Размер частиц различен. Оседающие частицы состоят из минерального ядра и органического слоя. Толща воды, кроме того, наполнена множеством микроорганизмов, находящихся в равновесии с окружающей средой.
Воздействие загрязнителей на природные водоемы различно. Тепловое загрязнение вызывает интенсификацию процессов жизнедеятельности водных организмов, что нарушает равновесие экосистемы. Минеральные соли опасны для одноклеточных организмов, обменивающихся с внешней средой осмотически. Взвешенные частицы уменьшают прозрачность воды, снижают фотосинтез водных растений и аэрацию водной среды, способствуют заилению дна в зонах с малой скоростью течения, оказывают неблагоприятное воздействие на жизнедеятельность водных организмов-фильтраторов. На взвешенных частицах могут сорбироваться различные загрязняющие вещества; оседая на дно, они могут стать источником вторичного загрязнения воды.
Загрязнение вод тяжелыми металлами не только оказывает экологический вред, но и наносит значительный экономический ущерб. Источниками загрязнения воды тяжелыми металлами служат гальванические цехи, предприятия горнодобывающей промышленности, черной и цветной металлургии. При загрязнении воды нефтепродуктами на поверхности образуется пленка, препятствующая газообмену воды с атмосферой. В ней, а также в эмульсии тяжелых фракций накапливаются другие загрязнители, кроме того, сами нефтепродукты аккумулируются в водных организмах.
Основными источниками загрязнения вод нефтепродуктами является водный транспорт и поверхностный сток с городских территорий. Загрязнение водной среды биогенными элементами ведет к эвтрофированию водоемов.
Органические вещества-красители, фенолы, ПАВ, диоксины, пестициды и др. создают опасность возникновения токсикологической ситуации в водоеме. Особенно токсичными и устойчивыми в окружающей среде являются диоксины. Это две группы хлорсодержащих органических соединений относящихся к дибензодиоксинам и дибензофуранам. Один из них -2, 3, 7, 8-тетрахлордибензодиоксин (2, 3, 7, 8-ТХДД) является самым токсичным соединением, известным науке. Токсическое действие различных диоксинов проявляется одинаково, но отличается по интенсивности. Диоксины накапливаются в окружающей среде, и их концентрация растет.
Изучение загрязнения воды имеет свои особенности. Как и при определении атмосферных загрязнений приходится определять малые количества веществ непостоянного состава в присутствии других загрязнителей. Отличие в том, что в незагрязненной воде постоянно содержатся органические и неорганические вещества сложного строения, кроме того, в воде протекают химические и фотохимические процессы, приводящие к изменению состава химических веществ. В химических превращениях большое участие принимают биологические объекты животного и растительного происхождения, Поэтому содержание кислорода является одним из важнейших показателей строения водной системы.
Особое значение для правильной оценки загрязнения воды, и в том числе для отбора проб, имеет распределение веществ, которое зависит от многих локальных условий: скорости и характера движения воды, осадков, физико-химических свойств загрязняющих веществ, их устойчивости в воде и т. д. Обычно устанавливается динамическое равновесие между ними. Если условно рассечь водную массу вертикальной плоскостью, можно выделить места различной реакционной способности: поверхностную пленку, основную водную массу и донный осадок.
Донный осадок и поверхностная пленка являются зонами концентрирования загрязняющих веществ. На дно оседают нерастворимые в воде соединения, а осадок является хорошим сорбентом для многих веществ.
В воду могут попадать не разлагаемые загрязняющие вещества. Но они способны реагировать с другими химическими соединениями, образуя устойчивые конечные продукты, которые накапливаются в биологических объектах (планктоне, рыбах и т.д.) и через пищевую цепь попадают в организм человека.
Вода, используемая человеком, имеет физиологическое, санитарно-гигиеническое, хозяйственное и эпидемическое значение. Употребление недоброкачественной воды, может быть причиной возникновения инфекционных болезней, геоэндемических заболеваний, заболеваний, связанных с загрязнением водоемов химическими веществами.
В основу гигиенического нормирования водопроводной воды положены два стандарта: ГОСТ 2874-82 «Вода питьевая» и ГОСТ 2761-84 «Источники централизованного хозяйственно-питьевого водоснабжения. Гигиенические, технические требования и правила выбора».
Отбор проб воды является важным и ответственным этапом во всем комплексе исследований воды. Результат анализа в значительной мере зависит от правильности отбора пробы [4]. При отборе проб необходимо соблюдать следующие правила.
При выборе места отбора пробы воды учитываются все обстоятельства, которые могут оказать влияние на состав взятой пробы.
Различают две основные пробы: разовую и среднюю. Разовую пробу получают путем отбора требуемого объема воды за один раз. Средняя проба получается смешением равных объемов проб, отобранных через равные промежутки времени. Средняя проба тем точнее, чем меньше интервалы между отдельно взятыми составляющими ее пробами.
Для отбора проб воды, на полный анализ берут бутыль вместимостью 5 дм3 с притертой или корковой пробкой. Для краткого анализа используют бутыль вместимостью 2 дм3. Бутыль должна быть чисто вымыта и ополоснута дистиллированной водой.
Проба воды из открытого водоема забирается в месте водозабора батометрами разной конструкции. Допускается отбор проб воды бутылью. Бутыль закрывают пробкой, к которой прикреплен шнур, к ней подвешивают груз на тросе. Обычно пробу берут на расстоянии 0,5-0,75 м от берега. Пробку вынимают при помощи шнура. Пробу воды с небольшой глубины, особенно зимой, отбирают шестом, с прикрепленной к нему бутылью.
Пробы из подземного источника (скважины, колодца) отбирают в часы максимального расхода воды. Из артезианской скважины пробы берут из устья скважины через пробоотборные краны, не реже чем 1 раз в квартал.
Из водопроводных кранов выемка пробы воды осуществляется через 10-15 мин после свободного спуска воды при полном открытии крана. Перед отбором пробы бутыль ополаскивают 2 раза отбираемой водой. Бутыль заполняют водой до верха, закрывают так, чтобы под пробкой оставался небольшой слой воздуха. На месте отбора пробы производят определение остаточного хлора, озона и запах.
Отбор пробы оформляется актом, в котором указывают: наименование источника, его адрес; место и глубину отбора; расстояние от берега; объем пробы; метеоусловия при отборе; вид пробы (разовая, средняя и др.); особые условия отбора; цель отбора; дату и время отбора и доставки; условия транспортировки, хранения; методы консервации; фамилию, имя, отчество лица, производившего отбор проб; ставится его подпись.
Хранение и транспортировка проб воды. Для транспортировки бутыли с водой упаковывают в ящик или корзинку с войлочной прокладкой или в сумку-холодильник. Доставленную воду рекомендуется исследовать в день отбора проб. В случае невозможности исследования воды в день отбора вода хранится в леднике: незагрязненная – 72ч; малозагрязненная 48ч. Срок хранения проб и выполнения анализа не должен превышать 72ч с момента отбора.
При невозможности произвести анализ в ближайшие 2-4 часа, производят консервацию проб. Доставляют 2-4 см3 хлороформа на 1 дм3 пробы, если в ней будут определять азотсодержащие вещества. Для определения в воде железа, алюминия, меди, мышьяка, цинка к ней добавляют концентрированную хлороводородную кислоту из расчета 3 см3 на 1 дм3. Для консервации используют также концентрированную азотную кислоту (3 см3 на 1 дм3) при определении свинца, марганца, молибдена, селена.
Не консервируют пробы при определении органолептических показателей, остаточного хлора, общей жесткости, сухого остатка, хлоридов, сульфата хлора и других.
18 Показатели качества воды
Физические свойства воды (температура, запах, вкус, цвет, прозрачность, осадок, муть) обусловливают внешний вид воды. Определение физических свойств воды имеет большое гигиеническое значение, т.к. наличие в воде постороннего запаха, привкуса, окраски может указывать на загрязнение воды посторонними веществами, кроме того, отталкивает потребителя, действуя на его эстетические чувства, даже если она безвредна.
Температура воды имеет большое физиологическое и гигиеническое значение. Наиболее благоприятной для питьевой воды является температура 7-12˚С.
Запахи и привкусы различают по интенсивности, измеряют в баллах. По ГОСТ - З≤2 балла, П≤2 балла.
Цветность воды определяется наличием различных гуминовых веществ и различной растительности, измеряется в градусах специальной платиново-кобальтовой шкалы. Ц<20 град.
Величина сухого остатка характеризует общее содержание растворенных в воде нелетучих минеральных и частично органических веществ, которые влияют на органолептические показатели воды. Согласно ГОСТ 2874-82, общее количество солей должно быть не выше 1000 мг/дм3.
Вода различных источников отличается постоянством. Появление в воде водоисточника новых соединений или повышение концентрации содержащихся в ней солей указывает на возможное загрязнение его за счет спуска промышленных, сельскохозяйственных или бытовых сточных вод. Вода хозяйственно-питьевого назначения отвечает гигиеническим требованиям, если она имеет постоянный химический состав, концентрации минеральных и органических веществ не превышают предельно допустимых, нет косвенных показателей ее загрязнения, отсутствуют ядовитые вещества.
Реакция воды обусловлена концентрацией водородных ионов. Активная реакция (рН) питьевой воды должна быть 6,0-9,0.
Жесткость воды определяется количеством растворенных солей угольной, серной, хлороводородной, фосфорной, азотной кислот, главным образом кальция и магния.
Щелочность природных вод обусловливается содержанием в ней гидрокарбонатов и карбонатов щелочноземельных металлов (Са, Мg, К, Nа) и других солей слабых кислот. Практически – это устранимая жесткость. Щелочность воды имеет большое значение для процесса коагуляции воды при ее очистке.
Важным косвенным показателем загрязнения воды органическими веществами животного происхождения являются соли аммиака, азотной и азотистой кислот. Присутствие аммонийных солей в количествах, превышающих 0,1 мг/дм3, указывает на свежее загрязнение воды, так как аммиак является начальным продуктом разложения органических азотсодержащих веществ. Иногда, особенно в глубоких подземных водах, возможно присутствие аммиака, образовавшегося за счет восстановления нитритов при отсутствии кислорода. В этом случае аммиак не указывает на недоброкачественность воды. Не является опасным в эпидемическом отношении и повышенное содержание аммиака в болотистых и торфяных водах (аммиак растительного происхождения).
Соли азотистой кислоты (нитриты) – представляют собой продукты окисления аммиака под влиянием микроорганизмов в процессе нитрификации. Наличие нитритов в количествах, превышающих 0,002 мг/дм3, свидетельствует об известной давности загрязнения.
Соли азотной кислоты (нитраты) – конечные продукты минерализации органических веществ. Присутствие в воде нитратов без аммиака и нитритов указывает на завершение процесса минерализации. Одновременное содержание в воде аммиака, нитритов и нитратов свидетельствует о явном неблагополучии водоисточника, постоянном его загрязнении; повышенные количества нитритов и нитратов без наличия аммиака указывают на прекращение загрязнения в настоящее время. Наличие в воде аммиака и нитритов указывают на недавнее появление постоянно действующего источника загрязнения. Присутствие в воде одних нитратов говорит об окончании процессов минерализации.
Повышенное содержание в воде нитратов может иметь минеральное происхождение (за счет химического состава почвы, применения минеральных удобрений и т.д.). Допустимое содержание нитратов в питьевой воде - не более 45 мг/дм3. Нитраты под влиянием микрофлоры кишечника переходят в нитриты, последние, поступая в кровь, вызывают у детей и взрослых метгемоглобинемию, что уменьшает снабжение тканей кислородом, оказывает неблагоприятное влияние на состояние ЦНС, сердечно-сосудистой, дыхательной систем, многие биохимические процессы. Химическое исследование начинают с качественных реакций, чтобы не тратить время на количественное определение тех солей, которые в воде отсутствуют. Биохимическая потребность в кислороде (БПК5). БПК – количество кислорода в миллиграммах, необходимое для биохимического окисления органических веществ, содержащихся в 1дм3 воды при температуре 20°С в течение 20 или 5 суток. Чем больше загрязнена вода органическими веществами, тем выше ее БПК. Согласно ГОСТ 2761-84, БПКполное должно быть не более 3 мг О2 /дм3 (для первого класса источника).
Перманганатная окисляемость воды – это количество кислорода в мг, которое расходуете» на химическое окисление органических и неорганических (соли Fе2+, сероводород, аммонийные соли, нитраты и др.) веществ, содержащихся в 1дм3 воды. Повышенная окисляемость может указывать на загрязнение воды. Наименьшую окисляемость (1-2 мг O2 /дм3) имеют глубокие подземные воды. В грунтовых водах окисляемость составляет 2-4 мг/дм3, причем она тем больше, чем выше цветность воды. В воде открытых водоемов окисляемость выше 5-6 мг/дм3 О2 в реках и 5-8 мг/дм3 О2 в водохранилищах.
Гигиеническое значение хлоридов определяется их происхождением. Большое содержание хлоридов возможно при прохождении водоносного горизонта через солончаковые почвы, загрязнении воды сточными водами (экскрементами человека и животных, кухонными отбросами). Согласно ГОСТ, содержание хлоридов в воде не должно превышать 350 мг/дм3. Содержание хлоридов в воде свыше 350 мг/дм3 придает ей соленый вкус. Значительное содержание хлоридов, аммиака, высокая окисляемость в сочетании с неблагоприятными бактериологическими показателями указывают на санитарное неблагополучие водоисточника.
Сульфаты в количествах, превышающих 500 мг/дм3, придают воде горьковато-солоноватый вкус, при концентрации 1000-1500 мг/дм3 неблагоприятно влияют на желудочную секрецию, могут вызвать диспергические явления. Сульфаты могут быть показателем загрязнения поверхностных вод животными отбросами, так как составной частью белковых тел является сера, которая при разложении и последующем окислении превращается в соли серной кислоты. В водопроводной воде содержание сульфатов не должно превышать 500 мг/дм3.
Санитарно-бактериологические показатели: общее число бактерий – допускается в 1 мл до 100. Коли титр – объем воды в мл, в котором содержится 1 кишечная палочка; он должен быть не более 300. Коли индекс - количество кишечных палочек в 1 литре воды; не более 3 в одном литре воды.
19 Исследование почвы
Почва является средой, с которой человек связан в течение всей своей жизни; в зависимости от условий она может влиять на состояние его здоровья [4]. При загрязнении почвы органическими веществами животного происхождения почва может явиться источником инфекции или инвазии. Почва может подвергаться радиоактивному и химическому загрязнению. Она может явиться причиной геохимических заболеваний (флюороз, зобная, уровская болезни и др.). Кроме отмеченных санитарных и эпидемических моментов, имеют значение механический и химический состав почвы, степень ее сухости и влажности, способность к самоочищению, что важно знать при градостроительстве.
При оценке санитарного состояния почвы применяют физико-химические, гельминтологические, бактериологические, энтомологические, радиологические и другие исследования в зависимости от поставленной цели. Так, при оценке санитарного состояния естественной почвы, земельных участков, отводимых под новые населенные пункты, рекомендуется проводить полный санитарный анализ почвы, который включает определение: механического состава, влажности свежевзятого образца и гигроскопической влажности; содержание солей аммония, нитритов, нитратов, хлоридов; общего, органического и почвенного азота; природного микро - и макроэлементарного состава; вредных химических веществ; общего числа микроорганизмов, колититра, титра анаэробов; содержания яиц гельминтов, личинок и куколок мух.
При гигиенической оценке искусственно созданной почвы населенных мест в случае благоприятной эпидемической обстановки рекомендуется проводить исследования по схеме краткого санитарного анализа: определение влажности, хлоридов, окисляемости, санитарного числа, микробного числа, колититра, титра анаэробов, содержания яиц гельминтов, личинок и куколок мух.
Частота отбора проб почвы для лабораторного анализа зависит от характера источника загрязнения.
На сельскохозяйственных объектах пробы почвы следует отбирать до первой обработки растений пестицидами и во время уборки овощей. Отбирать и исследовать почву необходимо одновременно с отбором и анализом овощей.
На территории детских учреждений, расположенных в зоне влияния промышленных предприятий, в местах массового отдыха и первого пояса зоны санитарной охраны источников питьевого водоснабжения, пробы почвы отбирают 2 раза в год – весной (апрель) и осенью (октябрь); на участках, размещенных в зоне влияния объектов, подвергающихся обработке химическими средствами защиты растений, до и после перовой обработки, в середине лета и после последней обработки.
В районе складирования промышленных отходов пробы почвы отбирают по четырем румбам на расстоянии 500 м от шламонакопителей и промышленных отвалов после таяния снега, в июле, августе, октябре.
В сопроводительном талоне указываются: дата и час отбора пробы, адрес, номер участка и пробной площадки, горизонт, глубина взятия пробы, характер метеорологических условий в день отбора проб; особенности, обнаруженные в день отбора проб (освещение солнцем, применение средств химизации, виды обработки почвы, наличие свалок, очистных сооружений и т.д.); чертеж земельного участка, фамилия, имя, отчество лица, отобравшего пробу, ставится его подпись.
Определение показателей органического загрязнения. Загрязненные почвы обычно содержат большое количество органических веществ и поэтому являются благоприятной средой для развития микроорганизмов. При оценке химических показателей проводится их сопоставление с аналогичными показателями контрольного участка.
На свежее загрязнение указывает присутствие органического азота, углерода и хлоридов в изучаемой почве в количествах, превышающих их содержание в почве контрольного участка Обнаружение повышенных количеств солей аммония, нитритов, нитратов свидетельствует о постоянном загрязнении почвы органическими веществами. Если количество органического углерода и органического азота в почве опытного участка не превышает их содержания в почве контрольного, то это является показателем чистоты почвы. Присутствие в такой почве нитратов и хлоридов указывает на давность загрязнения и окончание процессов минерализации органических веществ.
Анализ водной вытяжки из почвы. При воздействии воды на почву большинство из образующихся минеральных солей растворяются и переходят в водную вытяжку, в которой они могут быть определены соответствующими методами. Таким образом, по данным анализа водной вытяжки из почвы можно судить о санитарном состоянии почвы, т.е. о характере и степени загрязнения почвы органическими веществами, интенсивности их минерализации и завершенности процесса самоочищения почвы.
20 Вопросы для самостоятельного изучения
1) Спектральный анализ.
2) Атомно-абсорбционный метод анализа.
3) Потенциометрический и вольт амперометрический методы анализа.
4) Рентгено-флюоресцентный анализ.
5) Гравиметрический анализ.
6) Абсорбционная спектрометрия. Аппаратура и методы измерения.
7) Кулонометрический и кондуктометрический методы анализа.
8) Пламенно-ионизационный метод.
9) Кулоно-полярографический метод.
10) Концепция растворов и вычисления в количественном анализе.
11) Систематическая, случайная и суммарная погрешности.
12) Общая теория измерений.
13) Ионная хроматография, хроматография в тонком слое и на бумаге.
14) Инфракрасный метод анализа.
15) Нефелометрический и турбидиметрический методы анализа.
21 Терминологический словарь
Абсорбция – процесс поглощения веществ из растворов газов твердыми телами или жидкостями.
Адсорбция – процесс поглощения веществ из растворов или газов поверхностным слоем твердого тела.
Анализ – процесс получения информации о составе веществ и их смесей.
Анемометр – прибор для измерения скорости воздушного потока.
Ареометр – прибор для измерения плотности жидкости.
Газоанализатор – прибор для измерения концентрации определенных веществ в атмосферном воздухе или источниках выбросов, например, в отработанных газах автомобилей
Индикаторная трубка – запаянная стеклянная трубка, содержащая индикационную массу, которая изменяет свою окраску в результате химической реакции с определенным веществом. Перед использованием трубку вскрывают с двух концов, пропускают через нее определенный объем загрязненного воздуха. Концентрацию примеси определяют по длине окрашенного слоя. Используется в химических газоанализаторах (газоопределителях).
Коагуляция – процесс укрупнения дисперсных частиц в результате их взаимодействия и объединения в агрегаты.
Концентрация – основная физическая характеристика содержания вредных веществ в атмосфере – количество вещества, содержащееся в единице объема воздуха при нормальных условиях. Как правило, ее измеряют в мг/м3.
Манометр – прибор для измерения давления жидкостей и газов.
Метод анализа – способ получения информации об исследуемом объекте исследования на основе определенного явления природы, например атомная абсорбция, масс спектрометрия и т.д.
Методика анализа – детальное описание хода проведения анализа.
Предельно допустимый выброс (ПДВ) – максимальный объем выбросов веществ в единицу времени, который не ведет к превышению их предельно допустимых концентраций.
Предельно допустимый сброс (ПДС) вещества в водный объект – масса вещества в сточных водах, максимально допустимая к отведению с установленным режимом в данном пункте одного объекта в единицу времени с целью обеспечения нормального качества воды в месте отбора проб.
Предельно допустимая концентрация (ПДК) – количество вредного вещества в окружающей среде, которое при контакте или при воздействии за определенный промежуток времени практически не влияет на здоровье человека.
Проба – часть объекта исследования, взятая для проведения анализа. Очень важно, чтобы проба была представительной, т.е. ее состав должен максимально соответствовать составу объекта исследования, потому что выводы о состоянии объекта исследования делаются по результатам анализа пробы. Неправильно проведенный отбор пробы является одним из главных источников ошибок. Размер проб не является произвольно выбираемой величиной, он зависит от содержания в пробе определяемого вещества и чувствительности метода анализа. Способы и места отбора проб определяются задачами анализа и используемыми методами,
Расходомер – прибор для измерения расхода жидкости или газа.
Сорбент – поглощающее вещество.
Сорбция – поглощение твердым веществом или жидкостью вещества из окружающей среды.
Хемосорбция – процесс, сопровождающийся химическим взаимодействием поглощаемого вещества с реагентом, находящимся в поглотительном растворе или нанесенным на твердый сорбент. Химические реагенты наносят на твердый носитель или на сорбент с активной поверхностью (уголь, силикагель).
Литература
Основная
1 Голицын А.Н. Основы промышленной экологии: учебник. – М. : ИРПО; Издательский центр «Академия», 2002. – 240 с.
2 Федорова А.И., Никольская А.Н. Практикум по экологии и охране окружающей среды: учебное пособие для студ. высш. учеб, заведений- М. : Гуманит. изд. центр ВЛАДОС, 2003. – 288 с.: ил.
3 Природоохранные нормы и правила проектирования: справочник /сост. : Ю.Л. Максименко, В.А. Глухарев – М. : Стройиздат, 1990. – 527 с.
4 Руководство к практическим занятиям по методам санитарно-гигиенических исследований: учебное пособие. Азевич З.Ф./ под ред. Л.Г. Подуновой. – М. : Медицина, 1990. – 304 с.: ил.
5 Дмитриев М.Т. Санитарно-химический анализ загрязняющих веществ в окружающей среде: справочник. – М. : Химия, 1989. – 367с.
6 Перегуд Е.А., Горелик Д.О. Инструментальные методы контроля загрязнения атмосферы. – Л. : Химия, 1981. – 126 с.
7 Санитарно-химический контроль воздуха промышленных предприятий /под ред. С.И. Муравьевой. – М. : Химия, 1982. – 97 с.
8 Методы анализа загрязнений воздуха /Ю.С. Другок. – М. : Химия, 1984. – 133 с.
9 Перегуд Е.А. Химический анализ воздуха. – Л. : Химия, 1976. – 119 с.
10 Муравьева С.И., Казнина Н.И. Справочник по контролю вредных веществ в воздухе. - М. : Химия, 1988. – 320 с.
11 Руководство по контролю вредных веществ в воздухе рабочей зоны: Справочное издание / С.И. Муравьева, М.М. Буковский. – М. : Химия, 1991. – 368 с.
12 Физико-химические методы анализа. Практическое руководство / Алексовский В.В. – М. : Химия, 1988. 231 с.
13 Васильев В.П. Аналитическая химия. В 2-х частях. Ч. 2. Физико-химические анализы: учебное пособие для вузов. – М. : Высшая школа, 1989. – 187 с.
14 Симонов В.А. Анализ воздушной среды при переработке полимерных материалов. – Л. : Химия, 1988.113 с.
15 Лейте В. Определение загрязнений воздуха в атмосфере и на рабочем месте. – Л. : Химия, 1980. 92 с.
16 Грибанов А.С. Руководство по отбору и анализу пылегазовых выбросов: учебное пособие. – Брянск, 1997.- 104 с.
17 Унифицированные методы анализа воды /под ред. Ю.Ю. Лурье. – М. : Химия, 1988. 91 с.
18 Алексеев В. Н. Количественный анализ. – М, : Госхимиздат, 1972. – 305 с.
19 Крешков А. П. Основы аналитической химии. Книги 1, 2. – М. : Химия, 1971. – 214 с.
20 Лурье Ю. Ю. справочник по аналитической химии. – М. : Химия. 1979. – 183 с.
Дополнительная
21 Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / под редакцией профессора Н.В. Лазарева. В 3-х томах. – Л. : Химия, 1977. 267 с.
22 Грушко Я.М. Вредные неорганические соединения в промышленных выбросах в атмосферу. Справочное издание. – Л. : Химия, 1987. – 246 с.
23 Сборник методик по определению концентраций вредных веществ в промышленных выбросах. – Л. : Гидрометеоиздат, 1989.
24 Сборник методик по расчету выбросов в атмосферу загрязняющих веществ различными производствами. – М. : Гидрометеоиздат, 1990. – 304 с.
25 Защита атмосферы от промышленных загрязнений: справочник в 2-х частях /под ред. Л. Калверта. – М. : Металлургия, 1990. – Ч.2. – 285 с.
26 Контроль за выбросами в атмосферу и работой газоочистных установок на предприятиях машиностроения. Практическое руководство. – М. : Машиностроение, 1984. – 128 с.
27 Орлов Д.С. Экология и охрана биосферы при химическом загрязнении: учебное пособие для студентов хим., хим-технол. и биол. спец. – М. : Высшая школа, 2002. – 334 с.
28 Электроаналитические методы в контроле окружающей среды / под ред. А.А Неймана. – Л. Химия, 1990. 210 с.
29 Руководство к лабораторным занятиям по коммунальной гигиене: учебник / под ред. Е.И. Гончарука. – 2-е изд., перераб. и доп. – М. : Медицина, 1982. – 448 с., ил.
30 Руководство по контролю загрязнения атмосферы. ОНД-90. – Л. : Госкомгидромет, 1990. – 135 с.
31 Справочник по физико-химическим методам исследования объектов окружающей среды / Г.И. Арамович. – Л. : Химия, 1997. – 647 с.
32 Справочник по свойствам, методам анализа и очистке воды. – Киев: Наука, 1980. – 312 с.
33 Волков Э.П. Контроль загазованности атмосферы выбросами ТЭС. – М. : Энергоиздат, 1988. – 167 с.
34 Руководство по расчету загрязнения воздуха на промплощадках. – М. : Стройиздат, 1988. – 195 с.
35 Руководство по химическому и технологическому анализу воды. – М. : Стройиздат, НИИВОДГЕО, 1983. – 211 с.
36 Практикум по физико-химическим методам анализа /под ред. О.М. Петрухина. – М. : Химия, 1988. – 246 с.
Содержание
Введение……………………………….…………………...……............3
1 Методы и приборы измерения и контроля загрязняющих веществ…………………………………………………………..............5
2 Исследование воздуха……………………………………………..........6
3 Требования, предъявляемые к методам анализа воздуха ……............7
4 Отбор проб воздуха………………………………………………..........8
5 Оборудование, применяемое при отборе проб воздуха………………………………………………………….............10
6 Определение вредного вещества в воздухе ……………………........17
7 Определение термодинамических характеристик …………….........18
8 Определение скорости и расхода газовоздушных смесей ……........18
9 Определение запыленности газовоздушных потоков и атмосферного воздуха………………...…….........................................20
10 Методы анализа…………………………………………………........23
11 Методы физико-химических исследований ………………….........24
12 Фотометрический метод ……………………………………….........25
13 Полярографический метод ..……….……………………………......32
14 Люминесцентный метод…………………………………………......33
15 Метод газовой хроматографии………………………………….......35
16 Экспресс - методы определения токсичных веществ………….......37
17 Исследование воды …….…………………………………...….........39
18 Показатели качества воды……………………………………….......43
19 Исследование почвы……………………………………………........46
20 Вопросы для самостоятельного изучения …………………….........48
21 Терминологический словарь …………………………………..........48
Литература…..……………………………………………………......51
