Снмп/дгпж и половые расстройства: какая связь и возможности лечения? Доста Н. И., Вощула В. И., Вальвачев А. А. Введение
| Вид материала | Документы |
СодержаниеЭпидемиологические взаимоотношения между СНМП и ПР. Патофизиология взаимоотношений между СНМП и ПР Влияние лечения ДГПЖ на сексуальную функцию. Медикаментозная терапия. |
- Новое в патофизиологии преждевременной эякуляции: основы современной лекарственной, 637.64kb.
- Доброкачественная гиперплазия (аденома) предстательной железы, 24.71kb.
- Лекция №8. Женская половая система, 80.96kb.
- Лекция №8. Женская половая система, 78.12kb.
- Фармакоэкономический анализ оперативного и медикаментозного лечения доброкачественной, 21.16kb.
- Медикаментозная терапия, 93.08kb.
- Психофармакотерапия биполярного аффективного расстройства: как и почему практика отличается, 270.99kb.
- Статья посв, 308.64kb.
- F0 Органические, включая симптоматические, психические расстройства, 4147.6kb.
- Лекция IV, 354.94kb.
СНМП/ДГПЖ и половые расстройства: какая связь и возможности лечения?
Доста Н.И., Вощула В.И., Вальвачев А.А.
Введение
Половые расстройства (ПР) –это термин, который включает в себя расстройства полового влечения, отсутствие или снижение эрекции, нарушения эякуляции и оргазма или изменение сексуального поведения. Важно отметить, что эти проблемы часто имеют место у пожилых мужчин, а перечисленные симптомы являются обычным явлением у многих из них [1]. Оценку половой функции можно провести используя большое число специальных опросников, созданных специально для мужчин, среди которых являются наиболее известными и распространенными International Index of Erectile Function (IIEF), Derogatis Interview for Sexual Functioning (DISF) [2], и Changes in Sexual Functioning Questionnaire (CSFQ) [3,4]; последний сегодня адаптирован в краткой форме и содержит 14 вопросов [5].
Хотя давно было известно, что у мужчин с возрастом регулярные половые связи становятся ограниченными, только в последнее годы стали проводиться крупномасштабные эпидемиологические исследования, чтобы подтвердить это предположение. Такие исследования как Olmsted County Study, Masachusetts Male Aging Study, National Health and Social Life Survey и Cologne Male Survey выяснили не только связанное с возрастом снижение половой активности, но и так же увеличение недовольства мужчин имеющимися у них сексуальными нарушениями, а так же увеличением случаев именно эректильной дисфункции (ЭД) [1,6-8]. Увеличение значений среднего возраста и продолжительности жизни среди мужчин увеличивает интерес общества к сексу и половой жизни и этот интерес будет возрастать, что будет приводить к росту претензий внутри этой сферы жизни среди большой части населения.
Как и половая дисфункция, симптомы нижних мочевых путей (СНМП) более часто встречаются у мужчин с возрастом, что подтверждается в таких исследованиях, как Olmsted County Study [1,9-11] и Baltimore Longitudinal Study of Aging [12]. Наблюдая тесную связь ПР и СНМП можно предполагать, что они имеют место у каждого мужчины с увеличением возраста. Более того, это обстоятельство выдвигает вопрос имеется ли и, если да, то какая причинная связь между ПР и СНМП, а если такая связь имеется, то это является показанием для лечения обоих состояний, т.е. ПР и СНМП. Целью данной статьи является представить литературный анализ эпидемиологических связей между ПР и СНМП, попытку раскрытия их патофизиологических механизмов, а так же показать те подходы подходы лечения сочетания ПР и СНМП, которые логично вытекают из анализа механизмов связи ПР и СНМП. Хочется надеяться, что материал, представленный в статье покажется интересным не только с научной точки зрения, но и окажется полезным в практическом плане, поскольку половые расстройства у мужчин любого возраста, давно вышли из разряда популярной тематики, а становятся все более важной составляющей качества жизни мужской половины общества.
Эпидемиологические взаимоотношения между СНМП и ПР.
Несмотря на вероятность наличия связи между СНМП и ПР данные об эпидемиологических исследованиях, позволяющих количественно определить эти взаимоотношения появились только в конце 1990года. Ранние, совместные исследования на 2011 мужчинах, проведенные во Франции показали, что если такие факторы, как сопутствующие заболевания и возраст принимать во внимание, то вероятное число мужчин, недовольных своей половой жизнью увеличивается вдвое у мужчин со средней степенью выраженности симптомов и в 4 раза с тяжелыми симптомами [13]. Другое исследование касалось совместного изучения протокола из 423 мужчин и второго протокола, в который было включено 1271 пациент с СНМП, которые посещали урологические клиники и были частью большого исследования. В данном исследовании участвовало 12 стран (International Continence Society Benign Prostatic Hyperplasia – ICS-BPH) [14,15]. У мужчин, изучавшихся в параллельном совместном исследовании (423 человека) была установлена связь между частотой мочеиспускания и симптомами накопления, а так же снижением ригидности полового члена при эрекции с нарушением начала мочеиспускания, вялой струей мочи, выделением мочи каплями в конце мочеиспускания, ургентным недержанием, ночным недержанием мочи. Наибольшая вероятность связи частого мочеиспускания и ПР (5,63) была обнаружена при учащенном ночным мочеиспусканием. В целом, в вышеуказанных исследованиях, наибольшая связь снижения ригидности полового члена, т.е. снижения эрекции, ухудшения эякуляции, наблюдалась при симптомах накопления.
Продолжается поиск новых исследований для оценки взаимоотношения между СНМП и ПР, более глубоко детализируя их распространенность при множестве СНМП, измеренных по шкале IPSS [16-19]. Полученные данные о 1274 мужчинах, включенных в ALF-ONE исследование, показали, что линейные взаимоотношения между распространенностью сниженной эрекции, сниженной эякуляции и болями/дискомфортом при эякуляции и IPSS слабой, средней и тяжелой степени проблематичны [17]. Однако, эти взаимоотношения были подтверждены в большом исследовании на 8563 мужчинах с СНМП/ДГПЖ, которые лечились в урологических клиниках Германии. В данном исследовании наблюдалась отчетливая связь между распространенностью ЭД и IPSS с большим преобладанием этих расстройств у мужчин пожилого возраста (Рис.1) [18].
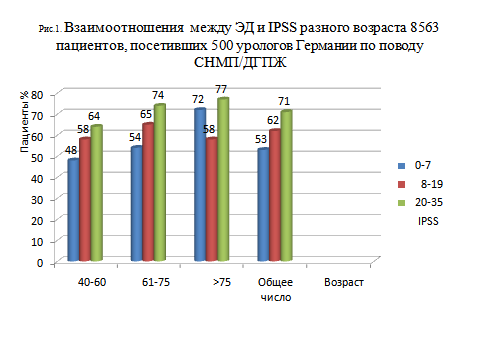
В группе больных с выраженными значениями симптомов по IPSS в возрасте > 75 лет ЭД обнаруживалась у 71% по сравнению с 48% в группе 40-60 лет и слабо выраженными симптомами IPSS, что лишний раз подтверждает неблагоприятное влияние возраста, а так же выраженности симптомов течения ДГПЖ на половую функцию. Такая же взаимосвязь была обнаружена в данных по нарушениям мочеиспускания и снижению либидо у 7334 мужчин, включенных в исследование Reduction by Dutasteride of Prostate Cancer Events (REDUCE); более высокие значения IPSS ассоциировались с более высоким преобладанием ЭД [19].
Важно подчеркнуть, что риск взаимосвязи между СНМП и ЭД может быть такой же строго вероятный, как и связи ЭД с другими факторами риска, как, например, с гипертонией и гиперлипидемией. В исследовании, проведенном на 2869 мужчинах средние значения разницы ЭД с показателями IPSS < и > 7 составили 2,20, которые сравнимы с гипертонией (2,05) и гиперлипидемией (2,29), но меньше, чем при сахаром диабете (3,00) [20]. Вместе с тем, в другом совместном исследовании на 1688 мужчинах в Нидерландах, СНМП были обозначены, как очень высокий фактор риска ЭД у 27% мужчин [19]. В этом исследовании средний показатель разницы в частоте ЭД со средней степенью симптомов и без них составил 3,4 и 7,5 в группе тяжелой степени СНМП и без симптомов и все это наблюдалось в возрасте пациентов ≥ 70 лет. Крупномасштабное исследовние Multinational Survey of the Aging Male (MSAM-7), в котором были собраны данные 14254 опрошенных мужчин показало, что эректильные расстройства были связаны только с тяжестью СНМП, и они не зависели от таких сопутствующих заболеваний, как диабет, гипертония, заболевания сердца и гиперхолестеринемия [21]. Это исследование, которое подтвердило независимость существующей взаимосвязи ПР и СНМП от сопутствующих заболеваний, было подтверждено в соответствующих данных, собранных при проведении исследования MTOPS на 3047 мужчинах [22]. Если связь между степенью СНМП и ПР в этом исследовании была четко установленной, то взаимосвязь между объемом простаты и ПР была менее доказанной. Одно исследование, которое проведено, как часть Olmsted County Study продемонстрировало достоверную связь между объемом простаты и ПР [23]. Между тем, в последнем исследовании Proscar Long-term Efficacy and Safety Study (PLESS), в котором исследовалась роль уровня ПСА в определении объема простаты и связи его с ПР, результат оказался отрицательным [24]. Это исследование подтвердило так же слабую связь между ПСА и значениями IPSS, что стало понятым несколько позже. Подводя итог можно все же предположить, что существует тесная связь между СНМП и ПР, между СНМП и размерами ДГПЖ.
Патофизиология взаимоотношений между СНМП и ПР
Наличие доказанных эпидемиологическими исследованиями четкой связи между СНМП и ПР позволяют предположить, что может существовать и истинная причинная связь между этими состояниями. Важно обнаружить и понять патофизиологию этих путей, которые могут быть ответственными за сосуществование вышеуказанных взаимоотношений. Предполагается существование четырех больших патофизиологических механизмов, не являющихся конкурирующими в объяснении существования связей между СНМП и ПР. Этими механизмами могут быть: изменения в путях превращения оксида азота в предстательной железе, тазовый атеросклероз, метаболический синдром и автономная гиперактивность [25].Считается, что такие факторы риска развития ЭД, как диабет, курение, дислипидемия и гипертония могут снизить активность закиси азота в предстательной железе и мочевом пузыре, а следовательно и локальный уровень NO в кавернозных телах полового члена. Теоретически это может привести к пролиферации клеток гладких мышц простаты, а стало быть – к обструкции шейки мочевого пузыря за счет усиления тонуса этих мышц. Подтверждением этой гипотезы может быть полученные от исследования на людях [26, 27] и на собаках [28] данные о снижении нитритергической иннервации в результате снижения уровня нитрат-оксид синтетазы (NOS) при ДГПЖ , что наблюдается напрямую, а так же отмечается снижение экспрессии другого вида синтетазы - NOS 2A mRNA. Поскольку синтез NO достоверно влияет на СНМП и ЭД, то можно ожидать, что ингибиторы 5-фосфодиэстеразы (PDE -5) так же могут оказывать свое влияние на оба этих состояния. Естественно, требуются дальнейшие конкретные, нацеленные исследования [29], после рандомизации которых, можно будет сделать окончательно соответствующие выводы. Логический же анализ поддерживает идею потенциального использования ингибиторов 5-PDE в лечении СНМП [30]. В дополнение к этому, данные представленные на встрече Ассоциации по сексуальной медицине Северной Америки в ноябре 2005 года в Нью-Йорке показали, что мужчины, которые принимали силденафил наряду с улучшением эректильной функции, отметили снижение ирритативных и обструктивных симптомов, обусловленных ДГПЖ. Более прямой механизм может быть объяснен индукцией увеличения симпатического тонуса в результате увеличения клеточной пролиферации предстательной железы (рост ДГПЖ). Автономная иннервация является важной для контроля за ростом железы и ее дифференцировкой, что подтверждается наблюдениями уменьшения объема простаты после симпатэктомии [31], в то время как спонтанный гипертонус гладких мышц простаты, способствует так же развитию симптомов ДГПЖ [32]. Исходя из нашего понимания об автономной нервной системе и ее роли в физиологии модуляции ответа на стресс, становится очевидным, что гиперактивность (гипертонус) могут играть более прямую роль в изменении мочеиспускания и эректильной функции. Прямым свидетельством о роли гиперактивности автономной нервной системы являются полученные в последних исследованиях данные о том, что автономные вариации уровня норэпинефрина и эпинефрина в моче, уровень эпинефрина в плазме и изменение уровня норэпинефрина в плазме после нагрузочного теста положительно коррелировали с субъективной оценкой СНМП по шкале Американской ассоциации урологов (AUA-SI), с индексом шкалы влияния на качество жизни, а так же с самими показателями качества жизни и максимумом скорости мочеиспускания (Qmax) [33]. Такие же данные получены в субисследовании MTOPS, показавшим интригующую возможность того, что хорошо известный эффект α-адреноблокаторов у мужчин с СНМП может быть скорее связан с центральным, чем с периферическим действием - гипотезой, которая еще полностью не объяснена.
И, наконец, атеросклероз, который является достаточно понятной причиной ЭД, может возникать и при снижении перфузии в стенке мочевого пузыря, что нарушает пролиферацию клеток гладкой мускулатуры и приводит к развитию спазмов и СНМП [34]. Таким образом имеются данные, которые поддерживают значимость гипоксии в развитии СНМП [35], хотя это вызывает споры при обсуждении возможных механизмов развития ЭД [36].
Таким образом, несмотря на то, что все эти патофизиологические гипотезы являются интригующими, природа связи между СНМП и ПР остается до конца непонятой, несмотря на то, что она достоверно существует. Возможно, что различные факторы могут привносить различные условия в течение болезни у каждого мужчины индивидуально.
И последнее, поскольку патогенетически взаимоотношения между СНМП ПР, в некотором роде, остаются гипотетическими, унифицированная теория, которая была бы рациональной в определении метода лечения сочетающихся СНМП и ПР пока отсутствует.
Влияние лечения ДГПЖ на сексуальную функцию.
Хирургическое и минимально инвазивное лечение.
Интуитивно можно себе представить, что и открытая аденомэктомия и ТУР по поводу СНМП из-за ДГПЖ могут влиять на нарушенную половую функцию. Вместе с тем, исследование, проведенное на 60 мужчинах, подвергнутых аденомэктомии по поводу ДГПЖ, не смогло выявить каких-либо изменений половой функции в результате аденомэктомии, предположив, что любая операция не может влиять на половую функцию или, что любое нарушение половой функции, наступившее после операции, уменьшалось в связи с улучшением СНМП, наступившем после операции [37]. Более того, по результатам других исследований, ТУР в некоторых случаях, скорее может повысить, чем понизить эректильную функцию [38], хотя боли и дискомфорт при эякуляции могут увеличиватся и ПР остаются, как возможное послеоперационное осложнение. Минимально инвазивные методы лечения (трансуретральная микроволновая терапия [TUMT] и трансуретральная игольчатая аблация [TUNA] ухудшают ПР в меньшей степени, чем ТУР, которые соотносятся, как 3:10 %, а по расстройства эякуляции, как 15:65%, соответственно.
Медикаментозная терапия.
Традиционно, данные о влиянии α-блокаторов и ингибиторов 5α-редуктазы на половую функцию рассмамриваются, как побочные эффекты, отмечаемые при клинических испытаниях этих лекарств, а так же при прямой оценке сексуальной функции, полученной при использовании опросников. Только оценка половой функции пациентов до начала лечения этими лекарствами и эта же оценка эффекта плацебо в этих исследованиях являются правильными в понимании влияния этих лекарств на половую функцию.
Однако, отрицательные эффекты на половую функцию не наблюдаются в такой степени при использовании α-блокаторов, как при использовании плацебо, [39-42]. Есть основания предполагать, что улучшение половой функции при использовании α-блокаторов является результатом улучшения их СНМП.
В одном открытом исследовании была дана оценка влияния альфузозина на половую функцию у 3076 пациентов, в течение 1 года получавших альфузозин [43]. По данным оценки конечных результатов, альфузозин достоверно улучшает показатели IPSS. У этих же пациентов были отмечены достоверные улучшения степени ригидности при эрекции, улучшение эякуляции и снижение показателя боль/дискомфорт при эякуляции. Эти данные представляют большой интерес и они должны учитываться при проспективных, рандомизированных исследованиях.
Представляет интерес пилотное исследование S. Kaplan и соавт (51). Данное исследование было предпринято для оценки эффективности и безопасности назначения α-блокатора альфузозина по 10 мг 1 раз в день и ингибитора ФДЭ-5 силденафила по 25 мг 1 раз в день и обоих препаратов в комбинации для лечения СНМП/ ДГПЖ сочетающимися с эректильной дисфункцией (ЭД).
Мужчины в возрасте 50-76 лет с ранее не леченными по поводу СНМП и ЭД были разделены на 3 группы: леченных альфузозином (n=20), принимавших силденафил (n=21) и леченных обоими препаратами (n=21). Лечение во всех группах продолжалось 12 недель.
Результаты лечения показали, что индекс IPSS улучшился во всех трех группах пациентов, однако, лучше всех он стал в группе, где проводилось комбинированное лечение (-24%), по сравнению с (-15,6%) в группе альфузозина и (-16,9) в группе пациентов, леченных только одним силденафилом ( р < 0,03). Частота мочеиспускания, ночное мочеиспускание, объем остаточной мочи и Qmax статистически достоверно улучшились, как при монотерапии альфузозином, так и при комбинированной терапии. Улучшение международного индекса эректильной функции (IIEF) составило 16,7% при приеме альфузозина и 49,7% силденафила и больше всего (58,6%) при комбинации этих препаратов. Соответственно увеличение частоты пенетраций (Q3) и способности поддержания достаточной для пенетрации эрекции (Q4) были выше при комбинированной терапии (65,2% и 68,2%) соответственно, чем при использовании силденафила (41,7% и 59,1%) и альфузозина, в виде монотерапии. Все три вида терапии хорошо переносились пациентами.
Таким образом, комбинация альфузозина по 10 мг в день и силденафила по 25 мг в день являются более эффективными, чем монотерапия этими препаратами в лечении СНМП и ЭД, проявляющихся в сочетании у больных с ДГПЖ.
Плацебо контролируемые исследования ингибиторов 5α-редуктазы показали, что при их приеме ЭД появляется у 7-8% мужчин (плацебо 4-5%), снижение либидо у 4-6% (плацебо 2-3) и ненормальная эякуляция у 1-2% мужчин (плацебо <1%). Эти эффекты более выражены в первые месяцы лечения и в последующем их частота снижается [44-47]. В дополнение к этим данным проводилось прямое сравнение α-блокаторов и ингибиторов 5α-редуктазы и их комбинации. Исследование ALFIN было одним из первых исследований, где проводилось прямое сравнение действия на половую функцию ингибитора 5α-редуктазы (финастерида) и α-блокатора (альфузозина) и их комбинации, хотя в этом исследовании не было плацебо группы [48]. Исследование ALFIN показало, что альфузозин оказывает положительное влияние на половую функцию, в то время как финастерид и комбинированная терапия увеличивает показатели датской шкалы симптомов, подраздела сексуальной функции – Danish Prognostic Symptom Score (DAN-PSS), что указывает на нарушение эректильной и эякуляторной функции [48,49]. Эти данные нашли свое подтверждение в крупномасштабном плацебо контролируемом исследовании MTOPS [45].
Несмотря на то, что уже из этих исследований является очевидным, что лечение ингибиторами 5α-редуктазы ассоциируется с большим числом сексуальных побочных эффектов в сравнении с α-блокаторами, является важным подчеркнуть, что общая частота этих побочных эффектов является низкой по сравнению с другими видами медикаментозного лечения различных больных с различными заболеваниями, которые более существенно дополняют ту популяцию мужчин, которая имеет ПР.
В фазе 3а исследования дутастерида около 30% мужчин, участвующих в исследовании отмечали снижение либидо в течение последних 3 месяцев до начала исследования. И только 4% из этой группы пациентов отметили снижение либидо, которое было связано с приемом лекарства на протяжении 24 месячного курса терапии. Эти данные были в дальнейшем положены в основу специального исследования о влиянии лечения ДГПЖ на половую функцию. Результаты данного исследования показали, что показатели улучшения и ухудшения сексуальной функции (эректильная функция и либидо) только при наблюдении и при применении α-блокаторов и финастерида были в целом одинаковы [50].
Заключение.
ПР и СНМП являются довольно распространенными у пожилых мужчин. Понятно, что взаимоотношения между этими двумя группами патологических состояний являются более, чем эпидемиологически связанными; ПР напрямую связаны с выраженностью СНМП. В настоящее время предложено много гипотез, которые объясняют патофизиологические факторы взаимосвязи ПД и СНМП, но до настоящего времени остается неясным, какие из них имеют решающее значение. Действительно, имеются некоторые виды лекарственной терапии, которые могут влиять на сочетающиеся ПР и СНМП, но они так же нуждаются в серьезных клинических исследованиях.
Однако уже сегодня становится важным, что для предложения пациентам рекомендаций в выборе средств для лечения СНМП, врачи должны хорошо знать о возможном влиянии различных видов лечения на СНМП, а так же на сексуальную функцию. Информация о том, что развитие сексуальных расстройств является неотъемлемой частью всех проблем у больных с СНМП, должна в доступной форме доводиться до пациента. Это может помочь не только выявить некоторые заболевания (например, сахарный диабет) связанные с эректильной дисфункцией, но и помочь некоторым мужчинам с или без ЭД выбрать необходимое лечение СНМП/ДГПЖ.
Литература.
[1] Panser LA, Rhodes T, Girman CJ, et al. Sexual function of men ages 40 to 79 years: the
Olmsted County Study of Urinary Symptoms and Health Status Among Men. J Am Geriatr Soc 1995;43:1107-11.
[2] Derogatis LR. The Derogatis Interview for Sexual Functioning (DISF/DISF-SR): an introductory report. J Sex Marital Ther 1997;23:291-304
[3] Clayton AH, McGarvey EL, Clavet GJ. The Changes in Sexual Functioning Questionnair (CSFQ): development, reliability, and validity. Psychopharmacol Bull 1997;33:73115.
[4] Clayton AH, McGarvey EL, Clavet GJ, Piazza L. Comparison of sexual functioning in clinical and nonclinical populations using the Changes in Sexual Functioning Questionnaire (CSFQ). Psychopharmacol Bull 1997;33:747-53.
[5] Keller A, McGarvey EL, Clayton AH. Reliability and construct validity of the Changes in Sexual Functioning Questionnaire Short-Form (CSFQ-14). J Sex Marital Ther 2006; 32:43- 52.
[6] Braun M, Wassmer G, Klotz T, et al. Epidemiology of erectile dysfunction: results of the 'Cologne Male Survey'. IntJ Impot Res 2000;12:305-11.
[7] Feldman HA, Goldstein I, Hatzichristou DG, Krane RJ, McKinlay JB. . Impotence and its medical and psychosocial correlates: results of the Massachusetts Male Aging Study.
[8] Laumann EO, Paik A, Rosen RC. Sexual dysfunction in the United States:
prevalence and predictors. JAMA 1999;281:537t4.
. [9] Roberts RO, Rhodes T, Panser LA, et al. Natural history of prostatism: worry and embarrassment from urinary symptoms and health care-seeking behavior.
Urology 1994;43:621-8.
[10] Chute CG, Panser LA, Girman CJ, et al. The prevalence of prostatism: a population-based survey of urinary symptoms. J Urol 1993;150:85-9.
[11] Sarma AV, Jacobson DJ, McGree ME, et al. A population based study of incidence and treatment of benign prostatic hyperplasia among residents of Olmsted County, Minnesota: 1987 to 1997. J Urol 2005;173:2048-53.
[12] Arrighi HM, Metter EJ, Guess HA, Fozzard JL. Natural history of benign prostatic hyperplasia and risk of prostatectomy. The Baltimore Longitudinal Study of Aging. Urology 1991;38(Suppl l):4-8.
[13] Macfarlane GJ, Botto H, Sagnier PP, et al. The relationship between sexual life and urinary condition in the French community. J Clin Epidemiol 1996;49:1171-6.
[14] Abrams P, Donovan JL, de la Rosette JJ, Schafer W. International Continence Society "Benign Prostatic Hyperplasia" Study: background, aims, and methodology. Neurourol Urodyn 1997;16:79-91.
[15] Frankel SJ, Donovan JL, Peters TI, et al. Sexual dysfunction in men with lower urinary tract symptoms. J Clin Epidemiol 1998;51:677-85.
[16] Marberger M, Gomella L, Montorsi F, Rittmaster R, Tam-mela T. Sexual function and its correlation with serum testosterone and lower urinary tract symptom severity— baseline data from the REDUCE trial. Abstract presented at the International Consultation on Prostatic Diseases, Paris, France, 24-27 June 2005.
[17] Vallancien G, Emberton M, Harving N, van Moorselaar RJ. Sexual dysfunction in 1,274 European men suffering from lower urinary tract symptoms. J Urol 2003;169:2257-61.
[18] Hoesl CE, Woll EM, Burkart M, Altwein JE. Erectile dysfunction (ED) is prevalent, bothersome and underdiagnosed in patients consulting urologists for benign prostatic syndrome (BPS). Eur Urol 2005;47:511-7.
[19] Blanker MH, Bohnen AM, Groeneveld FP, et al. Correlates for erectile and ejaculatory dysfunction in older Dutch men: a community-based study. J Am Geriatr Soc 2001; 49:436-42.
[20] Ponholzer A, Temml C, Mock K, et al. Prevalence and risk factors for erectile dysfunction in 2869 men using a validated questionnaire. Eur Urol 2005;47:80-6.
[21] Rosen R, Altwein J, Boyle P, et al. Lower urinary tract symptoms and male sexual dysfunction: the Multinational Survey of the Aging Male (MSAM-7). Eur Urol 2003;44:637-49.
[22] McVary KT, Foster H, KusekJ, Ramsdell J, Bautista O. Self-reported sexual function in men with symptoms of BPH— a MTOPS study report. Int J Impot Res 2002;14:ACP1.32.
[23] Girman CJ, Jacobsen SJ, Rhodes T, et al. Association of health-related quality of life and benign prostatic enlargement. Eur Urol 1999;35:277-84.
[24] Paick SH, Meehan A, Lee M, Penson DF, Wessells H. The relationship among lower urinary tract symptoms, prostate specific antigen and erectile dysfunction in men with benign prostatic hyperplasia; results from the Proscar long-term efficacy and safety study. J Urol 2005; 173:903-7.
[25] McVary KT. Erectile dysfunction and lower urinary tract symptoms secondary to BPH. Eur Urol 2005;47:838-45.
[26] Bloch W, Klotz T, Loch C, et al. Distribution of nitric oxide synthase implies a regulation of circulation, smooth muscle tone, and secretory function in the human prostate by nitric oxide. Prostate 1997;33:1-8.
[27] Luo J, Dunn T, Ewing C, et al. Gene expression signature of benign prostatic hyperplasia revealed by cDNA microar-ray analysis. Prostate 2002;51:189-200.
[28] Crone JK, Burnett AL, Chamness SL, StrandbergJD, Chang TS. Neuronal nitric oxide synthase in the canine prostate: aging, sex steroid, and pathology correlations. J Androl 1998;19:358-64.
[29] Sairam K, Kulinskaya E, McNicholas ТА, Boustead GB, Hanbury DC. Sildenafil influences lower urinary tract symptoms. BJU Int 2002;90:836-9.
[30] Andersson KE, Chappie CR, Hofner K. Future drugs for the treatment of benign prostatic hyperplasia. World J Urol 2002;19:436-42.
[31] McVary KT, Razzaq A, Lee C, et al. Growth of the rat prostate gland is facilitated by the autonomic nervous system. Biol Reprod 1994;51:99-107.
[32] Golomb E, Rosenzweig N, Eilam R, Abramovici A. Spontaneous hyperplasia of the ventral lobe of the prostate in aging genetically hypertensive rats. J Androl 2000;21: 58-64.
[33] McVary KT, Rademaker A, Lloyd GL, Gann P. Autonomic nervous system overactivity in men with lower urinary tract symptoms secondary to benign prostatic hyperplasia. J Urol 2005;174:1327-433.
[34] Tarcan T, Azadzoi KM, Siroky MB, Goldstein I, Krane RJ. Age-related erectile and voiding dysfunction: the role of arterial insufficiency. Br J Urol 1998;82:26-33.
[35] Brading A, Pessina F, Esposito L, Symes S. Effects of metabolic stress and ischaemia on the bladder, and the relationship with bladder overactivity. Scand J Urol Nephrol Suppl 2004;(215):84-92.
[36] Galvin DJ, Watson RW, O'Neill A, et al. Hypoxia inhibits human bladder smooth muscle cell proliferation: a poten¬tial mechanism of bladder dysfunction. Neurourol Uro¬dyn 2004;23:342-8.
[37] Gacci M, Bartoletti R, Figlioli S, et al. Urinary symptoms, quality of life and sexual function in patients with benign prostatic hypertrophy before and after prostatectomy: a prospective study. BJU Int 2003;91:196-200.
[38] Brookes ST, Donovan JL, Peters TJ, Abrams P, Neal DE. Sexual dysfunction in men after treatment for lower urinary tract symptoms: evidence from randomised con¬trolled trial. BMJ 2002;324:1059-61.
[39] Lepor H. Long-term evaluation of tamsulosin in benign prostatic hyperplasia: placebo-controlled, double-blind extension of phase III trial. Tamsulosin Investigator Group. Urology 1998;51:901-6.
[40] Schulman CC, Cortvriend J, Jonas U, et al. Tamsulosin: 3-year long-term efficacy and safety in patients with lower urinary tract symptoms suggestive of benign pros¬tatic obstruction: analysis of a European, multinational, multicenter, open-label study. Eur Urol 1999;36:609-20.
[41] Lepor H. Phase III multicenter placebo-controlled study of tamsulosin in benign prostatic hyperplasia. Urology 1998;51:892-900.
[42] Chappie CR, Wyndaele JJ, Nordling J, et al. Tamsulosin, the first prostate-selective alphalA-adrenoceptor antagonist: a meta-analysis of two randomised, pla¬cebo-controlled, mulitcentre studies in patients with benign prostatic obstruction (symptomatic BPH). Eur Urol 1996;29:155-67.
[43] van Moorselaar RJ, Hartung R, Emberton M, et al, Alfuzo-sin 10 mg once daily improves sexual function in men with lower urinary tract symptoms and concomitant sexual dysfunction. BJU Int 2005;95:603-8.
[44] McConnell JD, Bruskewitz R, Walsh PC, et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. N Engl J Med 1998;338:557-63.
[45] McConnell JD, Roehrbom CG, Bautista OM, et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Engl J Med 2003;349:2387-98.
[46] Roehrbom CG, Boyle P, Nickel JC, Hoefner K, Andriole G. Efficacy and safety of a dual inhibitor of 5-alpha-reduc-tase types 1 and 2 (dutasteride) in men with benign pros¬tatic hyperplasia. Urology 2002;60:434-41.
[47] Debruyne F, Barkin J, van Erps P, et al. Efficacy and safety of long-term treatment with the dual 5«-reductase inhi¬bitor dutasteride in men with symptomatic benign pros¬tatic hyperplasia. Eur Urol 2004;46:488-95.
[48] Debruyne FM, Jardin A, Colloi D, et al. Sustained-release alfuzosin, finasteride and the combination of both in the treatment of benign prostatic hyperplasia. European ALFIN Study Group. Eur Urol 1998;34: 169-75.
[49] Jardin A, Debruyne F, McCarthy C. Sexual function in men with BPH treated either with an alpha adrenergic blocker alfuzosin or the 5-alpha reductase inhibitor finasteride or the combination. J Urol 1998;159:331A.
[50] Leliefeld HH, Stoevelaar HJ, McDonnell J. Sexual function before and after various treatments for symptomatic benign prostatic hyperplasia. BJU Int 2002;89:208-13.
[51] Steven A.Kaplan, Ricardo R.Gonzalez, Alexis E.Te. Combination of Alfuzozin and Sildenafil is Superior to Monotherapy in Treating Lower Urinary Tract Symptoms andErectile Dysfunction. Eur.Urology 2007: 51; 1717-1723
Опубликовано в журнале "Здравоохранение", 2009г., №6, стр.68-71
