Биоактивных наноматериалов при раневом процессе
| Вид материала | Автореферат |
- Контроля и управления термобарическими условиями в авд для синтеза и спекания наноматериалов, 16.43kb.
- " Хронический остеомиелиет", 78.81kb.
- Утверждаю, 66.07kb.
- Анализ потребности отрасли наноматериалов в программа, 84.33kb.
- Материаловедение наноматериалов и наносистем, 44.24kb.
- Конкурс научно-исследовательских работ студентов вузов в области нанотехнологий и наноматериалов, 791.11kb.
- Цель конференции Конференция призвана с привлечением и при активном участии молодых, 89.39kb.
- Программа развития в Российской Федерации работ в области нанотехнологий и наноматериалов, 259.55kb.
- Программа координации работ в области нанотехнологий и наноматериалов в Российской, 155.3kb.
- Цель конференции Конференция призвана обеспечить квалифицированное обсуждение и координацию, 81.19kb.
Методы статистической обработки данных. Все количественные результаты исследований были подвергнуты статистической обработке (В.И. Юнкеров, 2002). Статистическую значимость различий в сравниваемых выборках оценивали при помощи t-критерия Стьюдента, статистически достоверными считали различия при р≤0,05 (Автадинов Г.Г., 1990).
Накопление базы данных и её информационно-аналитическую переработку, вычислительные операции и графическое изображение результатов исследований осуществляли на компьютере с использованием электронных таблиц Microsoft Excel 2010 для Windows 7.
Результаты проведённых исследований
При местном лечении ран необходимо решить следующие задачи: подавление инфекции в ране (антисептики), нормализация местного гомеостаза (антиоксидантные и антиферментные препараты, поддержание нейтрального pH), активация отторжения некротических тканей (некролитические препараты), сорбция продуктов микробного и тканевого распада (дренирующие сорбенты). Комбинация средств подобной направленности и применение их в комплексе с использованием новых наноструктурных материалов и лекарственных препаратов, по нашему мнению, может способствовать синергетическому эффекту, потенцированию лечебного воздействия и, как следствие, оптимизации раневого процесса, предупреждению его возможных осложнений и сокращению сроков заживления ран.
- Разработка абсорбирующих матриц для наноструктурных биоактивных раневых покрытий
При разработке раневых покрытий важной задачей является возможность абсорбции ими биоактивных компонентов. По опубликованным данным и нашим наблюдениям, наиболее эффективными вульнеросорбентами являются гидрогелевые и гидроколлоидные материалы.
При разработке гидрогелевого абсорбента на основе акриловой кислоты и акриламида со сшивающим агентом персульфатом аммония был получен супервлагоабсорбент. Для нейтрализации местного тканевого ацидоза в гидрогелевый абсорбент вводили раствор бикарбоната натрия, позволяющего поддерживать показатель рН в пределах 7,0–7,5.
Сорбционная способность гидрогелевого акриламидного абсорбента была исследована в различных средах, одновременно проведена сравнительная её оценка со сходным по химической структуре гидрогелем «Апполо» и дренирующим сорбентом «Диовином». Разработанный гидрогелевый абсорбент отличается эластичностью в связи с его фиксацией на тканевой основе и влагосодержанием 75%. Установлено, что гидрогелевый акриламидный абсорбент обладает более высокой сорбционной активностью в биологических средах по сравнению с гидрогелем «Апполо» и «Диовином», что может позволить в течение длительного времени осуществлять сорбцию раневого отделяемого, предупредить его застой в полости раны и возможное последующее нагноение.
При применении акриламидного абсорбента в эксперименте на модели кожно-плоскостных условно асептических ран на спине крыс клинически воспалительно-дегенеративных явлений в ране в послеоперационном периоде не отмечено. Исследуемый сорбент активно впитывал раневое отделяемое. По данным гистоморфологических исследований, на 7-е сутки выявлена классическая картина неосложнённого регенеративного процесса, что позволило сделать вывод о биосовместимости и биоинертности гидрогелевого акриламидного абсорбента.
Для установления времени насыщения НГП ЦАХ лекарственными препаратами и оценки сорбционной способности, кинетика сорбции отжатых гель-плёнок была определна во времени по массе в различных средах: растворах лекарственных препаратов – 1% раствор мочевины, 1% раствор диоксидина, 2,5% раствор аргентарабиногалактана; биологических средах – плевральный экссудат, желчь, свежезаготовленная донорская кровь, раствор аминокислот («Аминоплазмаль Е»); других средах – дистиллированная вода, физиологический раствор. Анализ полученных результатов позволил установить, что для достижения максимальной концентрации сорбированного НГП лекарственного препарата экспозиция дегидратированной гель-плёнки должна составлять 24 часа, т.к. в течение этого времени плёнка, сорбирующая воду, имеет массу 2,50±0,11 г, которая далее практически не меняется, а масса лекарственных препаратов через 24 часа составляет 2,25±0,22 г. При этом основное количество препаратов сорбируется в первые 120 минут. Таким образом, наиболее оптимальным временем для насыщения НГП бактериальной целлюлозы лекарственным препаратом составляет 120 минут. Оставшаяся сорбционная ёмкость при аппликации НГП на раны будет обеспечивать сорбцию раневого отделяемого. Установлено, что масса биологических сред через 24 часа от начала сорбции составила 2,24±0,26 г и далее оставалась на этом уровне. Таким образом, патологическое отделяемое из раны может максимально сорбироваться НГП ЦАХ на протяжении суток, что определяет сроки перевязок. При применении НГП ЦАХ в эксперименте на модели кожно-плоскостных условно асептических ран на спине крыс клинически и морфологически выявлена картина, аналогичная таковой при применении акрил-амидного гидрогеля, что позволило сделать вывод о биосовместимости и биоинертности плёнок бактериальной целлюлозы.
Сравнительная оценка сорбционной способности акриламидного гидрогелевого абсорбента, на основе акриловой кислоты и акриламида со сшивающим агентом персульфатом аммония и дегидратированной НГП ЦАХ проведена в различных биологических средах (таблица 2).
Таблица 2
Сравнительная оценка сорбционной способности акриламидного абсорбента и дегидратированной НГП ЦАХ (г/; X±σ)
| Абсорбируемые вещества | Вид сорбента | |
| Акриламидный гидрогелевый абсорбент | Дегидратированная НГП ЦАХ | |
| Дистиллированная вода | 319,8±4,04 | 76,50±2,18 |
| Физиологический раствор | 89,4±2,92 | 56,8±2,59 |
| Раствор аминокислот | 39,7±3,27 | 69,6±3,51 г/г |
| Плевральный экссудат | 40,5±2,74 | 68,0±2,2 г/г |
Установлено, что гидрогелевый акриламидный абсорбент обладает меньшей сорбционной способностью в сравнении с дегидратированной ЦАХ. Это преимущество является относительным, т.к. на ранах нецелесообразно применять сухие плёнки ЦАХ, не содержащие лекарственных препаратов. В связи с этим нами проведена сравнительная оценка гидрогелевого акриламидного абсорбента и НГП ЦАХ, содержащей дистиллированную воду после 120 минут экспозиции, что может соответствовать содержанию в ней лекарственных препаратов.
Анализ результатов выполненной работы позволил установить, что в качестве несущей сорбирующей матрицы для биоактивных раневых покрытий на обильно экссудатирующих ранах целесообразно применять гидрогелевый акриламидный абсорбент. На ранах с умеренно выраженной незначительной экссудацией можно рекомендовать раневое покрытие на основе НГП ЦАХ, учитывая возможность более легкой абсорбцией на ней необходимых лекарственных препаратов и их последующей десорбции в рану.
2. Биоактивные свойства кластера фуллерена.
Антиоксидантная активность. Наиболее изученными в отношении антиоксидантных свойств являются химически модифицированные производные фуллерена и его коллоидные растворы, например, кластер фуллерена С60/ПВП (Тюнин М.А., 2009). В то же время, использование ПВП в лекарственных композициях нежелательно (Kuo T.T., 1997). В связи с этим для установления возможности местного применения при раневом процессе нами исследована антиоксидантная активность кластера фуллерен С60/Tween 80.
С целью определения антирадикальной активности были исследованы водные растворы кластера фуллерен С60/Tween 80 с 0,01%, 0,02%, 0,03%, 0,04% и 0,05% концентрацией фуллерена С60 в сравнении с аналогичными концентрациями кластера фуллерен С60/ПВП. В ходе эксперимента (по показателю оптической плотности оценивали уровень радикалов) было установлено, что оба кластера фуллерена С60 обладают антиоксидантной активностью, возрастающей пропорционально увеличению их концентрации в растворе (таблица 3). При этом было показано, что антирадикальная активность значительно выше у кластера фуллерена С60/Tween 80 в сравнении с С60/ПВП и контролем.
Следующим этапом исследования антиоксидантных свойств кластера фуллерен С60/Tween 80 стало изучение его влияния на супероксидпродуцирующую активность тканевых макрофагов. Нами исследовано влияние водных растворов кластера фуллерен С60/Tween 80 с содержанием С60 в концентрации 0,02%, 0,05%, 0,1%. Результаты представлены в таблице 4.
Таблица 3
Антирадикальная активность кластеров фуллерена С60 с Tween 80 и ПВП
| Фуллереновый кластер | Антирадикальная активность (X±σ), выраженная в оптической плотности растворов в зависимости от молярной концентрации антиоксиданта | Контроль (вода) | ||||
| 0,01% | 0,02% | 0,03% | 0,04% | 0,05% | 0,550 0,05 | |
| С60/Tween 80 | 0,416 0,013* | 0,343 0,017* | 0,189 0,031** | 0,074 0,016** | 0,043 0,005** | |
| С60/ПВП | 0,493 0,038 | 0,467 0,016* | 0,396 0,019* | 0,192 0,030** | 0,107 0,012** | |
Примечание: * – различия с показателем соответствующего раствора достоверны при р≤0,05 по сравнению с контролем; ** – различия с показателем соответствующего раствора достоверны при р≤0,005 по сравнению с контролем.
Таблица 4
Влияние кластера фуллерена С60/Tween 80 на спонтанную хемилюминесценцию (ХЛсп) перитонеальных макрофагов (X±σ)
| Концентрация растворов С60/Tween 80 | ХЛсп перитонеальных макрофагов S (% от контроля) | ХЛсп альвеолярных макрофагов S (% от контроля) |
| 0,1% | 26,44±1,92* | 58,36±4,34* |
| 0,05% | 29,11±2,27* | 62,48±3,71* |
| 0,02% | 88,50±6,45 | 65,30±3,50 |
Примечание: * – различия с показателем соответствующего раствора достоверны при р≤0,05 по сравнению с контролем.
Как видно из таблицы, показатели спонтанной хемилюминесценции в присутствии кластера фуллерен С60/Tween 80 были ниже, по сравнению с контролем, что свидетельствует об уменьшении уровня супероксида в среде макрофагов.
Таким образом, изучение антирадикальной активности с использованием ДФПГ и влияния на супероксидпродуцирующую активность тканевых макрофагов кластера фуллерен С60/Tween 80 показало, что кластер фуллерен С60/Tween 80 проявляет антиоксидантную активность. Антирадикальная активность растворов фуллерена С60/Tween 80 с содержанием фуллерена С60 0,01–0,05% возрастает пропорционально увеличению его концентрации. В результате исследования влияния кластера фуллерен С60/Tween 80 на супероксидпродуцирующую активность тканевых макрофагов установлено, что он обладает антирадикальной активностью, снижая уровень продукции супероксида макрофагами. При этом выраженность супероксиддисмутирующего действия препарата имеет дозозависимый характер и в наибольшей мере проявляется при использовании 0,1% и 0,05% растворов кластера фуллерена С60/Tween 80.
Иммунологические сдвиги в организме здоровых животных и животных с глубокими ожогами при парентеральном введении кластера фуллерен С60/Tween 80. В опубликованных работах описаны иммунологические свойства фуллерена C60, проявляющего некоторую иммунотропную активность. Однако, экспериментальных данных, подтверждающих это свойство, в литературе не найдено. Данные обстоятельство определило необходимость изучения иммунологических показателей при моделировании обширных глубоких ожогов после внутрибрюшинного введения кластера фуллерен С60/Tween 80. В эксперименте на животных нами были определены нормальные показатели иммунитета (условная норма): реакция торможения миграции лейкоцитов (РТМЛ) с митогенами – клеточное звено иммунитета, показатели фагоцитоза (фагоцитарный показатель – ФП, фагоцитарное число – ФЧ, показатель завершенности фагоцитоза – ПЗФ), лизосомально-катионный тест (ЛКТ), тест восстановления нитросинего тетразолия (НСТ-тест), – отражающие состояние неспецифической защиты организма. При моделировании глубоких обширных термических ожогов на спине крыс определяли аналогичные показатели на третьи и восьмые сутки.
Установлено, что ожог у крыс сопровождался достоверными изменениями в показателях иммунной системы животных (таблица 5). При этом отмечены признаки развития вторичного иммунодефицита, заключающиеся в снижении фагоцитарной активности нейтрофилов, снижении функциональной активности Т-лимфоцитов, повышении активности кислороднезависимых микробицидных систем фагоцитов, что характерно для термических ожогов.
Иммунотропное действие кластера фуллерен С60/Tween 80 исследовали на третьи сутки после обширного термического ожога у животных, которым сразу после моделирования внутрибрюшинно вводили 0,5 мл 0,05% раствора кластера фуллерена). Контролем служили крысы с термическим ожогом, получавшие эквивалентный объём физиологического раствора. Результаты представлены в таблице 5.
Таблица 5
Влияние кластера фуллерен С60/Tween 80 на иммунологические показатели у крыс при моделировании обширного глубокого термического ожога (X±σ)
| Показатель | Группа животных | ||
| Условная норма | Термический ожог (контроль) | Термический ожог при введении С60/Tween 80 | |
| РТМЛ с КонА, % | 76,80±15,80 | 106,67±10,21 | 85,00±10,86* |
| РТМЛ с ФГА, % | 74,60±12,62 | 95,75±13,24 | 82,0±7,58* |
| ФП, % | 80,80±8,07 | 42,50±6,45 | 62,20±3,42* |
| ФЧ | 9,67±3,15 | 13,63±3,87 | 10,60±2,37 |
| ПЗФ, % | 26,20±3,49 | 31,45±1,73 | 31,52±6,43 |
| ЛКТ, усл.ед. | 0,156±0,05 | 0,265±0,03 | 0,20±0,04* |
| НСТ спонтанный, усл.ед. | 0,85±0,09 | 0,66±0,06 | 0,69±0,04 |
| НСТ стимулированный, усл.ед. | 1,49±0,3 | 1,49±0,01 | 1,46±0,02 |
Примечание: * – различия достоверны при р≤0,05 по сравнению с контролем.
Установлено, что парентеральное однократное введение в ранний срок при термическом ожоге у крыс кластера фуллерен С60/Tween 80 оказывает выраженное иммунотропное действие, вследствие чего изученные иммунологические показатели приближались к значениям, характерным для интактных животных. Результаты проведённых исследований являются дополнительным основанием целесообразности применения фуллеренов при раневом процессе в составе комплексной патофизиологически обоснованной терапии.
Морфофункциональные изменения во внутренних органах при внутрибрюшинном введении кластера фуллерен С60/Tween 80. Исследование общерезорбтивных (общетоксических) свойств различных водорастворимых форм фуллерена С60 является важной задачей в изучении их влияния на биологические системы.
Общерезорбтивные свойства кластера фуллерен С60/Tween 80 были определены с помощью гистоморфологического исследования тканей после внутрибрюшинного введения его 0,25 и 0,5 мл 10% раствора, что соответствовало 0,05% содержанию фуллерена С60 в сравнении с 10% раствором Tween 80. Животные были разделены на 4 группы: внутрибрюшинное введение 0,25 и 0,5 мл 10% раствора кластера фуллерен С60/Tween 80 (опыт), а также 0,25 и 0,5 мл 10% раствора Tween 80 (контроль).
При вскрытии большинства животных опытных и контрольных групп на 4-е и 9-е сутки отличий в макроскопической картине внутренних органов не обнаружено. Относительная масса органов во всех группах достоверных различий не имела.
Внутрибрюшинное введение 10% растворов кластера фуллерен С60/Tween 80 и Tween 80 вызывало схожие изменения в тканях внутренних органов, которые характеризовались формированием незначительных дистрофических явлений, редкими и незначительными нарушениями микроциркуляции. От дозы и от сроков изменения не зависят. Менее выраженные изменения во всех исследованных органах при введении кластера фуллерен С60/Tween 80, вероятно, связаны с антиоксидантной и иммунотропной активностью фуллерена С60.
Таким образом, установлено, что фуллерен С60 в комплексе с Tween 80 проявляет выраженные антиоксидантные и иммунотропные свойства, не оказывая при этом повреждающего воздействия на ткани внутренних органов. Применение кластера фуллерена С60/Tween 80 при раневом процессе должно способствовать стабилизации собственной системы антиоксидантной защиты и тормозить развитие свободнорадикального перекисного окисления липидов, клеточных и капиллярных мембран, предотвращая повреждение клеток и тканей, ограничивая распространение воспалительных изменений и вторичного некроза тканей, усиливая фагоцитарную активность макрофагов и повышение неспецифического иммунитета.
- Сравнительная характеристика антимикробной активности наночастиц металлов, традиционных и новых антисептиков.
Следующим этапом исследований был выбор антисептичесого препарата для абсорбции на раневых покрытиях. В литературе последних лет наблюдается увеличение числа публикаций, посвященных наноматериалам, где, в частности, особое внимание уделяется наноразмерным частицам металлов и неметаллов в силу их биоактивных свойств.
На первом этапе исследования была изучена антимикробная активность наночастиц металлов и новых препаратов в лабораторных условиях на референтных штаммах (S. aureus, E. coli, P. aeruginosa): неорганно-органические нанобиокомпозиты, содержащие металлы – серебро, золото, платину и железо, стабилизированные природным водорастворимым полимером арабиногалактаном; нанокластеры серебра, цинка и меди, стабилизация которых была осуществлена путём адсорбции наночастицами положительно заряженных ионов металлов; комплексы ПВП-нано-Ag0 (повиаргол) и ПВП-нано-Se0 (селенопол), представляющие собой наночастицы нуль-валентного серебра и селена, стабилизированные ПВП; комплекс фуллерен C60/ПВП и водная дисперсия шунгитового углерода. Для сравнения антисептической активности были использованы известные антисептики с широким спектром анти-микробного действия – диоксидин и катапол.
Установлено, что в отношении всех использованных штаммов микроорганизмов наиболее эффективными оказались растворы: 0,5–3% диоксидина, 2,5% катапола, 2,5% серебра, стабилизированного арабиногалактаном и 0,15% коллоидный раствор серебра. Высокоэффективными по отношению к штаммам E. coli ATCC 25922 и S. aureus ATCC 29212 оказались также 0,5% растворы селенопола, 2,5% повиаргола и 2,15% коллоидный раствор Zn0. Отсутствие антимикробной активности выявлено у исследуемых растворов: железа, золота, платины, стабилизированных арабиногалактаном, а также у кластера фуллерен C60/ПВП и водной дисперсии шунгитового углерода, что исключает их применение в качестве антисептического компонента для раневых покрытий.
На втором этапе исследования определяли чувствительность микроорганизмов к двум модифицированным формам катапола (МК-А), разработанного при нашем участии в ИВС РАН, с определением их оптимальной антимикробной концентрации на госпитальных штаммах, составившей 1,5%.
На третьем этапе была установлена оптимальная антимикробная концентрация серебра, стабилизированного природным полисахаридом арабиногалактаном, составившая 2,5%;
С целью окончательного выбора наиболее эффективных препаратов и выявления возможной антибиотикорезистентности на 4-м этапе нами исследованы растворы, проявившие максимальную антимикробную активность в предыдущих исследованиях (растворы диоксидина, катапола, серебра, стабилизированного арабиногалактаном, и модифицированный катапол). Установлено, что в отношении всех исследованных госпитальных штаммов, а также ассоциации этих микроорганизмов наиболее эффективными оказались образцы, содержащие растворы модифицированного катапола и диоксидина, обладающие мощным антибактериальным действием (рисунок 1). Серебро, стабилизированное арабиногалактаном, оказалось малоэффективным по отношению к K. pneumonia и к синегнойной палочке. Тем не менее, считаем возможным его включение в состав раневых покрытий, т.к. оно обладает не только антимикробным действием, но и другими биологически активными свойствами.
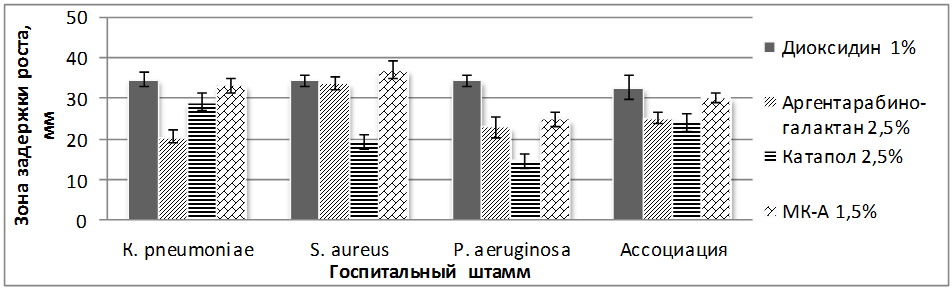 Рисунок 1 – Антимикробное действие антисептиков, сорбированных нано-гель-плёнкой целлюлозы Acetobacter xylinum, на госпитальные штаммы микроорганизмов по зонам задержки роста, мм
Рисунок 1 – Антимикробное действие антисептиков, сорбированных нано-гель-плёнкой целлюлозы Acetobacter xylinum, на госпитальные штаммы микроорганизмов по зонам задержки роста, ммНа 5-м этапе эффективность применения новых антисептиков была исследована при раневом процессе в эксперименте на гнойных ранах. Установлено, что под их действием микробная обсеменённость уже в первые сутки снижается ниже критического уровня. При этом отмечено более раннее очищение, уменьшение воспалительных явлений в ране и окружающих её тканях, ускорение краевой эпителизации, подтверждающие оптимизацию раневого процесса.
4. Патогенетическое обоснование комплекса лекарственных препаратов для иммобилизации его на раневых покрытиях.
На основе проведённых исследований для воздействия на основные звенья патогенеза раневого процесса нами с патофизиологичесих позиций обоснован комплекс лекарственных препаратов, который должна содержать матрица-носитель современного раневого покрытия: 1) антиоксидантный компонент – кластер фуллерена С60/Tween-80 с 0,1% содержанием С60 2) антимикробный компонент – один из эффективных антисептиков, подавляющих как первичную «уличную», так и госпитальную микрофлору; 3) гемостатический и антиферментный препарат; 4) некролитический препарат.
Иммобилизация такого комплекса лекарственных препаратов должна способствовать предупреждению осложнений и сокращению сроков заживления ран.
5. Разработка и применение в эксперименте биоактивных раневых покрытий на основе наноматериалов
Для лечения ран различной этиологии разработано два наноструктурных раневых покрытия. Первое – трехслойное гидрогелевое биоактивное фуллерен-содержащее. В качестве верхнего слоя использовали абсорбент – акрил-амидный гидрогель с нейтральным рН и абсорбционной ёмкостью в биологических жидкостях ~ 40 г/г, нанесённый на пористую хлопчатобумажную основу (средний слой), выполняющую каркасную функцию, и нижний, прилежащий к ране – желатиновый слой, включающий комплекс биоактивных ингредиентов разнонаправленного действия (рисунок 2).
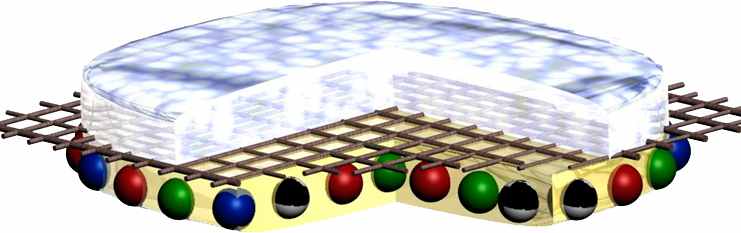

А Б
Рисунок 2 – Общая схема (А) и внешний вид (Б) гидрогелевого трёхслойного раневого покрытия
Второе раневое покрытие разработано на основе НГП ЦАХ (рисунок 3).

Рисунок 3 – Общий вид наноструктурного раневого покрытия на основе нано-гель-плёнки целлюлозы Acetobacter xylinum
Эффективность разработанных раневых покрытий на основе наноматериалов была исследована при местном лечении гранулирующих ран после глубоких ожогов в эксперименте на 80 крысах.
Планиметрическое исследование показало, что под влиянием трехслойного гидрогелевого раневого покрытия в опытной группе срок полного заживления ран составил 16 суток, в контрольной группе 20 суток. Под влиянием биоактивного раневого покрытия на основе бактериальной целлюлозы срок полного заживления ран составил 17 суток, в контрольной серии 20 суток (рисунок 4).
Подводя общий итог исследования эффективности разработанных наноструктурных раневых покрытий, необходимо отметить, что данные средства местного лечения ран, обладающие сорбционной, антибактериальной, антиферментной, иммунотропной и антиоксидантной активностью, способны оказывать комплексное воздействие на раневой процесс, неосложнённое течение которого во многом определяет оптимизацию его дальнейшего хода.
По результатам исследования можно рекомендовать на ранах с обильной экссудацией трёхслойное гидрогелевое раневое покрытие, в то время как на ранах с незначительной продукцией раневого отделяемого наиболее эффективно биоактивное покрытие на основе бактериальной целлюлозы. Раневое покрытие на основе нано-гель-плёнок целлюлозы Acetobacter xylinum также возможно насыщать заранее различными заготовленными ингредиентами с лечебным эффектом (экспозиция – 120 минут) для достижения наиболее оптимального воздействия при различных видах раневого процесса.
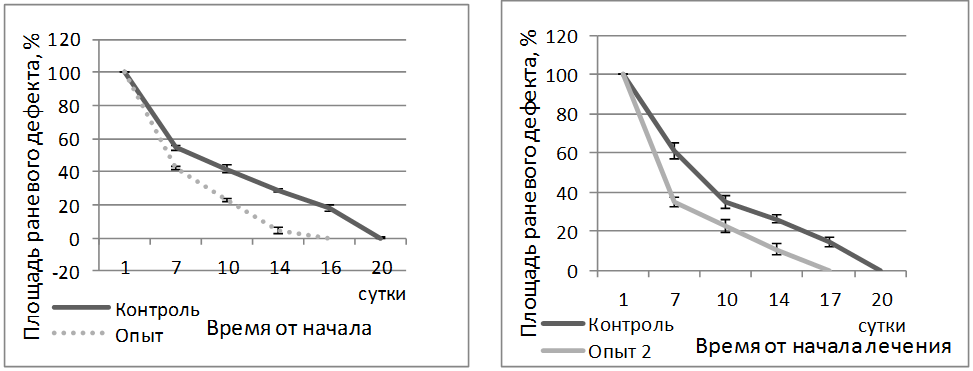
А Б
Рисунок 4 – Динамика уменьшения площади раневого дефекта глубоких ожогов на фоне применения гидрогелевого трёхслойного раневого покрытия (А) и на фоне применения биоактивного раневого покрытия на основе бактериальной целлюлозы (Б)
Экспериментальные исследования эффективности наноструктурных биоактивных раневых покрытий показали, что их применение при местном лечении гранулирующих ран после глубоких ожогов предупреждает осложнённое течение раневого процесса и сокращает сроки заживления ран, в среднем, на 17,5% (рисунок 5).
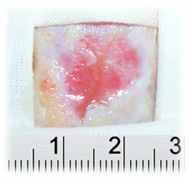
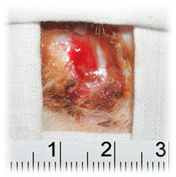
А Б
Рисунок 5 – Общий вид гранулирующих ран на 12 сутки с применением раневого покрытия на основе бактериальной целлюлозы (А) и покрытием не содержащего комплекс лекарственных препаратов (Б)
