|
< Предыдущая |
Оглавление |
Следующая > |
|---|
Массоперенос при адсорбции примесей
Поглотительная способность адсорбентов выражается концентрацией адсорбата в массовой или объемной единице адсорбента. Процесс адсорбции сопровождается выделением теплоты, поэтому снижение температуры способствует его проведению.
Равновесие при адсорбции. Независимо от природы адсорбционных сил на величину адсорбции и равновесие процесса влияют следующие факторы: природа поглощаемого вещества; температура; давление; примеси в фазе, из которой поглощается вещество.
Природа поглощаемого вещества - считается, что равновесная концентрация в адсорбенте тем выше, чем больше молекулярный вес поглощаемого газа, а в случае растворов - чем меньше растворимость поглощаемого вещества в жидкости.
Адсорбция ускоряется при понижении температуры или при повышении давления. Эти же факторы влияют на процесс десорбции в обратном направлении. Десорбция ускоряется с повышением температуры адсорбента и снижением давления, а также при пропускании через адсорбент паров, вытесняющих поглощенное вещество.
Примеси в фазе, из которой поглощается вещество - при наличии в фазе, из которой адсорбент поглощает вещество А, конкурирующего (вытесняющего) вещества В, т.е. вещества, также способного поглощаться этим адсорбентом, уменьшается равновесная концентрация вещества A в адсорбенте. В этом случае вещество В либо частично, либо полностью вытесняет или замещает вещество А в адсорбенте.
С течением времени при адсорбции наступает равновесие, при котором устанавливается определенная зависимость между концентрацией адсорбируемого вещества Х (кг/кг адсорбента) и его концентрацией Н в газовой фазе:
 (7.61)
(7.61)
где Y - равновесная концентрация инертной части газовой смеси, кг/кг; А, n - коэффициенты, определяемые опытным путем (причем n ≥ 1).
Зависимость (7.61) величины адсорбции целевого компонента в условиях равновесия между фазами при постоянной температуре называют изотермой адсорбции. Существует пять типов изотерм физической адсорбции паров (рис. 7.9).
Изотерма, показанная на рис. 7.9, а, соответствует мономолекулярной ленгмюровской адсорбции; изотермы на рис. 7.9, б, в - мономолекулярной и поли молекулярной адсорбции. Изотермы, приведенные на рис. 7.9, г, д, соответствуют случаю, когда мономолекулярная и поли молекулярная адсорбции сопровождаются капиллярной конденсацией.
Уравнение (7.61) можно представить в другом виде (так как концентрация компонента в газовой смеси при постоянной температуре пропорциональна его давлению):
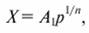 (7.62)
(7.62)
где A1 - коэффициент; р - равновесное давление поглощаемого вещества в парогазовой смеси, Па.
При высоких температурах или малых парциальных давлениях изотермы адсорбции аппроксимируются законом Генри:
 (7.63)
(7.63)
где  - количество поглощенного вещества, кг/кг (адсорбента) или кг/м3; Ap - константа фазового равновесия; рi - парциальное давление компонента в газе.
- количество поглощенного вещества, кг/кг (адсорбента) или кг/м3; Ap - константа фазового равновесия; рi - парциальное давление компонента в газе.
В практических расчетах широко используется уравнение Фрейндлиха:
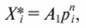 (7.64)
(7.64)
где А1 и n - коэффициенты.
Для мономолекулярной физической адсорбции используется уравнение Ленгмюра:
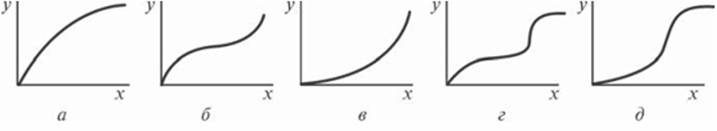
Рис. 7.9. Типы изотерм адсорбции (а - д)
 (7.65)
(7.65)
где b - коэффициент; am- предельная величина адсорбции.
Универсальный характер имеет уравнение Брунауер - Эммет - Теллер (БЭТ), описывающее мономолекулярную и многослойную адсорбцию:
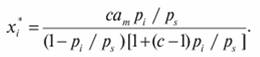 (7.66)
(7.66)
На поглощаемые молекулы со стороны поверхности адсорбента действует сила притяжения, пропорциональная адсорбционному потенциалу:
 (7.67)
(7.67)
Серьезным отклонением от реальных характеристик адсорбции является и предположение об изотермичности процесса. Адсорбция может быть изотермической только при соответствующей организации теплоотвода из зоны конденсации. В иных случаях теплота, выделяющаяся при конденсации адсорбата и смачивании поверхности адсорбента, пойдет на нагрев обрабатываемого газа, частиц адсорбента.
Материальный баланс процесса адсорбции. Процессы адсорбции проводят периодически или, если адсорбент движется через аппарат, непрерывно. Материальный баланс таких процессов выражается уравнением, общим для всех процессов массопередачи:
 (7.68)
(7.68)
где G - расход парогазовой фазы; L - расход адсорбента; у - рабочие концентрации адсорбируемого вещества в парогазовой фазе или растворе; x - рабочие концентрации адсорбируемого вещества в адсорбенте.
Адсорбция в слое неподвижного адсорбента является периодическим процессом, при котором концентрация поглощаемого вещества в адсорбенте и в парогазовой фазе меняется во времени и в пространстве.
Общий материальный баланс по сорбируемому веществу в элементе за время dt без учета продольного перемешивания газового потока выражается уравнением
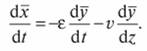 (7.69)
(7.69)
Равенство (7.69) называют дифференциальным уравнением материального баланса периодического процесса адсорбции в слое неподвижного адсорбента.
|
< Предыдущая |
Оглавление |
Следующая > |
|---|
