 Авторефераты по всем темам >>
Авторефераты по ветеринарии
Авторефераты по всем темам >>
Авторефераты по ветеринарии
Динамический морфо-сонографический контроль репаративной регенерации тканей в условиях хирургической травмы
Автореферат докторской диссертации по ветеринарии
|
Страницы: | 1 | 2 | 3 | |
а
Таблица 1.а Клеточный состав операционной раны на разных сроках заживления (%, Мm)
Эритроциты |
ейкоциты (нейтрофилы) |
Макрофаги |
имфоциты |
Фибробласты |
Жировые клетки |
Эпителий |
|
1 сутки (n=10) |
92,4707,344 |
4,1700,887 |
1,4670,340 |
0,8010,357 |
0,4290,128 |
0,7240,174 |
- |
5 сутки (n=9) |
69,3925,618 |
15,6801,324 |
5,6601,101 |
2,1270,586 |
1,7160,279 |
1,0020,351 |
4,4230,639 |
10 сутки (n=11) |
17,3321,290 |
8,5441,623 |
18,6701,066 |
3,0020,498 |
8,1520,856 |
17,2381,380 |
27,0622,844 |
20 сутки (n=8) |
3,1490,108 |
1,2780,167 |
3,8900,545 |
0,90,108 |
31,1012,322 |
19,3312,270 |
40,3511,580 |
30 сутки (n=12) |
0,0170,007 |
0,1070,029 |
1,1500,021 |
1,6650,251 |
28,4240,665 |
21,6602,026 |
46,9771,544 |
аа Обозначения:а * - разница по отношению к предыдущим срокам достоверна (* -p<0.05)
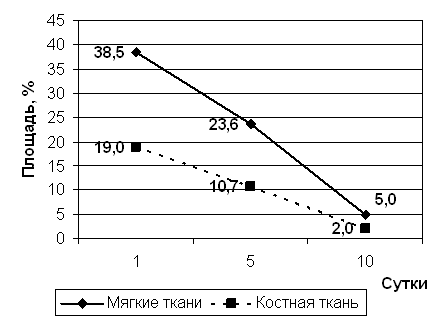
Рис 1. Площадь травматического отека.
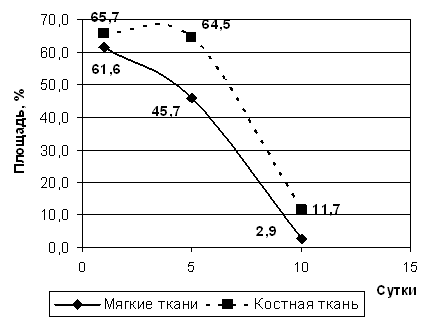
Рис. 2. Площадь гематомы.
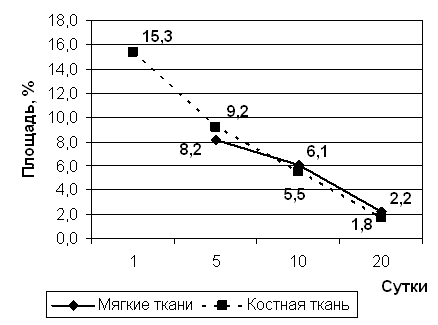
Рис 3.а Площадь лейкоцитарно-некротических масс.
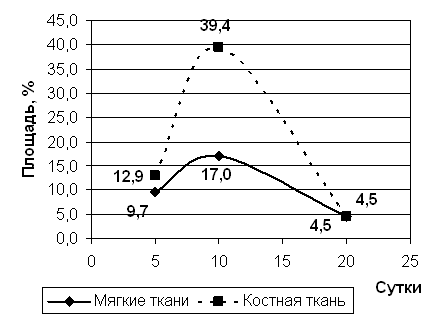
Рис 4. Площадь грануляционной ткани.
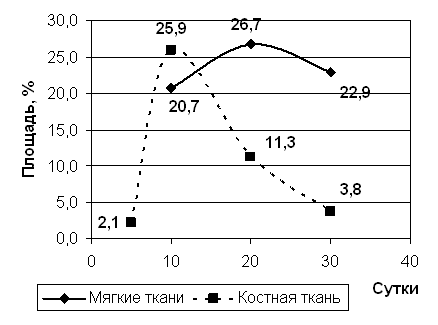
Рис 5. Площадь соединительнойа ткани.
.а
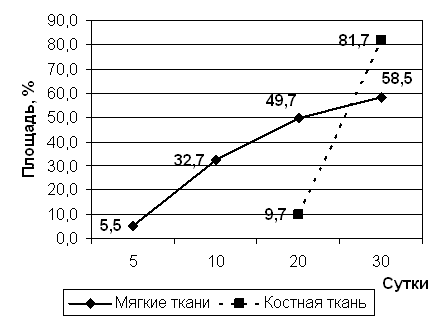
Рис 6. Площади эпителия и пластинчатой кости.
Целью следующей части исследования было выяснение вопроса о связи восстановительных процессов в коже с клиническим течением раневого процесса.
Результаты проведенных исследований показали, что внутримышечное введение Травматина и местное применение Травма геля животные переносили достаточно хорошо, поскольку его введение не вызывало у них аллергических реакций или каких-либо осложнений.
Раневой процесс протекал в виде асептического экссудативного воспаления. Экссудативные процессы у животных 1-й (контрольной) группы были выражены к концу первых суток после оперативного вмешательства и прекращались на 3-4 день.
У опытных животных они характеризовались более бурным течением и завершались в более короткий (на вторые сутки) период.а У животных подопытной группы процесс экссудации бурно проявлялся в течение 1-х и завершался на 2 сутки. Отечность краев раны уменьшалась. Объем раневого отделяемого не превышал 1.5-2 мл.
Все операционные раны заживали по первичному натяжению. Снятие швов в обеих группах проводили на 10-е сутки после операции.
Анализ цитоархитектоники раневого содержимого показал, что в первые сутки после операции в нем были выявлены сегментоядерные нейтрофилы (р<0,5) (Рис.11) с хорошо выраженной специфичной зернистостью (42%), к концу первых суток - средние и большие лимфоциты с интенсивно окрашенным ядром, моноциты. Кроме того, происходило достоверное (р<0,5) увеличение количества фибробластов.
К концу третьих суток у животных обеих групп в содержимом раны также преобладали сегментоядерные нейтрофилы, однако достоверно возрастало количество фибробластов (наиболее выражено в опытной группе). Было выявлено незначительное представительство тучных клеток, регулирующих, как известно, гемодинамические сдвиги (Омельяненко Н.П.,2009). У животных опытной группы в этот период наблюдений явления воспаления сменялись пролиферативным процессом. Область раневой зоны была заполнена относительно большим количеством молодых фибробластов с крупным округлым ядром и хорошо выраженной цитоплазмой. В ней грануляционная ткань меньшей рыхлостью по сравнению с животными контрольной группы и содержала нежные коллагеновые волокна. Отек мышечных волокон вокруг раны был слабо выражен. Таким образом, на третьи сутки наблюдения лецкоцитарная фаза воспалительного процесса сменялась на макрофагальную. Это период очищения раныа совпадал с началом формирования грануляционной ткани.
На 7 сутки у животных первой группыа раневая поверхность была заполнена рыхлой грануляционной тканью с увеличенными в объеме коллагеновыми волокнами, которые отличались слабой степенью морфологической зрелости и ориентированной упорядоченности. В ней были обнаружены молодые фибробласты, макрофаги, лимфоидные клетки. Отечность мышечных волокон, окружающих рану, уменьшалась. Следует подчеркнуть усиление васкуляризации раны по сравнению с предыдущими сроками наблюдения.
У животных второй группы раневой дефект был заполнен более плотной грануляционной тканью.а Мышечные волокна сохраняли специфическую для ткани поперечную исчерченность. Сам дефект был обильно васкуляризован. На его месте формировался молодой, соединительнотканный рубец, состоящий из коллагеновых, ретикулиновых и эластических волокон различной степени морфологической зрелости. В глубоких слоях раны обнаружено наличие пучков коллагеновых волокон.
На 10-е сутки эксперимента у контрольных животных по краям раны были выявлены первые признаки частичной эпителизации, сочетающиеся с инфильтрацией кориума полиморфно-ядерными лейкоцитами с формированием микроабсцессов в толще дермы и в подлежащей жировой клетчатке. Повсеместно наблюдаемый ангионекроз в области раны распространялся вне зоны повреждения. У контрольных животных установлена усиленная васкуляризация области раневого дефекта и при этом большинство сосудов располагалось в субэпидермальном слое. Волокнистые конструкции дермы вследствие их набухания были уплотнены. В морфологическом отношении коллагеновые волокна характеризовались гетерогенностью по степени морфологической зрелости, что может свидетельствовать о их структурных перестройках с формированием рубцовой ткани.
На 10-е сутки в группе животных, которым наносили Травма - гель и внутримышечно вводили Травматин поверхность раны была представлена в виде скоплений базофильных масс с незначительным присутствиемаа полиморфно-ядерных лейкоцитов. Раневая поверхность характеризовалась четко выраженной эпителизацией гнездного характера, причем большая часть шиповатых и базальных эпидермоцитов приобретали позиционную специфичность.а Более того, процесс эпителизации протекал полноценно, о чем может свидетельствовать отсутствие локальных дефектов в эпидермальной ткани.
На 20-е сутки у контрольных животных в отличии от опытных в области раны сохранялись клеточные инфильтраты в коже и подкожной клетчатке. Они былиа представлены преимущественно лимфоцитами и макрофогоподобнымиа клетками. Волокнистые стуктуры в зоне повреждения характеризовались признаками набухания и метахромазии. Обнаружена структурная декомпозиция волосяных фолликулов и сальных желез в глубоких отделах и краевых участках. Коллагеновые волокна были интегрированы в пучки. Это свидетельствует о перестройке рубцующейся грануляционной ткани в зрелую фиброзную.
На 20-е сутки у животных опытной группы в области раны сохранялись признаки клеточной пролиферации. Они касались преимущественно дермы,а поскольку процесс эпителизации уже завершился, о чем может свидетельствовать отсутствие латипичных выростов эпидермиса и равномерное распределение меланобластов. В глубоких слоях кожи присутствовали фибробласты (34%). Соединительнотканные структуры слабо воспринимали красители, присутствовали полинуклеарные клетки. Сформированные коллагеновые волокна отличались высокой плотностью упаковки и упорядоченнойа ориентацией. Выявлено формирование пучков за счет интеграции коллагеновых волокон преимущественно тангенциальной (параллельно поверхности рубца) или косой ориентации. Пучки, как правило,а локализовались в глубоких слоях дермы, что может отражать их субстративноеа значение для сформированного рубца.а
На 30-е сутки наблюдений выявлено завершение перестроечных процессов в рубцовой ткани, что подтверждается структурно-функциональным состоянием в нем коллагеновых волокон.
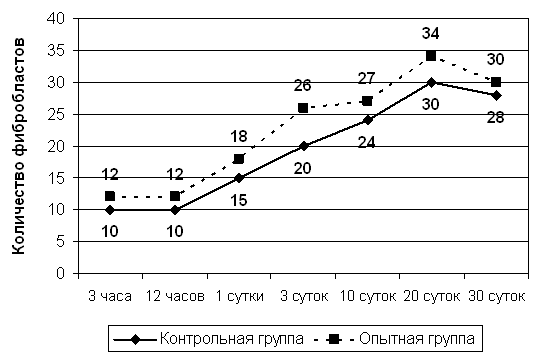
Рис 7. Динамика количественного содержания фибробластов в операционной ране.
Сравнение относительных величин количества фибробластов в опытной и контрольной группах (Рис.7) позволило сделать вывод о том, что их динамика на различных сроках наблюдения, практически, не отличается. аПри сравнительном анализе их количественного соотношения в изучаемых группах нами выявлены существенные различия, которые проявляются уже через 12 часов после операции. Нельзя исключить, что установленные различия в количественном представительстве фибробластов связаны с влиянием основного вещества изучаемого препарата - геля на гидрофильной основе, который обладает опосредованным кровоостанавливающим действием, становясь матрицей для кровяного сгустка. Возрастание количества клеток на 10 сутки могут быть связаны с тем, что завершение процесса экссудации в раннем послеоперационном периоде создает благоприятные условия, активизирующую их биосинтезирующие потенции. Данная тенденция сохраняется на протяжении всего эксперимента.
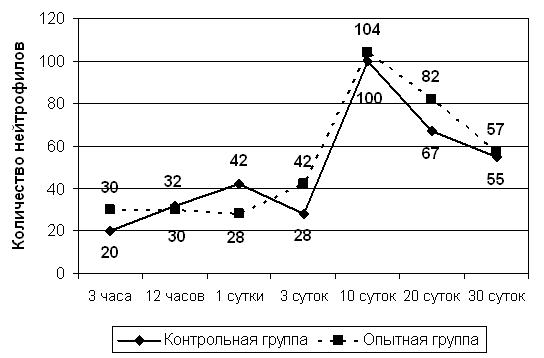
Рис 8. Динамика количественного содержания нейтрофилов в операционной ране.
При исследовании количества нейтрофилов (Рис.8) на различных сроках наблюдения в обеих группах выявлена сходная динамика. Вместе с тем, нами обнаружены в сравниваемых группах различия в их количественном соотношении, что может быть следствием более бурного, но кратковременного течения экссудативного процесса у животных в опытной группы. При этом, контрольные животные превосходили своих аналогов по данному показателю с 1-х суток наблюдения, что может быть следствием лишь только начинающихся воспалительных процессов.

Рис 9. Толщина пучков коллагеновых волокон, мкм
При изучении толщины пучков (Рис.9) коллагеновых волокон на различных сроках наблюдения выявлено, что до 10 суток динамика этого показателя в группах сравнения практически не отличается. К 20 суткам у животных опытной группы по сравнению с контрольной толщина коллагеновых конструкций возрастает, аналогичная тенденция сохраняется до 30 суток наблюдения. Этот факт может явиться отражением увеличения степени их зрелости, что находит подтверждение в данныха поляризационной микроскопии гистологических срезов рубцовой ткани. Показатели расстояния между пучками коллагеновых (Рис.10) волокон сохраняют аналогичную тенденцию. Своего максимума они достигают в опытной группе достигает через 3 часа после операции, а затем снижаются, что может свидетельствовать об уменьшении отека, в контрольной группе выявлена обратная картина, отражающая нарастание отека.а
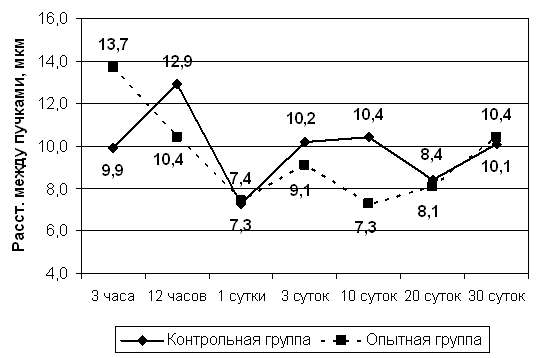
Рис 10. Расстояние между пучками, мкм.
Результаты ультрасонорафических исследований.
На эхограммах в режиме серой шкалы хорошо визуализировались все слои зоны повреждения: кожа, подкожная клетчатка, мышечная ткань, апоневроз мышц брюшной стенки, подапоневротическое пространство.
При проведении эхографии на 1 сутки после операции, мы оценивали толщину кожи и подкожной клетчатки. У животных контрольной группы были обнаружены изменения со стороны мягких тканей в виде отека подкожной клетчатки, который эхографически проявлялся утолщением и неоднородностью структуры. На первые сутки после операции отек подкожного слоя у животных обеих групп был слабо выражен и выглядел при сонографии в виде небольшого утолщения. Переход в режим цветовой допплерографии (ЦДК) и в режим энергодопплера (ЭД) показал отсутствие различий в сосудистом рисунке мягких тканей передней брюшной стенки по ходу послеоперационной раны у животных контрольной и опытной групп.а В области операционной раны визуализировались единичные тонкостенные сосуды и усиление сосудистого рисунка, характерное для начала воспалительной реакции, что соответствует наличию единичных соответствующих друг другу сигналов артериального и венозного кровотока.
При проведении эхографии на 3 сутки после операции у животных контрольной группы при серошкальном исследовании был выявлен инфильтрат в подкожной жировой клетчатке, выраженный отек по ходу послеоперационной раны с признаками лимфостаза.
При проведении ЦДК и ЭД мягких тканей обнаружены множественные, крупные, без выраженной ориентации сосуды, расположенныеа в подкожном слое, характеризующие воспалительный процесс. При проведении ЦДК у животныха контрольной группы были зарегистрированы преимущественно эхосигналы венозного кровотока, что является коррелятом застойных явлений в тканях.а
Эхографическое исследование травматических повреждений в опытной группе показало выраженные отличия. Так, на третьи сутки при серошкальном исследовании обнаружена менее выраженная, чем в контрольной группе воспалительная реакция, что при УЗ исследовании проявлялось меньшей толщиной мягких тканейа с отсутствием инфильтратов и скопления воспалительной жидкости по ходу послеоперационной раны.
На 3-и сутки у животных опытной группы допплерографическая картина характеризовалась наличием единичных упорядоченных цветовых эхосигналов, исходящих от тонких подкожных сосудов, что характеризует отсутствие выраженной воспалительной реакции. Признаков лимфостаза в коже и подкожной клетчатке нам обнаружить не удалось.
При проведении ЭД по ходу послеоперационной раны были обнаружены единичные сосудистые упорядоченные эхосигналы, свидетельствующие о начале пролиферативных явлений.
Таким образом, гистологические и ультрасонографические исследования динамики заживления полнослойных ушитых ран в области лапаротомного разреза выявили терапевтическую эффективность при воздействии препарата Травматин, что выражалось в ускорении их заживления. Этот процесс был инициирован более ранним созреванием грануляционной ткани и ее более быстрым рубцеванием.
Таблица 2.а Тинкториальные свойства исследуемых тканей
передней брюшной стенки в послеоперационный период
Сронки исслендования |
Степень морфологической зрелости волокон |
|||||
толщина пучков, мкм |
расстояние между пучками, мкм |
тинкториальные свойства |
||||
контроль |
опыт |
контроль |
опыт |
контроль |
опыт |
|
3 часа |
9,01,2 |
9,81,3 |
9,92,0 |
13,71,5 |
зеленый |
зеленый |
12 часов |
6,40,5 |
8,91,1 |
12,91,5 |
10,41,2 |
зеленый |
зеленый |
1 сутки |
12,80,9 |
12,753,5 |
7,320,4 |
7,380,6 |
зеленый |
зеленый |
3 суток |
23,24,0 |
28,34,3 |
10,21,1 |
9,11,0 |
зеленый |
оранжево-зеленый |
10 суток |
15,52,1 |
14,21,2 |
10,41,4 |
7,320,6 |
мало зеленого, мало красного, в основном ораннжевый |
красный, оранжевый, зеленый (немного |
20 суток |
9,12,7 |
18,31,9 |
8,370,8 |
8,121,2 |
зелено-оранжевый |
зелено-оранжевый |
30 суток |
9,00,3 |
15,20,8 |
10,11,3 |
10,41,0 |
оранжевый |
оранжевый |
Обозначения: * - изменения по отношению к исходным данным достоверны (* -p<0.05)
Выводы
1. а Научно обоснованы и разработаны объективные диагностические критерии оценки репараторного процесса в области ушитых операционных ран при хирургической травме, основанные на анализе корреляционных морфологических измененийа поврежденных тканей, определяющих направление и динамику восстановительного процесса.
2.аа Выявлены морфологические закономерности проявления репаративной регенерации в динамике постоперационного периода, базирующиеся на выявленных морфологических корреляциях между репаративными процессами в костиа и параоссальных тканях. На 5 сутки определена достоверная зависимость между тканями в зоне перелома по показателям травматического отека (r=0,698, р=0,036) и лейкоцитарно-некротических масс (r=0,825, р=0,006). При увеличении отека в мягких тканях, этот показатель увеличивается и в костной ткани, повышение площади лейкоцитарно-некротических масс в мягких тканях влечет за собой повышение таковых и в костной ткани. При этом активно протекающие процессы репарации в мягкотканных образованиях инициировали остеопластические. Степень развития грануляционной ткани в зоне костной травмы была прямопропорциональна таковой в параоссальных тканях. Корреляционные изменения на 5 сутки структурных повреждений данных тканей определяют дальнейшее ее синхронное течение регенераторных процессов.
3. а Формирование полноценного в структурном отношении эпидермиса над рубцовой тканью на 10 сутки наблюдения индуцирует пролиферативную и биосинтезирующую активность фибробластов. Положительная взаимосвязь выявлена между клетками эпителия и грубоволокнистой костной тканью (r=0,721, р=0,012).
Характер и масштабы регенераторных процессов в параоссальных тканях инициировало резорбцию интраоссальных некротических масс. Характер эпителизации определяет наличие воспаления ваа костной ткани. Определены достоверные корреляционные параллели - отрицательная взаимосвязь между соединительной тканью (%) и гематомой (%) (r=-0,540, р=0,087), хрящевой тканью и гематомой (r=-0,551, р=0,079), площадью эпителия и гематомы (r=-0,583, р=0,060). Образование соединительнотканной мозолиа и начале ее перестройки в костную на базе ретикулофиброзной костной ткани свидетельствует разрастание коллагеновых волокон и присутствие на фоне их гомогенизации первичной спонгиозы. Определена корреляционная обратная взаимосвязь между клеточным составом лейкоцитов операционной раны (%) и площадью грубоволокнистой ткани костной ткани (r=-0,734, р=0,010), между площадями хрящевой и грануляционной ткани костной ткани (r=-0,544, р=0,084). На 10 сутки наблюдений пролиферация фибробластов при одновременном увеличении коллагеновых волокон приводит к формированию субэпителильно рубцовой ткани.
4. а Выявлена взаимосвязь реорганизации рубцовой ткани со степенью развития грубоволокнистой кости и начальными признаками ее перестройки в пластинчатую кость на 20 сутки наблюдения. Наличие ячеистой соединительной ткани без клеточной инфильтрации определяет ускоряющую смену генераций костной ткани на стадии оссификации костной мозоли. Уменьшение площади и плотности рубца (проявление его реорганизации) соответствует выраженности перестройки костной мозоли с формированием ее конечной генерации - пластинчатой кости. Определена положительная взаимосвязь между количеством лимфоцитов и площадью лейкоцитарно-некротических масс мягких тканей (r=0,772, р=0,025), количеством эпителиальных клеток и фибробластов (r=0,627, р=0,096), отрицательная взаимосвязь между количеством фибробластов и лейкоцитов (r=-0,683, р=0,062). Была выявлена отрицательная взаимосвязь между количественным составом лимфоцитов и грануляционной костной ткани (r=-0,625, р=0,097), количественным составом лейкоцитов и площадью соединительной костной ткани (r=-0,775, р=0,024). а
5.аа Модифицированный нами метод внеочаговой чрескостной фиксации переломов трубчатых костей обеспечивает четкую репозицию и качественную фиксацию отломков на протяжении всего постоперационного периода. При идеальной репозиции восстановительные процессы протекают за счет усиления остеопластических механизмов без хондроидного пролиферата путем ангиогенного остеогенеза.
6.аа Разработан неинвазивный метод достоверной оценки динамики репаративного постраневого процесса с использованием сонографического исследования в режиме цветового и энергетического доплеровского картирования, который позволил унифицировать диагностические данные, полученные на этапах заживления. При этом показано, чтоа функциональное состояние микрогемоциркуляторного русла в области повреждения является объективным тестом прогнозирования послеоперационных осложнений и корректирования применяемого лечения.
7.аа Режимы цветового и энергетического допплеровского картирования позволяют оценитьаа характер течения репарации, выявлять застойные явления в тканях и выраженность пролиферативных процессов. Эхографические параметры раневого участка соответствуют данным, полученным при морфологическом исследовании.
8.аа Препарат Травматин, не нарушая стадийности раневого процесса, ускоряет его за счет сокращения фазы травматического и воспалительного отека, что коррелирует с данными сонографии. Это сопровождается активизацией пролиферативных процессов в грануляционной ткани (увеличение количественного состава фибробластов в опытной группе по сравнению с контрольной на 20%) и ускорением эпителизации, что приводит к формированию прочного, нежного, подвижного рубца, не спаянного с окружающими тканями. Полученные данные позволяют рекомендовать препарат Травматин в практике ветеринарной хирургии в раннем послеоперационном периоде.
9.аа Комплексное применение препарата Травматин и Травма гель ускоряет заживление ран на 20-30% по сравнению с общепринятыми методами за счет. Наилучшим терапевтическим эффектом обладает применение Травматина в виде геля, нанесенного на область раны.
СВЕДЕНИЯ О ПРАКТИЧЕСКОМ ИСПОЛЬЗОВАНИИ
НАУЧНЫХ РЕЗУЛЬТАТОВ
Результаты исследования отражены в учебном пособии: Современные представления о репаративной регенерации костной ткани при оперативном лечении переломов костей у животных, одобренное УМО Высших учебных заведений в области зоотехнии и ветеринарии, методическом пособии: Лечение переломов костей у плотоядных. Материалы диссертации используются в цикле занятий Ветеринарная хирургия для студентов очной и заочной формы обучения, для студентов по специализации Кинология.
аа Полученные результаты используются в учебном процессе на кафедре анатомии и гистологии животных им. А.Ф. Климова ФГОУ ВПО Московская государственная академия ветеринарной медицины и биотехнологии им. К.И. Скрябина, на кафедрах анатомии и ветеринарной хирургии ФГОУ ВПО Казанская государственная академия ветеринарной медицины им. Н.Э. Баумана.
РЕКОМЕНДАЦИИ ПО ИСПОЛЬЗОВАНИЮ НАУЧНЫХ ВЫВОДОВ
- Установлены и морфологически обоснованыа корреляционные этапы изменений репаративной регенерации в мягких и костной тканях, протекающих в зоне перелома. Данные показатели являются фундаментальными в вопросах визуального прогнозирования течения раневого процесса в области репаративного остеогенеза, становясь объективными критериями оценки.
- Применение цитоморфологических методик в исследовании раневого экссудата в области костной травмы позволит определить направление регенераторного процесса и позволит корректировать применяемое лечение в раннем постоперационном периоде.
- Полученные данные о гемодинамике в области раневого процесса вентральной части брюшной стенки в норме и патологии являются базовыми при дифференциальной диагностике и прогнозировании течения репаративной регенерации.
- Обосновано и доказано положительное влияние на течение раневого процесса применений аппликаций гелей на гидрофильной основе в фазе экссудации.
- Полученные результаты целесообразно использовать при клинической оценке течения раневого процесса, предупреждении возможных послеоперационных осложнений.
а
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Шакирова Ф.В. Применение стержневого аппарата чрескостной фиксации при переломах трубчатых костей у собак / В.Ф. Шакирова // Материалы конференции молодых ученых.ЧКазань, 2006.ЧС.76Ч78.
- Шакирова Ф.В. Комплексное лечение переломов костей голени у собак / Ф.В. Шакирова // Материалы ХIV Московского конгресса по болезням мелких домашних животных.ЧМ., 2006.ЧС.121Ч122.
- Шакирова Ф.В. Рентгенологическая характеристика заживления перелома костей голени при чрескостном и интрамедуллярном остеосинтезе / Ф.В. Шакирова, Н.З. Файзуллина // Ветеринарная медицина домашних животных.ЧКазань, 2006.ЧВып. 3.ЧС.141Ч143.
- Шакирова Ф.В. Динамика репаративной регенерации мягких тканей при применении Травматина у кошек / Ф.В. Шакирова, Н.З. Файзуллина // Ученые записки КГАВМ.ЧКазань, 2008.ЧТ. 194.ЧС.153Ч157.
- Шакирова Ф.В. Метод чрескостного внеочагового остеосинтеза стержневым аппаратом наружней фиксации / Ф.В. Шакирова, Н.З. Файзуллина // Ветеринарный врач.Ч2008.Ч№ 2.ЧС.37Ч39.
- Шакирова Ф.В. Морфодинамика заживления костной и мягких тканей при чрескостном остеосинтезе / С.В. Тимофеев, Ф.В. Шакирова // Доклады РАСХН.ЧМ., 2008.Ч№ 5.ЧС.60Ч62.
- Шакирова Ф.В. Репаративная регенерация мягких тканей при применении гомеопатических препаратов у кошек / Ф.В. Шакирова, Н.З. Файзуллина // Ученые записки КГАВМ.ЧКазань, 2008.ЧТ. 194.ЧС.149Ч153.
- Шакирова Ф.В. Структурные изменения мягких тканей при применении Травматина у кошек / Ф.В. Шакирова // Материалы международной конференции.ЧСПб., 2008.ЧС.105Ч106.
- Шакирова Ф.В. Морфодинамика репаративной регенераци мягких тканей при применении Травматина у кошек / Ф.В. Шакирова // Ветеринарный врач.Ч2009.Ч№ 1.ЧС.57Ч58.
- Шакирова Ф.В. Динамика заживления мягких тканей в зоне перелома в условиях чрескостного остеосинтеза у собак / Ф.В. Шакирова // Ветеринарная медицина домашних животных.ЧКазань, 2009.ЧВып. 6.ЧС.180Ч183.
- Шакирова Ф.В. Морфодинамика репаративной регенерации в костной ткани у собак / Ф.В. Шакирова // Ветеринарный врач.Ч2009.Ч№ 6.ЧС.52Ч54.
- Шакирова Ф.В. Мофодинамика репаративной регенерации костной тканиа / Ф.В. Шакирова // Ветеринарная медицина домашних животных.ЧКазань, 2009.ЧВып. 6.ЧС.178Ч180.
- Шакирова Ф.В. Морфодинамика репаративной регенерации мягких тканей при применении Травматина у кошек / Ф.В. Шакирова // Материалы ХVII Московского конгресса по болезням мелких домашних животных.ЧМ., 2009.ЧС.124Ч126.
- Шакирова Ф.В. Метод чрескостного внеочагового остеосинтеза стержневым аппаратом наружней фиксации у собак / Ф.В. Шакирова // Международный вестник ветеринарии.Ч2009.Ч№ 1.ЧС.19Ч21.
- Шакирова Ф.В. Динамика заживления мягких тканей в условиях чрескостного остеосинтеза / Ф.В. Шакирова // Практик.Ч2010.Ч№ 2.ЧС.95Ч97.
- Шакирова Ф.В. Динамический сонографический контроль за репаративными процессами в тканях / Ф.В. Шакирова // Тезисы 1 всероссийской межвузовской конференции по ветеринарной хирургии.ЧМ., 2010.ЧС.53Ч55.
- Шакирова Ф.В. Клиническая и морфологическая характеристика заживления послеоперационной раны при применении препарата Травматин /Ф.В. Шакирова // Ветеринарный врач.Ч2010.Ч№ 2.ЧС.48Ч50.
- Шакирова Ф.В. Морфодинамика заживления мягких тканей в зоне перелома в условиях чрескостного остеосинтеза / Ф.В. Шакирова // Ветеринарный врач.Ч2010.Ч№ 1.ЧС.35Ч38.
- Шакирова Ф.В. Морфологический контроль за репаративными процессами в костной ткани / Ф.В. Шакирова, С.В. Тимофеев // Ученые записки КГАВМ.ЧКазань, 2010.ЧТ. 203.ЧС.284Ч287.
- Шакирова Ф.В. Морфологический контроль заживления мягких тканей в зоне перелома в условиях чрескостного остеосинтеза / Ф.В. Шакирова // Ветеринарная медицина.Ч2010.Ч№ 2.ЧС.51Ч52.
- Шакирова Ф.В. Динамика заживления костной ткани у собак в условиях чрескостного остеосинтеза / Ф.В. Шакирова // Практик.Ч2010.Ч№ 1.ЧС.84Ч86.
- Шакирова Ф.В. Ультразвуковой контроль за раневым процессом в послеоперационный период / Ф.В. Шакирова, С.В. Тимофеев // Ученые записки КГАВМ.ЧКазань, 2010.ЧТ. 203.ЧС.260Ч263.
- Шакирова Ф.В. Ультразвуковой контроль репаративной регенерации мягких тканей / Ф.В. Шакирова // Ветеринарный врач.Ч2010.Ч№ 4.ЧС.50Ч51.
- Шакирова Ф.В. Ультрасонографический контроль заживления кожных ран / Ф.В. Шакирова, С.В. Тимофеев // Ветеринарная медицина.Ч2010.Ч№ 2.ЧС.51Ч52.
- Шакирова Ф.В. Корреляционные изменения в костной и мягких тканях при репаративной регенерации в условиях чрескостной фиксации у собака / Ф.В. Шакирова // Вопросы нормативно-правового регулирования в ветеринарии.Ч2010.Ч№ 4.ЧС.69Ч72.
|
Страницы: | 1 | 2 | 3 | |
 Авторефераты по всем темам >>
Авторефераты по ветеринарии
Авторефераты по всем темам >>
Авторефераты по ветеринарии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА