15. Электропроводность различных веществ
Электропроводность различных веществ определяется типом носителей тока и свойствами среды, в которой распространяется ток. Детальное рассмотрение механизма электропроводности возможно только на микроскопическом уровне, а следовательно, с помощью законов квантовой механики атомов и молекул.
Электропроводность проводников (металлов). Вольт-амперная характеристика металлов имеет типичный вид, соответствующий закону Ома I = U/R . Такая зависимость сохраняется в очень широком диапазоне температуры.
Температурная зависимость сопротивления. Для большинства чистых металлов удельное сопротивление линейно зависит от температуры:
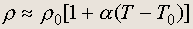 (15.1)
(15.1)
Здесь r 0 - значение удельного сопротивления при некоторой выбранной температуре T 0 , a - температурный коэффициент сопротивления, [ a ] = K -1 . Численно этот коэффициент для всех металлов порядка 10 -3 К
-1 . Иными словами, сопротивление металлов слабо зависит от температуры практически во всем диапазоне допустимых температур от точки плавления до сверхнизких.У некоторых металлов (например, ртуть, олово) сопротивление внезапно падает до нуля при охлаждении ниже некоторой критической температуры Т с . Это явление получило название сверхпроводимости . Типичные температуры перехода в сверхпроводящее состояние у металлов очень малы (< 20 К).
Электрический ток в жидкостях. Водные растворы электролитов проводят ток. Носителями тока являются ионы электролита , образовавшиеся в результате разложения молекул электролита в водном растворе. В растворе электролита непрерывно конкурируют процессы диссоциации и обратной рекомбинации ионов в молекулы электролита. При заданной температуре устанавливается динамическое равновесие и среднее число ионов обоих знаков не изменяется. Степень диссоциации (доля молекул электролита, распавшихся на ионы) растет с ростом температуры, поэтому в нагретом электролите концентрация положительных и отрицательных ионов увеличивается.
Закон электролиза. Ионы - проводники тока в растворе электролита - попадают на электроды и, отдавая, либо получая электроны, превращаются в атомы соответствующих веществ. Процесс выделения вещества на электродах при пропускании тока через раствор электролита называется электролизом .
Пусть m 0i - масса отдельного иона, q 0i = ne - его заряд ( n - валентность иона, е - величина элементарного заряда), а N i - число ионов, попавших на электрод за время D t . Полный заряд, прошедший за это время через электролит, равен D q = I D t , поэтому
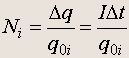
Масса вещества, выделившаяся на электроде, равна
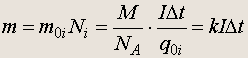 (15.2)
(15.2)
Коэффициент
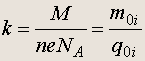
носит название электрохимического эквивалента . Эта величина различна для разных веществ.
Полученная формула (15.2) представляет основной закон электролиза (закон Фарадея):
Масса вещества, выделившегося на электроде, прямо пропорциональна количеству заряда D q , протекшему через раствор электролита. Постоянная величина Q F = eN A = 96500 Кл называется постоянной Фарадея. При прохождении количества заряда Q F на электроде выделяется количество вещества, равное массе одного моля вещества, деленной на валентность иона-носителя.
