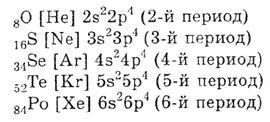
Наличие двух неспаренных электронов на наружном энергетическом уровне
указывает на валентность 2 в невозбужденном состоянии. Сравнение строения
внешних уровней показывает, что у S, Se, Те и Ро, в отличие от кислорода,
имеются вакантные орбитали d-подуровня. Отсутствие свободных орбиталей
на внешнем уровне кислорода не дает возможности увеличить число неспаренных
электронов и поэтому кислород имеет постоянную валентность, равную двум.
Атомы остальных элементов подгруппы имеют на внешнем энергетическом уровне
вакантные орбитали d-подуровня, куда при возбуждении могут переходить
s- и р-электроны этого же уровня. Этим объясняется валентность, равная
четырем и шести. Электронная конфигурация атомов в возбужденном состоянии:
В соединениях с металлами и водородом элементы подгруппы кислорода проявляют
остепень окисления -2 (Н2О,
H2S,
H2Se,
H2Te,
ZnS, Al2S3...).
В кислородных соединениях сера, селен, теллур проявляют степени окисления
+4 (S02,
SeO2,
Te02)
и +6 (S03,
Se03,
Те03).
Уравнения реакций, подтверждающих химические свойства кислорода:
а) отношение к металлам (1 реакция);
б) отношение к неметаллам (1 реакция);
в) отношение к сложным веществам (оксидам, основаниям, кислотам,
солям).
Кислород — элемент шестой группы главной подгруппы. Электронная конфигурация
атома Is22s2p4
свидетельствует о том, что кислород является активным неметаллом, сильным
окислителем. Он легко присоединяет два электрона, недостающих до завершения
восьмиэлектронного слоя: О0
+ 2ё --> О-2,
поэтому реагирует с многими веществами-восстановителями.
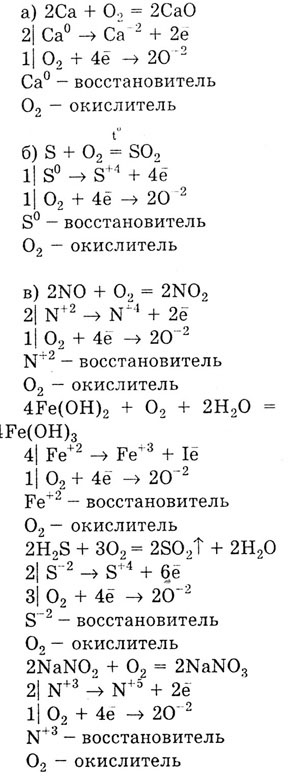
Уравнение реакции гидролиза сульфида лития в молекулярной и ионной формах.
Сульфид лития Li2S
— соль, образованная сильным основанием LiOH и слабой кислотой H2S,
поэтому гидролизуется по аниону в две стадии:
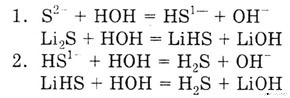
В растворе сульфида лития накапливаются гидроксид-ионы, поэтому соль
Li2S
в растворе имеет щелочную среду, в которой лакмус приобретает синюю окраску,
фенолфталеин - малиновую.
Задача. При взаимодействии двух веществ
образуется газ А с запахом тухлых яиц, при его горении в избытке кислорода
образуется газ В с раздражающим запахом. В результате взаимодействия газов
А и В выпадает вещество желтого цвета, при нагревании которого с железом
получается соединение, вступающее в реакцию с соляной кислотой с образованием
газа А. Определить состав образующихся газов и написать уравнения всех
протекающих реакций.
Решение. Газ А с запахом тухлых яиц — это
сероводород H2S.
Он образуется при взаимодействии серы и водорода:
Н2
+ S = H2S
При горении сероводорода образуется сернистый газ SO2:

|