По отношению их:
а) к воде;
б) к кислотам;
в) к основаниям;
г) друг к другу.
1. Взаимодействие с кислотными и амфотерными оксидами с образованием
соли и воды. Среди указанных веществ СО2
- кислотный оксид.
2NaOH + СО2
= Na2C03
+ Н20
20Н + СО2
= СО32-
+ Н20.
2. Взаимодействие с амфотерными гидроксидами, проявляющими в этом случае
свойства кислот; в результате образуется комплексная соль. Zn(OH)2
- амфотерный гидроксид.
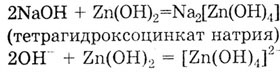
3. Взаимодействие с кислотами с образованием соли и воды. Взаимодействие
основания с кислотой называется реакцией нейтрализации. Среди перечисленных
в задании веществ две кислоты: сильная нелетучая серная кислота H2S04
и слабая летучая серо водородная кислота H2S.
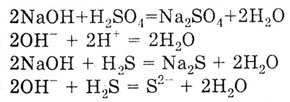
Следует помнить, что слабые электролиты пишут в молекулярном виде в
сокращенных ионных уравнениях реакций.
4. Взаимодействие с растворимыми солями с образованием новой соли и нового
основания, причем одно из образовавшихся веществ должно выпадать в осадок.
CuSO4
- растворимая соль, NaOH — щелочь.
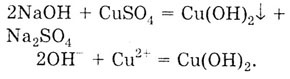
5. Щелочи могут взаимодействовать с некоторыми металлами в растворах.
К числу таких относятся Аl и Zn, которые проявляют амфотерные свойства.
Среди указанных в задании веществ есть алюминий, с которым происходит
следующая реакция: алюминий реагирует с водой, образуя гидроксид алюминия
Аl(ОН)3
и водород Н2.
Так как Аl(ОН)2
— амфотерный гидроксид, то в присутствии щелочи NaOH он проявляет свойства
слабой кислоты, поэтому растворяется в щелочи с образованием комплексной
соли:
2А1 + 6Н,0 = 2Аl(ОН)3
+ ЗН2
2Аl(ОН)3
+ 2NaOH = 2Na[Al(OH)4]
(тетрагидроксоалюминат натрия)
Задача. Напишите уравнения реакций в молекулярном
и ионном виде, доказывающих амфотерный характер:
а) гидроксида алюминия;
б) оксида цинка;
в) цинка.
Решение. Чтобы выполнить это задание, необходимо
знать, что доказательством амфотерности веществ является взаимодействие
их как с кислотами, так и с основаниями.
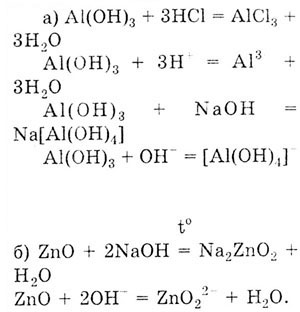
В этой реакции оксид цинка проявляет свойства кислотного оксида. Кислотному
оксиду ZnO соответствует кислота H2Zn02
(мысленно прибавили воду). Поэтому образуется соль цинковой кислоты -
Na2ZnO2
- цинкат натрия.
ZnO + 2НС1 = ZnCl2
+ Н20
ZnO + 2Н+
= Zn2+
+ Н20.
В этой реакции ZnO проявляет свойства основного оксида. Переход цинка
в раствор в виде катиона Zn2+
является свидетельством основных свойств оксида цинка при взаимодействии
с кислотой.
в) Цинк реагирует как с кислотой, так и со щелочью в растворе, что является
доказательством амфотерности.
Zn + 2НСl = ZnCl2
+ Н2
Zn + 2NaOH + 2Н20
= Na2[Zn(OH)4]
+ Н2
Задача. Получите оксид меди двухвалентной
всеми известными способами.
Решение. а) взаимодействие меди с кислородом
при нагревании:
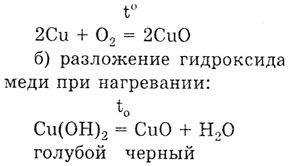
в) разложение соли летучей кислоты, например, малахита при прокаливании:

|