Мембранная энзимология
бислое указывает на высокую кооперативность процесса, в котором участвуют два необходимых для активации липидсвязывающих центра.
Кроме того, по данным о тушении флуоресценции триптофана производными фосфатидилхолина отдельно была определена доступность молекул фосфатидилхолина для БДГ. Степень тушения флуоресценции фактически является мерой связывания липида. Оказалось, что фосфатидилхолин связывается некооперативно с примерно 12 центрами в молекуле фермента. Такое некооперативное связывание с довольно большим числом центров весьма типично для мембранных белков в бислое. Кроме того, основная часть флуоресценции тушится при более низких концентрациях фосфатидилхолина, чем необходимо для активации. Такое расхождение между связыванием липида и активацией фермента можно объяснить, если предположить, что в активации участвует только очень небольшая часть центров, которые не удается выявить в экспериментах по тушению флуоресценции. Приведенные результаты интересны еще и тем, что позволяют сопоставить физическое взаимодействие определенного липида и фермента с биохимическим ответом.
Интерпретация результатов таких экспериментов осложняется тем, что активность фермента может сильно зависеть от степени его агрегации, т.е. активность фермента в различных липидах, по-видимому, будет соответствовать степени его дезинтеграции. БДГ замечателен еще и тем, что это один из немногих ферментов, активируемых короткоцепочечными гомологами фосфатидилхолина, которые связываются с ферментом и активируют его в концентрациях ниже критической концентрации мицеллообразования. Эти данные тоже подтверждают, что в активацию липидом вовлечено только небольшое число центров связывания на белке.
4.2 Пируватоксидаза
Эта флавиносодержащая дегидрогеназа из Е. coli, катализирующая окисление пирувата до уксусной кислоты и СОг и восстановление убихинона в цитоплазматической мембране, обеспечивает поступление электронов в аэробную дыхательную цепь. Фермент обладает рядом замечательных особенностей. Он растворим в воде и не проявляет никаких характерных для мембранного белка свойств. Однако в присутствии субстрата и кофактора происходит изменение конформации белка, в результате чего формируется центр связывания с мембраной. В этих условиях резко возрастает сродство фермента к детергентам и фосфолипидным везикулам, и белок по своим свойствам становится похож на истинный мембранный фермент. Пируватоксидаза может служить примером фермента, который является цитоплазматическим, пока субстрата мало, но превращается в мембранный, как только концентрация субстрата становится достаточно высокой.
Наибольший интерес при исследовании этого фермента представляла его эффективная активация липидами. Активность фермента можно измерить, используя вместо природного мембраносвязанного акцептора - убихинона какой-либо растворимый в воде искусственный акцептор электронов, например феррицианид. В присутствии липидов каталитическая активность пируватоксидазы возрастает до 50 раз. В отличие от /3-гидроксибутиратдегидрогеназы этот фермент активируется самыми разнообразными фосфолипидами и детергентами. В концентрациях ниже критических концентраций мицеллообразования фермент полностью активируется как анионными, так и катионными детергентами, а исследование связывания детергентов показывает, что в активации участвует очень небольшое число центров связывания. Связывание фермента с фосфатидилхолиновыми везикулами или детергентами не происходит до тех пор, пока не добавлены субстрат и кофактор. В присутствии субстрата и кофактора пируватоксидаза способна связываться и активироваться разнообразными везикулами, полученными из целого ряда фосфолипидов. Связывание происходит в первую очередь за счет гидрофобных, а не электростатических взаимодействий. Связывание липида и активация в случае пируватоксидазы, по-видимому, неразделимы, хотя и не все везикулы связываемого фосфолипида или амфифильного соединения ответственны за активацию фермента. Активация липидами вызывает изменения в спектре поглощения связанного флавина, вероятно, вследствие облегчения реакции переноса электронов.
Конформационные изменения в молекуле пируватоксидазы приводят не только к образованию липидсвязывающего домена, но и к появлению чувствительного к протеазам участка цепи вблизи С-конца. Протеолиз подавляет связывание липидов, но, как это ни удивительно, вызывает активацию фермента в отношении реакции восстановления водорастворимых искусственных акцепторов электронов. Активированный протеазами фермент, однако, уже не может восстанавливать мембраносвязанный убихинон, поскольку утрачивает способность связываться с мембраной.
Как показывают результаты клонирования и секвенирования гена, кодирующего пируватоксидазу, аминокислотная последовательность белка не имеет протяженных гидрофобных участков. Генетические исследования, а также данные по протеолизу показали, что за связывание липида ответствен участок полипептида, локализованный вблизи С-конца. В этом участке имеется короткая потенциально амфифильная а-спираль, которая и может участвовать в связывании с поверхностью бислоя. Получен мутантный штамм Е. coli, у которого пируватоксидаза лишена последних 24 аминокислотных остатков. Такой фермент полностью неактивен in vivo, но in vitro успешно катализирует реакцию с водорастворимым акцептором электронов. Предположительно такой мутантный вариант пируватоксидазы не способен связываться с мембраной даже при высоких концентрациях субстратов, а значит, не может осуществлять катализ, поскольку для этого фермент должен окисляться убихиноном. Приведенное исследование является хорошим примером того, как данные по связыванию липида и активации, полученные in vitro, могут с успехом применяться для объяснения механизма функционирования фермента в клетке.
И пируватоксидаза, и /3-гидроксибутиратдегидрогеназа могут активироваться либо 1) при связывании с небольшим числом молекул амфифильного соединения, либо 2) при связывании с поверхностью бислоя. В последнем случае некоторая часть белка проникает в глубь мембраны. Оба рассмотренных примера четко иллюстрируют роль фосфолипидов как аллостерических регуляторов.
4.3 Са2 + - АТРАза
Если предыдущие два примера иллюстрируют роль липидов как аллостерических эффекторов мембранных белков, то Са2 + - АТРаза и еще два фермента, рассмотренные ниже, являются примерами ферментов, на активность которых влияют структура липида и физическое состояние бислоя. Выделенная из саркоплазматического ретикула скелетных мышц Са2+ - АТРаза состоит из единственной полипептидной цепи с мол. массой 115 кДа. Фермент осуществляет активный транспорт Са2+ внутрь саркоплазматического ретикулума, уменьшая тем самым концентрацию Са2 + в цитоплазме во время релаксации мышцы. На каждую гидролизованную молекулу АТР через мембрану переносятся два иона Са2 +, и реакция является электрогенной, т.е. перенос зарядов через бислой создает трансмембранный электрический потенциал. По результатам секвенирования соответствующего гена установлена аминокислотная последовательность белка. Предполагается, что полипептид имеет 10 трансмембранных спиральных участков.
В мембране саркоплазматического ретикулума фермент, по-видимому, образует димеры, но мономерная форма в мицеллах детергента сохраняет основные кинетические свойства. С помощью процедуры дезоксихолатного диализа очищенная Са2 + - АТРаза может быть успешно встроена в везикулы. В некоторых препаратах реконструированный фермент образует более крупные агрегаты, чем димеры, хотя физиологическое значение этого процесса неясно.
В ряде лабораторий изолированный фермент был полностью обезжирен и реконструирован с целым рядом липидов и липидных смесей. На Рис.6.3 представлена зависимость активности АТРазы от количества связанного с ферментом липида в отсутствие детергентов. Из приведенных данных видно, что для полной активации на одну молекулу АТРазы должно приходиться 30 молекул фосфолипида; этого количества, по оценкам, достаточно, чтобы образовать вокруг каждой молекулы белка фосфолипидный монослой. Столь прямолинейная интерпретация этих данных, по-видимому, неправомочна, поскольку нам неизвестно физическое состояние такой смеси.
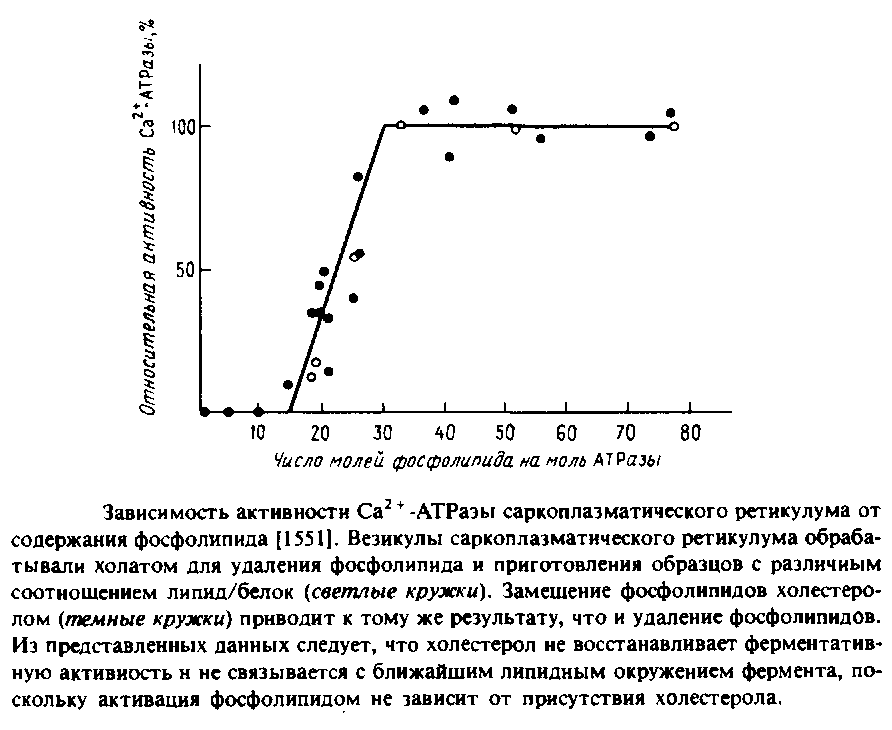
На основании результатов этой работы была предложена концепция пограничных, или аннулярных, липидов, т.е. липидов, непосредственно граничащих с белком. Критическим фактором, определяющим ферментативную активность, согласно этой концепции, должен быть липидный состав этого аннулярного слоя. Отсутствие влияния холестерола, включенного в фосфолипидно-белковые комплексы, предполагает, что холестерол не включается в аннулярный слой, однако соответствующие данные по связыванию холестерола показали, что это не так. Вообще говоря, на основании одних лишь кинетических данных понять механизм связывания липида довольно трудно.
В нескольких работах было достоверно доказано, что выше температуры фазового перехода липида отсутствует корреляция между вязкостью или параметром упорядоченности бислоя и ферментативной активностью. В регуляции ферментативной активности более важную роль, безусловно, играет структура самого липида, чем любой отдельно взятый параметр, отражающий физическое состояние бислоя. Но почему одни липиды активируют встроенные в везикулы ферменты лучше, чем другие, пока неизвестно.
4.4 Na+/K+ATPA3a
Этот фермент катализирует АТР-зависимый транспорт ионов Na+ и К+ через плазматическую мембрану животных клеток. На каждую молекулу гидролизованного АТР из клетки выводятся три иона Na + и поступают два иона К +. Фермент является электрогенным ионным насосом, генерирующим трансмембранный потенциал. Na +/К +-АТРаза выделена в чистом виде из нескольких источников. Она всегда состоит из двух суъединиц: большой каталитической субъединицы и малой, представляющей собой гликопротеин. Функция /3-субъ-единицы неясна. Полные аминокислотные последовательности обеих субъединиц известны для Na+/К+-АТРазы из почек овцы и из электрического органа ската Torpedo californica. Каталитическая субъединица гомологична Са + - АТРазе и также образует значительное число трансмембранных спиральных участков. /З-Субъединица, по-видимому, также пересекает мембрану; вероятно, трансмембранным является и единственный спиральный сегмент.
Функционирующей формой фермента, по-видимому, является либо гетеродимер а/3, либо тетрамер г; исследователи пока не пришли к единому мнению относительно минимальной единицы, необходимой для ионного транспорта. Очищенный фермент удается реконструировать с целым рядом фосфолипидов, но для восстановления активности наиболее эффективны фосфатидилсерин и фосфатидилглицерол. Причина этого неясна, но показано также, что фермент в бислое несколько лучше связывается с кислыми фосфолипидами. Липидное окружение влияет не только на каталитическую активность, но и на чувствительность фермента к специфическому ингибитору уабаину.
Для реконструкции Na+ /К + - АТРазы в первую очередь важна структура полярных головок фосфолипидов, но определенную роль, по-видимому, играет и вязкость бислоя. Об этом свидетельствуют результаты экспериментов по изменению с увеличением гидростатического давления вязкости липидов в содержащих фермент препаратах плазматической мембраны. Высокое давление стабилизирует систему в конфигурации с минимальным объемом. Поэтому с увеличением гидростатического давления свободный объем и вязкость бислоя уменьшаются. Как видно из рис, 6.4, между ферментативной активностью и вязкостью мембраны, измеряемой по степени анизотропии флуоресценции мембранных зондов, наблюдается четкая корреляция. Авторы полагают, что изменение свойств бислоя при повышении давления приводит к стабилизации определенных конформационных состояний фермента в ходе каталитического цикла, что влияет на лимитирующую стадию суммарной реакции.
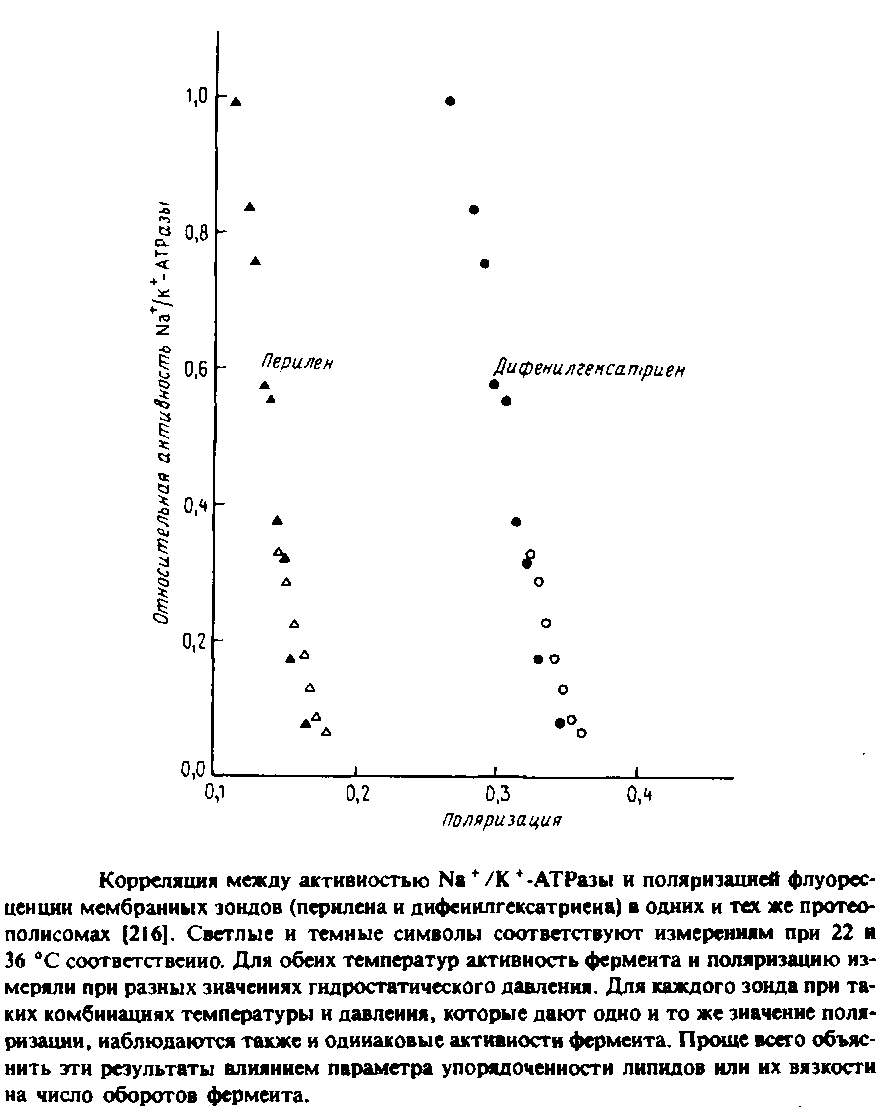
Нельзя, однако, исключить и иное объяснение: давление влияет на фермент прямо, а не опосредованно через липид. Впрочем, эти эксперименты важны уже тем, что показывают возможность изменения физического состояния мембраны под действием гидростатического давления.
4.5 Переносчик глюкозы
Поразителен, однако, тот факт, что на максимальную скорость работы этого переносчика вообще не влияет температурный фазовый переход липида из жидкокристаллического состояния в гель.
5. Мембраносвязанные электротранспортные цепи
В большинстве работ, посвященных мембранным ферментам, исследовались компоненты различных мембранных систем электронного транспорта. Эти системы выполняют весьма важные биохимические функции, а их компоненты содержат окрашенные простетические группы, что позволяет следить с помощью спектрофотометрического метода за кинетикой их редокс- или конформационных превращений как в нативной мембране, так и после выделения и очистки отдельных ферментов. Здесь мы рассмотрим четыре основные злектронтранспортные системы, схематически изображенные на рис. 5. Это:
1) участвующая в биосинтезе стероидов, содержащая цитохром Р450 система митохондрий коры надпочечников;
2) система микросомного окисления, включающая множество цитохромов Р450, а также цитохром bs 3) дыхательная цепь митохондрий;
4) фотосинтетическая система тилакоидов зеленых растений. Все четыре системы являются основными белковыми компонентами мембран, в которых они локализованы, и могут служить иллюстрацией различных уровней организации мультиферментных комплексов в мембранной энзимологии. Первые две системы катализируют анаболические и катаболические реакции, протекающие в присутствии молекулярного кислорода и обычно липофильных мембраносвязанных субстратов. Терминальные ферменты этих электронтранспортных цепей, цитохром Р450 и десатураза жирных кислот, характеризуются очень низким числом оборотов. Системы и являются основными электронтранспортными ансамблями энергетического обмена, первичная функция которых состоит в переносе протонов через мембрану. Генерируемый при этом градиент электрохимического потенциала протонов используется для синтеза АТР. В отличие от микросомной и митохондриальной систем цитохрома Р450, дыхательная и фотосинтетическая цепи катализируют трансмембранные реакции и характеризуются довольно высоким числом оборотов, 200-300 с " 1. В приведенном ниже кратком обзоре основное внимание обращается на частные вопросы, интересные с точки зрения энзимологии, отмечаются некоторые общие черты, а также представляющие особый интерес дискуссионные моменты.
При рассмотрении любой из этих систем, естественно, возникает вопрос: до какой степени могут взаимодействовать друг с другом различные мембраносвязанные компоненты этих электронтранспортных цепей, с тем чтобы образовались долгоживущие комплексы? Теоретическое рассмотрение вероятности ассоциации мембранных белков показывает, что наиболее важны следующие факторы:
1) высокая концентрация реакционноспособных белков из-за ограниченности мембранного пространства;
2) заранее заданная ориентация белков, поскольку они могут вращаться лишь в плоскости, параллельной плоскости мембраны; вращение перпендикулярно поверхности бислоя запрещено;
3) исключенный объем, связанный с наличием в мембране других белков, что приводит к еще большему концентрированию компонентов этих систем.
5.1. Система синтеза стероидов в митохондриях
Выделяемые надпочечниками стероидные гормоны, такие, как кортизон, синтезируются из холестерола в ходе реакций, катализируемых ферментами, которые локализованы в митохондриях и эндоплазматическом ретикулуме. При этом промежуточные продукты метаболического пути должны "курсировать" между данными органеллами. Реакции катализируются мембраносвязанными гемсодержащими белками - цитохромами Р450. Название этой большой группы ферментов связано с тем, что максимум их поглощения приходится на длину волны 450 нм. Эти ферменты являются оксидазами со смешанной функцией; в катализируемой ими реакции происходит расщепление молекулы кислорода, при этом один атом кислорода включается в состав молекулы воды, второй - в субстрат. В биосинтезе стероидов участвуют четыре цитохрома Р450. Два находятся в митохондриях, два - в эндоплазматическом ретикулуме ткани. Необходимые для реакции электроны поступают в систему через относительно простую электронтранспортную цепь.
В митохондриях коры надпочечников источником электронов для синтеза гормонов является NADPH, который восстанавливает флавопротеин и ферредоксин. Эти белки локализованы на матриксной стороне внутренней митохондриальной мембраны. Два цитохрома Р450, P450scc и Р450п#, являются интегральными мембранными ферментами, способными взаимодействовать с мембраносвязанными субстратами. Адренодоксин-редуктаза, возможно, частично погружена в бислой, но легко отделяется от мембраны. Адренодоксин - это низкомолекулярный рао" творимый белок, он переносит электроны от флавопротеи" на к цитохромам Р450. Взаимодействие адренодоксина с редуктазой и цитохромами Р450 осуществляется главным образом с помощью ионных взаимодействий. Вероятно, с обоими реакционными партнерами адренодоксин связывается с помощью одного и того же домена. Такой же способ передачи электронов между двумя мембранными ферментами при участии небольшого растворимого белка можно обнаружить и в дыхательной, и в фотосинтетической электронтранспортных системах. Связывание стероидных субстратов с цитохромами Р450 можно зарегистрировать по изменениям в спектре поглощения гема. Холе-стеролсвязывающий центр, по-видимому, экспонирован в гидрофобную область липидного бислоя. Показано также, что связывание холестерола более чем в 10 раз увеличивает сродство адренодоксина к цитохрому Р450.
Число оборотов адренодоксина гораздо выше, чем двух указанных ферментов, поэтому одна молекула восстановленного адренодоксина может обеспечить электронами несколько молекул цитохрома Р450. Указанная на Рис.6.5 стехиометрия компонентов при условии, что лимитирующим является функционирование цитохромов Р450, создает своеобразный эффект электронного каскада. Очевидно, что при таких обстоятельствах три компонента этой простой системы не смогут образовать единый суперкомплекс, да и вряд ли формирование такого комплекса способствовало бы эффективному переносу электронов по цепи.
5.2 Микросомные электронтранспортные цепи
Электронтранспортные цепи, локализованные на цитоплазматической поверхности эндоплазматического ретикулума, участвуют также в метаболических превращениях липофильных субстратов. Как видно из Рис.6.5, существуют две такие системы, но, как недавно выяснилось, они не являются независимыми. В одной системе NADH окисляется флавопротеином цитохром fts-редуктазой, которая в свою очередь через цитохромы восстанавливает стеарил-СоА-десатуразу. В микросомах печени десатураза является индуцибельным ферментом. Вторая система включает в себя окисление NADPH другим флавопротеином, цитохром Р450-редуктаз<цй, которая затем передает электроны на целое семейство цитохромов Р450. Одни из этих цитохромов также являются индуцибельными, другие - конститутивными. Отметим, что в обеих системах число терминальных ферментов значительно превышает число редуктаз в начале каждой цепи. Как и в Р450-содержащей системе митохондрий, число оборотов терминальных ферментов настолько мало, что небольшое число редуктаз вполне успевает обеспечить восстановительными эквивалентами все молекулы терминальных ферментов. Микросомная система не содержит каких-либо растворимых белковых компонентов, аналогичных адренодоксину; все ферменты представляют собой интегральные мембранные белки, их можно выделить из мембраны, очистить и исследовать в реконструированном виде.
В серии обстоятельных работ Штритматтер с коллегами четко показал, что цитохром />5-редуктаза и цитохром bs распределены в мембране случайным образом и взаимодействуют благодаря диффузии: эти два фермента диффундируют латерально по поверхности мембраны, а перенос электронов происходит только во время их случайных столкновений. Такой механизм реализуется как в реконструированных протеолипосомах, так и в микросомной мембране. Диффузия, однако, не является лимитирующим процессом. В норме в системе имеется десятикратный избыток цитохрома bs над редуктазой. Такой избыток связанного с мик-Росомной мембраной экзогенного цитохрома bs кинетически эквивалентен эндогенному пулу цитохромов bs. И цитохром bs, и цитохром 65-редуктаза являются двухдоменными белками, в которых глобулярный растворимый домен связывает простетическую группу, а единственный гидрофобный хвост заякоривает белок в мембране. Гемсвязывающий и флавинсвязывающий домены сконструированы таким образом, чтобы облегчить перенос электрона от флавина к гему при взаимодействии этих белков.
В более поздних исследованиях, однако, были получены серьезные указания на то, что часть цитохрома bs в микросомах не диффундирует свободно, а по крайней мере временно образует стехиометрические комплексы с цитохромами Р450 и, возможно, с NADPH-цитохром Р450-редуктазой. Таким образом, цитохром bs играет важную роль в работе электронтранспортной цепи, включающей по крайней мере некоторые изоформы цитохрома Р450 из микросом печени.
Различные цитохромы Р450 в микросомах печени окисляются целым рядом эндогенных липофильных субстратов, а также чужеродных молекул. Если исходить из первичной структуры изоформ цитохромов Р450, то эти белки должны иметь множество трансмембранных сегментов, однако экспериментальные исследования показывают, что, по-видимому, ферменты заякорены в микросомной мембране с помощью единственного трансмембранного спирального домена, расположенного ближе к N-концу полипептида. NADPH-цитохром Р450-редуктаза имеет близкую структуру с большим гидрофильным доменом, прикрепленным к мембране коротким гидрофобным хвостом. Чтобы объяснить, каким образом одна молекула редуктазы может "обслужить" столь большой избыток молекул Р450, предложено два механизма. В одном постулируется существование стабильного кластера, представляющего собой молекулу редуктазы в окружении молекул цитохромов Р450. Согласно второй модели, для переноса электронов необходимы свободная диффузия и столкновение ферментов. Получены некоторые данные о формировании в реконструированных фосфолипидных протеолипосомах эквимолярных комплексов цитохрома Р450 и его редуктазы. Если такие комплексы действительно существуют в микросомной мембране, то они, по-видимому, представляют собой временные образования, быстро распадающиеся и вновь образующиеся с участием других молекул Р450. Лишь в таком варианте единственная молекула редуктазы может восстановить много молекул цитохромов. Окончательную картину еще предстоит выяснить, но уже ясно, что компоненты микросомной цепи нельзя считать изолированными. Для успешного функционирования системы, вероятно, существенными могут оказаться какие-то сложные варианты белок-белковых взаимодействий.
5.3 Дыхательная система митохондрий
Внутренняя мембрана митохондрий является местом, где осуществляется окислительное фосфорилирование. Суть процесса состоит в сопряжении потока электронов, направленного от органических субстратов к кислороду, с перемещением протонов из матрикса митохондрий через мембрану в межмембранное пространство. Как и предыдущие две электронтранспортные цепи, компоненты этой системы тоже представлены не в эквимолярных количествах, т.е. дыхательная цепь не может функционировать как долгоживущий мультиферментный комплекс. Однако в данном случае число оборотов терминального фермента, цитохром с-оксидазы, весьма велико, а оценить, какая стадия является лимитирующей, в такой ситуации очень непросто. Цепь состоит из четырех трансмембранных мультисубъединичных комплексов, растворимого цитохрома с и убихинона-10. Перенос электронов через комплекс II не сопровождается переносом протонов. Однако реакции, катализируемые комплексом I, комплексом III и комплексом IV, сопровождаются векторным переносом протонов через мембрану. Эти реакции являются электрогенными и приводят к генерации трансмембранного электрического потенциала. Такие ферменты в составе цепи называются "местами сопряжения". Относительно механизмов перемещения протонов пока нет единого мнения, хотя в литературе обсуждаются конкретные модели, в частности для комплексов III и IV. Образующаяся трансмембранная разность электрохимических потенциалов протонов уменьшается за счет работы протонного канала АТР-синтазы. Энергия потока используется этим ферментом для синтеза АТР.
Концентрация компонентов дыхательных цепей в митохондриальной мембране довольно высока, однако существование эквимолярных комплексов между образующими эти цепи мультисубъединичными ферментами нельзя считать доказанным.
В литературе обсуждаются модели электронного транспорта с участием таких переходных долгоживущих белковых агрегатов, однако имеющиеся кинетические данные можно объяснить, не предполагая образование таких суперкомплексов. Цитохром с выполняет функцию челнока, быстро переносящего электроны между комплексами III и IV, аналогично адренодоксину в содержащей цитохром Р450 системе митохондрий. При физиологической ионной силе цитохром с может диффундировать не только вдоль поверхности бислоя, но и в объеме раствора, что увеличивает его способность к быстрому переносу электронов. Данная система обладает рядом особенностей, не характерных для описанных выше примеров электронтранспортных цепей.
Основные компоненты дыхательной цепи организованы в не-диссоциирующие комплексы. Например, комплекс III состоит из нескольких субъединиц и содержит три гема и один железосерный центр. Перенос электронов между простетическими группами внутри каждого из компонентов происходит быстро и не требует их случайных столкновений.
Жирорастворимые переносчики водорода служат для переноса восстановительных эквивалентов не только между ферментами, но и с одной стороны бислоя на другую. Показано, что убихинон обладает способностью к быстрой латеральной диффузии в плоскости мембраны, хотя вопрос о величине коэффициента диффузии не решен. В модельных системах убихинон также может переносить восстановительные эквиваленты через бислой. Убихинон при перемещениях не выходит из мембраны, однако в ходе редокспревращений он может захватывать или высвобождать протоны на границе раздела фаз липид-вода с любой стороны мембраны. Кинетические свойства изолированных ферментов, использующих убихинон в качестве субстрата, можно с успехом анализировать, используя уравнения Михаэлиса-Ментен с соответствующими значениями Км и Итах, если известна реальная концентрация хинона в бислое. Иное дело, если мы рассматриваем стационарную кинетику систем, в которых одна популяция ферментов сопряжена с другой посредством свободно диффундирующего пула хинонов как интермедиатов. Для описания подобных систем приходится применять специальные уравнения. Тот факт, что компоненты дыхательной цепи связаны через свободно диффундирующий пул хинонов, не вызывает сомнений, но в вопросе, является ли диффузия хинона лимитирующей стадией в работе электронтранспортной цепи, единого мнения среди исследователей нет.
Протоны, перенесенные через мембрану при работе дыхатель- ной цепи, возвращаются обратно с помощью АТР-синтазы, замыкая тем самым протонный цикл. Механизм, по которому протоны переносятся от компонентов электронтранспонтной цепи к АТР-синтазе, тоже до конца не установлен, и этот вопрос вряд ли будет разрешен в ближайшем будущем. Большинство исследователей считают, что протоны, переносимые через бислой, быстро приходят в равновесие со всей водной фазой. Согласно другой точке зрения, существует локализованный протонный поток и протоны переносятся либо вдоль поверхности бислоя, либо внутри бислоя, либо прямо на АТР-синтазу. Большинство данных в пользу этого механизма носят косвенный характер, но в литературе имеются свидетельства быстрого перемещения протонов вдоль поверхности фосфолипидного монослоя в нефизиологических условиях. Возможно, при некоторых обстоятельствах такой локализованный протонный поток имеет какое-то значение.
Таким образом, данная электронтранспортная система представляет собой совокупность небольшого числа высокоорганизованных комплексов, связанных между собой низкомолекулярными подвижными переносчиками, как липофильными, так и водорастворимыми. Кинетику переноса электронов можно объяснить в рамках модели свободно диффундирующих форм, которые могут перемещаться вдоль мембраны на расстояние более 100 А.
5.4. Фотосинтетическая электронтранспортная система тилакоидов
К фотосинтетической электронтранспортной системе можно также отнести светособирающие комплексы, поглощающие свет и передающие энергию электронного возбуждения на два реакционных центра. Захват энергии возбуждения реакционными центрами приводит к разделению зарядов и образованию на противоположных сторонах мембраны сильного окислителя и сильного восстановителя. Это в свою очередь Ведет к окислению воды до молекулярного кислорода фотосистемой II и создает движущую силу для транспорта электронов по цепи, сопряженного с трансмембранным переносом протонов. Образующийся на бислое градиент электрохимических потенциалов протонов используется для синтеза АТР с помощью АТР-синтазы, называемой сопрягающим фактором. Структура фотосистемы II, по-видимому, очень похожа на структуру бактериального фотореакционного центра, которая была детально изучена методом рентгеноструктурного анализа. &б/-Комплекс аналогичен комплексу III дыхательной цепи митохондрий, а сопрягающий фактор - митохондриальной АТР-синтазе. Роль пластоцианина очень напоминает роль цитохрома с в дыхательной цепи, являющегося растворимым переносчиком электронов, а пластохинон представляет собой полный аналог убихинона в электронтранспортной системе митохондрий.
В отличие от дыхательной цепи основные мембранные комплексы представлены в фотосинтетической системе примерно в эквимо-лярном соотношении. Однако какие-либо серьезные указания в литературе на формирование суперкомплексов отсутствуют. Напротив, для данной системы характерна поразительная латеральная гетерогенность, в результате которой фотосистема II оказывается локализованной в гранальных, плотно упакованных участках, а фотосистема I и сопрягающий фактор - в стромальных участках тилакоида. Пластохинон и комплекс, по-видимому, распределены между этими участками равномерно. Вследствие такого латерального разделения для сопряжения двух фотосистем необходима диффузия на расстояние по крайней мере 1000 А. Скорее всего основным переносчиком восстановительных эквивалентов на такие расстояния является пластохинон, хотя скорость его латериальной диффузии точно не известна. В оптимальных условиях лимитирующей стадией, вероятно, является окисление пластохинона Јб/-комплексом, однако связано ли это со скоростью его латеральной диффузии или с работой самого фермента - неясно.
Латеральное разделение компонентов цепи в тилакоидах явно не способствует ускорению переноса электронов между ферментами. Возможно, оно необходимо для эффективного перераспределения световой энергии между двумя фотосистемами. Фосфорилирование белка светособирающего комплекса II приводит к его перераспределению между гранальными и стромальными участками мембраны, облегчая его взаимодействие с фотосистемой I в стромальных участках, что в свою очередь увеличивает долю энергии возбуждения, поступающей на реакционные центры фотосистемы I.
5.5 Взаимодействия между мембранными и растворимыми ферментами
Биомембраны играют важную роль в функционировании целого ряда растворимых ферментов. После разрушения клетки многие ферменты можно обнаружить и в растворимой, и в мембранной фракциях. Отнесение некоего фермента к классу периферических мембранных белков зависит от силы его взаимодействия с мембраной и способа выделения. Кроме того, некоторые растворимые ферменты в специфических условиях связываются с мембраной, и, следовательно, в зависимости от физиологического состояния клетки локализуются либо на мембране, либо в цитозоле. Кроме того, существует группа растворимых ферментов, катализирующих реакции с участием мембраносвязанных субстратов. Для функционирования такие белки должны быть способны хотя бы временно связываться с мембраной.
Во всех этих случаях мембрана выполняет следующие функции:
1) определяет локализацию или компартментацию фермента или группы ферментов;
2) осуществляет аллостерическую активацию или инактивацию ферментов в определенных условиях или в определенной области в клетке;
3) создает среду, в которой липофильные субстраты могут быть превращены в соответствующие продукты.
6. Растворимые ферменты, которые при необходимости могут связываться с мембраной
Пока эта важная группа насчитывает небольшое число ферментов, но, по-видимому, в недалеком будущем их список увеличится. Наиболее характерный пример - протеинкиназа С, хотя и другие представители этой группы неплохо охарактеризованы.
6.1 Протеинкиназа С
Это ключевой фермент системы передачи сигнала, запускаемого быстрым расщеплением фосфатидилинозитолов в плазматической мембране. Такие внеклеточные вещества, как нейромедиаторы, гормоны или факторы роста, связываются со специфическими рецепторами на поверхности клетки. Это приводит к активации фосфолипазы С, которая начинает гидролизовать фосфатидилинозитолы с образованием вторых посредников. Один из продуктов гидролиза, инозитол-1,4,5-трифосфат, вызывает увеличение концентрации свободного кальция внутри клетки. Второй продукт, 5я-1,2-диацилглицерол, активирует протеинкиназу С, что в свою очередь приводит к фосфорилированию целого ряда белков-мишеней, многие из которых, например рецептор фактора роста эпидермиса, являются мембраносвязанными. Согласно современным представлениям, данная система участвует в осуществлении целого ряда клеточных функций, в частности в делении, дифференцировке и экзоцитозе.
До активации клетки какими-либо экзогенными агентами протеинкиназа С остается неактивной и обнаруживается только в цитозоле. Однако после стимуляции клетки фермент быстро активируется и оказывается в мембранных фракциях. Исследования in vitro показали, что для связывания с мембраной и активации необходимы кислые фосфолипиды, а также Са2 + и диацилглицерол. Специфичность к фосфолипиду, необходимому для активации, до некоторой степени зависит от природы субстрата. Для активации фосфотрансферазной активности фермента можно добавить прямо к клеткам проникающие через мембрану коротко цепочечные диацилглицеролы, например диоктаноилглицерол. Природные вторые посредники, длинноцепочечные диацилглицеролы, нерастворимы в воде и остаются в мембране. Аналогичное действие оказывают, по-видимому, промоторы опухолевого роста форболовые эфиры: как показано, они способны связываться с ферментом и вызывать те же изменения, что и эндогенный сигнал. После связывания форболовых эфиров или диацилглицеролов возрастает сродство фермента к Са2+ и фосфатидилсерину. Показано, что эффективным конкурентным ингибитором фермента является сфингозин.
На самом деле протеинкиназа С представлена несколькими разными, но близкими по структуре полипептидами с мол. массой - 80000. Например, из мозга кролика выделено три формы. Протеинкиназа С имеет двухдоменную структуру. Один домен содержит каталитические центры, связывающие АТР и белок-субстрат, и функционирует как сериновая и треониновая фосфотрансфераза. Второй домен, по-видимому, участвует в связывании фосфатидилсерина, диацилглицерола и Са2 +. С помощью мягкого протеолиза можно разделить два этих домена, получив полностью активный каталитический фрагмент с мол. массой - 50000. Таким образом, активировать фермент можно двумя взаимоисключающими способами: протеолизом и связыванием с мембраной. Таким же образом ведут себя и некоторые другие липидзависимые ферменты, например пируватоксидаза. Физиологическое значение протеолитической активации неясно.
Очищенный фермент был встроен в фосфолипидные везикулы и в смешанные везикулы, содержащие тритон Х-100 и фосфолипиды. В обоих случаях было показано, что само по себе связывание липида ферментом необходимо, но не достаточно для проявления ферментативной активности. Например, для связывания фермента с фосфолипидными везикулами достаточно 2 "Уо фосфатидилсерина, в то время как для оптимального фосфорилирования его необходимо уже 50. В норме содержание фосфати-дилсерина в плазматической мембране составляет 8-10%. Поскольку фермент активируется в смешанных мицеллах, содержащих примерно 20 мол. % фосфатидилсерина в тритоне Х-100, наличие бислойной структуры не является необходимым, что, вообще говоря, весьма типично для липидзависимых ферментов. Зависимость наблюдаемой активации от концентрации фосфатидилсерина свидетельствует о кооперативном характере взаимодействий фермента и липида, что также довольно обычно. По оценкам функционально активный фермент представляет собой комплекс, содержащий мономер фермента, одну молекулу диацилглицерола, один или более ионов Са2+ и по крайней мере четыре молекулы фосфатидилсерина. Связывание всегда происходит с поверхностью мембраны, но роль Са2+ неизвестна. Он может, например, хелатировать карбоксильные группы фосфатидилсерина и какие-то группы в белке и/или играть роль аллостерического регулятора при связывании белка. Тот факт, что фермент может быть помечен иодонафталин-1-азидом, служит указанием на некоторое проникновение белка в гидрофобную зону бислоя, но не более того.
6.2 Эффект поверхностного разведения в смешанных мицеллах
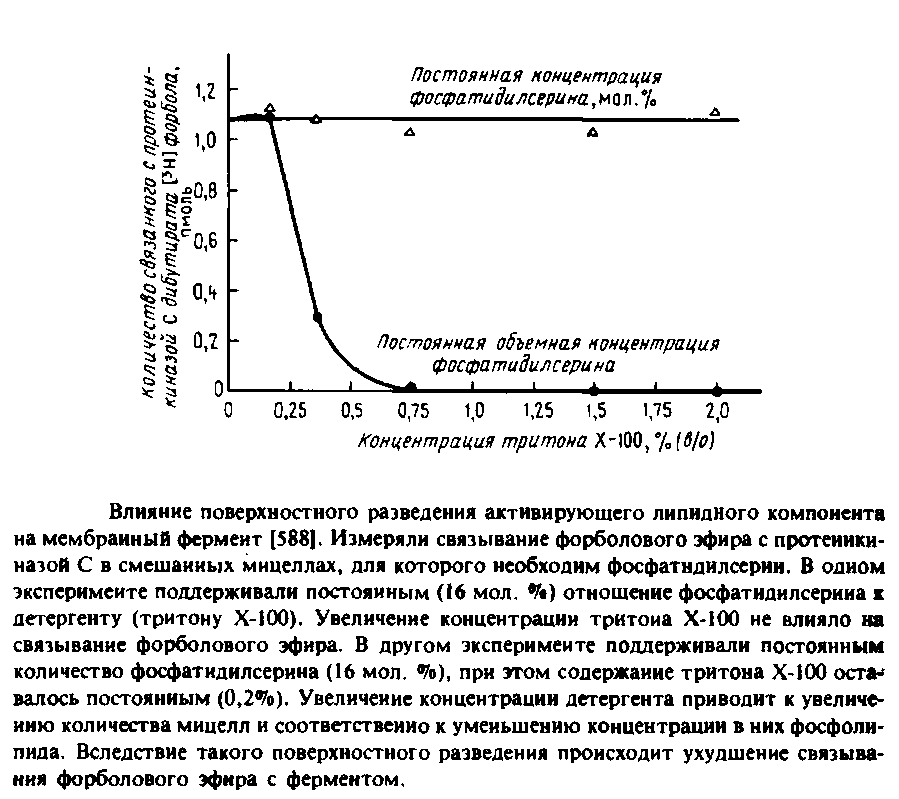
Рис. иллюстрирует интересную особенность протеинкиназы С и других мембранных ферментов, выявляемую при измерении их активности в системах со смешанными мицеллами. В этом эксперименте измеряли зависимость способности фермента связывать форболовый эфир от концентрации тритона Х-100. Если поддерживать постоянным содержание фосфатидилсерина в мольных процентах, а концентрацию тритона Х-100 увеличивать, то фермент будет связывать форболовый эфир даже при высокой концентрации детергента. Однако если поддерживать постоянной объемную концентрацию фосфолипида и увеличивать количество детергента, то фермент перестанет связывать форболовый эфир при высоких концентрациях тритона Х-100. Для активации фермента важна не объемная, а поверхностная концентрация липида, иными словами, число молекул липида на мицеллу. Если эта величина падает, то уменьшаются также способность фермента связываться с такими смешанными мицеллами и способность активироваться. Это явление называется явлением поверхностного разведения.
6.3 Другие примеры
Лимитирующей стадией
