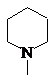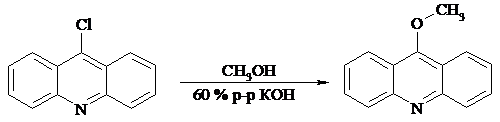Читайте данную работу прямо на сайте или скачайте
Синтез и противомикробная активность гидразонов акридона
Одесский национальный ниверситет им. И.И.Мечникова
Химический факультет
Кафедра фармхимии
Физико-химический институт им.А.В.Богатского
Национальной Академии Наук Украины
Отдел медицинской химии
СИНТЕЗ И ПРОТИВОМИКРОБНАЯ АКТИВНОСТЬ
ГИДРАЗОНОВ АКРИДОНА
Дипломная работа
студента VI курса заочного обучения
Одесса, 2007
РЕФЕРАТ
Квалификационная работа выполнена в Физико-химическом институте им. А.В.Богатского НАН Украины в отделе медицинской химии.
Работа посвящена синтезу гидразинсодержащих производных акридина и изучению их противомикробной активности. Квалификационная работа выполнена на 36 страницах печатного текста. Содержит 13 рисунков и 5 таблиц. Использовано 50 литературных источников.
Ресинтезировано 7 описанных ранее акридинилгидразонов N,N-диалкинлнглицина. Изучена их противомикробная активность и обнаружено, что все синтезированные соединения этого ряда значительно превосходят по активности Акридиновый оранжевый. Синтезировано два ранее неописаных акридинилгидразона N,N-диалкилгамма-аминомасляной кислоты, доказана их структура набором спектральных методов.
СОДЕРЖАНИЕ
TOC \o "1-2" Введение. 4
1.... Производные аминокридина: получение и противомикробная активность (обзор литературы) 5
1.1 Исходные акридинилирующие агенты и акридон. 5
1.2 Методы получения гидразинокридинов. 8
1.3 Антибактериальная активность производных акридина. 11
1.4 Биологическая активность гидразонов акридона. 12
2.... Обсуждение результатов. 14
2.1 Синтез исходных акридона, 9-хлоракридина и 9-метоксиакридина. 15
2.2 Синтез исходных гидразидов N,N-диалкилированого глицина. 17
2.3 Синтез исходных гидразидов N,N-диалкилированой ГАМК.. 18
2.4 Синтез гидразонов акридона. 20
2.5 Изучение противобактериальной активности гидразонов акридона. 24
3.... Экспериментальная часть. 27
3.1 Химическая экспериментальная часть. 27
3.2 Биологическая экспериментальная часть. 29
Выводы.. 30
Литература. 31
1.1 Исходные акридинилирующие агенты и акридон
Практичеcки вcе опиcанные в литературе акридинcодержащие интерканлянтонры получены конденcацией реакционноcпоcобных производных акридина, таких как 9-хлорнакридин и 9-метоксиакридин, c cоотнветcтнвующими соединениями, сондернжащими амино- или гидразиногруппу. Одним из вариантов получения исходных 9-хлор- и 9-метоксиакридина является метод, при котором сначала получают акридон.
аSTYLEREF 1 \s 1. SEQ
Соединение \* ARABIC \s 1 1
Рисунок
Синтез акридона окислением акридина
Рисунок
Синтез акридона окислением акридина
Опиcан метод получения 1.2 обработкой 1.1 надбензойной киcлотой c поcледующей изомеризацией образующегося N-окиcи акридина 1.4 в акридон кcуcным ангидридом [[2]]. Для получения акридонов, не cодержащих амино- и гидрокcильных групп (1.2, где R ¹ NH2, OH), раcпроcтраненной являетcя циклизация cоотнветнcтвующих N-фенилантраниловых киcлот 1.5 cерной киcлотой [[3]]. Для акридонов, содержащих амино- и оксигруппы добным cпоcобом полунченния являетcя изомеризация 3-фенилантранилов 1.3 в уcловиях киcлотного катализа [[4], [5]] или окиcление cоответcтвующих 2-аминобензофенонов 1.6 [[6]] (рис. 1.2)
|
|
|||||||||||
|
1.1 |
аSTYLEREF 1 \s 1. SEQ Соединение \* ARABIC \s 1 3 |
||||||||||
|
|
|||||||||||
|
1.2 |
|||||||||||
|
|
|||||||||||
|
Рисунок |
аSTYLEREF 1 \s 1. SEQ Рисунок \* ARABIC \s 1 2 |
Способы синтеза замещенных акридонов. |
|||||||||
1.1.2 9-Хлоракридин
В литературе [[7], [8]] описан способ получения 9-хлоракридина 1.7, в осннонве которого лежит циклизация N-фенилантраниловой кислоты 1.5 под действием 8-кратнного избытка хлорокиси фосфора при кипячении.
|
|
||||||
|
1.5 |
||||||
|
Рисунок |
STYLEREF 1 \s 1. SEQ Рисунок \* ARABIC \s 1 3 |
Синтез 9-хлоракридина |
||||
При этом, согласно литерантуре, выходы составляют 65 - 80 %. Ранее было показано [[9]], что меньншенние избытка хлорокиси фосфора из 8 до 1.5-кратного (от расчетного) с разбавнленнинем реакционной среды хлороформом снижает опасность проведения синтеза и трундонемкость стадии нейтрализации, но не меньшает количество образующихся в результате реакции смолистых примесей.
1.1.3 9-Метоксиакридин
9-Метоксиакридин 1.8 является добным реагентом при получении произнводнных 9-аминокридина в мягких словиях [[10]]. От 9-хлоракридина 1.7, применяемого в тех же целях, его выгодно отличают стабильность при хранении и отсутствие понбочных веществ кислого характера при акридинилировании оснований аминнонкомнпонентов. Основным методом получения 1.8 является обработка 1.7 метилатом натрия в кипящем метаноле (рис. 1.4). Выходы при этом составляют 85 - 90 % [[11]].
С другой стороны, было показано, что абсолютная среда не является обязательной для спешного проведения реакции. 9-Метоксиакридин образуется и в присутствии в качестве основания гидроксида натрия вместо метилата. В этом случае следует считаться с возможностью гидролиза как 9-хлоракридина, так и продукта реакции до акридона, однако скорость этого гидролиза, по-видимому, невелика. При ограниченном времени проведения реакции дается достичь выходов на ровне 65 - 70 %.

|
1.7 |
|
||||
|
Рисунок |
аSTYLEREF 1 \s 1. SEQ Рисунок \* ARABIC \s 1 4 |
Синтез 9-метоксиакридина в присутствии метилата натрия и |
||||
|
гидроксида натрия. |
||||||
аSTYLEREF 1 \s 1. SEQ
Рисунок \* ARABIC \s 1 5
Схема синтеза 9-гидразинокридинов
Схема синтеза 9-гидразинокридинов
9-хлоракридин явился первым производным акридина, использовавшимся для получения производных 9-гидразинокридина, при этом наилучшие результаты были достигнуты при проведении реакции в феноле [[12] Ц ,[13],[14],[15],[16],[17]].
Несмотря на обратимость реакции и, следовательно, целесообразность введения одного из реагентов в избытке (для смещения равновесия), в большинстве случаев синтезы ведут при соотношении реагентов близких к эквивалентному.
Количество фенола (с учетом его небольшой молекулярной массы) может быть небольшим. В большинстве случаев оно определяется растворимостью реагентов в феноле в выбранных экспериментальных словиях.
В большинстве случаев реакцию по молчанию проводят при 110 - 120 oC, одннако этот температурный диапазон не является строго обязательным. По-видинмому, реакция не менее спешно может протекать и при меньших температурах.
Так, при акридинилировании гидразидов аминокислот действием 2-метокси-6,9-дихлоракридина применялся следующий температурный режим: 40 мин при 100 oC и 150 мин. при 60 - 80 oC [[18]]. Одновременно, в работе [ NOTEREF _Ref167714278 \h а\* MERGEFORMAT 9] хорошие выходы были достигнуты при более мягких условиях для акридинилирования менее нуклеофильных аминокомпонентов. К сожалению, данные по рациональному выбору температурного диапазона реакции в доступной литературе нам обнаружить не далось.
Продолжительность синтеза, необходимая для достижения максимальных выннходов, варьируется в зависимости от нуклеофильности гидразинокомпонента и тенмнпенрантуры реакции в широких пределах. Так, при акридинилировании гидразинов дейнствием 9-хлоракридина, высокие выходы достигаются всего за 30 Ц 40 минут при 60 - 65 oC. Для достаточно полного акридинилирования 4-нитронилина требуется нагревание при 120 oC в течение 6 часов.
Считается [[19]], что реакция акридинилирования идет в словиях общего кислотного катализа. Именно этим соображением и обуславливают выбор фенола в качестве растворителя. С другой стороны, показано, что при реакции 9-хлоракридина с избытком первичного амина в отсутствии растворителя (т.е в среде, которую следует считать основной) продукты образуются в мягких словиях, быстро и с хорошими выходами [9]. Таким образом целесообразность кислотного катализа и использования фенола в качестве растворителя весьма сомнительна.
Основной проблемой при выделении продуктов акридинилирования является отделение остатков фенола и продуктов его окисления и, с другой стороны, отденление побочного продукта - акридона. Если от основной массы фенола дается изнбавиться отмыванием продукта раствором щелочи (при выделении продукта акнридинилирования в виде основания) или диэтиловым эфиром (при выделении в винде гидрохлорида), то даление остаточных количеств 1.2 представляет значитенльную проблему. Так, после двух последовательных операций (осаждение основания из водного раствора 1 M раствором NaOH, фильтрование и промывка основания на фильтре водой, перевод полученного основания в гидрохлорид) в продукте все еще оставался фенол на ровне 0.01 - 0.05 % [9].
Удаление акридона является еще более сложной задачей из-за крайне низкой растворимости акридона в большинстве органических растворителей. Так, во всех образцах гидразинокридинов, полученных из 9-хлоракридина и оснований гидразинов методом полуколичественной ТСХ в присутсвии свидетеля обнаружен акридон на ровне не менее 0.01 %. В отдельных образцах (как правило - акридиниламинокислотах) содержание неудаляемого акридона достигает 1 % [9].
Основными недостатками 9-хлоракридина является его низкая стабильность при хранении, раздражющие свойства и чрезвычайно высокая чувствительность к влаге в словиях синтеза.
Так, при хранении 9-хлоракридина в течение 1 месяца при комнатной температуре он подвергается трансформации на 10 - 15 %, причем акридон составляет не более 7 - 8 %. Через 1 год хранения при - 18 oC в герметично закрытрой таре 9-хлоракридин в образце не обнаруживается.
При попадании на слизистые (твердое вещество или пары) 9-хлоракридин вызывает сильное чувство жжения, при попадании значительных количеств на незащищенную кожу (особенно в виде раствора в органических растворителях) может вызвать изъязвление. Во всех случаях наблюдается стойкая пигментация покровов. Легко проникает через резиновые перчатки. При работе с ним следует применять специфические меры предосторожности.
При акридинилировании гидразинов действием 9-хлоракридина чрезвычайно важное значение имеет отсутствие влаги в растворителях, поскольку 9-хлоракридин с легкостью подвергается гидролизу и алкоголизу (рис.1.6), катализируемым сильными кислотами, причем реакция является автокаталитической, т.к в результате нее кроме акридона образуется HCl.
|
|
||||||
|
1.7 |
1.2 |
|||||
|
Рисунок |
аSTYLEREF 1 \s 1. SEQ Рисунок \* ARABIC \s 1 6 |
Гидролиз и алкоголиз 9-хлоракридина |
||||
Работ, в которых 9-метоксиакридин использовали для синтеза производных 9-амино- и 9-гидразинокридина, крайне мало. Так, на более чем 200 работ, в которых для получения 9-аминокридина использован 9-хлоракридин, приходится всего 12 работ, в которых использован 9-метоксиакридин. Для получения производных 9-гидразинокридина возможность применения 9-метоксиакридина впервые показана в работах сотрудников Физико-химического института им. А.В. Богатского НАН Украины. Этот реагент был применен нами для акридинилирования аминокислот и их эфиров [[20]], акридиниламиноспиртов [[21]], анилинов [[22]], гидразинов [[23]] и гидразидов феноксикарбоновых [[24]] и аминокислот [[25]]. Не рассматривая подробно эти работы отметим лишь основные результаты.
9-Метоксиакридин является эффективным акридинилирующим агентом и позволяет получать производные 9-амино- и 9-гидразинокридина с высокими выходами и в мягких словиях (кипячение в метаноле).
Скорость реакции в значительной степени зависит от нуклеофильности аминокомпонента и составляет от нескольких секунд (для акридинилирования производных арилгидразинов и семикарбазида) до 8 часов (для анилинов). Для нерастворимых в метаноле аминоксилот и дигидразидов двухосновных кислот продолжительность приходится величивать до 12 Ц 24 часов, соответственно.
При акридинилировании гидрохлоридов аминов категорически необходимо применение абсолютных растворителей и строго контролировать содержание влаги и избыточной HCl в гидрохлоридах аминокомпонентов в связи с чрезвычайно высокой склонностью 9-метоксиакридина к образованию акридона (при наличии в реакционной среде влаги и/или кислоты).
аSTYLEREF 1 \s 1. SEQ Соединение \*
ARABIC \s 1 9
аSTYLEREF 1 \s 1. SEQ Соединение \*
ARABIC \s 1 10
аSTYLEREF 1 \s 1. SEQ Соединение \* ARABIC \s 1 10
В серии работ [[30] -, [31], [32], [33]] показана активность ряда нитропроизводных 9-аминнокридина 1.10, зависящая в большей степени от характера и положения занмеснтителей R и R', чем от положения нитрогруппы.
Бис-акридины при слабом мутагенном эффекте (< 1 % относинтельно 9-аминокридина или 38.5 мут.кол./мкМ/чашку) являются сильными ингинбинторами роста Salmonella typhimurium (0.17 - 1.84 мкМ / чашку - 50 %) [[34]].
Однозначная корреляция противомикробной активности с интеркалирующей способностью и способностью ингибировать транскрипцию была показана для серии производных акридинона [[35]]. Кроме того, показано [[36]] сильное потенциирование малонактивными (при индивидуальном применении) акридинами действия сульфаниламидных препаратов.
И, наконец, вышедший в 2001 г подробный обзор по антибактериальной активности производных акридина [[37]] показывает, что эти объекты не теряют своей актуальности и работа в этом направлении продолжается.
[38]].
10-[2-(Диэтиламино)этил]-акридин-9-он-(тиазолидин)гидразон 1.11 проянвинл выраженную активность (p.o) относительно Shistosoma mansoni, причем трехнкратнное применение препарата в дозе 20 мг/кг через 12 недель после инфицинронванния мышей приводило к полному исчезновению всех форм паразита в органнизнме животных [[39]].
|
|
|
|
аSTYLEREF 1 \s 1. SEQ Соединение \* ARABIC \s 1 11 |
налогичные результаты были получены на обезьянах [[40], [41]] и при раем применении препарата, - в течение 24 ч после инфицирования (100 мг/кг) и через 7 суток после инфицирования (25 мг/кг) [[42]]. При этом препарат, как и ряд его аналогов оказался малотоксичным [[43]]. Активность препарата обусловлена изнбинрательным ингибированием экспрессии генов паразита [[44]]. В серии ананлонгов 1.11 по крайней мере 4 вещества проявили высокую шистосомоцидную акнтивнность, ингибируя развития паразита у инфицированных обезьян даже в коннценнтрациях 12.5 мг/кг; побочные эффекты при этом практически отсутствовали [[45]].
Фунгицидная активность производных акридина бедительно проденмонстнринронвана серией работ индийских исследователей [12 - 17], причем наибольшую активность проявили гидразинсодержащие производные 1.12.
|
|
|
||
|
аSTYLEREF 1 \s 1. SEQ Соединение \* ARABIC \s 1 13 |
аSTYLEREF 1 \s 1. SEQ Соединение \* ARABIC \s 1 14 |
||
Бис-аналоги 1.13 проявили высокую противовирусную активность в экспериментах куринных эмнбриноннах отннонсительно вируса гриппа А2/Гонконг [24], соединения 1.14 оказались высокоэффективными индукторами интерферона [[46]].
Для ранее синтензированных соединений общей формулы 1.14 нами [[47]] было становлено существование таутомерного равновесия и показано, что соединения 1.14 в виде оснований предпочтительно находятся в Уакридоновой форме 1.1Б.
|
|
|||||
|
1.14 |
|
1.14 |
Б |
Было обнаружено, что соединения аREF _Ref167716185 \h 1.14 являются интеркаляторами ДНК средней силы и эффективно ингибируют матричные функции ДНК в словиях ПЦР [25], являются эффективными противовирусными [[48]] и интерферониндуцирующими агентами [46]. В связи с этим, в рамках рабочей гипотезы о потенциальной активнности интеркаляторов относительно любых объектов - носителей доступной ДНК, было выдвинуто предположение о наличии у соединений 2.1 - аREF _Ref167872078 \h 2.9 противонбактенриальной активности.
|
|
||||
|
2.1 - аREF _Ref167872078 \h 2.9 |
где NR2 =
|
|
|
|
|
|
|
|
|
|
= 1 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 1 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 2 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 3 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 4 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 5 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 6 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 7 |
|
= 3 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 8 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 9 |
Для проверки этого предположения необходимо было ресинтезировать ранее описанные соединения 2.1 - 2.7, отработать методику получения и синтезировать неописанные ранее производные аREF _Ref167872164 \h 2.8 и аREF _Ref167872078 \h 2.9 и изучить их противонбактеринальную активность.
аSTYLEREF 1 \s 2. SEQ
Рисунок \* ARABIC \s 1 1
Синтез 9-хлоракридина
Синтез 9-хлоракридина
9-Хлоракридин получают на второй стадии (дезоксихлорировании), которую проводят твердофазным методом - спеканием тонкорастертой смеси 1.2 с расчетным количеством пентахлорида фосфора при 120 oC в течение 1 часа. Полунчеый после охлаждения твердый конгломерат растирают в тонкий порошок в шанровой мельнице, который затем с помощью механической мешалки перенмешинванют с концентрированным раствором аммиака. Последующие фильтрование, пронмывнка, высушивание и экстракция сухого остатка хлороформом приводят к 9-хлорнакридину 1.7 с выходом 65 - 70 %. Сухой остаток после экстракции чентынрехнхлонриснтым углеродом представляет собой чистый акридон (получается с выходом 25 - 32 %), который может быть повторно использован. Таким образом, общий вынход 9-хлорнакнриндина в расчете на N-фенилантраниловую кислоту составляет 85 - 92 %.
На следующей стадии получения 9-метоксиакридина 1.8, несмотря на хорошие выходы (85 - 90 %) описанного в литературе метода и добство пронведения синтеза, этот метод требует на поднготонвинтельнных стадиях получение абсолютного метанола и использование металнлинчеснконго натрия (пожаро-взрынвонопасность).
Нами был модифицирован метод получения 1.8 и показана вознможность использования в качестве основания 60 %-го раствора гидроксида канлия (или натрия) в коммерчески доступном метаноле (содержание влаги до 2 %).
Синтез 1.8 проводится (рис. 2.2) кипячением 1.7 в смеси 60 %-го водного раствора гидроксида калия и метанола в течение 8 ч. Избынток метанола даляют, реакционную массу разлагают водой, фильтруют с послендующей промывкой осадка водой, высушивают и перекристаллизовывают сырой продукт из петролейного эфира. В качестве побочного продукта с выхонданми 10 - 15 % образуется акридон 1.2, который может быть повторно испольнзонван для получения 9-хлоракридина. Таким образом при незначительном снижении выхондов (75 - 80 %) достигается снижение стоимости и повышение безопасности.
|
|
||||
|
1.7 |
1.8 |
|||
|
Рисунок |
аSTYLEREF 1 \s 2. SEQ Рисунок \* ARABIC \s 1 2 |
Синтез 9-метоксиакридина. |
||
действием гидранзиннгиднранта в меннтанноле приводила к гидразидам а2.17 - 2.23 с хорошими выходами (рис. 2.3).
|
|
|||
|
2.10 - 2.16 |
2.17 - 2.23 |
где NR2 =
|
|
|
|
|
|
|
|
|
||
|
эфиры |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 10 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 11 |
STYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 12 |
STYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 13 |
STYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 14 |
STYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 15 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 16 |
|
|
|
гидразиды |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 17 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 18 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 19 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 20 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 21 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 22 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 23 |
|
|
|
Рисунок |
аSTYLEREF 1 \s 2. SEQ Рисунок \* ARABIC \s 1 3 |
Синтез гидразидов N,N-диалкилированного глицина |
||||||||
Чистоту соединений 2.17 - 2.23 контролировали методом ТСХ на пластинках Silufol UV-254; строение - данными ИК-спекнтнроскопии и масс-спекнтрометрии.
|
Таблица |
STYLEREF 1 \s 2. SEQ Таблица \* ARABIC \s 1 1 |
|||||||||||||||
|
Физико-химические параметры исходных гидразидов N,N-диалкилированого глицина |
||||||||||||||||
|
Соеди- нение |
Мол. масса |
Брутто- формула |
Выход, % |
Т.пл., |
[М]+ |
Rf 2 |
|||||||||
|
Т.кип., Р (мм.рт.ст.) |
|||||||||||||||
|
2.17 |
145.21 |
С6H15N3O |
90 |
Ц 1 |
145 |
0.46 |
|||||||||
|
2.18 |
157.22 |
C7H15N3O |
81 |
98 Ц 99 |
157 |
0.30 |
|||||||||
|
2.19 |
159.19 |
C6H13N3O2 |
88 |
107 |
159 |
0.38 |
|||||||||
|
2.20 |
143.19 |
C6H13N3O |
52 |
Ц 1 |
143 |
0.24 |
|||||||||
|
2.21 |
171.24 |
C8H17N3O |
70 |
95 - 96 |
171 |
0.41 |
|
|||||||||
|
2.22 |
171.24 |
C8H17N3O |
75 |
72 - 73 |
171 |
0.43 |
|
|||||||||
|
2.23 |
172.23 |
C7H16N4O |
84 |
90 - 91 |
172 |
0.12 |
|
|||||||||
Примечания: 1 - некристаллизующееся маслообразное вещество; 2 - элюирующая система - хлороформ : метанол (10:1)
В масс-спектрах гидразидов 2.17 - 2.23 имеются пики монленкулярных ионов низнкой интенсивности. Наиболее характерным расщеплением монленкулярного ионна явнляется разрыв b-связи аминоцильного остатка и связи NЦN гиднранзина.
В ИК-спектрах гидразидов 2.17 - 2.23 по сравнению со спектрами эфиров отсутствует полоса при 1730 - 1735 см-1 (карбонильная группа сложного эфира), но появлянетнся полоса при 1650 см-1 (карбонильная группа гидразида). В области 3200 - 3450 см-1 (с максимумом при 3350 - 3370 см-1) появляется интенсивная широкая полоса с плечами, соответствующая валентным колебаниям связей NЦH различной степени и вида ассоциации.
аSTYLEREF 1 \s 2. SEQ Соединение \*
ARABIC \s 1 24

|
|||||||||
|
Рисунок |
аSTYLEREF 1 \s 2. SEQ Рисунок \* ARABIC \s 1 4 |
Ц Схема синтеза диэтиламинобутаноилгидразина |
|||||||
|
|
|
||||||||
|
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 30 |
|
||||||||
налогично, исходя из метилового эфира 4-пиперидинобутановой кислоты аREF _Ref167871065 \h 2.31а был получен соответствующий гидразид аREF _Ref167871073 \h 2.32.

|
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 31 |
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 32 |
|
||||||
|
Рисунок |
STYLEREF 1 \s 2. SEQ Рисунок \* ARABIC \s 1 5 |
Ц Схема синтеза пиперидинбутаноилгидразина |
|||||||
|
Таблица |
STYLEREF 1 \s 2. SEQ Таблица \* ARABIC \s 1 2 |
||||||
|
Физико-химические параметры исходных гидразидов N,N-диалкилированой ГАМК |
|||||||
Соеди- нение |
Мол. масса |
Брутто- формула |
Выход,% |
Т.пл., |
[М]+ |
Rf 2 |
|
|
REF _Ref167870816 \h 2.28 |
173.26 |
С9H19NO2 |
94 |
Ц1 |
173 |
0.54 |
|
|
REF _Ref167870817 \h 2.29 |
173.26 |
С8H19N3O2 |
85 |
62 Ц 63 |
173 |
0.22 |
|
|
REF _Ref167871065 \h 2.31 |
185.27 |
С10H19NO2 |
71 |
Ц1 |
185 |
0.58 |
|
|
REF _Ref167871073 \h 2.32 |
185.27 |
С9H19N3O |
77 |
68 - 69 |
185 |
0.21 |
|
Примечания: 1 - некристаллизующееся маслообразное вещество; 2 - элюирующая система - хлороформ : метанол (10:1)
аSTYLEREF 1 \s 2. SEQ
Рисунок \* ARABIC \s 1 6
Синтез
гидразонов акридона
Синтез гидразонов акридона
Чистоту всех синтезированных соединений контролировали методом ТСХ на пластинках Silufol UV-254; строение - данными ПМР и ИК-спекнтнроскопии и масс-спекнтрометрии.
В ИК спектрах акридинилированных продуктов 2.1 - аREF _Ref167872078 \h 2.9 в области 3200 Ц 3450 см-1 наблюдаются две полосы - зкая интенсивная полоса при 3410 - 3420 см-1 и широкая сложная полоса с несколькими Уплечами при 3150 - 3300 см-1. Кроме того, в спектре наблюдаются полосы при 1460 - 1465 см-1, 1540 - 1 см-1, 1585 Ц 1590 см-1, 1600 - 1610 см-1, характерные для колебаний ароматических и гетеронаронмантических систем. Волновое число полосы, соответствующей валентным конленбаниям карбонильной групнпы (1655 - 1675 см-1), изменяется симбатно электнронотнрицательности концевого аминна.
|
Таблица |
STYLEREF 1 \s 2. SEQ Таблица \* ARABIC \s 1 3 |
||||||||||||||
|
Физико-химические параметры гидразонов акридона |
|||||||||||||||
|
Соеди- нение |
Мол. масса |
Брутто- формула |
Выход, % |
Т.пл., |
[М]+ |
Rf1 |
||||||||
|
2.1 |
322.41 |
C19H22N4O |
75 |
187 |
322 |
0.52 |
|||||||||
|
2.2 |
334.42 |
C20H22N4O |
83 |
241 - 242 |
334 |
0.47 |
|||||||||
|
2.3 |
336.40 |
C19H20N4O2 |
85 |
253 |
336 |
0.45 |
|||||||||
|
2.4 |
320.40 |
C19H20N4O |
53 |
131 |
320 |
0.45 |
|||||||||
|
2.5 |
348.45 |
C21H24N4O |
75 |
246 - 247 |
348 |
0.51 |
|||||||||
|
2.6 |
348.45 |
C21H24N4O |
70 |
214 |
348 |
0.54 |
|||||||||
|
2.7 |
349.44 |
C20H23N5O |
64 |
249 - 250 |
349 |
0.18 |
|||||||||
|
REF _Ref167872164 \h 2.8 |
350.47 |
C21H26N4O |
30 |
126 - 127 |
350 |
0.42 |
|||||||||
|
REF _Ref167872078 \h 2.9 |
362.48 |
C22H26N4O |
41 |
108 - 110 |
362 |
0.44 |
|||||||||
Примечания: 1 - элюирующая система - бензол : триэтиламин : метанол (10:1:1).
В спектрах 1H-ЯМР конечных продуктов 2.1 - аREF _Ref167872078 \h 2.9 наблюдаются резоннанснные сигнналы протонов Уароматической Ф и алифатической частей молекунлы, соотнноншенние интегральных интенсивностей которых соответствует расчетнному. Существенно, что в спектрах в области 7.0 - 8.3 набнлюдается двоенный набор сигналов половинной от расчетной интенсивности кажндый, что свидентельствует в пользу существования двух таутомерных форм, нанходящихся в соотнноншении 1 : 1.
|
Таблица |
аSTYLEREF 1 \s 2. SEQ Таблица \* ARABIC \s 1 4 |
||||||
|
Описание ПМР-спектров гидразонов акридона |
|||||||
№ |
Характеристики спектра: мультиплетность, хим. сдвиг (м. д.), интенсивность, тип протонов |
||||||
|
1 |
2 |
||||||
|
REF _Ref167616347 \h 2.1 |
лифатические: т. 1.032 м.д., (Н, J = 7.2 Гц, (СН3СН2)2N); кв. 2.609 м.д., а(Н, J = 7.2 Гц, (СН3СН2)2N); с. 3.246 м.д., (Н, СОСН2N). роматические: м. 7.051 м.д., (Н); м. 7.124 м.д., (Н); м. 7.212 м.д., (Н); м. 7.365 м.д., (Н); м. 7.521 м.д., (Н); м. 8.177 м.д., (Н). Обменивающиеся: ш.с. 10.557 м.д., (Н); о.ш.с. 11.069 м.д., (Н). |
||||||
|
REF _Ref167617970 \h 2.2 |
лифатические: м. 1.460 м.д., (Н, J = 5.4 Гц, СН2(СН2СН2)2N); м. 1.580 Ц1.670 м.д., (Н, J = 5.4 Гц, СН2(СН2СН2)2N); т. 2.582 м.д., (Н, J = 5.4 Гц, СН2(СН2СН2)2N); с. 3.177 м.д., (Н, СОСН2N). роматические: м. 7.081 м.д., (Н); м. 7.197 м.д., (Н); м. 7.248 м.д., (Н); м. 7.411 м.д., (Н); м. 7.552 м.д., (Н); м. 8.204 м.д., (Н). Обменивающиеся: ш. с. 10.600 м.д., (Н); о. ш. с. 11.066 м.д., (Н). |
||||||
|
REF _Ref167617971 \h 2.3 |
лифатические: т. 2.644 м.д., (Н, J = 7.2 Гц, O(СН2СН2)2N); т. 3.710 м.д., (Н, J = 7.2 Гц, O(СН2СН2)2N); с. 3.231 м.д., (Н, СОСН2N). роматические: м. 7.086 - 7.137 м.д., (Н); м. 7.163 - 7.261 м.д., (Н); м. 7.374 - 7.464 м.д., (Н); м. 7.535 - 7.605 м.д., (Н); м. 8.180 - 8.250 м.д., (Н). Обменивающиеся: ш. с. 10.568 м.д., (Н); о. ш. с. 10.975 м.д., (Н). |
||||||
|
REF _Ref167617959 \h 2.4 |
лифатические: н/р т. 1.809 м.д., (Н, (СН2СН2)2N); н/р т. 2.700 м.д., (Н, (СН2СН2)2N); с. 3.350 м.д., (Н, СОСН2N). роматические: м. 7.035 Ц 7.128 м.д., (Н); м. 7.208 - 7.235 м.д., (Н); м. 7.369 - 7.395 м.д., (Н); м. 7.486 - 7.536 м.д., (Н); м. 8.112 - 8.210 м.д., (Н). Обменивающиеся: ш. с. 10.523 м.д., (Н); о. ш. с. 11.018 м.д., (Н). |
||||||
|
REF _Ref167617972 \h 2.5 |
лифатические: д. 0.918 м.д., (Н, J = 6.6 Гц, CH3CH(СН2СН2)2N); м. 1.300 - 1.420 м.д., (Н, CH3CH(СН2СН2)2N); набор мультиплетов 1.165 - 1.295 м.д., (Н) + 1.613 - 1.655 м.д., (Н) + 2.168 - 2.242 м.д., (Н) + 2.752 - 2.861 м.д., (Н) = (CH3CH(СН2СН2)2N); с. 3.153 м.д., (Н, СОСН2N). роматические: м. 7.030 - 7.081 м.д., (Н); м. 7.101 - 7.151 м.д., (Н); м. 7.198 - 7.242 м.д., (Н); м. 7.378 - 7.402 м.д., (Н); м. 7.501 - 7.552 м.д., (Н); м. 8.148 - 8.206 м.д., (Н). Обменивающиеся: ш. с. 10.408 м.д., (Н); о. ш. с. 11.018 м.д., (Н). |
||||||
|
REF _Ref167785020 \h 2.6 |
лифатические: набор мультиплетов 1.537 - 1.721 м.д., (Н) + 2.749 Ц2.784 м.д., (Н) + м. 3.315 - 3.340 м.д., (Н) = (СН2СН2СН2)2N); с. 3.354 м.д., (Н, СОСН2N). роматические: м. 7.075 - 7.126 м.д., (Н); м. 7.154 - 7.205 м.д., (Н); м. 7.229 - 7.255 м.д., (Н); м. 7.402 - 7.451 м.д., (Н); м. 7.532 - 7.583 м.д., (Н); м. 8.209 - 8.260 м.д., (Н). Обменивающиеся: ш. с. 10.507 м.д., (Н); о. ш. с. 11.051 м.д., (Н). |
||||||
Продолжение таблицы аREF _Ref167801044 \h 2.4
|
1 |
2 |
|
REF _Ref167616616 \h 2.7 |
лифатические: с. 2.240 м.д., (Н, CH3N(СН2СН2)2N); н/р м. 2.280 - 2.500 м.д., (Н, CH3N(СН2СН2)2N); н/р м. 2.578 - 2.711 м.д., (Н, CH3N(СН2СН2)2N); с. 3.207 м.д., (Н, СОСН2N). роматические: м. 7.063 Ц 7.114 м.д., (Н); м. 7.175 - 7.241 м.д., (Н); м. 7.391 - 7.445 м.д., (Н); м. 7.547 - 7.598 м.д., (Н); м. 8.167 - 8.206 м.д., (Н). Обменивающиеся: ш. с. 10.548 м.д., (Н); ш. с. 10.981 м.д., (Н). |
|
REF _Ref167872164 \h 2.8 |
лифатические: т. 1.034 м.д., (Н, J = 7.2 Гц, (СН3СН2)2N); кв. 2.611 м.д., (Н, J = 7.2 Гц, (СН3СН2)2N); т. 3.246 м.д., (Н, СОСН2СН2СН2N), м. 3.335 м.д. ((Н, СОСН2СН2СН2N); м. 3.998 м.д. (Н, СОСН2СН2СН2N). роматические: м. 7.056 м.д., (Н); м. 7.129 м.д., (Н); м. 7.221 м.д., (Н); м. 7.371 м.д., (Н); м. 7.528 м.д., (Н); м. 8.179 м.д., (Н). Обменивающиеся: ш.с. 10.56 м.д., (Н); о.ш.с. 11.10 м.д., (Н). |
|
REF _Ref167872078 \h 2.9 |
лифатические: м. 1.460 м.д., (Н, J = 5.4 Гц, СН2(СН2СН2)2N); м. 1.580 Ц1.670 м.д., (Н, J = 5.4 Гц, СН2(СН2СН2)2N); т. 2.582 м.д., (Н, J = 5.4 Гц, СН2(СН2СН2)2N); т. 3.254 м.д., (Н, СОСН2СН2СН2N), м. 3.332 м.д. ((Н, СОСН2СН2СН2N); м. 4.025 м.д. (Н, СОСН2СН2СН2N). роматические: м. 7.088 м.д., (Н); м. 7.191 м.д., (Н); м. 7.254 м.д., (Н); м. 7.412 м.д., (Н); м. 7.552 м.д., (Н); м. 8.210 м.д., (Н). Обменивающиеся: ш. с. 10.64 м.д., (Н); о. ш. с. 11.07 м.д., (Н). |
В масс-спектрах 2.1 - аREF _Ref167872078 \h 2.9 имеются пики молекулярных ионов низнкой иннтенсивности. Наиболее характерным расщеплением молекулярного ионна явнляется разнрыв b-связи аминоцильного остатка и связи NЦN гидразина (рис. 2.7).

|
Рисунок |
Фрагментация под электронным даром гидразонов акридона |
[50]].
|
|
||||
|
аSTYLEREF 1 \s 2. SEQ Соединение \* ARABIC \s 1 33 |
Проведенные исследования показали, что синтезинроваые гидразоны акридона проявляют заметную противобактериальную активность, так как контакт Staphylococcus aureus 209p с препаратами сопровождался снижением жизнеспособности казанного тест-штамма.
Результаты проведенных исследований свидетельствуют о том, что гидразоны акридона прявляют высокую бактериостатическую ктивность в дозах от 50 до 3 мкг/мл.
Изучение прямого противобактериального действия препаратов показало, что жизнеспособность тест-штамма зависит от времени его контакта с препаратами. При длительном контакте Staphylococcus aureus 209pа с препаратами бактерицидное действие гидразонов акридона было более выражено. Так, для большинства препаратов при двухчасовом контакте бактерицидность проявлялась при концентрации 50 мкг/мл, в то время как через 12 ч контакта - при 25 мкг/мл.
|
Таблица |
STYLEREF 1 \s 2. SEQ Таблица \* ARABIC \s 1 5 |
||||||||
|
Противомикробные свойства аминоцетилгидразонов акридона |
|||||||||
|
№ |
Минимальная бактериостатическая концентрация на St. Aureus 209p |
Минимальная бактерицидная концентрация на St. Aureus 209p |
|
||||||
|
мкг/мл |
mМ |
мкг/мл |
mМ |
|
|||||
|
2.1 |
6.2 |
19.2 |
25.0 |
77.5 |
|
||||
|
2.2 |
12.5 |
37.4 |
70.0 |
209.3 |
|
||||
|
2.3 |
3.1 |
9.2 |
25.0 |
74.3 |
|
||||
|
2.4 |
3.1 |
9.7 |
12.5 |
39.0 |
|
||||
|
2.5 |
6.2 |
17.8 |
25.0 |
71.7 |
|
||||
|
2.6 |
6.2 |
17.8 |
50.0 |
143.5 |
|
||||
|
2.7 |
6.2 |
17.7 |
50.0 |
143.1 |
|
||||
|
REF _Ref167801321 \h 2.33 |
400.0 |
1461.0 |
Ц |
Ц |
|
||||
На основании предварительных данных противомикробной активности соединений, имеющих наилучшие показатели относительно Staphylococcus aureus 209p, была становлена зависимость бактерицидной активности от микробной нагрузки. Увеличение микробной нагрузки от 10 - 50 раз для соединения аREF _Ref167617972 \h 2.5 не влияет на противомикробную активность. Для соединений аREF _Ref167617971 \h 2.3, аREF _Ref167617959 \h 2.4 и аREF _Ref167785020 \h 2.6 величение микробной нагрузки в 10 раз в присутствии препаратов не приводит к росту культуры.
Из приведенных данных следует, что соединения 2.1 - 2.7, способны ингибировать рост бактерий и проявлять бактериостатическую активность в низких концентрациях, почти в 100 раз меньших, чем препарат сравнения Акридиновый желтый. Наиболее активными бактерицидными препаратами являются соединения аREF _Ref167617971 \h 2.3 и аREF _Ref167617959 \h 2.4, наименее активное соединение - REF _Ref167617970 \h 2.2.
Таким образом, причинно-следственная связь между структурой соединений 2.1 - 2.7 и их способностью ингибировать размножение микроорганизмов заключается в способности этих соединений интеркалировать в ДНК микроорганизмов, следствием чего является ингибирование репликации и транскрипции, без которых размножение микроорганизмов невозможно.
Дополнительным аргументом в пользу этого предположения служит хорошее соответствие между способностью соединений ингибировать вирусную репродукцию и их противомикробным действием (рис. 2.8 ). Для двух разных инфекционных агентов с разной стратегией и механизмом размножение корелляция между способностью веществ ингибировать размножение обоих возможна, по-видимому, только в том случае, если у обоих агентов имеется одна и та же мишень. Такой мишенью изучаемых веществ для обоих инфекционных агентов является их геном.
|
|
||
|
Рисунок |
STYLEREF 1 \s 2. SEQ Рисунок \* ARABIC \s 1 8 |
Корреляция между противовирусной (AV) и противомикробной (AM) |
ктивностянми
.
[12] Sharma R.S., Bahel S.C. Synthesis of N-acridin-5-yl-NТ-aroyl(aryloxyacetyl)нhydнraнzines as a possible fungicides // Bokin Bobai. - 1982. - Vol. 10, № 3. - P. - 114.
[13] Pathak P.B., Bahel S.C. Synthesis and fungicidal activity of N-acridin-5-yl-NТ-aroyl(aryloxyaceнtyl)нhydrazines // Bokin Bobai. Ц 1980. - Vol. 8, № 6. - P. 247 - 250.
[14] Mishra V.K., Bahel S.C. Synthesis of some fungicidal N-acridin-5-yl-NТ-(a-arylнoxyннproнpiнonyl)нhydrazines // Bokin Bobai. - 1983. - Vol. 11, № 3. - P. 103 - 105.
[15] Mishra V.K., Bahel S.C. Synthesis of thiazolyl compounds as potential fungicides // J. Indian Chem. Soc. - 1984. Ц Vol. 61, № 10. - P. 916 - 918.
[16] Srivastava S.K., Pathak R.B., Bahel S.C. Synthesis of some N-acridin-9-yl-NТ-a-arylнoxypropiнonylнhydrazines as potential fungicides // Indian J. Pharm. Sci. - 1991. - Vol. 53. - P. 237 Ц 239.
[17] Srivastava S.K., Pathak R.B., Bahel S.C. Synthesis of anti fungal N-acridin-5-yl-NТ-a-aryloxyнbutanoylhydrazines // J. Indian Chem. Soc. - 1985. - Vol. 62. - P. 486 Ц 487.
[18] Шибнев В.А., Финогенова М.П., Гринберг Л.Н., Аллахвердиев А.М. Синтез акридиновых производных гидразидов аминокислот и их антималярийная активность // Биоорг. Хим..Ц 1988.Ц Т. 14, №.11.Ц С. 1565 - 1569.
[19] Sinha B.K., Cysyk R.L., Millar D.B., Chignell C.F.. Synthesis and biological properties of some spin-labeled 9-aminoacridines // J Med Chem.Ц 1976. - Vol. 19, № 8.Ц P. 994 Ц 998
[20] Lyakhov S.A., Suveyzdis Ya.I., Bykhovskaya O.V., Isko N.M., Litvinova L.A. Biological active acridine derivatives. Part 3: Acridinylaminoacids and their esters: synthesis and cytostatic activity // Die Pharmazie. - 1997. - Vol. 52, № 7. - P. 560 - 561
[21] Lyakhov S.A., Suveyzdis Y.I., Berezina L.K., Andronati S.A., Lvov D.K., Litvinova L.A., Denisenko R.V. Biological active acridine derivatives. 2. Chiral 9-aminoacridines // Die Pharmazie. - 1994. - Vol. 49, № 12. - P. 926 - 927
[22] Ляхов С.А., Сувейздис Я.
., Кривцанова НМ, Хоменко О.А., Литвинова Л.О., Андронат С.А. Синтез цитостатична активнсть деяких анлнонакриндинв // Фарм. журн. - 2. - № 2. - C. 61 - 64
[23] Ляхов С.А., Ляхова О.А., Мазепа О.В., Литвинова Л.О., Грень А.
. Синтез та цинтонтокнсичннсть акридинл-арилгдразонв // ФАР. - 2002. - №1 (33). - С. 30 - 34.
[24] Ляхов С.А., Ляхова Е.А., Панченко Н.Н., Литвинова Л.А., Андронати С.А. Синнтез и пронтинвовирусная активность новых производных бис-акридинилнгидннранзидов арилоксиуксусных кислот // Хим.-фарм. журн. - 2001. - Т. 35, № 12. - С. 10 - 13
[25] Ляхова Е.А., Ляхов С.А., Литвинова Л.А., Топилова З.М., Вельчева И.В., Грень А.И., Лебедюк М.Н., Федчук В.П., Хорохорина Г.А. Синнтезн и ДНК-свянзывающие свойстнва акридинилгидразидов N,N-диалкинлинронваых пронизнводных глицина // Хим.-фарм. журн. - 2003. - Т. 37, № 4. - С. 16 - 21.
[26] Dean A.C.R. Antibacterial action of acridines // Chem. Heterocycl. Compounds. Ц 1973. - Vol. 9. - P. 789 - 813.
[27] Пат. DD 212038 Германии, МКИ C 07 D 219/10. Acylated 2-alkoxy-6,9-diaminoacridine derivatives with antiseptic properties / H. Boehland (Германия), R. Muller (Германия), I. Loehrisch (Германия). Опубл. 21.07.1909.
[28] Wainwright M., Phoenix D.A., Marland J., Wareing D.R., Bolton F.J. In vitro photobactericidal activity of aminoacridinesа // J. Antimicrob. Chemother. - 1997. - Vol. 40, № 4. - P. 587 - 589.
[29] Abadi A.H., El-Subbagh H.I., Al-Khamees H.A. Synthesis, antitumor and antitubercular evaluation of certain new xanthenone and acridinone analogs // Arzneimittelforschung. - 1. - Vol. 49, № 3. - P. 259 Ц 266.
[30] Исаев С.Г., Дроговоз С.М., Шульга И.С., Сарбаш Т.Ф., Жиляева Г.М. Силаенва Л.Ф. Биологическая активность нитропроизводных акридина // Фарм. Журн. - 1990. - № 2. - С. 41 Ц 44.
[31] Шульга И.С., Сухомлинов А.К., Гончаров А.И., Дикая Е.М. Синтез и антинмикнробная активность некоторых производных 5-нитрокридина // Хим.-фарм. Журн. - 1974. - Т. 8, № 10. Ц С. 6 - 9.
[32] Шульга И.С., Сухомлинов А.К., Гончаров А.И., Дикая Е.М. Синтез и антимикробные свойства некоторых производных 1-нитро-9-аминокнридинна // Хим.-фарм. Журн. - 1974. Ц Т.8, № 4. - С. 16 - 18.
[33] Гайдукевич А.Е., Сухомлинов А.К., Гончаров А.И., Сашко Т.С. Синтез и противомикробная активность производных 6-нитро-9-аминокридина // Хим.-фарм. Журн. - 1971. - Т.6, № 1. - С. 29 - 32.
[34] Ferguson L.R., Turner P.M., Denny W.A. The mutagenic effects of diacridines and diquiнnolines in microbial systems // Mutat. Res. - 1990. - Vol. 232. - P. 337 - 343.
[35] Cremieux A., Chevalier J., Sharples D., Berny H., Galy A.M., Brouant P., Galy J.P., Barbe J. Antimicrobial activity of 9-oxo and 9-thio acridines: correlation with interacalation into DNA and effects on macromolecular biosynthesis // Res. Microbiol. - 1995. - Vol. 146, № 1. - P. 73 - 83.
[36] Tawil G.G., Youself R.T. Bacteriostatic and bactericidal activities of acryflavine-antibiotic combinations // Sci. Pharm. - 1986. - Vol. 54, №1. - P. 19 - 22.
[37] Wainwright M. Acridine - a neglected antibacterial chromophore (Review) // J. Antimicrob. Chemotherapy. - 2001. - Vol. 47. - P. 1 - 13.
[38] Пат. 4711889 США, МКИ A 61 K 031/47; C 07 D 219/10. Schistosomicidal acridanone hydrazones / U. Brombacher (США), H. Link (США), M. Montavon (США). № 887580; Заявл. 18.07.86; Опубл. 08.12.87; НКИ 514/297.
[39] [207-001762] Metwally A., Abdel Hadi A., Mikhail E.G., Abou Shadi O., Sabry H., El-Nahal H. Study of the efficacy of the new antischistosomal drug 10-[2-(diethylamino)нethyl]-9-acridanone-(thiazolidin-2-ylidene) hydrazone against an Egyptian strain of S. mansoni in mice // Arzneimittelforschung. Ц 1997. - Vol. 47, № 8. - P. 975 - 979.
[40] [207-589] Sulaiman S.M., Ali H.M., Homeida M.M., Bennett J.L. Efficacy of a new Hoffmann-La Roche compound (Ro 15-5458) against Schistosoma mansoni (Gezira strain, Sudan) in vervet monkeys (Cercopithecus aethiops) // Trop. Med. Parasitol. - 1989. - Vol. 40, № 3. - P. 335 - 336.
[41] [207-504] Sturrock R.F., Bain J., Webbe G., Doenhoff M.J., Stohler H. Parasitological evaluation of curative and subcurative doses of 9-acridanone-hydrazone drugs against Schistosoma mansoni in baboons, and observations on changes in serum levels of anti-egg antibodies detected by ELISA // Trans. R. Soc. Trop. Med. Hyg. - 1987. - Vol. 81, № 2. - P. 188 - 192.
[42] [207-001646] Pereira L.H., Coelho P.M., Costa J.O., de Mello R.T. Activity of 9-acridanone-hydrazone drugs detected at the pre-postural phase, in the experimental schistosomiasis mansoni // Mem. Inst. Oswaldo Cruz. - 1995. - Vol. 90, № 3. Ц P. 425 - 428.
[43] [207-001659] Coelho P.M., Pereira L.H., de Mello R.T. Antischistosomal activity of acridanone-hydrazones in Cebus monkeys experimentally infected with the SJ strain of Schistosoma mansoni а// Rev. Soc. Bras. Med. Trop. - 1995. - Vol. 28, № 3. - P. 179 - 183.
[44] [207-673] Eshete F., Bennett J.L. The schistosomicidal compound Ro 15-5458 causes a reduction in the RNA content of Schistosoma mansoni // Mol. Biochem. Parasitol. - 1991. - Vol. 45, № 1. - P. 1 - 8.
[45] [207-680] Coelho P.M., Pereira L.H. Schistosoma mansoni: preclinical studies with 9-acriнdaнnoнne-hydrazones in Cebus monkeys experimentally infected // Rev. Inst. Med. Trop. Sao Paulo. - 1991. - Vol. 33, № 1. - P. 50 - 57.
[46] Пат. 65845 А кра
[47] Дизайн синтез та зв'язок структура-властивост в низц нтерферонндукуючих та противрусних лгандв ДНК: Звт про НДР (заключний) / Фз.-хм. н-т м. О.В. Богатського НАН кра
[48] Ляхова Е.А. Синтез и биологическая активность гидразинсодержащих производных акридина, антрацена и флуорена: Автореф. дис. Е канд. хим. наук: 02.00.10 / Одесса, 2005. - 22 с.
[49] Синтезы органических препаратов: Пер. с англ.: Сбор. 2. / Под ред. Казанского Б.А. - М.: Изд. ин. лит., 1949. Ц 655 с.
[50] Азейман Б.Ю., Швайгер М.О., Мандрик Т.П.. Зелепуха С.
., Кпранова О.А. Зставлення антимкробно