Читайте данную работу прямо на сайте или скачайте
Ароматичн вуглеводн
Опорний конспект
на тему:
"Ароматичн вуглеводн"
Виконав:
учень 10 - А класу
середньо
Коркуна Дмитро
1. Ненасичен вуглеводн - це органчн сполуки, що складають ся з Карбону Гдрогену, в яких атоми Карбону не повнстю насичен атомами Гдрогену.
Загальна формула етиленових вуглеводнв - CnH2n
Загальна формула ацетиленових вуглеводнв CnH2n-2
2. Гомологи етилену Гомологи ацетилену:
С2H4 Ц етилен; C2H2 Ц ацетилен;
С3H6 Ц пропен; C3H4 Ц пропин
C4H8 Ц бутен; C4H6 Ц бутин
т.д
т д
Радикали: СН3 - метил; С2Н5 Ц етил; С3Н7 пропл;
Радикал - це атом або група атомв, що мстить неспарен електрони
3. Етилен:
С2Н4 Н2С Ц 2 Н
: С : : С : Н
2 Н
: С : : С : Н
Н Н
молекулярн струтурн електронн формули
цетилен:
С2Н2 НС º CH H : C 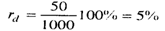
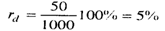
H H
Молекулярн структурн електронн формули
Фзичн властивост:
Етилен - безбарвний газ, майже без запаху, малорозчинний у вод, трохи легший за повтря
цетилен - безбарвний газ, без запаху, малорозчинний у вод.
Хмчн властивост:
1. як нш вуглеводн, етилен ацетилен горять на повтр з творенням оксиду карбону (
V) води:
СН2 = СН2 +3 О2 о СО2 + Н2О
СН ºСН+О3 оСО2 +2 Н2О ▲Н = 1307 к Дж.моль
СН4 Ц W( C) =75%; C2H4 - W( C) =86 %; C2H2 - W( C) = 92%
Чим менша кльксть С, тим свтлше полум'я
2. Гдрування - при
днання водню
Н2С = СН2 +Н2
 (t0, pt, N) H3C
Ц CH3
(t0, pt, N) H3C
Ц CH3
3. Гдратаця - при
дання води
4.
Н2С = СН2
+ Н2О  (t0, H2SO4)
CH3 - CH2 OH
(t0, H2SO4)
CH3 - CH2 OH
4. Яксн реакцÿ
Неповне окиснення Н2С = СН2 +[O]  аCH2 - OH
аCH2 - OH
|
CH2 Ц OH
5. Галогенування - при
днання галогеноводню
Н2С = СН2 +Сl2 о CH2Cl ЦCH2Cl
6. при
днання галогеноводню, правило Марковнка. При вза
модÿ ненасичених вуглеводнв з галогеноводнями атом Гдрогену при
дну
ться до бльш гдрогензованого атома Карбону атом Хлору - до менш гдронзованого




 Н3С - СН º СН2 +HCl о HC3 ЦCHCl ЦCH3
Н3С - СН º СН2 +HCl о HC3 ЦCHCl ЦCH3
6. Дегдрування
7.
Н2С = СН2  º СН + Н2
º СН + Н2
4. Характерна зомеря за мсцем розташування подвйного зв'язку:
)а зомери
СН3 - СН = СН2 - СН3 - 2 бутен
СН2 = СН - СН2 - СН3 - 1 бутен
б)
зомеря карбонового скелету
СН2а = С - СН3
|
CH3
-1-
Добування ецителену ацетилену
Етилен та його гомологи творюють в процес переробки вуглеводнв, що мстяться в нафт. творення може вдбуватися у результат термчного розщеплення ненасичених вуглеводнв,.
СН3
ЦСН2 Ц СН2 Ц СН2 Ц СН3  СН2 = СН2 + СН3 ЦСН2 - СН3
СН2 = СН2 + СН3 ЦСН2 - СН3
цетилен, що використовуэться для зварювальних робт, добувають часто на мсц в результат вза
модÿ карбду кальцю з водою: СС2 а+ Н2О о НС º СН +Са(ОН)2
Карбд кальцю добувають в результат нагрвання в аелектропечах сумш вапна СО та коксу до температури 2500 0 С: СО а+ С оСС2 +СО
Економчно вигднше добувати ацетилен з метану нагрванням до температури 15000 С.
СН4 о НС º СН + Н2
Застосування етилену ацетилену
З етилену добувають полетилен, етиловий спирт. Продукт при
днання хлору до етилену Ц1,2 -дихлорометан
розчинником засобом знищення шкдникв. А продукт при
днання хлороводню - хлороетан
нестезйною речовиною.
цетилен використовують для освтлення, для газового рзання зварювання металв. Ацетиленове кисневе полум'я ма
температуру 2800о С легко плавить сталь. З цетилену добувають вихдн речовини для виготовлення пластмас синтетичних каучукв, вн
сировиною для синтезу оцтово
-2-
1. Ароматизован вуглеводн - органчн сполуки, що мстять у сво
му склад бензольн ядра, у яких можуть бути насичен або ненасичен бчн ланцюги.
Загальна формула - СnH2n-6
1. гомологи бензолу:
бензол - аC6H6; тонуол - C7H8 ; ксилол - C8H10; стирол - C9H12.
3. Бензол:
С6Н6 СН2 = СН ЦС º СЦСН = СН2 бо СНºСЦСН2ЦСН2ЦcºCH
Молекулярн структурн формули

Формула А. Кекуле
У 1845 р. нмецький учений А. Кекуле зппропонував формулу, що найкраще вдобразила рвноцннсть атомв Карбону, атомв гдрогену
 |
Псля з'ясування електронно
2. Фзичн влстивост бензолу:
За звичайних мов бензол - рдина з специфчним запахом, tкип. 80о С, увод практично нерозчинний, хоча
розчинником багатьох органчних речовин.
5. Хмчн властивост:
Бензолу характерн реакцÿ замщення при
днання:
3. реакця горння
С6Н6 +1О2 о1СО2↑ + Н2О
4. Бромування:
Б-Н +Br2
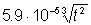 Б-Br +HBr;
Б-Br +HBr;
5. Нтрування:
Б-Н + НОЦNO2 о(Н2SO4)а Б-NO2 + H2O
4. Реакцÿ при
днання:
|
Cl2 |
|
Cl2 |
|
Б+3Cl2о(n,v) |
|
Cl2 |
|
Cl |
 |
 |
||
а) Хлорування:
|
Cl2 |
|
Cl |
 |
б)Б+Н2
 (k,H2C)а C6H12
(k,H2C)а C6H12
5. Добування
1. меридизаця ацетилену:
НСºНо([C], 600o) Б
2. Дегдрування циклогексану
С6Н12  Н2 + Б
Н2 + Б
6. Застосування
Бензол
вихдною речовиною речовиною для синтезу величезно
-1-

