Курсовая работа Производство циклогексана
| Вид материала | Курсовая |
- Справочник работ и профессий рабочих Выпуск 48 Разделы: "Общие профессии производств, 10592.39kb.
- Курсовая работа по теме: «Производство пекарских дрожжей». Научный кандидат биологических, 469.14kb.
- Курсовая работа по технологии лекарств тема: «Промышленное и серийное производство, 335.05kb.
- Методические рекомендации по выполнению курсовых работ курсовая работа по «Общей психологии», 54.44kb.
- Синтез, строение и реакции тиенилсодержащих кросс-сопряженных диеноновых производных, 287.71kb.
- Типовая форма бизнес-плана, 100.9kb.
- Министерство образования Российской Федерации Уральский институт туризма Курсовая работа, 847kb.
- Курсовая работа по дисциплине «Микроэкономика», 761.46kb.
- Курсовая работа Социокультурные лакуны в статьях корреспондентов, 270.94kb.
- Курсовая работа по технологии лекарств тема: «Производство мазей Влияние фармацевтических, 375.98kb.
Курсовая работа
Производство циклогексана
Содержание
стр.
Введение 3
1. Теоретические основы процесса 4
2. Способы получения циклогексана 7
3. Аппаратурное оформление процесса гидрирования бензола 9
4. Технология процесса гидрирования бензола 12
Список литературы 17
Введение
Первые органические вещества, с которыми познакомился человек, были выделены из растительных и животных организмов или из продуктов их жизнедеятельности. Каждый растительный или животный организм представляет собой своеобразную химическую лабораторию в которой протекает множество сложнейших реакций, приводящих к образованию огромного числа органических веществ, как весьма простых (например, метан, муравьиная, щавелевая кислоты и т. п.), так и самых сложных (например, алкалоиды, стероиды, белки).
Характерной чертой органического синтеза у растений является накопление потенциальной химической энергии путем превращения в нее энергии солнечных лучей. С помощью хлорофилла на свету растения синтезируют сложнейшие органические соединения из самых простых химических веществ, в конечном счете, из двуокиси углерода, улавливаемой из воздуха, из воды и из минеральных солей, находящихся в почве. По всей вероятности, первичными продуктами фотосинтеза являются углеводы, которые в дальнейшем превращаются в жиры и белковые вещества растительных организмов. Фотосинтез у растений сопровождается выделением кислорода, который, как теперь точно установлено, образуется не из двуокиси углерода, а из воды. Таким образом, путем фотосинтеза в растениях происходит накопление сложных органических веществ. Естественно, что растения в большей мере, чем животные, служат первоисточником получения органических веществ.
Особенно богатым источником органических веществ являются древесные растения.
Наиболее давно известны термические методы переработки древесины, приводящие к разрушению содержащихся в ней сложных органических веществ с образованием более простых соединений.
1. Теоретические основы процесса
Циклоалканами (циклопарафинами, нафтенами) называют предельные углеводороды, содержащие замкнутую цепь (цикл) углеродных атомов.
Основными соединениями этого гомологического ряда являются циклопропан, циклобутан, циклопентан и циклогексан.
Общая формула гомологического ряда циклоалканов CnH2n (n ≥ 3). Молекула циклоалкана содержит на два атома водорода меньше, чем молекула соответствующего алкана, что необходимо для замыкания углеродной цепи в цикл.
Все атомы углерода в циклоалканах находятся в состоянии sp3-гибридизации, поэтому эти соединения можно отнести к предельным углеводородам. Однако наличие цикла вносит некоторую специфику в химические свойства нафтенов. На свойства этих соединений существенное влияние оказывает устойчивость цикла, непосредственно связанная с его размером.
1. Изомерия и номенклатура
Для циклоалканов, как и для всех классов органических соединений, характерна изомерия углеродного скелета. В первую очередь она обусловлена размером цикла. Структурная изомерия может быть связана с положением заместителей в цикле (например, 1,2- и 1,3-диметилциклобутаны).
В отличие от алканов в циклоалканах невозможно свободное вращение относительно связей С-С в цикле. Это делает возможным существование у некоторых замещенных циклоалканов пространственных изомеров. Например, в молекуле 1,2-диметилциклопропана две группы CH3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):

СН3
СН3

СН3
Н








Н
Н
Н
СН3
цис-1,2-диметилциклопропан транс-1,2-диметилциклопропан
По размеру цикла циклоалканы делят на углеводороды с малым (С3, С4), средним (С5 – С7) и большим (С8 и более) циклом.
СН3
Названия циклоалканов дают, добавляя приставку цикло - к названию алкана с соответствующим числом атомов углерода. Нумерацию атомов углерода в цикле проводят, начиная от атома с простейшим заместителем и далее по кратчайшему пути к следующему заместителю. Главным требованием является минимальная сумма цифр в названии циклоалкана. Например, углеводород, формула которого

1
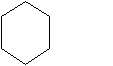
2
6
С2Н5
3
4
5
называют 1-метил-3-этилциклогексан.
2. Физические свойства
Циклопропан и циклобутан при обычных условиях представляют собой газообразные вещества, циклопентан и циклогексан – жидкости. Нафтеновые углеводороды практически не растворяются в воде, их температуры кипения и плавления выше, чем у соответствующих алканов.
3. Получение
Циклоалканы входят в состав некоторых нефтей (отсюда и появился термин «нафтены»), откуда они были впервые выделены и изучены профессором Московсковского университета В. В. Марковниковым.
Циклогексан и его производные образуются при каталитическом гидрировании ароматических углеводородов:


 + 2Н2
+ 2Н2 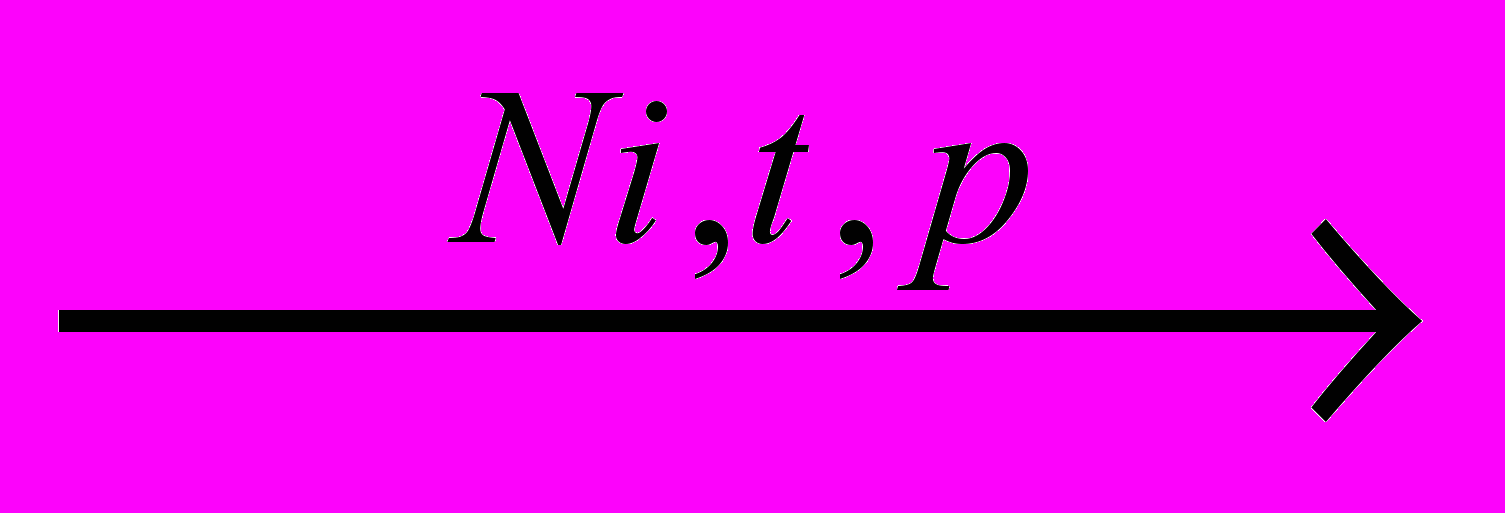
Внутримолекулярная реакция Вюрца – основной лабораторный способ получения циклоалканов:
H2C-CH2-Br H2C-CH2
Ι + Mg
 Ι Ι
Ι ΙH2C-CH2-Br H2C-CH2
4. Химические свойства
Существование углового напряжения в циклопропане и циклобутан приводит к тому, что их свойства существенно отличаются от свойств нафтенов со средним размером цикла. Неустойчивость малых циклов проявляется в легкости протекания реакций присоединения с образованием продуктов нециклического строения. Циклопентан и циклогексан по химическим свойствам близки к алканам. Они, оправдывая свою принадлежность к группе насыщенных углеводородов, легко вступают в реакции замещения.
1. Присоединение галогенов и галогеноводородов
Эти процессы с циклопропаном, циклобутаном и их алкилзамещенными производными идут труднее, чем с алкенами:

+ Br → BrCH2-CH2-CH2-CH2Br

+ HBr → CH3-CHBr-CH2-CH3
CH3
2. Гидрирование
Циклоалканы способны гидрироваться, т. е. присоединять водород. Различная температура проведения этой реакции также свидетельствует об относительной стабильности циклов: циклопропан гидрируется при 50 – 700С, тогда как циклопентан – при 3500С:

+ H2
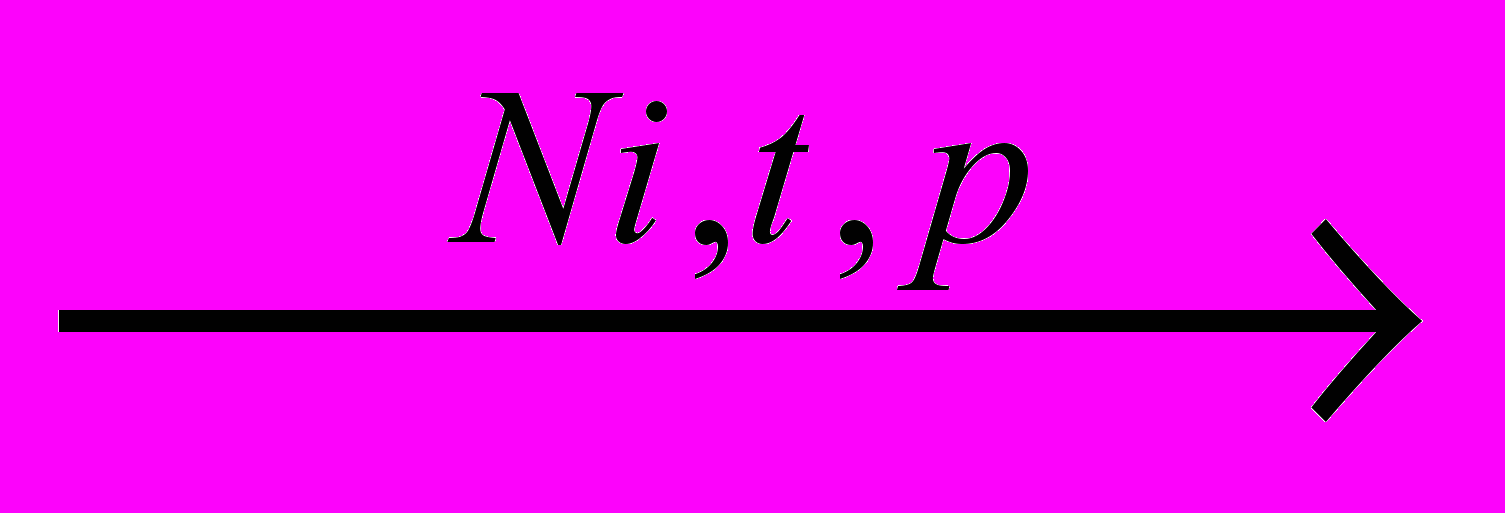 CH3-CH2-CH3
CH3-CH2-CH3
+ Н2
 СН3-СН2-СН2-СН2-СН3
СН3-СН2-СН2-СН2-СН3 3. Реакции радикального замещения
Циклы средних размеров при галогенировании не раскрываются, а вступают в реакции радикального замещения, подобно алканам:


 Br2
Br2 + Br2
 + HBr
+ HBr 4. Каталитическое дегидрирование
Это специфическая реакция циклогексана, которая протекает в присутствии никелевого катализатора и проводит к получению бензола:



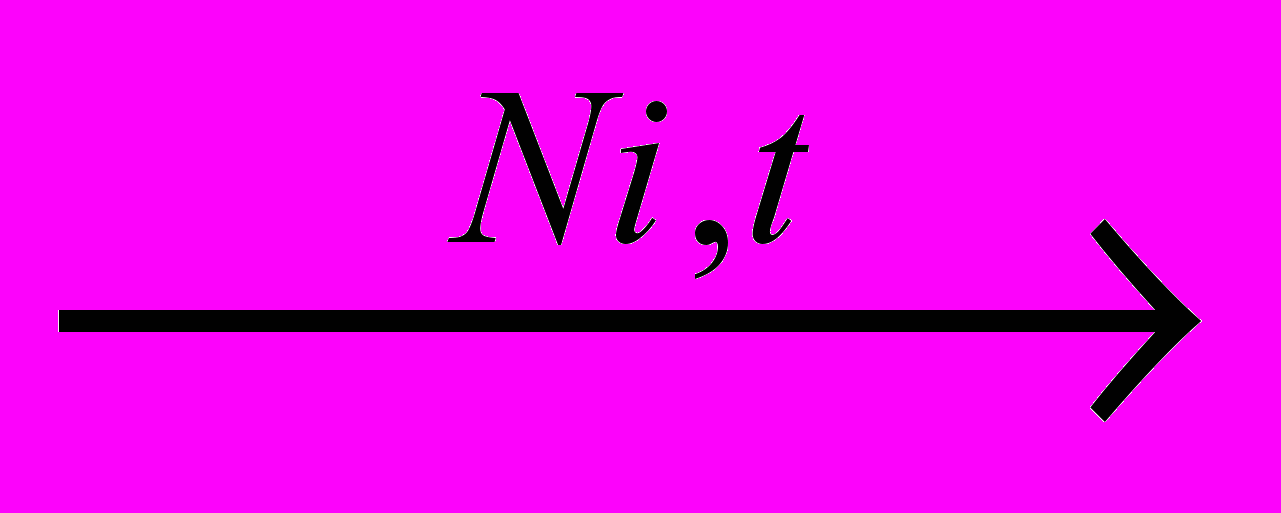 + 3H2
+ 3H2 5. Применение
Из циклоалканов практическое значение имеют циклогексан, метилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в бензол, толуол и другие вещества, которые широко используют для синтеза красителей, медикаментов и т. д. Циклопропан применяют в медицине для наркоза.
2. Способы получения циклогексана
1. Извлечение циклогексана из нефтяных фракций
В бензиновых фракциях некоторых нефтей содержится довольно значительное количество нафтенов, в том числе циклогексана и метилциклопентана. При достаточно большом содержании этих углеводородов оказывается целесообразным извлекать их из нефти путем ректификации и экстрактивной перегонки.
В таблице 1 приведены данные по содержанию циклогексана и метилциклогексана в бензиновых фракциях (конец кипения 1500С) некоторых нефтей России (в масс. % от бензина).
Таблица 1
Содержание циклогексана и метилциклогексана в бензиновых фракциях
| Показатели | Циклогексан | Циклопентан |
| 1 | 2 | 3 |
| Нефти старых месторождений: | ||
| Сураханская отборная | 7,37 | 4,59 |
| Туймазинская | 1,21 | 2,44 |
| Эмбенская | 4,64 | 3,51 |
| Небитдаганская | 1,97 | 5,03 |
| Нефти новых месторождений: | ||
| Западно-Тебукская (Коми АССР) | 2,47 | 3,0 |
| Каратайская (Эмба) | 6,40 | 4,08 |
| Усть-Балыкская | 2,72 | 2,4 |
Суммарное содержание циклогексана и метилциклопентана в нефтях восточных районов не превышает 5 – 6 %. В качестве источника циклогексана промышленный интерес представляют лишь сураханская и каратайская нефти. Необходимо отметить высокое содержание нафтенов в бензиновых фракциях некоторых газоконденсатных месторождений.
В некоторых странах встречаются нефти, более богатые нафтеновыми углеводородами, в частности циклогексаном. В таких странах извлечение циклогексана из бензиновых фракций нефти применяется в промышленности.
2. Получение циклогексана из метилциклопентана
Изомеризация метилциклопентана в циклогексан проводится в присутствии хлористого алюминия и хлористого водорода:
 CH3 →
CH3 →  Процесс идет в жидкой фазе при 800С. Изомеризации подвергается узкая фракция (пределы кипения 66 – 850С), в которой, помимо циклопентана и циклогексана, содержатся также н – гексан и небольшое количество бензола и других углеводородов. Поточная схема процесса представлена на рис. 1.
Процесс идет в жидкой фазе при 800С. Изомеризации подвергается узкая фракция (пределы кипения 66 – 850С), в которой, помимо циклопентана и циклогексана, содержатся также н – гексан и небольшое количество бензола и других углеводородов. Поточная схема процесса представлена на рис. 1. Сырье


Изомеризация
HCI

Свежий катализатор


Отработанный катализатор
Отделение катализатора

Выделение HCI


Промывка щелочью
Ректификация

Сырой циклогексан
Рис. 1. Поточная схема изомеризации метилциклопентана и выделения циклогексана
Выделенная циклогексановая фракция (сырой циклогексан) содержит около 12% примесей бензола и диметилпентана. Для получения 99% циклогексана требуется дополнительная очистка, заключающаяся в экстрактивной перегонке и ректификации.
3. Получение циклогексана гидрированием бензола
Процесс производства циклогексана из бензола базируется на хорошо известном процессе гидрирования:
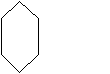





 + 3H2 + 49,2 ккал (206 кДж)
+ 3H2 + 49,2 ккал (206 кДж) Для получения 1 моль циклогексана требуется 3 моль водорода. Реакция гидрирования обратима, идет с уменьшением объема и выделением тепла. Поэтому сдвигу равновесия вправо благоприятствует повышенное давление и умеренные температуры.
Изменение свободной энергии реакции гидрирования бензола в газовой фазе с температурой описывается уравнением:
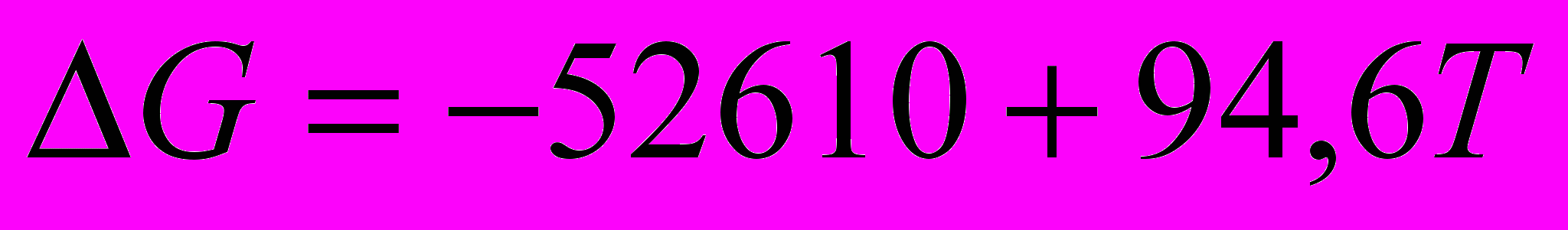
Из этого уравнения следует, что изменение свободной энергии становится равным нулю при температуре около 2820С. Следовательно, термодинамически благоприятны для реакции более низкие температуры, при которых значение
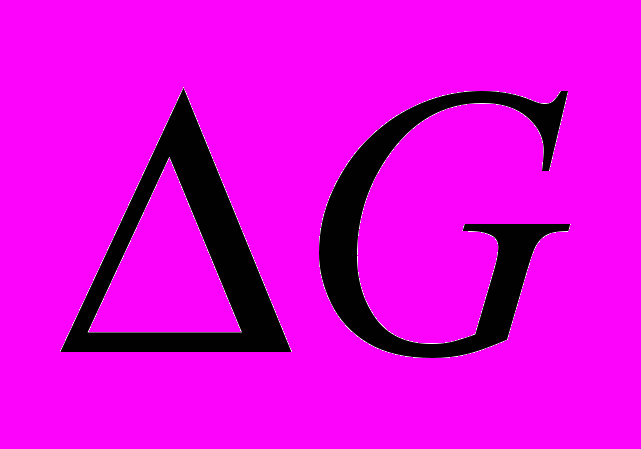 становится отрицательным. Однако процесс можно вести и при более высоких температурах, сдвигая равновесие вправо повышением давления водорода.
становится отрицательным. Однако процесс можно вести и при более высоких температурах, сдвигая равновесие вправо повышением давления водорода. Процесс гидрирования бензола может проводиться в паровой или жидкой фазе. Наиболее распространен жидкофазный процесс.
В качестве катализатора гидрирования бензола могут применяться металлические или сульфидные катализаторы. Металлические катализаторы (платина, никель) могут работать при сравнительно низких давлениях – до 50 кгс/см2 (4,9 МН/м2) и температурах 150 – 2000С. В этих условиях достигается полное превращение бензола в циклогексан. Однако металлические катализаторы очень чувствительны к примесям в бензоле, в частности к тиофену, который всегда содержится в коксохимическом бензоле. Поэтому для гидрирования на этих катализаторах требуется предварительная очистка бензола.
Сульфидные катализаторы (сульфиды никеля, молибдена) эффективны только на осерненном бензоле, но для гидрирования требуется давление 300 кгс/см2 (29,4 МН/м2) и температура 350 – 3700С. На этих катализаторах не удается добиться полной конверсии бензола в циклогексан; кроме того, наблюдается частичная изомеризация циклогексана в метилциклопентан. Непревращенный бензол и метилциклопентан необходимо отделять от циклогексана, что значительно усложняет процесс.
3. Аппаратурное оформление процесса гидрирования бензола
Аппаратурное оформление процесса гидрирования бензола в циклогексан определяется необходимостью отвода больших количеств тепла – около 630 ккал (1750 КДж) на 1 кг бензола. Для гидрирования применяются реакторы с непрерывным или ступенчатым отводом тепла. Реакторы первого типа трубчатые; по конструкции они напоминают кожухотрубчатые теплообменные аппараты (рис. 2).
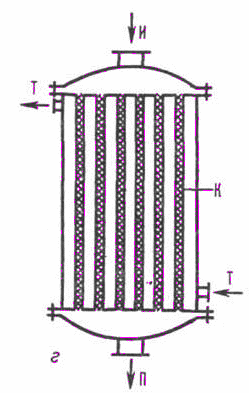
Рис. 2. Трубчатый реактор
И – исходные вещества, П – продукты реакции, Т – теплоноситель, К – катализатор
В трубки насыпан катализатор, в межтрубном пространстве циркулирует конденсат. Тепло отводится за счет испарения части конденсата с образованием водяного пара и регулируется изменением давления в межтрубном пространстве (при изменении давления изменяется температура кипения конденсата и количество отводимого тепла).
Реакторы со ступенчатым отводом тепла представляют собой аппарат колонного типа (рис. 3).
Отвод тепла может осуществляться либо поддувом холодного водорода между слоями катализатора, либо охлаждением реакционной смеси в выносных холодильниках в сочетании с рециркуляцией циклогексана.
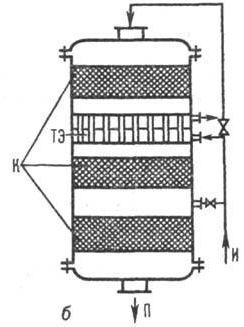
Рис. 3. Многослойный каталитический реактор с промежуточными теплообменными элементами
И – исходные вещества, П – продукты реакции, К – катализатор, ТЭ - теплообменные элементы
В промышленности используется несколько разновидностей процесса гидрирования бензола.
Рассмотрим процессы гидрирования бензола в жидкой и газовой фазах.
4. Технология процесса гидрирования бензола
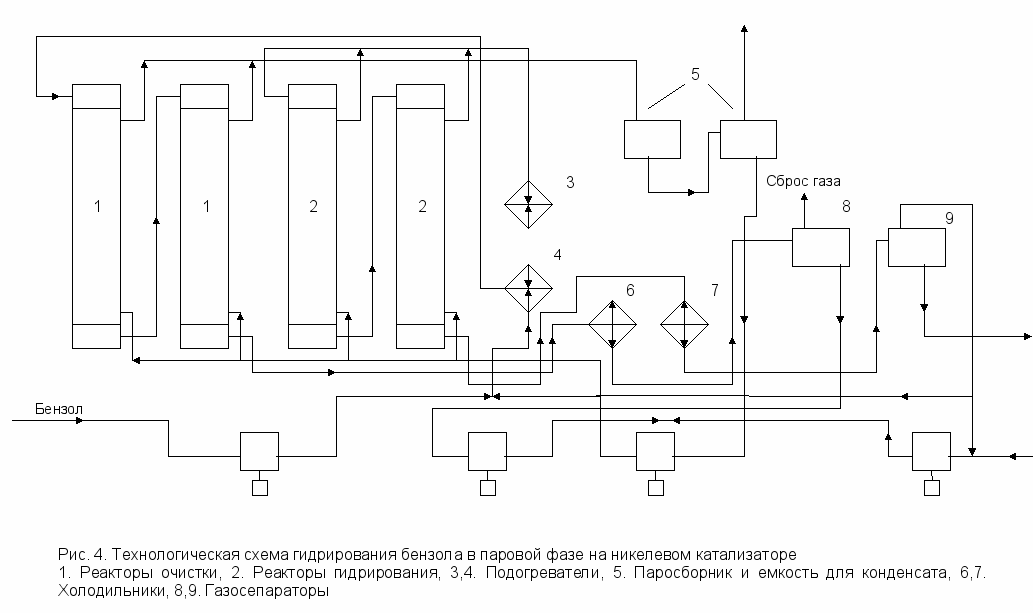
4.1 Гидрирование бензола в газовой фазе
Технологическая схема процесса приведена на рис. 4. Гидрирование осуществляется в газовой фазе, причем для очистки бензола от серы используется тот же катализатор (никель на кизельгуре), но в качестве хемосорбента. Процесс хемосорбции идет при 150 – 1800С, объемной скорости подачи сырья 1,0 ч-1 и подаче водорода 10 – 30 объемов на 1 объем бензола (0,05 – 0,13 моль/моль).
Бензол смешивается с циркулирующим водородом, смесь подогревается в подогревателе 4 и проходит последовательно реакторы очистки 1. Пары из реакторов 1 охлаждаются в холодильнике 6. Жидкий очищенный бензол отделяется от водорода в газосепараторе 8 и подается насосом в подогреватель 3. Перед поступлением в подогреватель 3 бензол смешивается с циркуляционным и свежим водородом. Сырьевая смесь из подогревателя 3 направляется в реакторы гидрирования 2. Продукты реакции проходят холодильник 7 и поступают в газосепаратор 9, где циклогексан отделяется от циркуляционного водорода. Товарный циклогексан отводится в емкость, а циркуляционный водород поступает на прием компрессора и вновь подается в систему. Часть водорода отдувается для удаления инертных примесей. Реакторы 1 и 2 трубчатые. Температура в них регулируется путем циркуляции парового конденсата в межтрубном пространстве.
Водород
Циклогексан
4.2 Гидрирование бензола в жидкой фазе
Гидрирование бензола в жидкой фазе может быть осуществлено в реакторе со стационарным слоем либо в суспендированном слое катализатора.
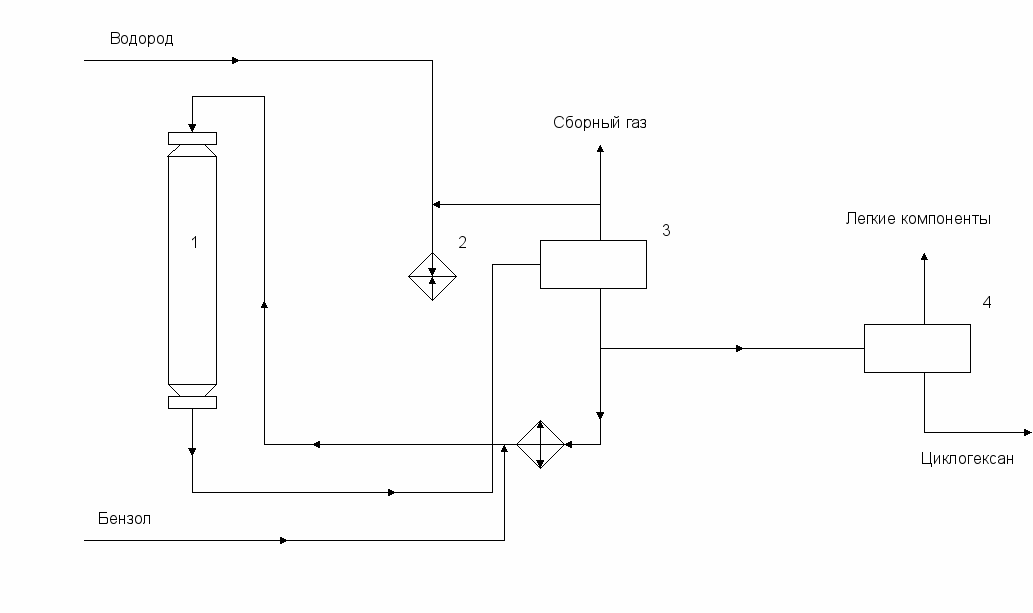
Принципиальная схема процесса гидрирования бензола в жидкой фазе приведена на рис. 5. В этом процессе используется реактор колонного типа, заполненный стационарным слоем платинового катализатора. Тепло реакции отводится циркулирующим циклогексаном. Бензол и циркулирующий циклогексан в смеси с циркуляционным и свежим водородом нагреваются до температуры реакции (частично за счет тепла отходящей реакционной смеси) и поступает в реактор 1. Реакционная смесь из реактора проходит через теплообменники в газосепаратор высокого давления 3. Водород из газосепаратора 3, возвращают в реактор для регулирования температуры. Остальной циклогексан поступает в газосепаратор низкого давления 4, где от него отделяются газообразные углеводороды.
Условия процесса гидрирования в жидкой фазе приведены в таблице 2.
Таблица 2
Условия процесса гидрирования в жидкой фазе
| Наименование | Показатели |
| 1 | 2 |
| Температура, 0С | 250 - 280 |
| Давление, кгс/см2 | 35 9 (3,44 МН/м2) |
| Объемная скоростьподачи сырья, ч-1 | 2 |
Производительность установок по производству циклогексана из бензола составляет от 30 до 120 тыс. т в год.
Рис. 5. Технологическая схема гидрирования бензола в жидкой фазе
1. Реактор, 2. Компрессор, 3. Газосепаратор высокого давления, 4. Газосепаратор низкого давления
Список литературы
1. Габриэлян О. С., Остроумов И. Г. Химия. М., Дрофа, 2008;
2. Чичибабин А. Е. Основные начала органической химии. М., Госхимиздат, 1963. – 922 с.;
3. Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза. М., Химия. 1988. – 592 с.;
4. Паушкин Я. М., Адельсон С. В., Вишнякова Т. П. Технология нефтехимического синтеза. М., 1973. – 448 с.;
5. Юкельсон И. И. Технология основного органического синтеза. М., «Химия», 1968.
