Все авторефераты докторских диссертаций
Все авторефераты докторских диссертаций
Концепция механоэлектрического преобразования в миокарде на основе физико-химической природы цитоскелета
Автореферат докторской диссертации
На правах рукописи
Шкляр Татьяна Фридриховна
КОНЦЕПЦИЯ МЕХАНОЭЛЕКТРНЧЕСКОГО ПРЕОБРАЗОВАНИЯ В МИОКАРДЕ НА ОСНОВЕ ФИЗИКО-ХИМИЧЕСКОЙ ПРИРОДЫ ЦИТОСКЕЛЕТА
03.03.01 - физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени доктора биологических наук
Челябинск - 2012
2
Работа выполнена в Центральной научно-исследовательской лаборатории ГБОУ ВПО Уральская государственная медицинская академия Министерства здравоохранения и социального развития Российской Федерации.
Научный консультант:
Цывьян Павел Борисович, доктор медицинских наук, профессор.
Официальные оппоненты:
Брюхин Геннадий Васильевич, доктор медицинских наук, профессор, зав.кафедрой гистологии, цитологии и эмбриологии ГБОУ ВПО Челябинская государственная медицинская академия
Баньков Валерий Иванович, доктор биологических наук, профессор, зав.кафедрой нормальной физиологии ГБОУ ВПО Уральская государственная медицинская академия
Пряхин Евгений Александрович, доктор биологических наук, зав.экспериментальным отделом ФГБУН "Уральский научно-практический центр радиационной медицины"
Ведущая организация: ФГБУН Институт физиологии КНЦ УрО РАН
Защита состоится 24 мая 2012 г. в 12.00 на заседании
диссертационного совета Д 212.295.03 на базе ФГБОУ ВПО Челябинский государственный педагогический университет по адресу: 454080, г. Челябинск, проспект им. В.И.Ленина 69, конференц-зал (ауд. 116).
С диссертацией можно ознакомиться в читальном зале библиотеки ФГБОУ ВПО Челябинский государственный педагогический университет
Автореферат разослан л___ _______________ 2012 года
О |
Ученый секретарь диссертационного совета доктор биологических наук
Of", |
У>аа .,/tP ^Ефимова Н.В.
3
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Хорошо известно, что в возбудимых клетках и, в частности, в кардиомиоцитах механические переменные, прежде всего, деформация миокарда оказывает влияние на внутриклеточный потенциал покоя (ПП), контролируя при этом условия возникновения потенциала действия (Камкин и др., 2003; Камкин, Каменский, 2004; Lab, 1996; Taggart, 1996; Franz, 2000; Taggart, Lab, 2008). Данный феномен получил название механоэлектрической обратной связи (МЭС) в миокарде. Выраженность МЭС существенно возрастает при увеличении нагрузки на сердце вне зависимости от того, связано ли это с интенсивными физическими нагрузками или же развитием патологических изменений в сердечной мышце. Это влечет за собой, прежде всего, глобальные изменения в структуре сердечного ритма, которые могут приводить к фибрилляции желудочков.
Согласно данным ВОЗ различные нарушения ритма сердца являются первостепенной причиной внезапной смерти человека. В этой связи актуальность затронутой проблемы приобретает необычайную важность, поскольку для успешного предупреждения и лечения нарушений ритма сердца необходимо ясно представлять молекулярные механизмы, лежащие в основе механоэлектрического преобразования в кардиомиоцитах.
Традиционно, описание МЭС связывают с идентификацией и исследованием свойств специфических механочувствительных (МЧ) каналов в мембране клетки. Экспериментально установлено существование как неселективных, так и селективных активируемых растяжением каналов для различных типов ионов (Камкин и др., 2000, 2001, 2002; Ravens, 2003; Kamkin et al, 2003; Isenberg et al, 2005; Baumgarten, 2007; Nishimura et al., 2008).
Вместе с тем, даже самые детальные подробности строения МЧ каналов не дают представления о том, как происходит трансформация механического стимула (растяжения) в электрофизиологический или биохимический ответ клетки. Существует несколько теорий для объяснения механоэлектрических преобразований в клетке. Одна из них, как полагают некоторые авторы, применима ко всем эукариотическим клеткам, подразумевает участие субмембранных структур цитоскелета (кортекса) в реализации МЭС (Hamill, Martinac, 2001; Baumgarten, 2007; Chalfie, 2009; Sachs, 2010). Доказательства необходимости присутствия
4
актинового кортикального цитоскелета для механопреобразования получены в многочисленных исследованиях с применением цитохалазина, ингибитора полимеризации фибриллярного актина (Казанский и др., 2000; Wang et al, 2002; Isenberg et al, 2003; Karpushev et al., 2010).
Цитоскелет, особенно в субмембранной области, представляет собой рыхлую сеть биополимеров, образованную F-актином и множеством сопутствующих актин-связывающих белков (Weihing, 1985; Pullarkat et al., 2007; Baumgarten, 2007). Установлено, что концы молекулы филамина могут взаимодействовать с нитями актина, образуя между ними сшивки, тем самым, детерминируя трехмерное расположение актиновых филаментов (Weihing, 1985; Matsudaira, 1991). Кроме того, в клетках, обеспечивающих подвижность, обнаружен регуляторный белок р53 (JMY), который определяет формирование ансамблей актина в рыхлые сети (Wrighton, 2009).
С физико-химической точки зрения, трехмерные белковые структуры цитоскелета, погруженные во внутриклеточный раствор самых различных ионов, могут рассматриваться как полиэлектролитные гидрогели - то есть трехмерные полимерные сетки, несущие электрические заряды, локализованные на макромолекулярных нитях, и содержащие большое количество жидкой среды с распределенными в ней подвижными ионами. Необычайное сходство особенностей структуры синтетических и биологических полиэлектролитных гелей было отмечено рядом исследователей (Ling, 1990, 2003; Pollack, 2001, 2006).
Изучение свойств интактного цитоскелета в значительной мере лимитировано наличием множества взаимосвязанных явлений и процессов в клетке. Поэтому в исследованиях роли цитоскелета в регулировании клеточных функций широко используются математические и физические модели, которые с долей допущений, воспроизводят основные черты и свойства выбранного объекта (Guilak et al., 2006; Mofrad, 2009).
В настоящей работе предлагается оригинальная экспериментальная модель цитоскелета на основе синтетических полиэлектролитных гидрогелей. Результаты изучения характеристик модельного цитоскелета позволили сформулировать новое теоретическое толкование совокупности экспериментальных фактов проявления механоэлектрических взаимоотношений в миокарде с позиции, согласно которой возможный молекулярный механизм МЭС тесно сопряжен с физико-химическими свойствами цитоскелета.
5
С точки зрения гелеподобной природы цитоскелета роль деформации в регулировании электрической активности миокарда может быть рассмотрена исходя из фундаментальных законов взаимодействия полимерных нитей цитоскелета со средой. Данный подход, опирающийся на универсальность законов для объяснения физических и биологических явлений, дает возможность по-новому взглянуть на природу ряда фактов, теоретическое обоснование которых открывает широкие возможности для диагностики и лечения заболеваний сердца.
Цель работы состояла в разработке теоретических основ молекулярного механизм механоэлектрическогоаа преобразованияаа ваа миокардеаа путем использования методов экспериментального моделирования. Для достижения поставленной цели были сформулированы следующие задачи исследования:
- В экспериментах на изолированном миокарде лабораторных животных и препаратах сердечной мышцы человека, выделенных в ходе кардиохирургических операций, выявить влияние растяжения миокарда на электрическую активность кардиомиоцитов.
- В экспериментах на изолированном миокарде животных установить механизмы регулирования величины растяжения мышцы в норме и патологии.
- Теоретически обосновать и разработать экспериментальную модель цитоскелета на основе синтетических полиэлектролитных гидрогелей.
- Количественно охарактеризовать механические и электрические свойства экспериментальной модели цитоскелета.
- На экспериментальной модели цитоскелета определить факторы, регулирующие степень выраженности МЭС.
- Сформулировать представления о механизме механоэлектрических преобразований в миокарде на основе сопоставления экспериментальных фактов, полученных на биологических и синтетических объектах.
Научная новизна работы
Х Установлено, что в условно нормальном изолированном миокарде желудочков животных и человека в физиологическом диапазоне растяжений сердечной мышцы механоэлектрическая обратная связь выражена слабо. Возникновение патологических отклонений в сердце различного генеза приводит каа увеличению степени влияния
6
растяженияа миокарда на внутриклеточныйа потенциал,а чтоа может провоцировать возникновение спонтанных ПД.
- Разработана экспериментальная модель неоднородности миокарда, состоящая из препаратов миокарда механически соединенных в последовательный тандем, и взаимодействующих друг с другом за счет компьютерных средств управления экспериментом в составе стенки сферического желудочка в реальном масштабе времени.
- Экспериментально обосновано, что в систолический период сердечного цикла регионы сердечной стенки растягиваются вследствие механической асинхронности в сердце, возникновение которой связано как с различием в структуре, так и функции участков сердечной стенки.
- Выяснено, что в качестве экспериментальной модели трехмерной структуры цитоскелета могут быть использованы полиэлектролитные гидрогели на основе акриловой и полиметакриловой кислот. Разработаны критерии синтеза гелей с учетом подобия особенностей структуры цитоскелета, в частности, качественного сходства в степени сшивки и заряженности полимерных нитей, в использовании ключевых физиологически значимых противоионов.
- Установлено, что электрический потенциал внутри геля и внутриклеточный потенциал имеют близкое по величине значение, которое зависит от степени набухания геля, его ионизации и плотности сшивки полимерной сети, а также от ионной силы раствора, в которую гель помещен.
- Установлено, что механические свойства гидрогелей качественно и количественно схожи с характеристиками цитоскелета, и зависят от особенностей структуры, прежде всего, от плотности сшивки полимерной сети.
- Обнаружено существование механоэлектрической связи в синтетических гидрогелях, выраженность которой зависит, в первую очередь, от упругих свойств полимерной сети.
- Предложен механизм механоэлектрических преобразований в возбудимых клетках, в котором ключевая роль отводится универсальному физическому явлению конденсации зарядов на полимерной сети при ее растяжении.
Основные положения диссертации, выносимые на защиту
1. Существование механоэлектрической обратной связи в миокарде сопряженоа са физико-химическимиа свойствамиа полимернойа сети
7
цитоскелета, которые могут быть определены с высокой степенью адекватности на синтетических гидрогелях, выбранных в качестве экспериментальной модели цитоскелета.
- Величина внутриклеточного потенциала в клетке зависит от ряда физико-химических характеристик цитоскелета, среди которых ключевую роль играет степень набухания и плотность сшивки полимерной сети.
- Степень выраженности механоэлектрической обратной связи в клетке зависит от совокупности факторов, регулирующих ионный баланс между цитоскелетом и окружающей его средой, однако, при прочих равных условиях плотность сшивки полимерной сети выступает главным детерминантом механоэлектрического преобразования в миоците.
- Механизм регулирования механоэлектрических взаимоотношений в клетке базируется на универсальном законе физики полимеров, и связан с конденсацией электрических зарядов на полимерной сети цитоскелета при ее осевой деформации.
Теоретическая значимость работы
Работа углубляет современные представления в области физиологии клетки и электрофизиологии о роли цитоскелета в регулировании электрической функции клетки за счет рассмотрения этого объекта с точки зрения трехмерной сети биополимеров, погруженной в цитозоль. В диссертационном исследовании оценен вклад цитоскелета в ионный баланс клетки в зависимости от степени ее растяжения с позиции фундаментальных физико-химических законов и явлений.
Практическая значимость работы
- Разработанная экспериментальная модель цитоскелета может быть использована в фундаментальных исследованиях для выяснения роли цитоскелета в регулировании механической и электрической активности мышечных клеток.
- Модель также может быть использована для тестирования механизмов антиаритмического действия фармакологических агентов при моделировании патологических ситуаций в миокарде.
- Методические аспекты работы по направленному синтезу гидрогелей и научные основы о механизмах регулирования в гелях механической и электрической активности могут составить
8
теоретическую основу для создания искусственных биосовместимых протезов мышечной ткани.
Внедрение результатов работы
Материалы диссертационного исследования внедрены в педагогический процесс на кафедре медицинской физики УГМА в общем курсе лекций Современная научная картина мира (раздел законы функционирования живых систем), а также на кафедре молекулярной физики ИЕН УрФУ в специальных курсах лекций Молекулярная природа биологической подвижности и Общая биология для физиков (раздел физиология клетки).
Апробация работы
Основные положения исследования были представлены на ряде отечественных и зарубежных конференций, симпозиумов и съездов в форме стендовых докладов и устных сообщений. В частности, на Всемирном конгрессе Клеточная и молекулярная биология, Франция, 2005; на 18 и 21 Российских конференциях Проблемы теоретической и экспериментальной химии, Екатеринбург, 2008 и 2011; на Международных конференциях Биологическая подвижность, Пущино, 2008 и 2010; на Международном конгрессе Кардиология на перекрестке наук, Тюмень, 2010; на 17 Международной конференции Механика в биологии и медицине, Польша, 2010; на 19 Международной конференции Научного общества исследователей сердечнососудистой динамики, Япония, 2010. Работа была официально апробирована на межкафедральном заседании сотрудников ГБОУ ВПО Уральская государственная медицинская академия с участием специалистов сторонних организаций.
Публикации
По материалам исследования опубликовано 60 печатных работ, из которых 17 в журналах, рекомендованных ВАК.
Структура и объем работы
Работа изложена по стандартной схеме и состоит из введения, обзора литературы, методического раздела, трех экспериментальных глав и обсуждения результатов. Манускрипт содержит 220 страниц текста и иллюстрирован 61 рисунком и 13 таблицами. Список литературы включает 323 цитируемых источника.
9
СОДЕРЖАНИЕ ДИССЕРТАЦИИ
МАТЕРИАЛЫ И МЕТОДЫ
Основные результаты настоящей работы были получены на материально-технической базе отдела биомедицинской физики и инженерии ЦНИЛ УГМА и кафедр высокомолекулярных соединений и молекулярной физики ИЕН УрФУ.
Объекты исследований
Изолированныйа миокарда лабораторныха животных.
Эксперименты на лабораторных животных выполнены с соблюдением требований, установленных Европейской конвенцией по защите позвоночных животных, используемых в экспериментальных и других научных целях (ETS N 123), от 18 марта 1986 г., Страсбург. В исследовании использовали изолированный миокард лабораторных животных: морская свинка, кролик, лягушка.
Для перфузии препаратов теплокровных животных использовали аэрируемый (95% 02 и 5% С02) раствор Кребса, для холоднокровных животных - раствор Рингера. Стимуляцию миокарда осуществляли массивными платиновыми электродами (базовая частота 0,3 Гц).
Изолированный миокард больных врожденными и приобретенными пороками сердца. Экспериментальное исследование биоптатов миокарда человека проведено с соблюдением этических принципов проведения медицинских исследований с участием человека в качестве субъекта исследования, включая исследования, в которых используются полученные от человека биологические материалы, разработанных и принятых на 18-й Генеральной ассамблее Всемирной медицинской ассоциации (World Medical Association - WMA), Хельсинки, Финляндия, июнь 1964 г.
Был использован биопсийный материал, полученный у больных во время кардиохирургических операций, проведенных в Областной клинической больнице №1 (Екатеринбург). У пациентов с митральным стенозом (80) и с врожденными пороками сердца (40) иссекали ушки предсердий. У больных с митральным пороком при операциях по замене митрального клапана были получены кусочки папиллярных мышц (40).
Перфузию биоптатов проводили аэрированным раствором Кребса, того же состава, как для теплокровных животных. Скорость протока - 5-10
10
мл/мин. Температуру поддерживали на уровне 330,5 С. Базовая частота стимуляции - 0,3 Гц
Синтетические полиэлектролитные гидрогели. Использованы гели полиметакриловой (ПМАК) и полиакриловой кислот (ПАК). Гели были синтезированы в результате свободнорадикальной полимеризации частично нейтрализованной акриловой (метакриловой) кислоты с ?,?'-метилен-диакриламидом в качестве сшивающего агента в водном растворе. В синтезе использовали реагенты фирм Merck (Schuchardt, Hohenbrunn).
Готовили раствор соответствующей кислоты в воде с добавлением гидрооксида калия, магния или кальция взятых в количестве, требуемом для нейтрализации заданной доли кислотных групп. В полученный раствор вводили сшивающий агент в количестве, обеспечивающем заданное число мономерных звеньев линейного полимера на один узел сетки. Варьирование условий синтеза позволило получать гели с различной степенью сшивки. Количество внесенного в поле реакции оксида калия (магния, кальция) определяло степень ионизации (заряженности, нейтрализации).
Гели маркировали согласно условиям синтеза. Первое число в маркировке указывало на среднее число звеньев линейных участков, приходящихся на один узел сетки. Второе число соответствовало процентному содержанию солевых групп по отношению к общему числу звеньев. Например, КЛАК 100/50 - гель акриловой кислоты, со степенью сшивки 100 мономеров на одну сшивку, 50% групп акрилата калия.
Методы
Базовая экспериментальная установка. Для исследования механических и электрических свойств биологических и синтетических объектов была создана установка, включающая комплекс оборудования, представленная на рис. 1.
За счет сопряжения измерительных и исполнительных (мотор) устройств с компьютером по средствам аналого-цифровых и цифро-аналоговых преобразователей, установка обеспечивала управление экспериментом, в соответствии с поставленными задачами. Оборудование позволяло задавать образцу деформации произвольной формы и различные режимы нагрузок, включая изометрический, изотонический и физиологический режимы.
Электрохимический потенциал (?) определялся с помощью микроэлектродной техники, стандартно используемой для фиксации электрохимических потенциалов в живой клетке. Величина помех не превышала 3 мВ.
Исследование еязкоупругих свойств объектов. Упругие свойства материалов оценивали путем задания образцам деформаций различной формы с помощью мотора. Одновременно регистрировали силу, возникающую при изменении длины препаратов, предварительно растянутых вручную до удаления их провисания. Величина деформации определялась по относительному изменению длины образца: e = AL/Lo. Механическое напряжение (?) рассчитывали как отношение силы к площади поперечного сечения образца. Модуль упругости (Юнга) E определялся как тангенс угла наклона кривой в координатах л? - ?: tga = ? I? = E.
Для характеристики релаксационных свойств материала к образцу прикладывали ступенчатые деформации прямоугольной формы. Рассчитывали время релаксации ? по модели Максвелла и эффективное значение вязкости образца: ?=??.
Регистрация механоэлектрической связи в объектах. Влияние растяжения на электрические свойства изолированных сердечных мышц исследовали в двух режимах. В статическом режиме препарат растягивали от L0 (исходная длина препарата после устранения провисания) до 1,20 Lmax (Lmax - длина, при которой активная сила препарата максимальна) с шагом 5% L0 . Электрическую активность регистрировали неподвижным электродом. На каждой длине проводили не менее 10 измерений и вычисляли средние величины параметров электрической активности клеток миокарда. В динамическом режиме мышцу растягивали мотором до 1,50 Lmax и затем возвращали к L0 (циклическая деформация) с постоянной скоростью от 0,03 до 0,3 м/сек. Измерения электрического потенциала велось с помощью подвижного плавающего микроэлектрода.
12
Для выявления механоэлектрической связи в синтетических гелях использовали оборудование, аналогичное описанному выше для мышц. Образцы геля растягивали либо ступенчато, либо непрерывно в динамическом режиме на величину до 50% от их начальной длины.
Экспериментальная модель желудочка была разработана на базе комплекса устройств экспериментальной установки (см. рис. 1) для оценки механического поведения миокарда в сердечной стенке. Свойства стенки желудочка были представлены изолированным миокардом, а архитектура камеры математической моделью тонкостенной сферы. Мышечное взаимодействие со сферической моделью осуществлялось на основе обратной связи в реальном времени с помощью компьютера.
Электрический сигнал от датчика силы (F) соответствовал мышечному напряжению (?), рассчитанному как cr=F/s, где s поперечное сечение мышцы. Давление (Р) в сферическом желудочке рассчитывали по закону Лапласа. Радиус камеры рассматривали как R=kбl, где / - текущая длина мышцы, a kб - коэффициент преобразования текущей длины в радиус сферической камеры. Объем камеры (V) желудочка рассчитывали как: V=4/3nR2.
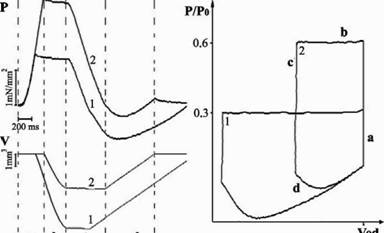
На рис. 2. приведены примеры экспериментальной записи полного сердечного цикла модельного желудочка при двух постнагрузках и диаграммы давление-объем, характеризующие его насосную функцию. Для данного эксперимента была выделена сердечная мышца из желудочка лягушки {Rana radibunda), длиной около 4 мм и поперечным сечением ~2 мм2. Вначале задавали величину пред нагрузки желудочка и его конечно-диастолический объем.
|
Рис. 2. Пример работы
модельного желудочка
во время сердечного
цикла и диаграммы его
насосной функции при
двухпостнагрузках
(пояснения в тексте).
13
Трасса, обозначенная как л1, соответствует сокращению желудочка, когда давление на периферии (постнагрузка) составляет 30% от максимально возможного изоволюмического давления (Р0) при данном конечно-диастолическом объеме желудочка. Трасса, обозначенная л2, соответствует экспериментальным условиям, когда постнагрузка для желудочка составляет 60% от Р0. На этом же рисунке (справа) показаны диаграммы связи давление-объем для сокращений желудочка при двух постнагрузках. По оси абсцисс -объем желудочка, по оси ординат -давление, нормированное на максимальную величину (Р0). Фазы сердечного цикла : а - изоволюмическое сокращение, в - фаза выброса, с-изоволюмическое расслабление, d - фаза диастолического наполнения.
Для имитации различной степени структурно-функциональной неоднородности в стенке модельного желудочка к компьютерному блоку управления экспериментом были дополнительно подключены устройства для механического испытания еще одной сердечной мышцы, идентичные уже имеющимся (см. рис. 1). Не смотря на то, что препараты находились в отдельных экспериментальных камерах и механически соединены с независимыми техническими устройствами, алгоритм управления представлял каждую их мышц соответствующим элементом стенки желудочка.
Работа желудочка в данном случае была реализована на принципе взаимодействия тандема двух мышц, сформулированном много лет назад (Tyberg et al, 1969) и развитом позже (Бляхман, 1996). В компьютерной системе управления две мышцы были представлены механически соединенными последовательно. Для этого сила мышц поддерживались одинаковой за счет динамического перераспределения длин препаратов с помощью соответствующих сервомоторов. При наличии взаимодействия двух мышц, лимплантированных в сердечную стенку, радиус камеры, ее объем, и изменение этих параметров рассчитывали, на основе оценки текущей длины препаратов во время эксперимента.
Для моделирования различных типов структурно-функциональной неоднородности в сердечной стенке были использованы препараты миокарда с исходно неодинаковыми морфо-функциональными характеристиками. Кроме того, наличие независимых систем жизнеобеспечения мышц, позволило управлять масштабом неоднородности за счет, например, введения временных задержек в стимуляцию мышц, либо внесения в перфузат одной из них кардиотропных соединений.
14
Определение степени набухания - сжатия гелей. В зависимости от поставленной задачи, в ряде экспериментов оценивали степень набухания геля, то есть его способность поглощать растворитель. В других случаях необходимо было оценить процесс сжатия геля, то есть уменьшение его объема. Применяли два различных метода оценки степени набухание-сжатие.
В статических условиях эксперимента оценивали степень набухания образца как отношение веса набухшего в соответствующем растворе образца к весу остатка после полного его выслушивания: а = (РнабуХ-
* сухой/' * сухой
При исследовании динамики процесса сжатия применяли метод видеосъемки, для чего была разработана оптическая установка, включающая видеокамеру (лSamsung VP-W80) формата Hi8 с выходным сигналом формата PAL. Камера была сопряжена с персональным компьютером, где видеоизображения объекта оцифровывались с помощью аналого-цифрового устройства (лConexant Ы878). Были разработаны алгоритмы обработки видеоизображений и использована оригинальная программа в среде Delphi, позволяющая количественно оценить линейные размеры образца в любом направлении, а также площадь видимой поверхности геля и полную абсолютную погрешность вычисления площади.
Обработка экспериментальных данных.
Статистическая обработка данных осуществлялась с использованием пакетов программы Microsoft Excel и Statistica-6. Нормальность распределения данных проверялась критерием Шапиро-Уилкса. Значимость различий непрерывных величин определялась по критерию Манна-Уитни, достоверность корреляции с помощью рангового коэффициента Спирмена. В ряде случаев был применен дисперсионный и регрессионный анализы. Достоверность уравнений регрессии оценивалась по критерию Фишера.
РЕЗУЛЬТАТЫ РАБОТЫ И ИХ ОБСУЖДЕНИЕ
В первом разделе экспериментальной части работы, приведены результаты исследований электрической активности кардиомиоцитов и МЭС в сердечной ткани нормальных животных и человека, при возникновении в его сердце патологических изменений. Данный фрагмент
15
работы был выполнен на базе Института гигиены труда и профзаболеваний под руководством профессора Мархасина B.C.
В табл. 1 приведены средние значения параметров, характеризующих электрическую активность папиллярных мышц, для всех тестированных препаратов миокарда. Обращает на себя внимание высокие значения средних ошибок для всех временных характеристик ПД папиллярных мышц больных с пороками сердца. Данный факт связан с тем, что в ряде случаев в биоптатах папиллярной мышцы человека наряду с нормальными клетками присутствовали и клетки с измененными электрофизиологическими характеристиками.
Табл. 1. Параметры электрической активности кардиомиоцитое папиллярных мышц лабораторных животных и больных пороками сердца |
|||||
Объект |
ПП (мВ) |
Амплитуда ПД (мВ) |
ВДМ (мс) |
ВР (50%) (мс) |
ВР(90%) (мс) |
больные пороками сердца (п=25) |
-8512 |
11511 |
2110 |
20050 |
42055 |
ягушка (п=5) |
-939 |
1012 |
10015 |
72223 |
80312 |
морская свинка (п=5) |
-786 |
1168 |
201 |
38414 |
45211 |
кролик (п=8) |
-882 |
1071 |
182 |
2124 |
31312 |
В таких клетках регистрировали низкие значения амплитуды ПП и ПД и замедленную фазу деполяризации по сравнению с нормальными кардиомиоцитами. Вместе с тем, следует констатировать отсутствие каких-либо значимых отличий в параметрах электрической активности кардиомиоцитов папиллярных мышц экспериментальных животных и человека.
Электрические характеристики миоцитов предсердий больных врожденными и приобретенными пороками сердца отличались большим разнообразием, чем клетки желудочков. В частности, величина ПП в клетках предсердий варьировала от -45 до -75 мВ, в среднем -6218 мВ. При этом кардиомиоциты больных приобретенными пороками сердца имели значение 1111 достоверно меньшее по абсолютной величине, чем клетки у больных с врожденными пороками: -5412 мВ и -738 мВ, соответственно.
Здесь же следует добавить, что спонтанная электрическая активность миоцитов была установлена только в препаратах миокарда предсердий, в то время как в клетках сердечной ткани желудочка, то есть
16
в биоптатах папиллярных мышц экспериментальных животных и больных с дефектами митрального клапана, не была обнаружена.
В миокарде больных септальными дефектами сердца вспышки ритмической активности проявлялись чаще, чем в биоптатах предсердий больных ревматическими пороками сердца. При одновременной записи электрической и механической активностей кардиомиоцитов (рис. 3) можно было видеть, что во многих препаратах отсутствовала синхронизация между электрической спонтанной активностью, возникающей в этой клетке, и механическим ответом всего препарата миокарда (рис. За и б).
В случаях, представленных на рис. 3(в,г) электрическая и механическая активности препарата хорошо синхронизованы. На рис. 3(г) показана задержанная постдеполяризация, которая регулярно следует за каждым ПД. Видно, что постдеполяризация сопровождается сократительным ответом мышцы.
Примечательно, что авторитмическая активность кардиомиоцитов могла быть легко индуцирована различными воздействиями. В частности, внесение адреналина в концентрации 0,1 ммоль/л в питательный раствор или повышение его температуры всего на 1-2С приводило к возникновению устойчивой и регулярной авторитмической активности.
Вспышки спонтанной активности возникали также при случайном растяженииа препаратова миокарда воа времяа их крепленияа в
17
экспериментальной камере. Данное наблюдение косвенно свидетельствует о наличие МЭС в миокарде, количественному описанию которой был посвящен следующий раздел экспериментальной части работы.
Относительные величины параметров типичных ПД клеток папиллярных мышц кролика и больных пороками сердца при растяжении препаратов до длины, близкой к Lmax , то есть на 25% от исходной длины, приведены в табл. 2.
Табл. 2.аа Изменениеаа электрофизиологическихаа параметров кардиомиоцитое при растяжении до L=L0+25% LД.
ТипПД |
ППьтах/ nnLo |
АПДЬтах/ АПДЬо |
вдмЬтах/ вдмЬо |
BPbmax/ BPlo |
ПД папилл. мышцы кролика(п=5) |
1.000.03 |
1.000.02 |
1.000.02 |
1.000.03 |
Нормальные ПД больных (п=8) |
1,000.05 |
0.980.04 |
0.990.03 |
1.000.01 |
Медленные ПД больных (п=12) |
0.840.42* |
0.740.11* |
1.500.27* |
0.830.08* |
*-р<0,05
Согласно полученным данным можно заключить, что кардиомиоциты папиллярных мышц экспериментальных животных и нормальных клеток у больных пороками сердца в физиологическом диапазоне растяжений демонстрируют слабо выраженную механоэлектрическую связь.
Полученный результат не означает, что в таких клетках нет МЭС. Данный факт, скорее всего, говорит о том, что выбранный нами диапазон деформаций препарата не достаточен для проявления МЭС в конкретной клетке. Другими словами, относительное растяжение фрагмента нормальной ткани не совпадает по величине с относительным растяжением кардиомиоцита.
Действительно, на изолированных кардиомиоцитах желудочка крысы установлено, что их растяжение на 20% от начальной длины приводило к сдвигу мембранного потенциала на 15-20 мВ (Nishimura et al., 2008). Растяжение изолированных кардиомиоцитов желудочка морской свинки в примерно таком же диапазоне вызывало выраженную деполяризацию потенциала покоя (Nishimura et al, 2008). На математической модели электромеханического сопряжения в сердечной ткани была установлена величина деформации, способная вызвать появление индуцированного растяжением потенциала действия, равная 24%) от начальной длины кардиомиоцита (Cherubini et al., 2008).
18
Таким образом, полученный нами результат об отсутствии МЭС в
нормальном миокарде свидетельствует о том, что в физиологическом
диапазоне деформаций сердечной стенки растяжение не оказывает
выраженногоа влиянияа наа механизмы,а контролирующие
механоэлектрическое преобразование в кардиомиоцитах.
Напротив, в клетках патологически измененного миокарда желудочков с исходно модифицированными электрофизиологическими характеристиками МЭС проявлялась достоверно ярче, чем в нормальных кардиомиоцитах (см. табл. 2). На рис. 4(a) в форме суперпозиции приведены записи ПД клетки, чувствительной к растяжению, до- и после задания деформации. В таком представлении хорошо видно, что растяжение препарата миокарда приводит к деполяризации ПП кардиомиоцита на 10 мВ и изменению временных параметров ПД.
В миокарде предсердий больных врожденными и приобретенными пороками сердца наиболее часто наблюдалось наличие двухкомпонентных ПД (рис. 46), состоящих из препотенциала (первый компонент) и последующего высоковольтного спайка (второй компонент). Возникновение второго компонента при деформации препарата начинало запаздывать, причем, чем больше было растяжение, тем больше запаздывание.
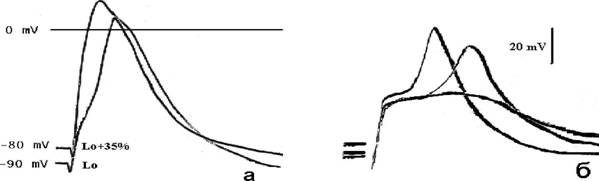
Рис. 4. Суперпозиция потенциалов действия кардиомиоцитов изолированной папиллярной мышцы (а) и миокарда предсердий (б) больных пороками сердца до- и после их растяжении.
Так, в одном из конкретных примеров, при L=Lo время задержки между компонентами ПД составляло 130 мс, при L = Lo+10%Lo - 460 мс, а при L = Lo+20%Lo - 660 мс. Скорость нарастания второго компонента ПД уменьшалась по мере растяжения (0,17 В/с при L= L0 и 0,06 В/с при L = L0 +20% L0). Как видно на рис. 4(6) в конечном итогеаа наблюдалось
19
полное исчезновение этого компонента. В клетках с двухкомпонентными потенциалами действия ПП составлял -65 мВ, то после растяжения на 25% L0 его величина приближалась к -55 мВ.
Таким образом, в патологически измененном миокарде предсердий человека существует тесная связь между параметрами электрической активности клеток и величиной механической деформации. Растяжение сердечной ткани, даже в физиологических пределах может быть потенциально важным детерминантом формирования ПД в клетках и, следовательно, оказывать непосредственное влияние на механическую функцию миокарда в целом.
Качественно похожий результат был получен и другими авторами, например, на кардиомиоцитах пациентов с хронической сердечной недостаточностью, где незначительные деформации клетки сопровождались существенным сдвигом мембранного потенциала (Kamkinetal.,2000).
Сравнение результатов о выраженности МЭС в норме и патологии дает основание высказать несколько в одинаковой мере реалистичных суждений. Первое, степень МЭС зависит от морфологии миокарда, оказывающей влияние, прежде всего, на упругие свойства сердечной ткани. На это указывает исходно высокое пассивное напряжение и крутая зависимость длина - пассивное напряжение в патологическом миокарде. Данный факт, вероятно, связан с наличием гипертрофии и фиброза у пациентов с пороками сердца.
Второе суждение вытекает из результатов наших экспериментов с использованием фармакологического препарата фенотиазинового ряда -этмозина. Основной эффект этого вещества заключается в снижении скорости фазы деполяризации ПД за счет ингибирования быстрого входящего натриевого тока. Исследования были проведены на препаратах папиллярных мышц кролика и биоптатах папиллярных мышц больных пороками сердца, у которых исходно были зафиксированы ПД близкие к нормальным.
Оказалось, что добавление в перфузирующий раствор этмозина в концентрации 2x10"5 М приводило к увеличению выраженности МЭС как в папиллярных мышцах кролика, так и больных пороками сердца (табл. 3).
Полученный результат о влиянии этмозина на выраженность механоэлектрической связи в нормальном миокарде дает основания полагать, что при частичной или полной блокаде быстрого натриевого внутрь направленного тока увеличивается роль механизмов, ответственных за реализацию механоэлектрического преобразования в
20
кардиомиоцитах. Следовательно, можно говорить о соответствующей роли мембранных структур, регулирующих ионный баланс в клетке, и принимающих участие в реализации МЭС.
Табл. 3. Изменение электрофизиологических параметров кардиомиоцитое папиллярных мышц больных пороками сердца и кролика при растяжении до 25% L0 до- и после действия этмозина.
пд |
Этмозин 2*10~5М |
ППьтах/ nnLo |
АПДЬтах/ АПДЬо |
вдмЬтах/ вдмЬо |
BPbmax/ BPlo |
нормальные ПД больных (п=8) |
- |
1,000.05 |
0.980.04 |
0.990.03 |
1.000.01 |
нормальные ПД больных (п=8) |
+ |
0.850.26 |
0.750.08* |
1.780.20* |
0.570.09* |
папиллярной мышцы кролика(п=3) |
- |
1.000.03 |
1.000.02 |
1.000.02 |
1.000.03 |
папиллярной мышцы кролика(п=3) |
+ |
0.950.12 |
0,800,09* |
1,690,35* |
0,570,09* |
*-р<0,05
Следует добавить, что значительная вариабельность характеристик потенциалов клеток патологического миокарда, их высокая степень авторитмичности, дают основания рассматривать деформацию сердечной ткани в качестве модулятора электрической активности кардиомиоцтов и, следовательно, функции сердца при патологии, включая структуру сердечного ритма.
Важная роль деформации миокарда для деятельности сердца побудила нас к исследованию возможных механизмов растяжения сердечной стенки в норме и патологии. Сердечная ткань представляет собой вязкоупругое тело. При любом данном значении пред нагрузки в камере диастолическое растяжение регионов сердечной стенки определяется их упругими свойствами, а также особенностями геометрии камеры (толщина стенки, радиус кривизны). Следовательно, чем выше степень структурной неоднородности сердечной стенки, тем больше различия в величине деформации регионов.
21
На первый взгляд, высказанное умозаключение выглядит вполне тривиальным, во всяком случае, с точки зрения законов физики. Однако оно позволяет объяснить, почему различные участки сердечной стенки в конце диастолы имеют неодинаковую степень растяжения. Неоднородность распределения длин сократительных элементов имеет место также на клеточном и субклеточном уровне мышцы. Данное обстоятельство приобретает необычайно большое значение в патологически измененном сердце.
Между тем, в настоящем разделе работы мы обратили внимание на ряд факторов, которые способны детерминировать растяжение регионов сердечной стенки, прежде всего, в период систолической функции миокарда, то есть после возбуждения сердца. В столь нетривиальной постановке провести подобное исследование в интактном сердце не представляется возможным из-за ряда методических ограничений. Для этого была разработана и использована гибридная модель желудочка (см. Методы), в которой с помощью компьютерных средств управления экспериментом свойства сердечной стенки были представлены двумя изолированными мышцами, а геометрия камеры в виде математической модели тонкостенной сферы. Использование двух препаратов миокарда, соединенных механически в последовательный тандем, позволило нам имитировать различные струкурно-функциональные неоднородности в стенке желудочка в норме и патологии. Это дало возможность изучить вклад неоднородности в регуляцию растяжения миокарда.
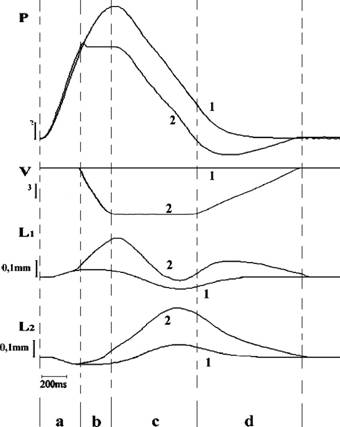
Рис. 5 демонстрирует пример работы модельного желудочка за полный сердечный цикл. Два мышечных препарата желудочка лягушки с различным поперечным сечением были использованы для испытания. Масштабные коэффициенты были выбраны одинакового значения, поэтому вклад регионов в систолическую функцию был одинаковым. Предварительно были заданы значения конечнодиастолического давления (преднагрузки) и конечнодиастолического объема в камере.
Трассы л1 на этом рисунке соответствуют условиям изоволюмического сокращения желудочка, то есть когда постнагрузка (давление на периферии) больше, чем максимально возможное систолическое давление (Р0), возникающее при данном значении конечнодиастолического объема. Видно, что при постоянном объеме в камере возрастающее давление в ней после возбуждения миокарда приводит к перераспределению длин мышц, то есть участков сердечной стенки.
22
Не смотря на то, что изоволюмическое сокращение не является физиологическим для сердца, рассмотрение такого режима нагрузки на миокард позволяет выяснить механизм взаимоотношений регионов сердечной стенки с неодинаковой толщиной. Сила, генерируемая мышцей, прямо зависит от ее поперечного сечения, причем, чем оно больше, тем сильнее препарат. Это означает, что в любой момент времени сила толстой мышцы, больше чем тонкой. Поэтому, начиная с момента возбуждения миокарда, препарат с большим поперечным сечением (Li) укорачивается, растягивая при этом мышцу с меньшим сечением (L2). Для желудочка это означает различное по направлению движение одних регионов стенки по отношению к другим. Другими словами, это означает, что за счет различной толщины регионов сердечной стенки, участки с большим поперечным сечением деформируют регионы с меньшим сечением.
|
lmN/mm' |
10mm |
Рис.5.Пример
экспериментальнойзаписи
механическихпараметров
мышц мышцы смещение трассы для сокращения трассы, |
евого желудочка во время
сердечного цикла. Р - давление
внутри сферического желудочка;
V - объем камеры; Lб и L2
изменениедлин
(укорочению
соответствует
кривой вверх); 1
изоволюмического
желудочка; 2
полученные в ходе моделирования
полного сердечного цикла. Фазы
сердечного цикла: а -
изоволюмическое сокращение, b -
изгнание, с - изоволюмическое
расслабление,d-
диастолическое наполнение.
На этом же рисунке трассы л2 соответствуют экспериментальным условиям, когда постнагрузка для желудочка была установлена равной 70% от Р0. В этом случае желудочек выполняет насосную функцию в соответствии со всеми
23
фазами сердечного цикла. Хорошо видно, что вклад мышц в процесс изгнания крови желудочком значительно отличается. Прежде всего, это связано с тем, что в период изоволюмического сокращения (промежуток времени ла на рис. 5) происходит перераспределение длин между препаратами. Поэтому к моменту фазы изгнания, участки сердечной стенки находятся в принципиально различных условиях нагрузки.
С помощью масштабных коэффициентов у нас имелась возможность изменять процентное соотношение присутствия каждого препарата в составе сердечной стенки. Рис. 6 иллюстрирует механическое поведение мышц с различным поперечным сечением, имплантированных в стенку модельного желудочка.

Рис. 6. Механическое поведение мышц, лимплантированных в модель сферического желудочка и его насосная функция в зависимости от степени неоднородности толщины регионов. (А) -регистрация изменения длин мышц в ходе моделирования полного сердечного цикла. Lб - изменение длины толстого образца, L2 - изменение длины тонкого образца (укорочение мышц соответствует смещению кривых вверх). (В) - петли давление- объем. Ось абсцисс - объем желудочка, нормализованный на величину конечносистолического объема (EDV). Ось ординат - давление желудочка, нормализованное к его максимальной изоволюмической величине (Po). Фазы сердечного цикла: ab - изоволюмическое сокращение, be - изгнане, ed -изоволюмическое расслабление, da - диастолическое наполнение. 1,2- низкая и высокая степень неоднородности, соответственно (пояснение в тексте).
Трассы л1 на этом рисунке соответствуют условиям, при которых тонкий (слабый) сегмент стенки был в 5 раз меньше, чем другой, толстый (сильный). В таком масштабном соотношении практически минимизируется разница в региональной толщине стенки желудочка, поскольку присутствие одной мышцы доминирует над другой. Трассы л2
24
отражают экспериментальные условия, когда оба сегмента имеют одинаковый размер. Это подразумевает максимальную степень неоднородности сердечной стенки по толщине.
На рисунке видно, во-первых, что увеличение структурной неоднородности сопровождается значительным растяжением тонкого участка стенки не только в период фазы изоволюмического сокращения, но еще в большей степени в период фазы изгнания крови. Во-вторых, увеличение неоднородности приводит к снижению ударной работы желудочка в целом (площадь внутри петли давление-объем). По данным всех наблюдений (п=16) растяжение миокарда с меньшим поперечным сечением варьировало в диапазоне 0.17 - 8.0 % от исходной длины.
Функциональную неоднородность в сердечной стенке моделировали несколькими способами. В первой серии экспериментов (п=16) были созданы условия асинхронного сокращения регионов миокарда за счет введения задержек в возбуждении одной мышцы по отношению к другой. Для этой серии экспериментов были подобраны препараты с примерно одинаковым поперечным сечением и близкими по значению механическими характеристиками. Задержки в возбуждении между мышцами задавались в диапазоне 10-15% от длительности механического цикла желудочка. В среднем, при физиологической величине постнагрузки на желудочек примерно 30% от Р0 и задержке в стимуляции 10%), задержанная активация участка камеры желудочка приводила к его растяжению на 11,3+/-1,8% от исходной величины.
В другой серии экспериментов (п=12) функциональную неоднородность в стенке желудочка моделировали за счет использования препаратов с различной сократимостью, величину которой увеличивали путем избирательного добавления хлорида кальция или адреналина в перфузат мышцы. Препараты стимулировали синхронно. С помощью масштабных коэффициентов задавали различную степень присутствия препаратов в стенке желудочка. В такой постановке эксперимента моделировалось ситуация в сердце, качественно схожая с региональной ишемией.
В этой серии экспериментов мы не имели возможности усреднить значения относительного растяжения фрагментов сердечной стенки из-за строго неуправляемого воздействия фармакологических агентов на уровень сократимости миокарда. Вместе с тем, степень растяжения патологического участка стенки варьировала в широком диапазоне, и при некоторых экспериментальных условиях достигала 25-30% от начальных условий.
25
Таким образом, принципиально важный результат этой части работы заключается в том, что существование в сердечной стенке структурно-функциональной неоднородности может оказывать влияние на растяжение миокарда не только в диастолическую часть сердечного цикла, но и в систолический период. На первый взгляд, установленный факт выглядит парадоксально: в систолу, когда миокард генерирует активное механическое напряжение и укорачивается, в отдельных регионах стенки происходит противоположный процесс - растяжение ткани!
В общем случае, полученные факты относятся к феномену механической асинхронности в сердце (Бляхман, 1996), то есть неодинаковому проявлению механической функции регионов сердечной стенки в пространстве и во времени. Механическая асинхронность имеет место, как в нормальном, так и патологически измененном сердце, где масштаб этого явления много больше, чем в норме. Связано это с нарушениями в структуре и функции миокарда в ответ на развитие того или иного заболевания. Развитие гипертрофии или ишемии миокарда, связанный с этим фиброз сердечной ткани и многое другое есть факторы механической асинхронности.
Принимая во внимание высокую степень выраженности МЭС в патологически измененном миокарде, полученный результат свидетельствует о потенциально высоком аритмогенном риске асинхронного сокращения миокарда. Иными словами, механическая асинхронность может выступать дополнительным детерминантом структуры сердечного ритма при патологии.
Сделаем промежуточные выводы по итогам рассмотренной части работы. Итак, в физиологическом диапазоне растяжений миокарда МЭС четко проявляется в патологически измененном сердце. В силу ряда причин, среди которых наличие высокой степени механической асинхронности регионов сердечной стенки, деформация вызывает частичную деполяризацию кардиомиоцитов, видоизменение формы ПД и возникновение авторитмичности. Это может быть связано с увеличением диастолической жесткости сердечной ткани и/или нарушением ионного баланса через мембрану кардиомиоцита.
Уже упоминалось, что механизм механоэлектрической обратной связи в кардиомиоцитах реализуется за счет специализированных мембранных каналов, активируемых растяжением. Предполагается также, что ключевая роль в регулировании активности механочувствительных каналова (МЧ)а принадлежита цитоскелету,а преждеа всего,а его
26
субмембранной структуре, кортексу (Gillespie, Walker, 2001; Ingber, 2008; Doyle, Yamada, 2010). Реалистичность данной гипотезы была подтверждена в многочисленных экспериментах с цитохалазином, ингибитором полимеризации F-актина - основного компонента кортекса (Guharay, Sachs, 1984; Kim, 1993; Karpushev et al, 2010; Zhang et al, 2000; Wang et al, 2002; Els, Chou, 1993; Isenberg et al, 2003; Kamkin et al, 2003). Действие цитохалазина приводит к снижению плотности сшивки трехмерной сети цитоскелета и уменьшению его упругости. Это обстоятельство может приводить к уменьшению жесткости мембраны и, следовательно, к повышению чувствительности канальных структур мембраны к растяжению (Mils et al, 1994; Dick, Lab, 1998; Byfield et al, 2004; Rotsch, Radmacher, 2000).
С точки зрения объяснения наших находок в эксперименте на изолированном миокарде, упомянутые выше предположения других авторов вполне созвучны. Роль упругих свойств кардиомиоцитов и трансмембранных ионных токов в реализации МЭС выглядит весьма реалистично.
Вместе с тем, исходя из особенностей структуры и функции цитоскелета, его роль лишь в качестве посредника в регулировании МЭС выглядит, по меньшей мере, слишком примитивной. Чтобы расширить наши представления о значимости цитоскелета в регулировании функции клеток нами была разработана экспериментальная модель этого объекта на основе синтетических полиэлектролитных гидрогелей.
Выбор основывался на поразительном сходстве особенностей структуры синтетических и биологических полиэлектролитных гелей, отмеченном ранее рядом исследователей (Ling, 1990, 2003; Pollack, 2001, 2006). Действительно, цитоскелет эукариотической клетки представляет собой трехмерную густую сеть белковых нитей, которые погружены в жидкую фазу цитозоля, по сути, представляющую собой белково-ионно-водный матрикс.
|
|
Рис. 7. Актиновыи
субмембранный цитоскелет
фибробластое - А (Васильев,
1996),
схема структурной
организации
полиэлектролитного геля -Б.
27
Основные компоненты сетки субмембранного цитоскелета (кортекса) - филаменты актина и сшивающие их белки (рис. 7 А). Актин-связывающие белки выступают в роли сшивок и контролируют организацию актина в структуру, похожую на сетчатый гель. Актин имеет отрицательно заряженные карбоксильные группы, а жидкая составляющая цитозоля содержит низкомолекулярные ионы (Васильев, 1996; Nakamura, 1996; Kinoshitaet et al, 2009; Tang et al,1996).
С физико-химической точки зрения, белковая ионно-водная структура цитоскелета напоминает синтетический полиэлектролитный гель с рыхлой полимерной сетью, набухшей в растворителе (рис. 7 Б). Сшивки между полимерными цепями могут осуществляться как за счет лабильных зацеплений, образованных слабыми связями (например, водородными), так и за счет устойчивых ковалентных связей (Хохлов, 1998). Полиэлектролитные гели содержат ионогенные группы, способные диссоциировать с образованием заряженного звена и противоиона.
Поразительно, что силы, действующие между белками цитоскелета и жидкой фазой цитоплазмы те же самые, что и в синтетических полиэлектролитных гелях, помещенных в растворы воды. Они включают Ван-дер-ваальсовые силы, гидрофобные взаимодействия, водородные связи, кулоновские взаимодействия между участками заряженных белковых или полимерных сетей и окружающих их ионов.
В настоящей работе были использованы гели, синтезированные на основе соли полиметакриловой (полиакриловой) кислот с ковалентно сшитыми полимерными сетками. Полиэлектролитные гели содержали ионогенные группы, способные диссоциировать с образованием заряженного звена и противоиона. В исследуемых гелях диссоциация приводила к образованию отрицательно заряженных звеньев из-за наличия карбоксилатных групп и свободно диффундирующих положительно заряженных ионов соответствующего металла (К, Са, или Mg) в качестве противоионов.
Не смотря на необычайное структурное сходство синтетических гелей и актинового цитоскелета, первостепенный вопрос, на который нам необходимо было получить ответ, связан с функциональной адекватностью разработанной модели ее биологическому прототипу. Для этого мы детально изучили электрические и механические свойства гидрогелей. Этому посвящена следующая экспериментальная глава настоящей работы.
Так, было установлено, что в синтетических гидрогелях возникает неравновесное распределение подвижных низкомолекулярных
28
противоионов внутри геля и таких же ионов в окружающей гель среде. Это приводит к возникновению потенциала Доннана (Donnan, 1924). Анионные гели, то есть, гели с преобладанием отрицательно заряженных кислотных групп, при установлении Доннановского равновесия обладают отрицательным электрическим потенциалом по отношению к окружающему растворителю. Примеры регистрации потенциала при погружении электрода в гели с различной ионизацией представлены на рис. 8.
Измерения равновесных потенциалов во всем ассортименте имеющихся образцов гелей в растворах с различными солями выявили аналогичный процесс. Всегда, при увеличении ионной силы раствора, равновесный электрохимический потенциал геля уменьшался по абсолютной величине. Выявленная закономерность снижения величины потенциала при повышении ионной силы является достоверной. Об этом свидетельствует высокий коэффициент обратной корреляции г= -0,871; р<0,01. Знак минус означает, что чем выше ионная сила раствора, тем ниже отрицательные величины потенциала геля.
Таким образом, мы выяснили, что анионные гели при установлении Доннановскогоаа равновесияаа обладаютаа отрицательнымаа электрическим
30
потенциалом по отношению к окружающему растворителю. Зависимость величины электрохимического потенциала от вариации внутренних параметров геля или внешних условий можно объяснить на основе уравнения Доннана:
Fа [H+Yаа Fа [ОН~ Y
Варьирование плотности сшивки геля приводит к изменению расстояния между нитями полимера, что может влиять на процессы диссоциации ионов, следовательно, на их концентрацию. Природа полимера влияет на конфигурацию полимерных цепей в соответствии с их взаимодействием с водой (гидрофильность и гидрофобность). Наконец, очевидно, что внесение солей в окружающий раствор сдвигает условия Доннановского равновесия и приводит к изменению электрохимического потенциала системы.
Наличие потенциала в гелях было установлено и другими авторами (Guelch et al., 2000; Gao et al., 2003). Однако созданные нами гели имели электрохимический потенциал близкий по величине к таковому в клетке. Возможность направленного и контролируемого синтеза гелей позволила нам подобрать материал, наиболее близкий по своим свойствам к биологическому прототипу. Важно отметить, что в качестве противоионов были использованы физиологически значимые для клетки элементы: калий, кальций, магний. Следовательно, формирование потенциала внутри геля также как и в клетке было связано с ограниченной диффузией аналогичных ионов.
Далее, в этом же разделе работы мы подробно рассмотрели механические свойства гидрогелей. Было установлено, что полимерная сеть гидрогеля проявляет вязкоупругие свойства. При периодических треугольных линейных деформациях сила в период растяжения увеличивалась близко к линейному закону, а в период укорочения образца эта зависимость носила экспоненциальный характер. При задании деформаций прямоугольной формы равновесное значение механического напряжения в геле достигалось в результате релаксационного процесса, происходящего в две стадии (рис. 10).
Значения модуля упругости, например, для образцов гелей СаПМАКЮО/100, СаПМАК200/100, СаПМАКЗОО/100 в воде составили в среднем: Е=3,90,5 кПа, Е=3,40,2 кПа и Е=2,20,4 кПа, соответственно. Модуль упругости гидрогелей линейно зависел от степени сшивки полимерных нитей (коэффициент корреляции г=-0,79; р<0,01; п=15).
31
Знак минус означает, что с уменьшением числа звеньев на одну сшивку модуль упругости образцов геля возрастает. То есть, рыхлые гели, у которых на одну сшивку приходится большее количество мономерных звеньев, менее упруги.
Эффективная вязкость была рассчитана в каждый период времени, при быстрой релаксации ?} и медленной ?2. Значения составили для СаПМАКЮО/100 //;=1.560.29 кПа*с //2=4.680.68 кПа*с, СаПМАК200/100 //;=0.680.25 кПа*с ?2=2.90.29 кПа*с и СаПМАКЗОО/100 //;=0.430.15 кПа*с //2=0.810.21 кПа*с. Данные свидетельствуют, что вязкость геля возрастала при увеличении степени сшивки. Зависимость носила линейный характер, коэффициент корреляции, г = -0,921; р<0,01; п=\5.
Полученные факты убедительно говорят, что по своим механическим характеристикам синтезированные нами гели напоминают клетки возбудимых тканей (Charras et al; 2004; Nishimura et al., 2008). В частности, модуль упругости изолированных кардиомиоцитов составлял 3-5 кПа (Nishimura et al., 2006). Параметры процесса релаксации (время релаксации, значение эффективной вязкости) также хорошо согласуются с результатами исследований на биологических объектах (Tagawa et al, 1997; Lammerding et al., 2003; Nishimura et al, 2006; Alberts, 2009; Moreno-Flores et al, 2010).
Более того, зарегистрированные величины упругости гидрогелей хорошо согласуются с данными других авторов, полученными при исследовании цитоскелета живых клеток. Так, модуль Юнга актиновых волокон в эндотелиальных клетках имел значение 5-10 кПа (Lu et al., 2008), в клетках фибробластов модуль упругости цитоскелета приблизительно равен 1 кПа (Mofrad, 2009).
32
Универсальное свойство полиэлектролитных гелей заключается в их способности к обратимым процессам сжатия-набухания при смене растворителя. Внесение в окружающий раствор ионов кальция в концентрации 10 мМ приводило к сжатию геля. Этот процесс регистрировали в двух режимах, обычно применяемых для исследования механических свойств изолированных мышц. Такой подход связан с тем, что во время сердечного цикла кардиомиоциты в разные моменты времени находятся в подобных условиях нагрузки. На рис. 11 видно, что при повышении ионной силы раствора за счет внесения в него ионов кальция, при фиксированной длине образца (изометрический режим нагрузки) гель генерировал силу, а при постоянной нагрузке (изотонический режим) образец укорачивался.
|
|
|
100 200а 300а 400 500 000а 700 800а 900аа 1000а 1100а 1
70а ВОаа 90 100 110 120аа 130аа 110 150аа 160 170 1SQаа 190аа 200
Рис. 11. Экспериментальная запись изометрического (А) и изотоническогоа (Б)а сокращенияа (сжатия)аа дляа образца геляа СаПМАК.
Верхняя панель - сила, нижняя - длина образца (укорочение вверх).
Увеличение ионной силы раствора до 0,03 г-и/л сопровождалось снижением степени набухания геля СаПМАК почти в 10 раз и увеличением модуля Юнга с 2.0 до 5.0 кПа. Анализ сводных данных позволил выявить высоко достоверную связь между степенью сжатия-набухания гелей (а) и модулем упругости (Е). Зависимость хорошо аппроксимировалась уравнением линейной регрессии Е=-1.5а+11.5, коэффициент корреляции г=0.882, р<0,01; п=16. Следовательно, чем больше степень набухания геля, тем ниже значение модуля Юнга. Другими словами, по аналогии с мышечной тканью увеличение механического напряжения в геле за счет его сжатия приводит к возрастанию жесткости объекта.
Таким образом, полиэлектролитные гидрогели, выбранные нами в качествеаа экспериментальнойаа моделиаа цитоскелета,аа проявляют
33
электрические и механические свойства, качественно и количественно схожие с биологическим объектом. Следовательно, разработанная нами экспериментальная модель цитоскелета адекватна по структуре и функции биологическому аналогу. Необходимо добавить, что все эксперименты на синтетических и биологических объектах были выполнены на одном и том же оборудовании (см. Методы). И это есть дополнительный аргумент в пользу адекватности используемой модели.
В контексте поставленной цели настоящего исследования, наибольший интерес представляют результаты исследования МЭС в синтетических гидрогелях, чему была посвящена самостоятельная глава работы. Предпосылкой для детального изучения МЭС в гелях послужили результаты экспериментов, в которых нами была установлена достоверная связь между степенью сжатия-набухания геля и величиной потенциала в нем. Коэффициент корреляции имел значение -0.934 (п=19, рО.001). Знак минус означает, что чем больше степень набухания геля, тем отрицательнее потенциал. Регрессионный анализ показал статистически значимую логарифмическую зависимость потенциала от степени набухания: ? = -35,3Ln(a) - 24,8; R2 = 0.96.
|
О т-------------- 1------------ 1------------ 1------------ 1------------ 1------------ 1------------ 1----------------- 1 -8а -7а -6аа -5аа -4а -3аа -2аа -1аа О 1од[С(Са!*,М)1 |
Рис. 12. Изменения степени набухания и электр охими ческого потенциала геля КПМАК 200/25 при различных концентрациях ионов Са++ e растворе. По оси абсцисс - логарифм концентрации ионов кальция в растворе в молях, по оси ординатаа относительное изменение степени набухания геля (пояснение в тексте).
На рис. 12. представлена зависимость изменения степени набухания (?/?0) и потенциала (?/?0) от концентрации ионов Са"^ в растворе. Показаны средние величины параметров (п=8). Отношения ?/?0 и ?/?0 вычисляли путем нормирования текущего значения параметра на величину этих показателей в чистой воде (?0, ?0), принятых за единицу. Данные демонстрируют, что резкое изменение объема за счет вытеснения
34
части растворителя из полимерной сети происходит при более низких концентрациях Са++, чем изменение электрохимического потенциала. Другими словами, при любой фиксированной концентрации Са^ величина объемных (механических) преобразований в геле больше, чем электрохимических преобразований.
Полученный факт имеет принципиальное значение, поскольку прямо указывает на ключевую роль механических явлений в гелях в регулировании электрического потенциала в них. Действительно, выяснилось, что выбранные нами гели имеют высокую чувствительность к растяжению, подобно тому, что мы наблюдали в патологическом миокарде. Типичный пример экспериментальной записи приведен на рис. 13.
|
I I Iаа I Iаа I Iаа I Iаа I Iа I i............... L......J..................... 1............... 1............ J.............. L............. 1............ 1.............. L............ J............... |
;а жжжжж!...... жжжi........ г*...... г*..... г*...... г....... i...... т....... |ЧжЧi....... гл.
i i i i i---------------- 1 i i i iаа i
Рис. 13. Экспериментальная запись одного цикла деформации образца геля Mg ПМАК 200/100. Верхняя ломаная линия (в) - изменение длины образца, нижняя кривая (?) - изменение потенциала.
Начальная величина электрохимического потенциала (?) была равна -124 мВ, что на рисунке соответствует минимальному значению на кривой регистрации потенциала. Отклонение этой кривой вверх означает смещение потенциала в область менее отрицательных величин. В конкретном примере при растяжении геля на 17% его потенциал изменялся на 17 мВ и составлял -107 мВ, или 86% от начальной величины электрохимического потенциала. Важно отметить, что максимум растяжения образа по времени возникал раньше, чем максимумом потенциала по абсолютной величине. То есть имеет место определенная задержка между изменением длины препарата и возникновением электрических событий в геле.
Варьирование амплитуды деформации (?) при заданной скорости изменения длины, равной 0,1 мм/с, выявило высоко значимую зависимость потенциала от степени растяжения образца: п=10, г=0.992, /?<0.001. С увеличением степени растяжения геля электрохимический потенциал снижается по абсолютной величине. Другими словами, чем
35
больше деформация образца, тем гель становится заряженным менее электроотрицательно. Данная зависимость хорошо описывалась уравнением линейной регрессии: (р(мВ)=122.б8(А17Ь0)-246.7; R2=0,983.
На рис. 14 показана связь между относительным изменением потенциала и деформацией образца геля при двух скоростях растяжения. Видно, что при увеличении скорости растяжения геля крутизна зависимости падает (прямая 2). Количественно, об этом свидетельствует значение коэффициента уравнения линейной регрессии, отражающего наклон прямой. Так, для высокой скорости деформации коэффициент регрессии равен 52,7; а для медленной - 97,5.
|
Рис.аа 14.аа Зависимостьаа изменения
потенциалаотскорости
растяжения.
1.аа скоростьа 0.015а ед.дл.аа ва сек.,аа 2. скорость 0.040 ед.дл. в сек.
1.00
1.05
1.10
1.15
1.20
ULo
Таким образом, было установлено, что электрохимический потенциал гидрогеля зависит от величины и скорости продольной (осевой) деформации объекта. Причем, чем больше величина относительного растяжения геля, тем меньше по абсолютной величине его потенциал. Кроме того, при любой фиксированной величине деформации, относительное изменение потенциала тем больше, чем меньше скорость растяжения образца.
Исходя из полученных закономерностей, не трудно было предположить, что величина потенциала в геле может быть тесно связана с упругими свойствами материала. В табл. 5 представлены значения электрохимического потенциала и модуля упругости (Юнга) для гелей различной природы. Видно, что жесткость геля возрастает с уменьшение количества мономеров, приходящегося на одну сшивку, а величина потенциала снижается по абсолютной величине.а Так, для Mg ПМАК
36
коэффициент корреляции между величиной потенциала и модулем Юнга имел значение: г=0,982 (р<0,01), а для Са ПМАК: г=0,959 (р<0,01).
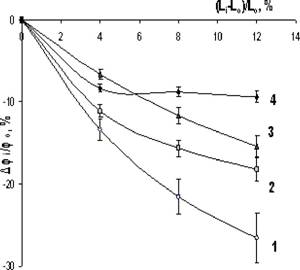
Для сравнительной оценки эффекта растяжения гелей на степень выраженности МЭС в них, были вычислены относительные изменения потенциала при задании образцу деформации треугольной формы с фиксированными амплитудой (12% от начальной длины) и скоростью растяжения. Результат, представленный на рис. 15, показывает, что с уменьшением степени сшивки геля возрастает относительное изменение потенциала. Так, если потенциал редкосшитого геля СаПМАК при его растяжении уменьшался на 25% от первоначальной величины, то в плотносшитых образцах СаПМАК изменение не превышало 8-9%.
Табл. 5. Характеристики образцов полиэлектролитных гелей
Полимер |
Число мономеров на одну сшивку |
Потенциал (mV) |
Модуль Юнга, E (kPa) |
Mg ПМАК |
200 |
-143,62,3 * |
2,90,4 # |
100 |
-130,83,0 * |
3,50,2 |
|
50 |
-114,34,2 |
3,90,3 |
|
СаПМАК |
400 |
-94,55,4 * |
2,00,4 * |
200 |
-57,31,8 |
3,40,3 |
|
100 |
-57,52,3 |
3,90,5 |
|
50 |
-60,31,2 |
3,80,2 |
*аа -аа р<0,01;аа #аа -аа р<0,05:аа достоверностьаа различийаа междуаа текущимаа и последующим значением в столбце с различными степенями сшивки геля.
Если сопоставить величину изменения потенциала при фиксированном изменении длины во всех образцах, то можно определить связь между модулем упругости гелей с разной плотностью сшивок и степенью выраженности МЭС. Такая зависимость, оказалась высоко достоверной для всех тестируемых типов гелей, например, для СаПМАК: г= -0,953 (п=8, р<0,01). Отрицательное значение коэффициента означает, что чем ниже модуль упругости геля, тем в большей степени изменяется потенциал образца в ответ на его растяжение. То есть, механоэлектрическая связь больше выражена в менее упругих, слабосшитых гелях.
37
|
Рис. 15. Зависимость относительного изменения электрохимического потенциала геля СаПМАК от растяжения образца.
По оси абсцисс - относительное удлинение образца, в % к начальной длине; по оси ординат -относительное изменение потенциала, в % к начальному значению. 1- СаПМАК 400, 2 -CaMgHMAK 200, 3 - СаПМАК 100, 4-СаПМАК 50.
Таким образом, одноосное растяжение полиэлектролитного геля вызывало сдвиг потенциала в сторону деполяризации, причем, выраженность этого явления не зависела от типа тестируемого геля и выбранного противоиона, но была достоверно связана с упругими свойствами материала.
Исходя из природы возникновения Доннановского потенциала в геле, уменьшение отрицательных значений потенциала при его растяжении может быть обусловлено только снижением концентрации свободных противоионов внутри полимерной сетки. Базируясь на этом очевидном положении, мы можем предложить несколько механизмов для объяснения МЭС в гелях.
Первый механизм, назовем его условно миграцией растворителя, основан на предположении о том, что при осевой деформации геля происходит разворачивание полимерных цепочек в продольном направлении, их сближение друг к другу и, как следствие, сжатие геля в поперечном сечении. При этом объем образца может уменьшаться за счет выхода из структуры геля воды с противоионами. В таком случае, разница в концентрации противоионов внутри и вне геля уменьшается и, как следует из уравнения Доннана, на границе гель/вода потенциал уменьшается по модулю.
Подобное толкование согласуется с результатами исследования, в котором образец геля помещался под пресс, после чего был определен объем вышедшей из него воды в зависимости от приложенных нагрузок (Vervoort et al, 2005). Кроме того, согласно результатам нашего исследования,аа величинаа электрохимическогоаа потенциалаа завесил от
38
степени сжатия-набухания геля. Причем, чем меньше была степень набухания, тем менее электроотрицательным становился гель. Выход растворителя из структуры геля однозначно снижает его степень набухания, и это должно сопровождаться уменьшением потенциала по абсолютной величине.
Гипотеза о миграции растворителя во время осевых деформаций гидрогеля позволяет объяснить полученный в этой работе результат о влиянии скорости деформации на выраженность МЭС. С физической точки зрения, конформационные преобразования в структуре гидрогеля при его растяжении характеризуются определенным временем релаксации, которое определяется как отношение эффективного коэффициента внутреннего трения нитей к модулю упругости. Если скорость деформации геля превышает скорость релаксации, то конформационные преобразования и связанные с ними изменения объема просто не успевают развиться в полной мере, и величина потенциала изменяется в меньшей степени.
Второй механизм регулирования МЭС в гелях, названный нами конденсацией противоионов, подразумевает изменение плотности заряда полимерной сети вследствие уменьшения межфиламентарного расстояния в геле при его продольном растяжении. Известно, что в процессе деформации аморфных полимеров происходит переход макромолекул из клубкообразной в выпрямленную конформацию, в результате чего одноименно заряженные цепи располагаются параллельно и сближаются друг с другом.
При этом электростатическое отталкивание между нитями полимера возрастает, что является термодинамически невыгодным процессом, который система (деформируемый гель) стремится компенсировать по принципу Ле-Шателье-Брауна. Процесс компенсации происходит за счет конденсации противоионов на полимерных нитях с образованием ионных ассоциатов. Это приводит к уменьшению эффективного заряда цепей и снижению сил отталкивания. Поскольку свободные противоионы связываются с сетью, их концентрация в геле уменьшается и его отрицательный потенциал снижается. При восстановлении размеров геля ионные ассоциаты вновь диссоциируют, противоионы освобождаются и отрицательное значение потенциала увеличивается.
Механизм конденсации противоионов, также как и гипотеза о миграции растворителя, позволяет объяснить полученный в этой работе результат о влиянии скорости деформации на величину электрохимического потенциала. В данном случае, за счет различий в
39
характерных временах конформационных изменений макромолекул и процесса образования - разрушения ионных ассоциатов (Гуль, Кулезнев, 1994).
Итак, мы имеем две вполне правдоподобные гипотезы для объяснения МЭС в гелях, и стоим перед выбором наиболее реалистичной. Наше предпочтение склонилось в пользу конденсации противоионов. Во-первых, потому что эта гипотеза базируется на универсальном законе, хорошо изученном и описанном в физике полимеров. Во-вторых, потому что в пользу гипотезы миграции растворителя у нас нет прямых экспериментальных доказательств постулируемому уменьшению объема геля при его продольной деформации. Другими словами, наше предположение о выходе растворителя из геля при его растяжении является лишь умозрительным.
Вернемся к результатам исследования МЭС в гелях. Наиболее важный из них гласит о том, что выраженность МЭС прямо зависит от упругих свойств полимерной сети: чем больше плотность сшивки полимера (больше жесткость), тем слабее выражена МЭС. В основе этого явления, вероятно, лежит все тот же универсальный механизм конденсации противоионов при уменьшении расстояния между нитями геля вследствие его растяжения.
Действительно, при одинаковой величине осевой деформации в слабо сшитых гелях происходит большее сближение нитей, чем в плотно сшитых (жестких) гелях. Проиллюстрируем это положение качественной схемой (ниже), где показан образец геля в виде цилиндра с полимерными нитями внутри.
Среднееа расстояниеа междуа нитямиа ва поперечнома сеченииа - х0,а xj, пропорционально корню из площади,а приходящейся на нить:
Ъ*^о), / = 0,1.
iЧ iаа Ж i
Тогда: Ах = х0 -хх ~^0{\Ч=^) = -=(1Чт==).
/1 + fi *JN y/? + ?
Видно, что при заданной площади поперечного сечения образца S0 и величине относительной деформации растяжения ? сближение нитей обратно пропорционально корню из числа нитей, пересекающих поперечное сечение. То есть в редко сшитых гелях нити сближаются больше, чем в сильно сшитых (жестких) гелях.
Следовательно, в редко сшитых гелях концентрация свободных противоионов при растяжении будет уменьшаться сильнее, что приведет к более существенному изменению потенциала по сравнению с плотно сшитыми гелями. Поэтому в редко сшитых гелях феномен механоэлектрической связи выражен ярче, чем в плотно сшитых. Другими словами, снижение упругости полимерной сети геля сопровождается увеличением степени выраженности механоэлектрической связи.
Суммируя совокупность представленных фактов по изучению электрических и механических свойств экспериментальной модели цитоскелета, мы можем сформулировать новую концепцию механоэлектрического преобразования в возбудимых клетках и, в частности, в кардиомиоцитах.
Так, при растяжении клетки происходят конформационные преобразования в цитоскелете, в результате которых уменьшается межфиламентарное расстояние актиновых нитей, несущих отрицательный заряд. Это приводит к тому, что часть положительно заряженных противоионов конденсируется на актине, и концентрация свободных противоионов в субмембранной области клетки уменьшается. При прочих равных условиях, данное обстоятельство должно сдвигать внутриклеточный потенциал в направлении деполяризации.
Флуктуации потенциала в клетке вследствие растяжения цитоскелета, вероятно, инициируют или регулируют активность механочувствительных каналов, усиливая выраженность МЭС. Такое толкование выглядит вполне правдоподобным, поскольку хорошо известно, что множество идентифицированных на сегодня мембранных каналов демонстрирует свою чувствительность, как к деформациям, так и к величине потенциала внутри клетки (Martinac, 2004; Laitko et al, 2006; Morris, Juranka, 2007).
41
Таким образом, концепция механоэлектрического преобразования в миокарде постулирует участие цитоскелета в регулировании ионного баланса между субмембранным цитоскелетом и жидкой фазой клетки за счет вовлечения механизма конденсации ионов на полимерной сети. Это подразумевает, что физико-химические свойства цитоскелета, по крайней мере, частично контролируют внутриклеточный потенциал.
ВЫВОДЫ
1.а В нормальном миокарде желудочка экспериментальных животных
и человека в физиологическом диапазоне деформаций сердечной стенки
растяжение не оказывает выраженного влияния на механизмы,
контролирующие механоэлектрическоеа преобразование в
кардиомиоцитах. Напротив, в клетках патологически измененного
миокарда желудочков деформация мышцы на 25% от начальной длины в
среднем достоверно смещает ПП в сторону деполяризации на 16%. В
миокарде предсердий деполяризация ПП при растяжении препаратов на
такую же величину сопровождается также возникновением
авторитмичности. Высокая чувствительность электрических
характеристик кардиомиоцитов патологического миокарда к растяжению
ассоциируется с увеличением диастолической жесткости сердечной ткани
и/или нарушением ионного баланса через клеточную мембрану.
- Наличие в сердечной стенке структурно-функциональной неоднородности, связанной, например, с региональными различиями в толщине стенки желудочка или же с задержками возбуждения регионов камеры оказывает влияние на деформацию миокарда не только в диастолическую часть сердечного цикла, но и в систолический период. Увеличение растяжения соответствующих регионов миокарда в фазы изоволюмического сокращения и изгнания крови может достигать 30% от их начальной длины.
- Полиэлектролитные гидрогели акриловой (метакриловой) кислоты, выбранные в качестве экспериментальной модели цитоскелета, проявляют электрические (ПП от -70 до -190 мВ) и механические свойства (модуль Юнга 1-10 кПа), качественно и количественно схожие с биологическим прототипом. Поэтому с определенной долей допущений могут быть использованы для изучения роли цитоскелета.
4.аа Молекулярная природа электрохимического потенциала
модельного цитоскелета связана с установлением Доннановского
равновесия ваа полиэлектролитныхаа гидрогелях, возникающего из-за
42
ограниченной диффузии одноименных ионов на границе гель-растворитель. Величина потенциала модельного цитоскелета достоверно зависит от ряда факторов: степени набухания (г=-0,930; р<0,01), ионизации (г=0,925, р<0,01) и плотности сшивки полимерной сети(г=-0,975, р<0,01), а также от ионной силы окружающего цитоскелет раствора (г=-0,871,р<0,01).
5.аа Упругие свойства модельного цитоскелета зависят от ряда
факторов, из числа которых плотность сшивки полимерной сети является
наиболее важным и значимым детерминантом упругости цитоскелета. На
это указывает линейная зависимость модуля упругости от степени сшивки
полимерных нитей (г=-0,79; р<0,01).
6.а Одноосное растяжение модельного цитоскелета вызывает сдвиг
электрохимического потенциала геля в сторону деполяризации, причем,
чем больше величина деформации, тем меньше по абсолютной величине
потенциал (г=0,992, р<0,001). Выраженность этого явления увеличивается
по мере уменьшения упругости полимерной сети.
7.а Деполяризация модельного цитоскелета при растяжении
обусловлена снижением концентрации свободных противоионов внутри
полимерной сетки. Молекулярный механизм этого явления базируется на
известном в физике полимеров законе конденсации зарядов на
полимерной сети при ее растяжении.
8.аа Сформулированная концепция механоэлектрического
преобразования в миокарде постулирует участие цитоскелета в
регулировании ионного баланса между кортексом и жидкой фазой
цитозоля, и дает обоснование важной роли физико-химических свойств
цитоскелета в регулировании внутриклеточного потенциала.
Список наиболее важных научных трудов, опубликованных по теме
диссертации
В журналах, рекомендованных ВАК МОиН РФ
- Бляхман Ф.А. Особенности влияния катехоламинов на расслабление миокарда желудочков теплокровных и холоднокровных животных / Ф.А. Бляхман, В.Я. Изаков, Т.Ф. Шкляр // Физиологический журнал СССР. - 1989.- Т.75. - №12. - С.1708-1713.
- Аретинский В.Б. Нарушение сократимости миокарда при экспериментальных атерогенных дислипопротеидемиях / В. Б. Аретинский, Т.Ф. Шкляр, Ф.А. Бляхман // Кардиология. - Деп. ВИНИТИ, №4923-В от 7.09.90.
43
- Бляхман Ф.А. Устройство для исследования механических свойств мышцы / Ф.А. Бляхман, B.C. Мархасин, Т.Ф. Шкляр // А.С. 1650088. Бюлл. Изобретений. - 1991. - №19. - С.13-14.
- Izakov V.Ya. Cooperative effects due to calcium binding by troponin and their consequences for contraction and relaxation of cardiac muscle under various conditions of mechanical loading / V.Ya. Izakov, L.B. Katsnelson, F.A. Blyakhman, V.S. Markhasin, T.F. Shklyar // Circulation Res. - 1991. - V.69. -N5.-P.1171-1184.
- Шкляр Т.Ф. Оценка сократимости миокарда при экспериментальном атеросклерозе / Т.Ф. Шкляр, Ф.А. Бляхман, В.Б. Аретинский // Физиологический журнал СССР им. Сеченова. - 1991. -Т.77. -№11.-С.48-53.
- Blyakhman F.A. Quantal motor action in muscle contraction / F.A. Blyakhman, G.H. Pollack, T.F. Shklyar, A.V. Tourovskaya, T. Tameyasy, P. Yang // Adv Exp Med Biol. - 1998. - V.453. - P. 361-369.
- Blyakhman F.A. Quantal length changes in single contracting sarcomeres / F.A. Blyakhman, T.F. Shklyar, G.H. Pollack // J Muscle Res Cell Motil. - 1999. - V.20(5-6). - P. 529-538.
- Шкляр Т.Ф. Влияние урбанизации на сократительную функцию миокарда бурых лягушек / Т.Ф. Шкляр, В.Л. Вершинин // Сибирский экологический журнал. - 2002. - № 6. - С.721-728.
- Blyakhman F.A. Why the left ventricle is not a sphere / F.A. Blyakhman, T.F. Shklyar, I.V. Pavlov, S.S. Sokolov // Appi. Bionics. Biomechanics. - 2004. -V.2. - P.101-105.
- Умникова M.B. Сердечно-сосудистые заболевания и возможности чрескожной электронейростимуляции / М.В. Умникова, Е.В. Губернаторова, К.Ю. Черемхин, Т.Ф. Шкляр, Ф.А. Бляхман // Военно-медицинский журнал. - 2009. - Т.330. - №1. - С.60-64.
- Шкляр Т.Ф. Связь между механическими и электрическими свойствами синтетического гидрогеля, выбранного в качестве экспериментальной модели цитоскелета / Т.Ф. Шкляр, А.П. Сафронов, И.С. Клюжин, Дж. Поллак, Ф.А. Бляхман // Биофизика. - 2008. - Т.53. -№6. -С.1000-1007.
- Шкляр Т.Ф. Методы чрескожной электро нейростимуляции в лечение сердечно-сосудистых заболеваний / Т.Ф. Шкляр, К.Ю. Черемхин, М.В. Умникова, Ф.А. Бляхман // Ж. Вестник восстановительной медицины. - 2008. - №3. - С.36-40.
- Safronov А.Р. The influence of counterion type and temperature on Flory-Haggins binary interaction parameter, itsenthalpy and entropy parts in poly(acrylic acid) and poly(methacrylic acid) hydrogels polyelectrolyte / A.P. Safronov F.A., Blyakhman, T.F. Shklyar, M.A. Kostareva, G.H. Pollack // J. Macromolecular Chemistry and Physics. - 2009. - V. 210. - №7. - P.511-519.
44
- Шкляр Т.Ф. Механоэлектрические явления в синтетических гидрогелях: возможная связь с цитоскелетом / Т.Ф. Шкляр, А.П. Сафронов, О.А. Торопова, Дж. Поллак, Ф.А. Бляхман // Биофизика. -2010. - Т.55. - вып.6. - С.1014-1021.
- Шкляр Т.Ф. Акустические свойства водных суспензий оксидов металлов / Т.Ф. Шкляр, О.А. Торопова, А.П. Сафронов, Д.В. Лейман, Ю.А. Котов, Ф.А. Бляхман // Ж. Российские нанотехнологии. - 2010. - Т.5. -№ 3-4. - С. 24-30.
- Шкляр Т.Ф. Механические характеристики физической модели цитоскелета на основе синтетических полиэлектролитных гелей / Т.Ф. Шкляр, О.А. Торопова, А.П. Сафронов, Дж. Поллак, Ф.А. Бляхман // Биофизика. -2011. -Т.56. - вып.1. - С.78-84.
- Safronov A. DC electric fields produce periodic bending of polyelectrolyte gels / A. Safronov, M. Shakhnovich, A. Kalganov, I. Kamalov, T. Shklyar, F. Blyakhman, G. Pollack // Polymer. - 2011. - V.52. - P. 2430-2436.
Коллективные монографии
- Бляхман Ф.А. Изучение детерминант изометрического расслабления миокарда / Ф.А. Бляхман, B.C. Мархасин, Т.Ф. Шкляр, В.Я. Изаков // Серия препринтов "Научные доклады" КНЦ УрО РАН, ротапринт Коми НЦ УрО АН СССР, 1991. - 40 с.
- Pollack G.H. Implication of quantal motor action in biological systems / G.H. Pollack, F.A. Blyakhman, T.F. Shklyar, A.V. Tourovskaya, T. Tameyasy, P. Yang // Chapter In Book "Mechanisms of work production and work absorption in muscle", Eds. H. Sugi, G. Pollack. - Plenum Press, 1998. -P. 361-369.
20.аа Safronov A.P. Donnan Potential in Hydrogels of Poly(Methacrylic
Acid) and Its Potassium Salt / A.P. Safronov T.F. Shklyar, V. Borodin, E.A.
Smirnova, S. Sokolov, G.H. Pollack, F. Blyakhman // Chapter In Book "Water
in Biology" /Eds. G. Pollack, I. Cameron, D. Wheatley. -"Springer", NW,
2006. - P.273-284.
Статьи в рецензируемых сборниках трудов
- Гринько А. А. Экспериментальная модель механической неоднородности в сердце / А.А. Гринько, СЮ. Соколов, Е.В. Мелкишева, Т.Ф. Шкляр, Ф.А. Бляхман // Физика и радиоэлектроника в медицине и биотехнологии. Сб. научн. тр. ВГУ, Владимир: изд-во ВГУ, 1998. - С. 187-188.
- Павлова И.А.аа Экспериментальноеа моделирование патологических состояний миокарда / И.А. Павлов, Т.Ф. Шкляр, Ф.А. Бляхман // Сб.а трудова Междунар.а Конфер.аа Современныеа проблемы
45
атомнойа наукиа иа техники,аа 15-20а сентябряа 2003,аа Снежинск,аа изд-во СГФТФ, 2003. -С. 416-418.
- Шкляр Т.Ф. Характеристика сократительной функции миокарда как маркер биогеохимической специфики среды / Т.Ф. Шкляр, В.Л. Вершинин // Сб. трудов Междунар. Конфер. Современные проблемы атомной науки и техники, 15-20 сентября 2003, Снежинск, изд-во СГФТФ, 2003. - С. 448-450.
- Shklyar T.F. Electrochemical properties of a synthetic gel chosen as the cytoskeleton experimental model / T.F. Shklyar, A.P. Safronov, G.H. Pollack, F.A. Blyakhman // Proceedings of the International Symposium "Biological Motility: Achievements and Perspectives" Pushchino, Pushino: Foton-Vek, 2008. - P.272-274.
- О.А.Торопова. Упругие и релаксационные свойства са-замещенных полиэлектролитных гелей / О.А. Торопова, Т.Ф. Шкляр, А.П.Сафронов. // Сб. материалов III Евразийского Конгресса по Медицинской Физике и Инженерии Медицинская физика-2010, Москва, 21-26 июня 2010, Изд-во МГУ, 2010. - С. 371-373.
- Shklyar T.F. Mechanical behavior of the synthetic polyelectrolyte gel chosen as a physical model of the cytoskeleton In: Biological motility: from fundamental achievements to nanotechnologies / T.F. Shklyar, O.A. Toropova, A.P. Safronov, G.H. Pollack, F.A. Blyakhman F.A. // Pushchino, Synchrobook, 2010. - С 250-253.
- Нечкина K.C. Сравнительная оценка элекромеханических свойств полиэлектролитных гелей / К.С. Нечкина, М.В. Шахнович, Т.Ф. Шкляр, А.П. Сафронов, Ф.А. Бляхман // Сб. материалов III Евразийского Конгресса по Медицинской Физике и Инженерии Медицинская физика-2010, Москва, 21-26 июня 2010 г., Изд-во МГУ, 2010. - С. 309-311.
- Шкляр Т.Ф. Цитоскелет кардиомиоцитов как модулятор аритмогенного эффекта растяжения: экспериментальное моделирование / Т.Ф. Шкляр, А.П. Сафронов, Ф.А Бляхман // Материалы Междунар. конгресса Кардиология на перекрестке наук, Тюмень, 19-21 мая 2010, 2010. - С. 294-295.
Материалы международных конференций
- Blyakhman F. Peculiarities of mechanochemical incoupling in human pathological myocardium / F.A. Blyakhman, T.F. Shklyar, V.S. Markhasin, V.Ya. Izakov // 10-th European section meeting "International society for heart research", Italy, Venice, 15-17 June, J. of Moll. Cell. Cardiol. -1989. -V.21, Suppl. IV, - P.56.
- Blyakhman F.A.Significance of cooperative troponin-calcium binding for mechanical phenomena of cardiac muscle / F.A. Blyakhman, V.Ya. Izakov, L.B. Katsnelson, V.S. Markhasin, T.F. Shklyar //10th International Biophysics congress, July 29-August 8, Vancouer, Canada, 1990, P. 14.
46
- Blyakhman F.A. An experimental model of mechanical non-homogeneity of myocardium and its dependency on the stimulation frequency, Ca-ions concentration and catecholamines / F.A. Blyakhman, V.S. Markhasin, T.F. Shklyar // European Muscle Club XX Annual Meeting, 1991, Oxford, England, 23-27 Sept., "J. Muscle Res. and Cell Motility", 1992. - V.13, - №2, -P.223-224.-P.ll.
- Blyakhman F.A. Who is better as an assistant: back but it own, or good but a strange? / F.A. Blyakhman, T.F. Shklyar // European Muscle Congress XXI Annual Meeting, 1992, Bieleefeld, Germany 21-24 Sept., J. Muscle Res. & Cell Motility, 1993. - V.14. - P.234.
- Shklyar T. F. The influence of newly synthetized antiarrhythmic compounds on the contractile function of the isolated myocardium / T. F. Shklyar, D. S. Trenin // J.Mol.Cell.Cardiol. - 1993. - V.25, Suppl. 3. - P.8.
- Blyakhman F.A. Interrelation between pulmonary venous flow and regional inhomogeniety left ventricular wall motion/ F.A. Blyakhman, S.F. Melyakh, T.F. Shklyar//J.Mol.Cell. Cardiol. - 1993. - V.25, Supplм. - P.23.
- Tsyvian P.B. Passive stress relaxation measurements in human embrionic myocardium / P.B. Tsyvian, T.F. Shklyar // Cardiovascular development meeting, Netherlands, Rochester, 15-17 May, 1995. - P.75.
- Tsyvian P.B. The effect of digoxin on human adult and embryonic myocardium / P.B. Tsyvian, T.F. Shklyar // Cardiovascular development meeting, Netherlands, Rochester, 15-17 May, 1995. - P.78.
- Blyakhman F.A. In vitro and in situ studies of myocardial asynchrony / F.A. Blyakhman, V.V. Chestukhin, T.F. Shklyar, B.L. Mironkov, A.A. Grinko, S.Yu. Sokolov // J. Cardiovascular Diagnosis & Procedures. -1996.-V.13.-N4.-P.284.
- Blyakhman F.A. Quantal nature of sarcomere shortening / F.A. Blyakhman, T.F. Shklyar, G.H. Pollack // XXXIII International Congress of Physiol. Sciences, June 30-Jule 5, St-Petersburg, 1997. - P.034.14.
- Blyakhman F.A. On the role of inhomogeneity in the heart. In book of abstracts PV-loops International congress on ventricular function and failure from mice to man / F.A. Blyakhman, T.F. Shklyar, LA. Pavlov, A.A. Grinko, N.F. Balakhonov // International Congress on ventricular function and failure: from mice to man, Netherlands, Maastricht, 11-13 October, 2000. - P. 106.
- Blyakhman F.A. Possible role of the cytoskeleton in creating the cell's electrochemical potential: a synthetic gel model / F.A. Blyakhman, LA. Klyuzgin, G.H. Pollack, A.P. Safronov, T.F. Shklyar // 4th World Congress of Cellular and Molecular Biology, France, October 17-20, 2005. - P. 128.
- Prosheva V. New insights into the avian heart functioning / V. Prosheva, T. Shklyar, F. Blyakhman // International Conference on comparative physiology. Germany, 3-5 September 2009, J. Comparative Biochemistry and Physiology, 2009. - V.154A. -N.l, Suppl. - P. S32.
47
- Nechkina K.S. Mechanical Behavior of the Biomimetic Polyelectrolyte Gels Under the DC Electric Field / K.S. Nechkina, M.V. Shakhnovich, T.F. Shklyar, A.P. Safronov, F.A. Blyakhman // Proceedings of the 17th International Conference on Mechanics in Medicine and Biology (ICMMB-17), Krakуw, Poland, 19-23 Sept., 2010. - CD, 1 p.
- Shklyar T.F. Cytoskeleton as a Possible Modulator of the Stretch-induced Arrhythmia Phenomena: an Experimental Modeling / T.F. Shklyar, O.A. Toropova, A.P. Safronov, F.A. Blyakhman // 19th International Conference of the Cardiovascular System Dynamics Society, Sept. 23-26, Fukuoka, Japan, 2010. - P. 238.
Методические разработки и данные, представленные в ряде разделов настоящей работы, были получены в результате исследований, поддержанных на разных этапах грантами РФФИ №№ 96-04-50039-а, 99-04-48610-а, 01-04-49531-а, 02-04-49334-а, 08-02-9907 6-р_офи; CRDF (REC-005).
Список сокращений
АПД - амплитуда потенциала действия ВДМ - время достижения максимума ВР - время реполяризации МЭС - механоэлектрическая связь ПАК - полиакриловая кислота ПМАК - полиметакриловая кислота ПД - потенциал действия 1111 - потенциал покоя
 Все авторефераты докторских диссертаций
Все авторефераты докторских диссертаций