 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Флуоресцентные димерные бисбензимидазолы - ингибиторы ДНК-зависимых ферментов
Автореферат кандидатской диссертации
а На правах рукописи
Иванов Александр Александрович
ФЛУОРЕСЦЕНТНЫЕ ДИМЕРНЫЕ БИСБЕНЗИМИДАЗОЛЫ - ИНГИБИТОРЫ ДНК-ЗАВИСИМЫХ ФЕРМЕНТОВ
03.01.03 - Молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
кандидата химических наук
Москва - 2012
Диссертация выполнена в Лаборатории ДНК-белковых взаимодействий Федерального государственного бюджетного учреждения науки Института молекулярной биологии
им. В.А. Энгельгардта Российской академии наук
Научный руководитель: к.х.н., Жузе Алексей Львович
Официальные оппоненты:а
Формановский Андрей Альфредович, д.х.н.
ФГБУН ИБХ им. М.М.Шемякина и Ю.А. Овчинникова РАН, в.н.с.
Тимофеев Эдуард Николаевич, д.х.н.
ФГБУН ИМБ им. В.А.Энгельгардта РАН, в.н.с.
Ведущая организация:а Федеральное Государственное Бюджетное Учреждение УНаучно-исследовательский институт по изысканию новых антибиотиков им. Г.Ф.ГаузеФ Российской Академии медицинских наук
Защита диссертации состоится л___ ______________2012 г. в ____ ч. на заседании Диссертационного совета Д 002.235.01 при Федеральном государственном бюджетном учреждении науки Института молекулярной биологии им. В.А. Энгельгардта Российской академии наук по адресу: 119991, г. Москва, ул. Вавилова, д. 32, _______________.
С диссертацией можно ознакомиться в библиотеке Института молекулярной биологии им. В.А. Энгельгардта РАН.
Автореферат разослан л___ __________________2012 г.
Ученый секретарь
Диссертационного совета к.х.н. аа аа Крицын Анатолий Михайлович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Молекулы двухцепочечной ДНК (ДНК) служат мишенью многих противоопухолевых и противовирусных агентов. Узкая бороздка B-формы ДНК представляет собой ключевой участок воздействия большого числа низкомолекулярных соединений, способных нековалентно и сайт-специфично связываться с нуклеотидными последовательностями. Создание таких соединений - узкобороздочных лигандов является перспективной задачей современной молекулярной биологии. Данные вещества, благодаря возможности высокоспецифично взаимодейстовать с определенной последовательностью нуклеотидов, теоретически могут обладать способностью отличать поврежденную ДНК опухолевых клеток, либо ДНК, подвергшуюся воздействию вирусов, от неповрежденной ДНК здоровых клеток. При этом они лишены недостатков, свойственных традиционным биологически активным препаратам на основе алкилирующих агентов и интеркаляторов, в частности - не повреждают ДНК и не вызывают значительного искажения ее пространственной структуры.
Основное требование к структуре молекул узкобороздочных лигандов - их серповидная форма, изогеометричная узкой бороздке ДНК. Удобным повторяющимся структурным мотивом, удовлетворяющим данному условию и при этом комплементарным по отношению к нуклеотидной последовательности расположением доноров водородной связи, является гетероциклический бензимидазольный фрагмент. Такой мотив содержится, в частности, в структуре флуоресцентного красителя Хёхст 33258 (Ht), используемого в цитологии в качестве ДНК-специфичной метки.

Рис. 1. Химическая структура красителя Ht и димерных бисбензимидазолов серий
bis-Ht(n) и DB(n), где n - число метиленовых групп в линкере.
Ранее в нашей лаборатории был осуществлен синтез аналогов Ht - димерных бисбензимидазолов bis-Ht(n) (рис. 1). Однако из-за большой склонности к образованию агрегатов эти соединения имели низкую растворимость в водных растворах. При создании новых ДНК-специфичных лигандов DB(n) для увеличения растворимости гидрофобные фенильные ядра, присутствующие в молекулах bis-Ht(n), были заменены на гидрофильные СONH-группы.
Целью работы являлось создание и исследование серии флуоресцентных ДНК-сайт-специфичных димерных бисбензимидазолов.
В задачи работы входило: (1) синтез серии димерных бисбензимидазолов DB(n), различающихся длиной олигометиленового линкера, соединяющего два бисбензимидазольных фрагмента молекулы; (2) изучение их взаимодействия с ДНК различными оптическими методами; (3) определение константа связывания (Ксв) с ДНК для отдельных представителей серии; (4) исследование DB(n) в качестве ингибиторов нескольких ДНК-зависимых ферментов; (5) определение мутагенности для наиболее биологически активного из соединений; (6) тестирование синтезированных димерных бисбензимидазолов в качестве флуорохромов в цитологии.
Научная новизна. Разработан удобный метод синтеза димерных бисбензимидазолов DB(n), позволяющий варьировать длину линкера в молекулах, где n - число метиленовых групп в линкере. Метод основан на cинтезе мономерного бисбензимидазола MB с его последующей конденсацией с ?,?-алкандикарбоновыми кислотами, либо их активированными диэфирами. Данным способом впервые получены и охарактеризованы димерные бисбензимидазолы DB(n). Спектральными методами изучено взаимодействие данных соединений с ДНК. Показано, что DB(n) in vitro ингибируют некоторые ДНК-зависимые ферменты. Установлено, что эти соединения являются эффективными флуорохромами при дифференциальной окраске хромосом в цитологии.
Практическая значимость. Синтезированные димерные бисбензимидазолы DB(n) оказались эффективными ингибиторами трёх ДНК-зависимых ферментов: ДНК-топоизомеразы-I, ДНК-метилтрансферазы мыши Dnmt3a и хеликазы NS3 вируса гепатита С человека (HCV), проявляющими ингибирующую активность в низких микромолярных концентрациях. Было установлено, что DB(n) являются перспективными флуоресцентными красителями в цитогенетических исследованиях, поскольку данные соединения способны проникать через клеточную и ядерную мембраны и окрашивать ядра клеток, а также дифференциально окрашивать хромосомы человека и растений.
Апробация результатов работы. Материалы диссертационной работы представлены на следующих научных конференциях: конференция молодых учёных Института молекулярной биологии им. В.А. Энгельгардта РАН (Москва, 2008 г.); XX и XXIII зимние молодежные научные школы "Перспективные направления физико-химической биологии и биотехнологии" (Москва, 2008 г., 2011 г.); XXIV International Congress of ISAC (International Society of Analytical Cytology) (Budapesht, 2008 г.); Keystone Symposia on Molecular and Cellular Biology: DNA Replication and Recombination, (Keystone, Colorado, 2011); Albany 2011: The 17th Conversation (Albany, New York, 2011).
Публикации. По материалам диссертации опубликовано 7 статей и 7 тезисов.
Структура и объем диссертации. Диссертационная работа состоит из введения, обзора литературы, обсуждения результатов, экспериментальной части, выводов и списка цитируемой литературы, включающего 222 источника. Работа изложена на 138 страницах машинописного текста и содержит 2 таблицы, 28 рисунков и 104 схемы.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Конструирование димерных бисбензимидазолов DB(n).
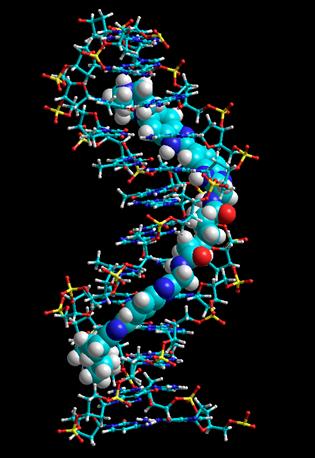 В качестве линкеров между двумя бисбензимидазольными блоками в молекулах DB(n) были выбраны производные ?,?-алкандикарбоновых кислот, олигометиленовые цепочки которых обладают конформационной подвижностью и низким сродством к сахарофосфатному остову и парам оснований ДНК. Длина выбиралась такой, чтобы дать возможность молекулам DB(n) занимать до одного витка ДНК (рис. 2).
В качестве линкеров между двумя бисбензимидазольными блоками в молекулах DB(n) были выбраны производные ?,?-алкандикарбоновых кислот, олигометиленовые цепочки которых обладают конформационной подвижностью и низким сродством к сахарофосфатному остову и парам оснований ДНК. Длина выбиралась такой, чтобы дать возможность молекулам DB(n) занимать до одного витка ДНК (рис. 2).
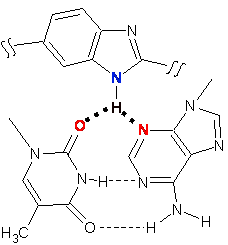 Структура линкеров должна позволить молекулам DB(n) принимать форму, изоспиральную узкой бороздке ДНК, а их параметры - разрешить молекулам DB(n) выполнять роль бидентантного лиганда. Краситель Ht, являющийся мономерным бисбензимидазолом, обладает способностью нековалентно связываться с ДНК преимущественно в АТ-богатых участках. При этом образуются две водородные связи между атомами азота N1 бензимидазольных гетероциклов Ht с одной стороны и атомами О2 тимина и N3 аденина ДНК с другой (рис. 3).
Структура линкеров должна позволить молекулам DB(n) принимать форму, изоспиральную узкой бороздке ДНК, а их параметры - разрешить молекулам DB(n) выполнять роль бидентантного лиганда. Краситель Ht, являющийся мономерным бисбензимидазолом, обладает способностью нековалентно связываться с ДНК преимущественно в АТ-богатых участках. При этом образуются две водородные связи между атомами азота N1 бензимидазольных гетероциклов Ht с одной стороны и атомами О2 тимина и N3 аденина ДНК с другой (рис. 3).
Рис. 2. Пространственная расчетная модель комплекса DB(5) с d(GCTTTTGCAAAAGC)2, построенная с помощью программы Amber 99 (совместно с В.А. Олейниковым, ИБХ РАН).
Рис. 3. Схематическое изображение одной из трёхцентровых водородных связей между молекулой Ht и АТ-парой ДНК (изображены жирными точками). Синим цветом выделены доноры водородной связи, красным - акцепторы.
Таким образом, молекулы DB(n), представляющие собой димерные бисбензимидазолы, будут одновременно образовывать четыре водородные связи между атомами азота N1 четырёх бензимидазольных фрагментов, выступающими в роли доноров, и основаниями ДНК, выступающими в роли акцепторов водородной связи.

Рис. 4. Схематическое изображение комплекса DB(n) c двумя сайтами, состоящими из двух подряд расположенных AT-пар. Пунктирные линии - водородные связи. Толстой линией изображена ДНК.
2. Синтез димерных бисбензимидазолов DB(n).
2.1. Синтез соединений DB(3, 4, 5, 7, 11).
В процессе получения димерных бисбензимидазолов DB(n) ключевым этапом был синтез основного структурного блока - мономерного бисбензимидазола MB, содержащего два ковалентно 2,6Т-связанных бензимидазольных ядра. В настоящее время наиболее часто встречающимся в литературе методом получения бензимидазолов можно считать конденсацию альдегидов с о-фенилендиаминами с использованием различных окислителей. Этим способом был синтезирован большой набор 2-замещённых бензимидазолов с различными ароматическими и гетероциклическими заместителями. Однако воспроизвести данный метод с хорошим выходом при использовании нитробензола в качестве окислителя в наших условиях не удалось. Недостатками этого способа синтеза являлись, прежде всего, достаточно высокие температуры проведения реакции (140-160С), длительное нагревание и необходимость хроматографического выделения целевого продукта. Использование же в качестве окислителей хлоранила, DDQ (2,3-дихлор-5,6-дицианбензохинон), пиросульфита натрия или кислорода воздуха также не привело к приемлемому выходу целевого продукта. Вероятно, один из самых удачных вариантов синтеза с помощью окислительной конденсации заключается в использование в качестве окислителя п-бензохинона. Тем не менее, данный способ требует тщательного подбора условий конденсации из-за возможного осмоления, происходящего в ходе реакции.
Выходы целевых продуктов в случае восстановительной циклизации ацетилированных о-нитроанилинов сильно зависят от структуры реагентов и даже в наиболее благоприятных условиях, как правило, не превышают 80 %.
Синтез бензимидазолов конденсацией о-фенилендиаминов с карбоновыми кислотами встречается редко, хотя раньше этот способ был очень распространён. К его недостаткам можно отнести проведение реакции при высокой температуре, длительное нагревание и, что самое главное, невозможность использования легко окисляющихся производных о-фенилендиамина. Кроме того, необходим подбор оптимальной концентрации минеральной кислоты.
При конденсации замещенных о-фенилендиаминов с эфирами карбоновых кислот выходы целевых продуктов были в наших случаях неудовлетворительными. Использование же смешанных ангидридов карбоновых кислот позволяет реакции протекать в мягких условиях, но часто требует хроматографического выделения конечного продукта. Тем не менее, данным методом в случае использования 3,4-диаминобензонитрила в качестве исходного о-фенилендиамина (схема 1, стадии h, i) нам удалось получить целевой продукт с удовлетворительным выходом, не прибегая к хроматографической очистке. Следует отметить, что первоначальные варианты осуществления этого этапа синтеза, в котором ацилирование 3,4-диаминобензонитрила проводили с помощью ацетилглицина или фталилглицина не привели к желаемым выходам целевого соединения. Последнего удалось добитьсяа только при использовании трет-бутилоксикарбонилглицина.а
Однако, наиболее часто используемым и удачным, в том числе и в нашем случае, оказался метод конденсации о-фенилендиаминов с имидоэфирами карбоновых кислот (схема 2, стадия a). Этот способ удобен, прежде всего, тем, что не требует подбора специальных условий. Кроме того, при синтезе данным методом, реакция проходит в очень короткие сроки, а выходы продуктов, в некоторых случаях, достигают почти количественных значений.
Полученный при конденсации 5-хлор-2-нитроанилина и 1-метилпиперазина 5-(4-метилпиперазин-1-ил)-2-нитрофениламин (I) был восстановлен гидрированием над катализатором Адамса в 4-(4-метилпиперазин-1-ил)бензол-1,2-диамин (II). После восстановления 4-нитробензонитрила железом, активированным NH4Cl, полученный 4-аминобензонитрил был ацетилирован уксусным ангидридом с образованием N-(4-цианфенил)ацетамида. Последний был пронитрован при (-5)-0С смесью KNO3/конц. H2SO4, после чего полученный N-(4-циан-2-нитрофенил)ацетамид был дезацетилирован 20 % H2SO4 (100С, 1 ч) с образованием 4-амино-3-нитробензонитрила. После гидрирования над Pd/C полученный 3,4-диаминобензонитрил (III) был ацилирован Boc-Gly-OH по методу смешанных ангидридов с использованием изобутилхлорформиата. Синтезированное моноацильное производное 3,4-диаминобензонитрила (IIIa) было без выделения циклизовано при кипячении в ледяной AcOH с образованием N-[(6-циан-1H-бензимидазол-2-ил)метил]ацетамида (IV), который был затем с практически количественным выходом превращён по реакции Пиннера в соответствующий дихлоргидрат имидоэфира (V) (схема 1). Суммарный выход соединения (V), исходя из 4-нитробензонитрила, составил 21 % (после 8 стадий).
Схема 1. Начальные стадии синтеза димерных бисбензимидазолов DB(n).
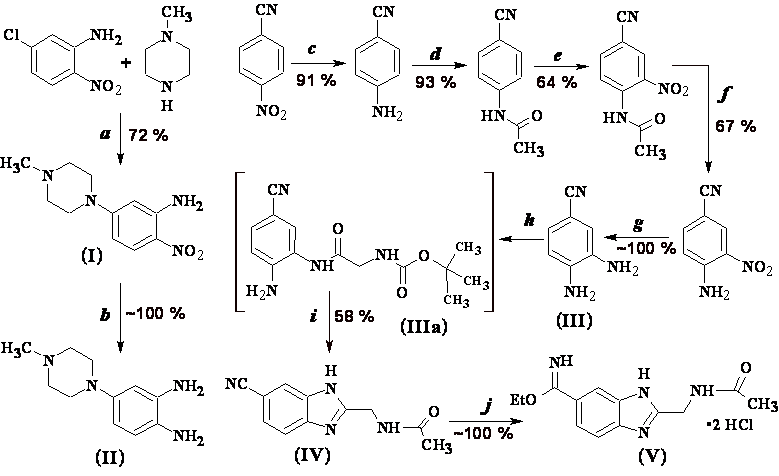
Реагенты и условия реакций: а) K2CO3, DMF,160С, 4 ч; b) H2/Pt, AcOH; с) Fe, NH4Cl, H2O, 90C, 10 мин, 4-нитробензонитрил, 100C, 2 ч; d) CH3COONa3H2O, Ac2O, aq. HCl, 0C, 30 мин; e) KNO3, конц. H2SO4, (-3) - (-5)С, 1 ч; f) 20 % H2SO4, 104C, 1 ч;g) H2, Pd/C, EtOH; h) iBuOCOCl, 4-метилморфолин, Boc-Gly-OH, DMF; i) AcOH, 65-70С, 1 ч, 120С, 4 ч; j) HClгаз/EtOH, 0-4С, 3 сут.
Конденсация диамина (II) с дихлоргидратом имидоэфира (V) была проведена в смеси ледяной AcOH и абс. EtOH при 95С в атмосфере азота. Образовавшееся N-ацетильное производное бисбензимидазола MB(Ac) было дезацетилировано кипячением с конц. HCl. Димеризацию полученного в результате мономерного бисбензимидазола MB осуществляли с помощью его реакции с активированными диэфирами ?,?-алкандикарбоновых кислот (VI a-d). Последние были синтезированы конденсацией соответствующих дикарбоновых кислот с пентафторфенолом, N-гидроксисукцинимидом, либо п-нитрофенолом при комнатной температуре в абс. диоксане с помощью N,NТ-дициклогексилкарбодиимида. Соединение MB в соотношении 2:1 было введено в реакцию конденсации с полученными диэфирами ?,?-алкандикарбоновых кислот с образованием димерных бисбензимидазолов DB(3, 4, 5, 7, 11) c выходами 50.4 - 78.3 % (схема 2).
Схема 2. Конечные стадии синтеза димерных бисбензимидазолов DB(n).

Реагенты и условия реакций: a) AcOH/EtOH, N2, 95С, 1 ч; b) конц. HCl, 105С, 20 мин; c) DB(3, 4, 5, 7, 11): (VIв-д, VIж, VIл), DMF, Et3N, 20С, 16 ч.; DB(1, 2, 6, 8, 9, 10, 12): (VIа,б, VIе, VIз-к, VIм), DMF, DIPEA, BOP, 0С, 30 мин, 20С, 12 ч.
Соединения DB(1, 2, 6, 8, 9, 10, 12) были получены с использованием конденсирующего реагента BOP (гексафторфосфат бензотриазол-1-ил-окси-трис-(диметиламино)-фосфония). Отличительной стадией данного варианта методики являлась конденсация мономерного бисбензимидазола MB непосредственно с ?,?-алкандикарбоновыми кислотами, минуя стадию получения активированных эфиров (схема 2). К преимуществам данного способа получения DB(n), помимо сокращения количества стадий, можно отнести существенное упрощение выделения конечного продукта конденсации. Однако следует отметить, что выходы продуктов на последней стадии синтеза при этом были значительно ниже (22.3 - 49.9 %), чем при конденсации MB с активированными эфирами ?,?-алкандикарбоновых кислот. Таким образом, исходя из 4-нитробензонитрилаа суммарный выход для соединений DB(3, 4, 5, 7, 11) составил 7-11 %, а для соединений DB(1, 2, 6, 8, 9, 10, 12) - 3-7 %.
Все синтезированные новые соединения были гомогенным по данным ТСХ, их структура была подтверждена данными ПМР-спектроскопии и MALDI-TOF масс-спектрометрии. В таблицах 1, 2 приведены данные ПМР-спектроскопии для всех синтезированных димерных бисбензимидазолов DB(n).
Таблица 1. Данные ПМР спектров гексахлоргидратов DB(1-6) (ДMCO-d6, 32С).
Протоны* |
Соединение, ?, м.д. |
|||||
DB(1) |
DB(2) |
DB(3)** |
DB(4) |
DB(5) |
DB(6) |
|
CO(CH2)2 CH2 |
|
|
|
|
1.32, 2Н, квин, J 7.5 |
1.30, 4Н, м |
COCH2CH2 |
|
|
1.86, 2Н, квин, J 7.5 |
1.60, 4Н, м |
1.58, 4Н, квин, J 7.5 |
1.56, 4Н, квин, J 6.5 |
COCH2 |
3.48, 2H, c |
2.63, 4Н, с |
2.33, 4Н, т, J 7.5 |
2.32, 4Н, м |
2.26, 4Н, т, J 7.5 |
2.26, 4Н, т, J 7.5 |
CH3-NH+ |
2.84, 6Н, ушс |
2.84, 6Н, ушс |
2.84, 6Н, д, J 3.7 |
2.83, 6Н, д, J 2.5 |
2.85, 6Н, с |
2.84, 6Н, с |
H(3'', 5'') |
3.23, 8Н, м |
3.23, 8Н, м |
3.38, 8Н, м*** |
3.24, 8Н, м |
3.39, 8Н, м**** |
3.23, 8Н, м |
H(2'', 6'') |
3.54, 4Н, м 3.88, 4Н, м |
3.54, 4Н, м 3.87, 4Н, м |
3.58, 8Н, м*** |
3.53, 4Н, м 3.86, 4Н, м |
3.78, 8Н, м**** |
3.54, 4Н, м 3.88, 4Н, м |
CH2NH |
4.79, 4Н, д, Jа 5.0 |
4.74, 4Н, д, Jа 5.6 |
4.72, 4Н, д, Jа 5.0 |
4.77, 4Н, д, Jа 5.0 |
4.63, 4Н, д, Jа 5.6 |
4.69, 4Н, д, Jа 5.0 |
H7' |
7.19, 2Н, ушс |
7.17, 2Н, ушс |
7.18, 2Н, ушс |
7.18, 2Н, ушс |
7.20, 2Н, д, J1.9 |
7.20, 2Н, с |
H5' |
7.34, 2Н, д, Jа 9.3 |
7.32, 2Н, д, Jа 8.7 |
7.34, 2Н, дд, Jа 1.9, 9.3 |
7.33, 2Н, д, J 9.3 |
7.31, 2Н, дд, J 1.9, 8.7 |
7.33, 2Н, дд, J 2.5, 8.7 |
H4' |
7.69, 2Н, д, Jа 8.7 |
7.68, 2Н, д, Jа 9.3 |
7.70, 2Н, д, Jа 9.3 |
7.69, 2Н, д, Jа 8.7 |
7.68, 2Н, д, Jа 8.7 |
7.71, 2Н, д, Jа 9.3 |
H4 |
7.92, 2Н, д, Jа 8.7 |
7.87, 2Н, д, Jа 8.7 |
7.94, 2Н, д, Jа 8.7 |
7.96, 2Н, д, Jа 8.7 |
7.89, 2Н, д, Jа 8.7 |
7.94, 2Н, д, Jа 8.7 |
H5 |
8.34, 2Н, д, Jа 8.7 |
8.32, 2Н, д, Jа 8.7 |
8.34, 2Н, д, Jа 8.7 |
8.47, 2Н, д, Jа 9.3 |
8.26, 2Н, д, Jа 8.7 |
8.36, 2Н, д, Jа 8.7 |
H7 |
8.75, 2Н, с |
8.72, 2Н, с |
8.73, 2Н, с |
8.84, 2Н, с |
8.66, 2Н, с |
8.77, 4Н, м |
CH2NH |
9.19, 2Н, т, Jа 5.3 |
8.99, 2Н, т, Jа 5.6 |
8.97, 2Н, т, Jа 5.3 |
8.95, 2Н, т, Jа 5.3 |
8.68, 2Н, т, Jа 5.3 |
|
* Протоны NH-групп бензимидазольных колец в ПМР-спектрах обычно проявлялись только частично. Спектр снят при 23С ** , 97С ***, 84С ****.
Таблица 2. Данные ПМР спектров гексахлоргидратов DB(7-12) (ДMCO-d6, 32С).
Протоны* |
Соединение, ?, м.д. |
|||||
DB(7) |
DB(8) |
DB(9) |
DB(10) |
DB(11)** |
DB(12) |
|
CO(CH2)2 (CH2)8 |
|
|
|
|
|
1.22, 16Н, м |
СО(СН2)2 (СН2)7 |
|
|
|
|
1.22, 14Н, м |
|
CO(CH2)2 (CH2)6 |
|
|
|
1.24, 12Н, м |
|
|
CO(CH2)2 (CH2)5 |
|
|
1.25, 10Н, м |
|
|
|
CO(CH2)2 (CH2)4 |
|
1.27, 8Н, м |
|
|
|
|
CO(CH2)2 (CH2)3 |
1.28, 6Н, м |
|
|
|
|
|
COCH2 CH2 |
1.55, 4H, м |
1.55, 4H, квин, J 6.9 |
1.54, 4H, квин, J 6.5 |
1.54, 4H, квин, J 6.9 |
1.52, 4H, м |
1.53, 4H, квин, J 6.9 |
COCH2 |
2.23, 4H, т, J 7.5 |
2.25, 4H, т, J 7.5 |
2.25, 4H, т, J 7.5 |
2.25, 4H, т, J 7.5 |
2.23, 4H, т, J 7.2 |
2.24, 4H, т, J 7.5 |
CH3-NH+ |
2.83, 6Н, ушс |
2.84, 6Н, с |
2.84, 6Н, с |
2.84, 6Н, с |
2.83, 6Н, ушс |
2.84, 6Н, с |
H(3'', 5'') |
3.38, 8Н, м*** |
3.23, 8Н, м |
3.23, 8Н, м |
3.23, 8Н, м |
3.21, 8Н, м |
3.23, 8Н, м |
H(2'', 6'') |
3.55, 8Н, м*** |
3.54, 4Н, м 3.88, 4Н, м |
3.54, 4Н, м 3.88, 4Н, м |
3.54, 4Н, м 3.88, 4Н, м |
3.53, 4Н, м 3.88, 4Н, м |
3.54, 4Н, м 3.88, 4Н, м |
CH2NH |
4.58, 4Н, д, Jа 5.0 |
4.68, 4Н, д, Jа 5.6 |
4.68, 4Н, д, Jа 5.6 |
4.69, 4Н, д, Jа 5.6 |
4.69, 4Н, д, Jа 5.0 |
4.68, 4Н, д, Jа 5.0 |
H7' |
7.19, 2Н, с |
7.20, 2Н, с |
7.20, 2Н, с |
7.20, 2Н, с |
7.19, 2Н, с |
7.21, 2Н, с |
H5' |
7.26, 2Н, д, Jа 8.7 |
7.33, 2Н, дд, Jа 1.9, 8.7 |
7.34, 2Н, дд, Jа 2.2, 8.7 |
7.34, 2Н, дд, Jа 1.9, 9.3 |
7.33, 2Н, дд, Jа 1.2, 8.7 |
7.34, 2Н, дд, Jа 2.5, 8.7 |
H4' |
7.66, 2Н, д, Jа 8.7 |
7.71, 2Н, д, Jа 9.3 |
7.72, 2Н, д, Jа 8.7 |
7.71, 2Н, д, Jа 8.7 |
7.70, 2Н, д, Jа 8.7 |
7.72, 2Н, д, Jа 9.3 |
H4 |
7.80, 2Н, д, Jа 8.1 |
7.94, 2Н, д, Jа 8.7 |
7.95, 2Н, д, Jа 8.7 |
7.95, 2Н, д, Jа 8.7 |
7.91, 2Н, д, Jа 8.7 |
7.94, 2Н, д, Jа 8.7 |
H5 |
8.20, 2Н, д, Jа 8.1 |
8.36, 2Н, д, Jа 8.7 |
8.37, 2Н, д, Jа 8.7 |
8.39, 2Н, д, Jа 8.7 |
8.34, 2Н, д, Jа 8.7 |
8.36, 2Н, д, Jа 8.7 |
H7 |
8.60, 4Н, м |
8.75, 4Н, м |
8.76, 4Н, м |
8.77, 4Н, м |
8.73, 2Н, с |
8.73, 4Н, м |
CH2NH |
8.78, 2Н, т, Jа 5.3 |
|||||
* Протоны NH-групп бензимидазольных колец в ПМР-спектрах обычно проявлялись только частично. Спектр снят при 23С **, 84С ***.
3. Результаты оптических исследований комплексов DB(n) с ДНК.
Взаимодействие синтезированных соединений с тимусной ДНК (Sigma, США) было изучено совместно с В.И. Саляновым (ИМБ РАН) комплексом оптических методов, включая поглощение в УФ- и видимой областях спектра, круговой дихроизм (КД) и флуориметрию, с целью определения структурных характеристик образующихся комплексов.
3.1. Спектры поглощения DB(n).

 Были получены спектры поглощения DB(1-12) в присутствии ДНК. Все они имели схожий характер. На рис. 5 (а, б), в качестве примеров, приведены спектры DB(5) и DB(9) в присутствии ДНК в разных концентрациях (кривые 1-3). При увеличении концентрации ДНК ([ДНК]), выраженной в парах оснований (п.о.), в растворе наблюдался гипохромный эффект и небольшой сдвиг полосы поглощения в длинноволновую область спектра. Такой характер изменения в спектрах поглощения DB(n) свидетельствует об образовании комплекса DB(n)-ДНК.
Были получены спектры поглощения DB(1-12) в присутствии ДНК. Все они имели схожий характер. На рис. 5 (а, б), в качестве примеров, приведены спектры DB(5) и DB(9) в присутствии ДНК в разных концентрациях (кривые 1-3). При увеличении концентрации ДНК ([ДНК]), выраженной в парах оснований (п.о.), в растворе наблюдался гипохромный эффект и небольшой сдвиг полосы поглощения в длинноволновую область спектра. Такой характер изменения в спектрах поглощения DB(n) свидетельствует об образовании комплекса DB(n)-ДНК.
Рис. 5. Спектры поглощения DB(5) (а) и DB(9) (б), в отсутствие (1) и в присутствии ДНК (кривые 2, 3); 0.3 М NaCl + 0.002 М Na3PO4 буфер, рН 6.85. Длина оптического пути 10 мм.
(а) [ДНК] - 1 - 0; 2 - 11.2110-5 М п.о.; 3 - 39.5410-5 М п.о. [DB(5)] - 11.3210-6 М;
(б) [ДНК] - 1- 0; 2 - 12.7510-6 М п.о.; 3 - 53.1310-6 М п.о. [DB(9)] - 10.6010-6 М;
3.2. Спектры флуоресценции DB(n).
Были получены спектры флуоресценции DB(1-12) в отсутствие и в присутствии ДНК. На рис. 6 (а, б), в качестве иллюстрации, приведены спектры флуоресценции для DB(5) и DB(9). Интенсивность флуоресценции в присутствии ДНК увеличивалась в несколько раз для DB(n) с короткими и средними, и примерно в 1.5 раза для лигандов с длинными линкерами. Разгорание флуоресценции DB(n) в присутствии ДНК также подтверждает сделанный выше вывод об образовании этими молекулами комплексов с ДНК.

Рис. 6. Спектр флуоресценции буфера (1), DB(5) (а), DB(9) (б) в отсутствие (2) и в присутствии ДНК (3); 0.3 М NaCl + 0.002 М Na3PO4 буфер, рН 6.85. Флуоресценция возбуждалась при 320 нм, со щелями на возбуждении и испускании 5 нм. Длина оптического пути 10 мм.
(а) [DB(5)] - 1.1810-6 М, [ДНК] - 7.0510-5 M п.о.
(б) [DB(9)] - 2.6110-6 М, [ДНК] - 4.2510-5 M п.о.
3.3. Спектры флуоресценции DB(7) в присутствии акридинового оранжевого, иллюстрирующие индуктивно-резонансный перенос энергии.
Исследование выполнено совместно с В.А. Кузьминым (ИБФ РАН). При определенных условиях возбужденная молекула D* может передавать свою энергию подходящему акцептору A на расстояния (примерно, 50Ч100 A), что намного больше диаметра столкновения. В квантовомеханической трактовке индуктивно-резонансный механизм переноса энергии рассматривается как слабое межмолекулярное взаимодействие на больших расстояниях между молекулами D* и A, которое является частным случаем более общего экситонного механизма передачи энергии.
Спектры флуоресценции DB(7) в присутствии ДНК и акридинового оранжевого (АО) (рис. 7) свидетельствовали об осуществлении индуктивно-резонансного переноса энергии от возбужденного состояния DB(7) в комплексе с ДНК на молекулу красителя АО, также находящегося в комплексе с молекулой ДНК. При этом происходило тушение флуоресценции DB(7) и одновременно появлялась новая полоса флуоресценции комплекса АО-ДНК при 520 нм. Увеличение концентрации ДНК в этой системе приводило к увеличению эффективности процесса переноса энергии и интенсивность флуоресценции комплекса АО-ДНК возрастала. Следует отметить, что при использованной длине возбуждения флуоресценции в 335 нм для красителя АО не наблюдается собственное свечение, поскольку в этой спектральной области он практически не поглощает света и его квантовый выход флуоресценции весьма мал в водном растворе.
 Рис. 7. Индуктивно-резонансный перенос энергии с DB(7) на AO в комплексе с ДНК; 0.02 М Na3PO4 буфер, рН 7.0. Флуоресценция возбуждалась при 335 нм. Длина оптического пути 10 мм.
Рис. 7. Индуктивно-резонансный перенос энергии с DB(7) на AO в комплексе с ДНК; 0.02 М Na3PO4 буфер, рН 7.0. Флуоресценция возбуждалась при 335 нм. Длина оптического пути 10 мм.
(1) [AO] - 510-7 М, [ДНК] - 310-6 М п.о.
(2) [DB(7)] - 510-7 М, [AO] - 510-7 М, [ДНК] - 310-6 М п.о.
(3) [DB(7)] - 510-7 М, [AO] - 510-7 М, [ДНК] - 610-6 М п.о.
(4) [DB(7)] - 510-7 М, [AO] - 510-7 М, [ДНК] - 1.210-5 М п.о.
(5) [DB(7)] - 510-7 М, [ДНК] - 310-6 М п.о.
3.4. Спектры кругового дихроизма DB(n) в комплексе с ХЖКД ДНК.

 Для определения локализации DB(n) в комплексе с ДНК был применен метод кругового дихроизма (КД). При регистрации спектров КД холестерической жидкокристаллической дисперсии (ХЖКД) ДНК в присутствии DB(n) наблюдали появление в спектре КД положительной полосы в области поглощения хромофоров лиганда. Это свидетельствовало не только об образовании комплекса ДНК-лиганд, но и позволяло определить положение лиганда в комплексе с ДНК.
Для определения локализации DB(n) в комплексе с ДНК был применен метод кругового дихроизма (КД). При регистрации спектров КД холестерической жидкокристаллической дисперсии (ХЖКД) ДНК в присутствии DB(n) наблюдали появление в спектре КД положительной полосы в области поглощения хромофоров лиганда. Это свидетельствовало не только об образовании комплекса ДНК-лиганд, но и позволяло определить положение лиганда в комплексе с ДНК.
Рис. 8. КД-спектры ХЖКД ДНК в растворе в отсутствие (кривая 1) и в присутствии DB(5) (а), DB(9) (б), (кривые 2 - 4). Концентрация полиэтиленгликоля (4000) - 170 мг/мл; 0.3 М NaCl + 0.002 М Na3PO4 буфер, рН 6.85. Длина оптического пути 10 мм.
(а) 1 - 0; 2 - 0.6510-6 M; 3 - 1.9110-6 M; 4 - 3.2210-6 M DB(5). [ДНК] - 3.7810-5 M п.о.; в интервале длин волн от 300 до 380 нм амплитуда кривых 2-4 увеличина в 10 раз.
(б) 1 - 0; 2 - 10.6010-6 M; 3 - 15.9010-6 M DB(9). [ДНК] - 1.5510-5 M п.о.
На рис. 8, в качестве примеров, приведены КД-спектры ХЖКД ДНК в отсутствие (кривая 1) и присутствии DB(5) (кривые 2-4, рис. 8а) аи DB(9) (кривые 2-3, рис. 8б). Появление интенсивной отрицательной полосы в спектре КД в области поглощения оснований ДНК (1) свидетельствует об образовании ХЖКД ДНК. В присутствии лигандов наблюдается появление небольшой положительной полосы в области поглощения лигандов (280 - 335 нм) (2, 3), при этом отрицательная полоса в области поглощения ДНК меняется незначительно. Положительный знак полосы в области поглощения хромофоров лиганда указывает на то, что их угол наклона в составе комплекса с молекулой ДНК находится в пределах 0 - 54, что возможно только в случае их расположения в бороздке ДНК. Согласно данным рентгеноструктурного анализа, Ht связывается с ДНК в узкой бороздке, а поскольку DB(n) являются димерами производного Ht, то мы полагаем, что они также располагаются в узкой бороздке ДНК.
4. Определение констант связывания cоединений DB(7) и MB(Ac) с ДНК.
Способность лигандов связываться с ДНК характеризуется константой связывания (Ксв) и длиной участка полимера (L), занимаемого ими в комплексе. Любой метод определения величины Ксв основан на определении соотношений концентраций лиганда, связанного с ДНК, и свободного лиганда в растворе. Определение концентраций лиганда, связанного с ДНК, в свою очередь базируется на том, что свойства комплекса лиганд-ДНК (оптические, гидродинамические и др.) отличаются от свойств свободного лиганда, что позволяет отличать их друг от друга.
Для определения Ксв и L в совместной работе с Е.С. Лисицыной и В.А. Кузьминым (ИБФ РАН) были получены зависимости интенсивности флуоресценции DB(7) в отсутствие и в присутствии двух концентраций poly(dA-dT)poly(dA-dT) от концентрации добавленного лиганда (данные не приводятся). Из анализа зависимостей следовало, что при концентрации poly(dA-dT)poly(dA-dT) равной 1.1210-5 М п.о. весь добавленный DB(7) должен был быть связан с полимером. При концентрации 1.1210-8 М п.о. в растворе должны были находиться как связанные, так и свободные молекулы DB(7). Пусть I1 - интенсивности флуоресценции красителя DB(7) в присутствии 1.1210-5 M п.о. poly(dA-dT)poly(dA-dT), I2 - интенсивности флуоресценции красителя DB(7) в присутствии 1.1210-8 M п.о. poly(dA-dT) poly(dA-dT), I0 - интенсивности флуоресценции красителя DB(7) в буфере, [DB(7)]total - общая концентрация DB(7) в растворе. Тогда Cb = (I1-I0/I2-I0)[DB(7)]total - концентрация связанного DB(7), m = [DB(7)]total - Cb - концентрация свободного DB(7), r = Cb/[poly(dA-dT)poly(dA-dT)] (где [poly(dA-dT)poly(dA-dT)] = 1.1210-8 М) - количество связанного DB(7), рассчитанное на одну п.о. дуплекса. С помощью полученных данных была построена изотерма адсорбции в отложении Скэтчарда, представляющая собой зависимость r/m от r (рис. 9а).
Согласно моделям Гурского - Заседателева и МакГи - фон Хиппеля, касательная к такой изотерме в начальной её части пересекает ось ординат в точке Ксв, а ось абсцисс - в точке 1/(2L-1). Средние значения величин Ксв и L по результатам трёх экспериментов составили 1.50.4108 М-1 и 92 п.о., соответственно. Для сравнения способности мономерного бисбензимидазола образовывать комплекс с ДНК была исследована молекула MB(Ac).

а

Рис. 9. Изотермы адсорбции DB(7) (а) и MB(Ac) (б) на poly(dA-dT)poly(dA-dT) в отложении Скэтчарда; 0.001 М Na-какодилатный буфер, рН 7 в присутствии 1 % ДМСО.
r - отношение концентрации связанного лиганда к концентрации полимера, m - концентрация свободного лиганда в растворе в молях. Квадратами отмечены экспериментальные точки, через которые методом наименьших квадратов проведена прямая.
Также как и в случае DB(7), для соединения MB(Ac) были получены зависимости интенсивности флуоресценции от концентрации данного соединения в буфере и в присутствии 310-5 и 110-6 М п.о ДНК (рис. 9б). Аналогичным образом на основе найденных зависимостей была построена изотерма адсорбции в отложении Скэтчарда. Средние значения величин Ксв и L, определённые из полученных изотерм, по результатам трёх экспериментов для соединения MB(Ac) составили 2.10.2106 М-1 и 31 п.о., соответственно.
Таким образом, как мы и предполагали на стадии планирования структур ДНК-специфичных соединений, димеризация бисбензимидазольной молекулы MB(Ac) привела к существенному (примерно в 100 раз) увеличению Ксв димерного бисбензимидазола DB(7) с ДНК. При этом длина участка связывания молекулы DB(7) на ДНК увеличилась втрое по сравнению с MB(Ac) - как за счёт удвоения молекулы, так и за счёт наличия олигометиленового линкера, что также находится в соответствии с нашими теоретическим расчётами.
5. Изучение взаимодействия DB(n) с ДНК-зависимыми ферментами.
5.1. Ингибирование ДНК-топоизомеразы-I.
ДНК-топоизомераза I (топо-I) [EC 5.99.1.2] является одним из ключевых ферментов, определяющих жизнедеятельность клетки. Топо-I регулирует топологию ДНК во время процессов транскрипции, репликации, рекомбинации и репарации. Этот фермент релаксирует молекулы суперскрученной ДНК (ссДНК) за счет внесения одноцепочечных разрывов с последующим восстановлением ковалентной целостности ссДНК путем лигирования. В совместной работе с О.Ю. Сусовой и Е.А. Лесовой (РОН - РАМН) было исследовано in vitro влияние пяти димерных бисбензимидазолов DB(3,4,5,7,11) на ингибирование эукариотической топо-I. С целью достижения термодинамического равновесия в растворе между разными агрегатными формами молекул DB(n), соединения подвергали предварительной инкубации. Для этого DB(n) разводили до микромолярных концентраций и выдерживали при комнатной температуре в течение трех дней. Затем последующие трое суток соединения инкубировали с плазмидной ссДНК для установления термодинамического равновесия уже в ее присутствии.
 Первоначально был изучен эффект предварительной инкубации димерных бисбензимидазолов DB(3,4,5,7,11) с плазмидной ссДНК на способность ингибировать активность топо-I. Предварительная инкубация с ссДНК значительно усилила эффект ингибирования топо-I для двух лигандов - DB(3,4) (рис. 10). Действительно, при концентрации 2.5 мкМ в присутствии топо-I происходило замедление релаксации ДНК с сохранением большей части ДНК в суперскрученной форме. Тогда как без предварительной инкубации DB(3) или DB(4) даже при концентрации 10 мкМ присутствовали только следы ссДНК. Аналогичная картина наблюдалась и с DB(5) (данные не представлены). Наиболее активным из исследованных соединение оказался димерный бисбензимидазол DB(11), который даже без предварительной инкубации оказывал мощное ингибирующее действие на топо-I (рис. 10). Необходимо отметить, что Соединение МВ (см. схему 2), являющееся мономерным бисбензимидазолом, практически не ингибировало топо-I вплоть до концентрации ~ 200 мкМ.
Первоначально был изучен эффект предварительной инкубации димерных бисбензимидазолов DB(3,4,5,7,11) с плазмидной ссДНК на способность ингибировать активность топо-I. Предварительная инкубация с ссДНК значительно усилила эффект ингибирования топо-I для двух лигандов - DB(3,4) (рис. 10). Действительно, при концентрации 2.5 мкМ в присутствии топо-I происходило замедление релаксации ДНК с сохранением большей части ДНК в суперскрученной форме. Тогда как без предварительной инкубации DB(3) или DB(4) даже при концентрации 10 мкМ присутствовали только следы ссДНК. Аналогичная картина наблюдалась и с DB(5) (данные не представлены). Наиболее активным из исследованных соединение оказался димерный бисбензимидазол DB(11), который даже без предварительной инкубации оказывал мощное ингибирующее действие на топо-I (рис. 10). Необходимо отметить, что Соединение МВ (см. схему 2), являющееся мономерным бисбензимидазолом, практически не ингибировало топо-I вплоть до концентрации ~ 200 мкМ.
Рис. 10. Влияние предварительной инкубации димерных бисбензимидазолов с ссДНК на эффективность ингибирования топо-I: соединения DB(3), DB(4), DB(11) в концентрациях 2,5, 5 и 10 мкМ; знак * означает, что вещество выдерживали трое суток в водном растворе при комнатной температуре, затем столько же с ссДНК при 4С. В качестве контроля соединения вносили в реакционную смесь непосредственно перед реакцией, которую инициировали внесением в реакционную смесь топо-I. Эксперимент проводили в трёх и более повторах.
На рис. 11 представлено сравнение ингибирующих свойств димерного бисбензимидазола DB(7) c алкалоидом камптотецином - классическим ингибитором топо-I. При взаимодействии DB(7) с ссДНК наблюдалось увеличение ингибирующей активности по сравнению с камптотецином в десятки раз. Действительно, уже в присутствии 0,5 мкМ DB(7), после предварительной инкубации с ссДНК, активность топо-I подавлялась в той же степени как при добавлении 25 мкМ камптотецина (если судить по количеству ссДНК, не подвергшейся действию топо-I).

Рис. 11. Сравнение камптотецина и DB(7), предварительно инкубированного с ссДНК, на способность ингибировать топо-I. Эксперимент ставили в трех и более повторах. Остальные условия как в подписи к рис. 10.
 Использованная в работе плазмида рНОТ1 (Topogen) содержит один высокоаффинный сайт расщепления топо-I (рис. 12). Мы полагаем, что относительно
Использованная в работе плазмида рНОТ1 (Topogen) содержит один высокоаффинный сайт расщепления топо-I (рис. 12). Мы полагаем, что относительно
Рис. 12. Последовательность плазмиды рНОТ1.Стрелкой отмечено место расщепления топо- I, подчеркнуты AT- сайты в самом месте расщепления и ближайшие к нему.
высокая ингибирующая активность димерных бисбензимидазолов связана с тем, что в сайте расщепления топо-I плазмиды pHOT1 места от (Ц2) до (+1) и от (+5) до (+10), а также - от (Ц6) до (Ц7) заняты как минимум двумя AT-парами. Следовательно, имеются две пары сайтов, на каждом из которых может связаться один из бисбензимидазольных фрагментов молекулы DB(n). Действительно, молекула Ht, содержащая один бисбензимидазольный фрагмент, по данным рентгеноструктурного анализа, образует водородные связи с двумя подряд расположенными AT-парами. Поэтому на двух парах сайтов, разделенных короткой последовательностью из любых пар нуклеотидов, может происходить одновременное связывание в линейной раскрытой форме всей молекулы димерного бисбензимидазола. Следовательно, молекулы DB(n) могут связываться c ccДНК как непосредственно с местом расщепления ссДНК топо-I, так и рядом с ним. Поэтому, естественно предположить, что такие лиганды могут оказаться конкурентными ингибиторами топо-I.
Таким образом, соединения DB(n) могут рассматриваться в качестве нового класса ингибиторов топо-I, обладающих, по крайней мере, в десятки раз большей эффективностью, чем традиционно используемый ингибитор топо-I камптотецин. Было показано, что предварительная инкубация лигандов в течение трех суток с ссДНК многократно повышает ингибирующую активность исследованных соединений в отношении топо-I.
5.2. Ингибирование ДНК-метилтрансферазы мыши Dnmt3a.
ДНК-метилтрансфераза (МТаза) мыши Dnmt3a [EC 2.1.1.37] принадлежит к недавно открытому семейству МТаз млекопитающих Dnmt3. Dnmt3a узнает в ДНК участок СрG и метилирует остаток цитозина по атому углерода С5 (С5-МТаза), формируя профиль метилирования de novo на стадии эмбриогенеза и гаметогенеза. Правильное распределение метилированных СрG-участков в геноме чрезвычайно важно для развития клетки. Одним из механизмов развития раковых опухолей является инактивация генов-супрессоров опухолевого роста, которая происходит из-за гиперметилирования de novo промоторных СрG-островков этих генов в процессе канцерогенеза . Изменение статуса метилирования ДНК зависит от функционирования МТаз. Этим объясняется повышенный интерес к ингибированию активности данных ферментов.
В данном исследовании, проведённом совместно с Н.А. Черепановой и Е.С. Громовой (Химфак МГУ), был использован C-концевой каталитический домен Dnmt3a (Dnmt3a-CD), который сохраняет свою каталитическую активность в отсутствие N-концевого регуляторного домена. В качестве ингибиторов Dnmt3a-CD были опробованы димерные бисбензимидазолы DB(1-5,7,11).
Ингибирующая активность лигандов DB(n) была исследована в реакции метилирования МТазой Dnmt3a-CD 30-звенного ДНК-дуплекса I, содержащего CpG-участок и флуоресцентную метку (6(5)-карбоксифлуоресцеин, FAM) на 5Т-конце верхней
цепи. 5Т-FAM- C TGAATACTA C T T G CGC T Cа T аC аTAACC T GAT
3Т-GACT T AT GAT GAACGСGAGAGATT GGAC TA
Рис. 13. Последовательность 30-звенного ДНК-дуплекса I. Жирным выделен CpG-участок, метилируемые остатки цитозина подчеркнуты.
Для количественной оценки ингибирующей активности определяли значения IC50 - концентрацию ингибиторов, при которой эффективность метилирования дуплекса I уменьшалась на 50 %. Степень метилирования определяли по защите метилированного дуплекса I от расщепления его эндонуклеазой рестрикции HhaI (R.HhaI). Эксперимент проводился в двух вариантах: 1) c предварительным инкубированием комплекса DB(n) c 30-звенным ДНК-дуплексом I (3 суток, +4С) и 2) без предварительного инкубирования. Полученные результаты представлены в таблице 3.
Следует отметить, что, как и при ингибировании топо-I, предварительное инкубирование DB(n) с дуплексом значительно увеличивало ингибирующую активность молекул лигандов. При этом максимальная способность понижать активность МТазы Dnmt3a-CD
аТаблица 3. Ингибирование метилирования дуплекса I МТазой Dnmt3a-CD в присутствии DB(n).Соединение |
IC50, мкM |
|
Время инкубации смеси соединения с ДНК |
||
10 мин |
3 дня |
|
DB(1) |
33,9 (9,8) |
12.5 (5.5) |
DB(2) |
35,5 (9,2) |
9.8 (1.6) |
DB(3) |
150 (40) |
11.2 (3.0) |
DB(4) |
300 (70) |
38.0 (7.0) |
DB(5) |
700 (95) |
77.8 (12.0) |
DB(7) |
53.0 (9.5) |
18.7 (4.8) |
DB(11) |
18.0 (5.6) |
5.0 (1.5) |
наблюдалась для соединений с наиболее коротким (DB(2)) и наиболее длинным (DB(11)) линкерами между бисбензимидазольными фрагментами молекулы.
Необходимо подчеркнуть, что и в случае МТазы Dnmt3a-CD мономерный бисбензимидазол MB даже в условиях длительного инкубирования с ДНК практически не проявлял ингибирующей активности (активность фермента уменьшалась всего на 7 % в присутствии 200 мкМ соединения MB). Этот факт свидетельствует о том, что именно удвоение молекулы MB приводит к созданию соединений, обладающих высокой ингибирующей активностью.
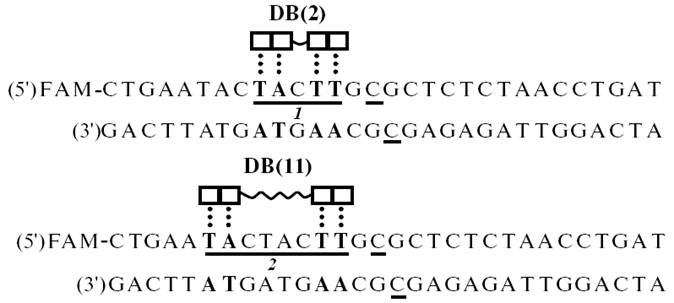 Более наглядно вероятный механизм взаимодействия DB(n) c дуплексом I представлен на рис. 14. Дуплекс I содержит две AT-пары (выделены жирным на рисунке) рядом с метилируемыми нуклеотидами С. Эти АТ-пары образуют один из сайтов связывания для молекул DB(n). Другой сайт, содержащий две подряд расположенные АТ-пары, также выделенные жирным, находится через одну (участок 1) или четыре пары оснований (участок 2). Следовательно, на дуплексе I имеются два участка связывания для молекул DB(n).
Более наглядно вероятный механизм взаимодействия DB(n) c дуплексом I представлен на рис. 14. Дуплекс I содержит две AT-пары (выделены жирным на рисунке) рядом с метилируемыми нуклеотидами С. Эти АТ-пары образуют один из сайтов связывания для молекул DB(n). Другой сайт, содержащий две подряд расположенные АТ-пары, также выделенные жирным, находится через одну (участок 1) или четыре пары оснований (участок 2). Следовательно, на дуплексе I имеются два участка связывания для молекул DB(n).
Рис. 14. Взаимодействие исследованных соединений DB(n) с 30-звенным дуплексом I. Подчеркнуты нуклеотиды C, которые метилируются по 5-му положению цитозинов, и предполагаемые участки связывания для DB(2) и DB(11). Квадрат обозначает бензимидазол, пара квадратов (прямоугольник) - бисбензимидазольный блок. Волнистая линия, соединяющая два бисбензимидазольных блока, - линкер. Точки - водородные связи между N1-атомами бензимидазолов и акцепторами в нуклеотидах - А (атом N3) и Т (атом O2). Жирным шрифтом выделены АТ-пары, входящие в состав участков связывания с DB(2) и DB(11).
Участок 1 должен быть оптимальным для связывания с DB(n), имеющим линкер, накрывающий одну пару оснований, тогда как участок 2 подходит для взаимодействия с DB(n), у которого линкер способен накрывать четыре пары оснований. На основании пространственной структуры синтезированных DB(n) мы предполагаем, что относительно высокая ингибирующая активность соединений DB(1-3) и DB(11) по сравнению с DB(4, 5, 7) обусловлена тем, что они оптимальным образом в виде бидентантных лигандов сайт - специфично связываются с участками 1 и 2, соответственно.
Таким образом, в рамках данного исследования было показано, что ряд исследованных соединений сайт-специфично ингибируют МТазы Dnmt3ain vitro в низких микромолярных концентрациях.
5.3. Ингибирование хеликазной активности белка NS3 вируса гепатита С человека.
В совместной работе с В.Л. Туницкой и А.В. Муковня (ИМБ РАН) было исследовано влияние DB(n) на хеликазную активность неструктурного белка NS3 HCV. Данный белок обладает тремя ферментативными активностями: его большему C-концевому домену присущи хеликазная и сопутствующая активность в качестве NTP-азы, в то время как малый N-концевой домен является специфической протеазой, обеспечивающей invivo процессинг вирусного полипептида. Ранее было установлено, что исследования взаимодействия полноразмерного белка и его хеликазного домена с ингибиторами хеликазной и NТР-азной активностей возможно проводить как на полноразмерном белке, так и на хеликазном домене. Поэтому изучение ингибирующего воздействия DB(n) на хеликазную активность NS3 было проведено с использованием одного хеликазного домена как более доступного.
В качестве контрольных соединений были протестированы Ht и соединение MB(Ac), являющееся мономерным предшественником соединений серии DB(n) (см. схему 2). Оптимальным субстратом для хеликазы NS3 является частично-спаренный олигонуклеотидный дуплекс с одноцепочечным 3Т- концом. Наличие последнего является неотъемлемым условием проявления ферментативной активности: предполагается, что связывание хеликазы NS3 происходит на одноцепочечном участке, передвигаясь вдоль которого фермент достигает двухцепочечной части дуплекса и осуществляет его расплетание. Определение хеликазной активности в присутствии исследуемых соединений проводили с использованием олигонуклеотидных дуплексов различной структуры (рис. 15).
В первых экспериментах был использован частично-спаренный ДНК-дуплекс произвольной последовательности с одноцепочечным 3Т- концом S1. При использовании этого субстрата было показано (табл. 4), что практически все тестированные соединения имеют близкие значения IC50, и лишь одно из них - DB(11) с максимальной длиной линкера демонстрировало более сильный ингибирующий эффект (IC50 отличалось более чем на порядок). Мономерные бисбензимидазолы Ht и MB(Ac) не оказывали ингибирующего действия на фермент вплоть до концентраций 400-500 мкМ.
Таблица 4. Ингибирование хеликазной активности NS3 димерными бисбензимидазолами DB(n), и мономерными бисбензимидазолами Ht и MB(Ac).
ДНК-дуплекс Соединение |
ДНК-дуплексыIC50, mM |
|||||
S1 |
SM1 |
S(DB2)a |
S(DB2)b |
S(DB11) |
SМ2 |
|
DB(2) |
> 100* |
230 |
250 |
260 |
240 |
240 |
DB(3) |
> 100 |
235 |
220 |
250 |
230 |
Ц |
DB(4) |
Ц |
230 |
150 |
240 |
170 |
- |
DB(5) |
> 100 |
225 |
150 |
200 |
160 |
Ц |
DB(7) |
> 100 |
210 |
150 |
140 |
140 |
Ц |
DB(11) |
10 |
7 |
7 |
12 |
8 |
9 |
Ht |
** |
** |
** |
** |
** |
Ц |
MB(Ac) |
*** |
*** |
*** |
*** |
*** |
Ц |
* В экспериментах с использованием дуплекса S1 ингибиторы (за исключением мономерных соединений) не тестировались в концентрациях выше 100 мкМ
** Нет ингибирующего эффекта в концентрации < 400 мкМ.
*** Нет ингибирующего эффекта в концентрации < 500 мкМ.
S1: 3Т- ACCTCAGGATATCACTCAGCATAATTA TAGCTA C-5Т
5Т - аG T CGTA TTA ATATCGATG-3Т
S(DB2)a: а3Т- ACCTCAGGATATCACT CAGCATGATCGCGGCTAC-5Т
5Т - GT CGTA CTAGCGC CGATG-3Т
S(DB2)b:аа 3Т- ACCTCAGGATATCACT CAGCATGATCGCGGCCGC-5Т
5Т - G TCG TACTAGCGC CGGCG-3Т
S(DB11):аа 3Т- ACCTCAGGATATCACT CAGCATGGCCATAGCTAC-5Т
5Т - GTCG T ACCGGTAT CGATG-3Т
SM1:аа 3Т- ACCTCAGGATATCACTCAGCATGGCCGCGGCTAC-5Т
5Т -а G T C GTACCGGCGCCGATG-3Т
аSM2:а 3Т- ACCTCAGGACACCACTCAGCACAGT CACAGCT GC-5Т
5Т - G TC G TG T CAGTGT C GACG-3Т
Рис. 15. Структуры ДНК-дуплексов, использованных в работе. Жирным шрифтом выделены А-Т последовательности, подчеркнуты участки предполагаемого связывания с соединениями DB(2) и DB(11).
Поскольку последовательность ДНК-субстрата в случаеS1 была произвольной, нельзя было исключить влияния на ингибирующий эффект соединений расположения (А-Т)-богатых кластеров, которое могло оказаться наиболее подходящим именно для связывания с дуплексом DB(11). Поэтому в дальнейшей работе в исследовании использовался набор специально синтезированных матриц (Литех (Россия)) с различным расположением (или с полным отсутствием) в двухцепочечном участке А-Т пар, к которым специфичны DB(n). Субстраты S(DB2)а и S(DB2)b обладали последовательностями, оптимальными для связывания лиганда DB(2) (отличаясь между собой наличием в S(DB2)a дополнительной А-Т пары). Субстрат S(DB11) - был оптимален для взаимодействия с DB(11), в то время как в субстрате SM1 расстояние между двумя А-Т парами было столь большим, что участок дуплекса, в который они входили, не мог быть специфичным ни для одного из исследуемых соединений. В структуре дуплекса SM2 полностью отсутствовали АТ/ТА кластеры, причем не только в спаренном, но и в одноцепочечном участке дуплекса.
Тем не менее, ожидаемой корреляции между структурой дуплекса и ингибирующим эффектом соединений с разной длиной линкера обнаружить не удалось. Как и на случайно взятой последовательности дуплекса (S1), максимальный ингибирующий эффект наблюдался у соединения DB(11), а более слабые и близкие по величине эффекты - на соединениях с более короткими линкерами (n = 2-5, 7) (табл. 4).
Следовательно, можно однозначно заключить, что поскольку эффективность связывания ингибиторов с двуспиральным участком дуплекса, определяющаяся расположением (А-Т)-кластеров, ни в коей мере не коррелирует с ингибирующим эффектом соединения, то для хеликазной реакции взаимодействие DB(n) с ДНК не является причиной ингибирования ферментативной активности. В таком случае единственно возможным представлялось предположение о непосредственном взаимодействии лигандов с ферментом, что и было подтверждено с помощью регистрации спектров флуоресценции свободного лиганда DB(11) и его комплекса с ферментом (данные не приводятся).
Таким образом, в случаях предыдущих двух ферментов DB(n) действовали исключительно как узкобороздочные лиганды, и их ингибирующая активность была полностью или в значительной степени обусловлена именно связыванием с участком ДНК, служащим субстратом или матрицей для фермента. Однако, при изучении влияния соединений DB(n) на хеликазную активность NS3 впервые продемонстрирован альтернативный механизм ингибирования этого фермента соединениями данного класса. Хотя связывание лигандов в узкой бороздке дуплекса, несомненно, имеет место, оно, тем не менее, не влияет на ингибирование. Последнее определяется непосредственным взаимодействием фермент-лиганд, что приводит, как мы полагаем, к нарушению способности связывания фермент-ингибиторного комплекса с одноцепочечным участком субстратного дуплекса, и/или перемещения вдоль этого участка. Поэтому одновременное связывание тех же лигандов в узкой бороздке двухспиральной ДНК не вносит вклада в ингибирующий эффект соединений: фермент в комплексе с ингибитором не достигает двухцепочечного участка дуплекса.
6. Исследование мутагенных свойств соединений MB, MB(Ac) и DB(11).
Биохимические исследования димерных бисбензимидазолов серии DB(n) показали, что данные соединения проявляли значительный ингибирующий эффект по отношению ко всем трём протестированным ДНК-зависимым ферментам. На основании полученных данных можно сделать вывод о перспективности изучения лигандов DB(n) в качестве противоопухолевых, противовирусных и антибактериальных агентов. Поскольку данные вещества являются узкобороздочными лигандами, нековалентно связывающимися с ДНК, то их действие не должно сопровождаться повреждением ДНК, или сколько-либо значительным искажением ее пространственной структуры. Следовательно, можно было бы ожидать, что соединения DB(n) не будут обладать мутагенными свойствами. Для подтверждения данного предположения совместно с О.Ю. Сусовой и К.И. Кирсановым (РОН - РАМН) были проведены исследования мутагенных свойств димерного бисбензимидазола DB(11) и мономерных бисбензимидазолов MB и MB(Ac) (см. схему 2) с помощью двух краткосрочных тестов: теста Эймса (генетический тест для оценки мутагенного потенциала химических соединений с использованием бактерий Salmonella Typhimurium в качестве тест-объекта) и теста SMART (тест на соматический мутагенез и рекомбинацию на дрозофиле). Было установлено, что в отличие от мономерных бисбензимидазолов MB и MB(Ac) димерный бисбензимидазол DB(11) ни в тесте Эймса, ни в тесте SMART не проявлял мутагенной активности.
7. Изучение DB(3, 4, 5, 7, 11) и MB в качестве новых флуорохромов в цитогенетических исследованиях. (Исследования проведены совместно с К.В. Поповым и Е.И. Егоровой, ИМБ РАН).
7.1. Флуоресцентное окрашивание фиксированных препаратов клеток фибробластов линии MRC-5 эмбрионального легкого человека.
Флуоресценцию препаратов, окрашенных исследуемыми лигандами, наблюдали при возбуждении в ультрафиолетовой (? = 365 нм), синей (? = 460 нм) и зеленой (? = 525 нм) областях спектра. Контролем специфичности окраски служило окрашивание соединениями DAPI (4Т,6-диамидино-2-фенилиндол) и Ht, являющимися высокоэффективными флуоресцентными красителями (флуорохромами) ДНК.
Поскольку лиганды DB(3, 4, 5, 7) вызывали яркую, устойчивую к выцветанию гетерогенную окраску клеточного ядра при УФ-возбуждении и низкую яркость флуоресценции ядра при возбуждении синим и зеленым светом и низкую яркость флуоресценции цитоплазмы при возбуждении в УФ, синей и зеленой областях спектра, они были признаны перспективными для дальнейшего исследования. Таким образом, можно отметить, что перечисленные соединения по своим флуорохромным характеристикам оказались аналогичными обычно используемым в практической цитогенетике АТ-специфичным красителям Ht и DAPI.
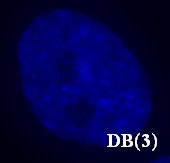
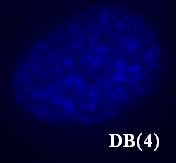
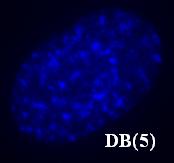

Рис. 16. Окраска ядер клеток линии MRC-5 соединениями DB(3, 4, 5, 7).
7.2. Дифференциальное окрашивание хромосом человека.
 При окрашивании хромосомных препаратов линии MRC-5 фибробластов человека лигандами DB(3, 4, 5, 7) наблюдались рисунки дифференциального окрашивания хромосом, сходные с рисунками, выявляемыми DAPI и Ht. При этом контрастность рисунка, полученного при использовании DB(4) и DB(5), оказалась выше, чем в случае использования аHt и DAPI (рис. 17).
При окрашивании хромосомных препаратов линии MRC-5 фибробластов человека лигандами DB(3, 4, 5, 7) наблюдались рисунки дифференциального окрашивания хромосом, сходные с рисунками, выявляемыми DAPI и Ht. При этом контрастность рисунка, полученного при использовании DB(4) и DB(5), оказалась выше, чем в случае использования аHt и DAPI (рис. 17).
Рис. 17. Метафазные хромосомы линии MRC-5 фибробластов человека, окрашенные соединениями DB(3, 4, 5, 7), Ht и DAPI. Масштабная черта - 10 мкм.
7.3. Выявление рисунка дифференциального окрашивания хромосом льна.
 При окрашивании хромосомных препаратов льна (Linum grandiflorum L.) соединениями DB(3, 4, 5, 7), DAPI и Ht был выявлен рисунок подобный DAPI- и С-дифференциальному окрашиванию (т.е. окрашиванию преимущественно центромеров и других районов богатых гетерохроматином, содержащих высокоповторяющиеся последовательности ДНК).
При окрашивании хромосомных препаратов льна (Linum grandiflorum L.) соединениями DB(3, 4, 5, 7), DAPI и Ht был выявлен рисунок подобный DAPI- и С-дифференциальному окрашиванию (т.е. окрашиванию преимущественно центромеров и других районов богатых гетерохроматином, содержащих высокоповторяющиеся последовательности ДНК).
Рис. 18. Дифференциальная окраска хромосом льна: DB(4) (а); DAPI (б); Ht (в); С-окраска (г).
Подводя итог данного исследования, можно заключить, что димерные бисбензимидазолы DB(4) и DB(5) могут быть рекомендованы для применения в цитогенетической практике по совокупности ряда критериев: 1) специфичности окрашивания хромосом, 2) яркой и устойчивой к обесцвечиванию флуоресценции и 3) контрастному рисунку поперечной исчерченности хромосом (Q-бэндингу).
ВЫВОДЫ
1. Осуществлён синтез двенадцати флуоресцентных симметричных димерных бисбензимидазолов DB(n), различающихся длиной олигометиленового линкера (n = 1-12), соединяющего два бисбензимидазольных фрагмента молекулы.
2. Рядом спектральных методов подтверждено связывание DB(n) с ДНК, установлена локализация DB(n) в узкой бороздке ДНК при образовании комплекса.
3. С помощью метода, основанного на флуориметрических измерениях, определены константы связывания и число пар оснований на дуплексе poly(dA-dT)poly(dA-dT), которые занимают димерный бисбензимидазол DB(7) и мономерный бисбензимидазол MB(Ac) при образовании комплексов. Установлено, что величина константы связывания DB(7) составляет 1.5108 М-1, что ана два порядка выше, чем у MB(Ac).
4. Продемонстрировано, что некоторые из соединений серии DB(n) ингибирует invitro в микромолярных концентрациях три ДНК-зависимых фермента: ДНК-топоизомеразу-I, ДНК-метилтрансферазу мыши Dnmt3a и хеликазу NS3 вируса гепатита С человека. Обнаружена сайт-специфичность при ингибировании ДНК-метилтрансферазы соединениями серии DB(n).
5. Показано, что соединения DB(n) являются новыми перспективными АТ-специфичными флуорохромами, способными проникать через клеточную и ядерную мембраны, окрашивать ядра и дифференциально окрашивать хромосомы.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи:
1.аа Zhuze A.L., Gromyko A.V., Ivanov A.A., Salyanov V.I., Popov K.V., Korolev S.P., Gottikh M.B., Oleinikov V.A., Streltsov S.A. New highly fluorescing bis-Hoechsts: physicochemical, biochemical and cytological studies. // J. Biomol. Struct & Dyn. 2007. V. 24. № 6. P. 666-668.
2.аа Иванов А.А., Стрельцов С.А., Приказчикова Т.А., Готтих М.Б., Жузе А.Л. Синтез и свойства ДНК-специфичного лиганда - симметричного димерного бисбензимидазола. // Биоорган. химия. 2008. Т. 34. № 2. С. 285-288.
3.аа Попов К.В., Егорова Е.И., Иванов А.А., Громыко А.В., Жузе А.Л., Большева Н.Л., Семенова О.Ю., Муравенко О.В., Зеленин А.В. Димерные бис-бензимидазольные красители на основе Hoechst 33258 - новые ДНК-специфичные флуорохромы для цитогенетики человека и растений. // Биологич. мембраны. 2008. Т. 25. № 3. C. 173-179.
4.аа Сусова О.Ю., Иванов А.А., Моралес Руис С.С., Лесовая Е.А., Громыко А.В., Стрельцов С.А, Жузе А.Л. Узкобороздочные димерные бисбензимидазолы ингибируют in vitro связывание с ДНК эукариотической ДНК-топоизомеразы I. // Биохимия. 2010. Т. 75. № 6. С. 781-788.
5.аа Cherepanova N.A, Ivanov A.A., Maltseva D.V., Minero A.S, Gromyko A.V., Streltsov S.A., Zhuze A.L., Gromova E.S. Dimeric bisbenzimidazoles inhibit the DNA methylation catalyzed by the murine Dnmt3a catalytic domain. // J. Enz. Inh. & Med. Chem. 2011. V. 26. № 2. P. 295-300.
6.аа Иванов А.А., Салянов В.И., Стрельцов С.А., Черепанова Н.А., Громова Е.С., Жузе А.Л. Лиганды, специфичные к определенным последовательностям пар оснований ДНК. XIV. Синтез флуоресцентных биологически активных димерных бисбензимидазолов - DB(3, 4, 5, 7, 11). // Биоорган. химия. 2011. Т. 37. № 4. С. 530-541.
7.аа Tunitskaya V.L., Mukovnya A.V., Ivanov A.A., Gromyko A.V., Ivanov A.V., Streltsov S.A., Zhuze A.L., Kochetkov S.N. Inhibition of the helicase activity of the HCV NS3 protein by symmetrical dimeric bis-benzimidazoles. // Bioorg Med Chem Lett. 2011. V. 21. № 18. P. 5331-5335.
Тезисы:
1.аа Егорова Е.А., Иванов А.А., Попов К.В., Жузе А.Л., Зеленин А.В. Тестирование новых ДНК-специфичных флуоресцентных красителей для дифференциального окрашивания хромосом человека и растений. // II Съезд Общества клеточной биологии. Санкт-Петербург, 17-19 октября,Цитология. 2007. Т. 49. № 9.С. 742.
2.аа Иванов А.А., Жузе А.Л. Синтез и исследование узкобороздочного лиганда - ингибитора ДНК-специфичных ферментов. // X молодежная конференция по органической химии. Уфа, 26-30 ноября 2007 г., С. 167.
3.аа Иванов А.А., Жузе А.Л. 2008 Синтез и исследование симметричных димерных бисбензимидазолов - ингибиторов ДНК-специфичных ферментов. // XX?зимняя международная молодежная научная школа УПерспективные направления физико-химической биологии и биотехнологииФ. Москва, 11-15 февраля 2008 г.,С. 96.
4.аа Zelenin A.V., Popov K.V., Egorova E.I., Ivanov A.A., Gromyko A.V., Zhuze A.L., Bolsheva N.L, Yurkevich O.U., Muravenko O.V. Novel AT-specific DNA-binding dimeric bis-benzimidazoles as efficient fluorochromes for cytogenetics and chromosome analysis. // Abstracts of XIV Interntional Congress of ISAC (International Society of Analytical Cytology), Budapesht, 17-21 May 2008, P. 188.
5.аа Иванов А.А., Жузе А.Л. Физико-химические исследования ряда узкобороздочных лигандов - ингибиторов ДНК-зависимых ферментов. // XXIII Международная зимняя молодежная научная школа УПерспективные направления физико-химической биологии и биотехнологииФ, Москва, 7-10 февраля 2011г., С. 21.
6.аа Ivanov A.A., Kirsanov K.I., Lesovaya E.A., Susova O.Y., Zhuze A.L., Belitsky G.A., Yakubovskaya M.G. Mutagenic and blastomogenic effects of bisbenzimidazoles with different DNA binding characteristics. // Keystone Symposia on Molecular and Cellular Biology: DNA Replication and Recombination, Keystone, Colorado, February 27 - March 4 2011, P. 124.
7.аа Ivanov A.A., Streltsov S.A., Salyanov V.I., Susova O.Y., Gromova E.S., Zhuze A.L. Minor groove ligands based on dimeric bisbenzimidazoles as inhibitors of DNA-dependent enzymes. // Albany 2011: The 17th Conversation, Albany, New York, 14-18 June 2011, P. 1131-1132.
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
