Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Разработка тест-систем для оценки мукозального и клеточного иммунитета птиц
Автореферат кандидатской диссертации
На правах рукописи
Ирза Анна Викторовна
РАЗРАБОТКА ТЕСТ- СИСТЕМ ДЛЯ ОЦЕНКИ МУКОЗАЛЬНОГО аИ КЛЕТОЧНОГО ИММУНИТЕТА ПТИЦ
03.02.02 Вирусология
Aвтореферат
диссертации на соискание ученой степени
кандидата биологических наук
Владимир - 2012
Работа выполнена в Федеральном государственном бюджетном учреждении Федеральный центр охраны здоровья животныха (ФГБУ ВНИИЗЖ), г. Владимир
Научный руководитель Ц |
кандидат ветеринарных наук,а старший научный сотрудник, Старов Сергей Константинович |
Официальные оппоненты: |
Цыбанов Содном Жамьяновича доктор биологических наук, профессор, заведующий лабораторией биофизики ГНУ Всероссийский научно-исследовательский институт ветеринарной вирусологии и микробиологии Российской академии сельскохозяйственных наук (ГНУ ВНИИВВиМ Россельхозакадемии), г. Покров |
Смоленский Владимир Иванович доктор биологических наук, профессор, заместитель директора ФГБУ Всероссийский государственный центр качества и стандартизации лекарственных средств для животных и кормов (ФГБУ ВГНКИ) г. Москва |
Ведущая организация Ц Государственное научное учреждение Всероссийский институт экспериментальной ветеринарии им. Я.Р. Коваленко Российской академии сельскохозяйственных наук (ГНУ ВИЭВ Россельхозакадемии), г. Москва
Защита диссертации состоится 15 мая 2012 г. ва л10 00 часов на заседании совета по защите докторских и кандидатских диссертаций Д 220.015.01 при ФГБУ Федеральный центр охраны здоровья животных по адресу: 600901,аа г. Владимир, мкр. Юрьевец
С диссертацией можно ознакомиться в библиотеке ФГБУ Федеральный центр охраны здоровья животных.
Автореферат разослан л__ апреля 2012 г.
Ученый секретарь совета по защите
докторских и кандидатских диссертаций
ФГБУ ВНИИЗЖ
доктор биологических наук а а А.П. Пономарев
1. Общая характеристика работы
1.1. Актуальность темы. Поверхности слизистых респираторного и желудочно-кишечного тракта представляют собой основные ворота для проникновения большинства патогенов, поражающих птиц. Защитные реакции слизистых оболочек играют роль наружного барьера, предохраняя организм от воздействия различной патогенной микрофлоры. Этот тип иммунного ответа получил название иммунитета слизистых оболочек или мукозального иммунитета. Одно из перспективных направлений совершенствования иммунологических препаратов представляет конструирование мукозальных вакцин, главными компонентами которых являются специфический антиген и адъюванты, обладающие мукоадгезивной активностью, вводимые интраназально или перорально [2, 3, 13].
Преимуществом мукозальных вакцин при локальной иммунизации является их высокая безопасность, а также формирование не только местной защиты слизистых оболочек, но и системного иммунного ответа. Разработка методов оценки мукозального и клеточного иммунитета необходима для определения типа, динамики и направления иммунного ответа при изучении резистентности организма птиц к возбудителям болезней или эффективности вакцинации [7, 9, 12].
В связи с этим исследования по разработке различных количественных и качественных методов, сравнению и установлению корреляции между ними с целью построения общей картины иммунного ответа приобрели актуальность.
1.2. Степень разработанности проблемы. Вопросам оценки клеточного и мукозального иммунитета птиц и взаимодействия их с гуморальными факторами защиты посвящены работы ряда зарубежных авторов [7, 8, 10, 12, 13]. Lambrecht B. и сотр. (2004) предложили сэндвич-вариант ИФА для выявления ?-интерферона [4]. AL-Garib S.O. и сотр. (2003) с помощью ИФА аопределили кинетику и распределение классов иммуноглобулинов к вирусу ньюкаслской болезни (ВНБ) [8]. Применение метода проточной цитофлуориметрии позволило количественно охарактеризовать субпопуляции лимфоцитов. В работах Dalgaard T.S. и сотр. (2010), Однако данные, полученные разными исследователями при изучении иммунных реакций птиц, имеют большие отличия и носят противоречивый характер. В РФ Колабской Л.С. (1987) были предложены методы исследований отдельных направлений клеточного иммунитета птиц, но в комплексе глубокого изучения различных факторов иммунного ответа не проводилось [1]. До текущего времени надёжных и достоверных диагностических тест-систем по оценке мукозального и клеточного иммунитета не разработано.
1.3. Цель и задачи исследований. Цель данной работы состояла в разработке тест-систем дляа оценки мукозального и клеточного иммунитета птиц. Для осуществления поставленной цели необходимо было решить следующие задачи:
- Оптимизировать методы отбора проб секреторных жидкостей с поверхностейа слизистых оболочек для получения качественных образцов, позволяющих проводить оценку мукозального иммунитета.
- Разработать методы комплексной оценки иммунитета:
- клеточного (иммунофенотипирование и оценка пролиферации лимфоцитов, анализ экспрессии цитокинов, количественное определение интерферона;
- мукозального (выявление иммуноглобулинов классов IgА, IgG, IgM в секреторных жидкостях);
- гуморального (выявление специфических иммуноглобулинов класса M).
- С помощью разработанных методов изучить иммунный ответ цыплят на введение различных вакцинных препаратов против НБ: коммерческие живые и аинактивированные вакцины; инактивированные вакцины, содержащие мукозальные адъюванты.
- Определить взаимосвязь между изучаемыми показателями местных факторов защиты и гуморального иммунитета.
- Изучить зависимость между уровнем защиты и параметрами иммунного ответа вакцинированной птицы до и после контрольного заражения высоковирулентным вирусом НБ с помощью разработанных методов.
1.4. Научная новизна исследований. Впервые в отечественной ветеринарной лабораторной диагностике разработаны методы комплексной оценки гуморального, мукозального и клеточного иммунитета птиц с использованием современных лабораторных тест-систем. Испытаны адьюванты в составе экспериментальных вакцин против НБ для местного применения. На биологической модели с контрольным заражением цыплят высоковирулентным вирусом НБ установлены параметры местных и системныха иммунных реакций, обеспечивающие устойчивость птиц к заболеванию и гибели.
1.5. Практическая значимость работы. По результатам исследований разработаны и утверждены директором ФГБУ ВНИИЗЖ 7 методических указаний и рекомендаций по комплексной оценке иммунитета птиц, которые используются в лабораторной практике.
1.6. Соответствие диссертации паспорту научной специальности. В соответствии с формулой специальность 03.02.02 Вирусология представляет собой область науки, занимающуюся исследованием вирусов, их происхождения, состава, строения, генетики, морфологии, механизмов размножения, аспектов взаимоотношений с клеточными организмами, проблемами противовирусного иммунитета, патогенности вирусов, разработкой мер и средств предупреждения, диагностики и лечения вызываемых вирусами заболеваний. В диссертации приведены результаты исследований по разработке методов оценки клеточного и мукозального иммунитета птиц иа их применению для изучения иммунного ответа цыплят на введение различных вакцин против НБ, что асоответствует пунктам 6, 7, 10 паспорта специальности.
1.7. Апробация результатов работы. Материалы диссертации представлены, опубликованы и обсуждены ана конференции молодых ученых Актуальные проблемы инфекционной патологии ветеринарной медицины (г. Покров, ГНУ ВНИИВВиМ, 2009 г.), международной научно-практической конференции молодых ученых Достижения молодых ученых в ветеринарную практику (г. Владимир, 2010 г.), заседаниях учёного совета ФГБУ "ВНИИЗЖ" 2005-2009 гг., в материалах международной конференции по мукозальным вакцинам в г. Порто (Португалия, 2008 г.).
1.8. Публикации научных исследований. По теме диссертационной работы опубликовано 8 научных статей, в том числе 2 статьи в изданиях, рекомендованных ВАК Министерства образования и науки РФ.
1.9. Основные положения, выносимые на защиту. Разработанные методы комплексной оценки иммунного ответа. Результаты их применения для изучения иммунного ответа цыплят на введение различных вакцинных препаратов против НБ: живых и инактивированных вакцин, инактивированных вакцин с мукозальными адъювантами. Определение взаимосвязи между показателями местных факторов защиты и гуморальным иммунитетом.
1.10. Структура и объём работы. Диссертация изложена на 152 страницах и содержит следующие разделы: введение, обзор литературы, результаты собственных исследований, обсуждение и выводы. Список используемой литературы включает 210 источников, из которыха 188 иностранных. Работа включает 33 таблицы иа иллюстрирована а30 рисунками.
Исследования по диссертационной работе выполнены в 2004-2011 гг. в лаборатории диагностики болезней сельскохозяйственных животных ФГБУ ВНИИЗЖ, г. Владимир.
1.11. Личный вклад соискателя. Основной объем исследований проведен автором самостоятельно. Консультативную и методическую помощь при выполнении отдельных этапов работы оказывали сотрудники лаборатории диагностики болезней птиц: М.А. Волкова, И.А. Чвала, Н.С. Мудрак, за что автор выражает им признательность.
2. Собственные исследования
2.1. Материалы
Антиген.Инактивированный аАЭЭИ и концентрированный ультрацентрифугированием вирус НБ, штамм Ла Сота, полученный культивированием в 9-11-сут. эмбрионах СПФ-кур. Для изготовления вакцин использовали препарат антигена с гемагглютинирующей активностью 13 log2 и концентрацией белка 0,4 мг/мл, определенной по методу Бредфорд.
Животные. Серонегативные к вирусу НБ цыплята 20-23-сут. возрастаа кросса УХайсекс белыйФ, а также цыплята, выведенные из СПФ КЭ фирмы УLohman TierzuchtФ (Германия).
Вирус контрольного заражения. Использовали высоковирулентный вирус НБ из коллекции ФГБУ ВНИИЗЖ NDV/Chicken/Rus/Amursky/1057/06 Птиц заражали внутримышечно (в/м) в область бедра в дозе 10 6 ЭИД50/0,5 мл.
Иммуноспецифические компоненты реакции: БСА (Sigma, США); антивидовые иммунопероксидазные конъюгаты к IgА, IgМ и IgG кур (Serotec, Англия); моноклональные антитела, меченные FITC, к CD4, СD8, СD3 (SouthernBiotest, США); моноклональные антитела, меченные фикоэритрином, к CD4, CD45 (SouthernBiotest, Serotec, США); стрептавидиновый иммунопероксидазный конъюгат к IFN-g кур, рекомбинантный куриный IFN-g, антикуриные IFN-g - улавливающие антитела, антикуриные IFN-g антитела с биотином - детекторные антитела (BioSource, США).
2.2. Методы
2.2.1. Выделение суммарной РНК из селезенок кур проводили с помощью набора для выделения РНК фирмы БИОКОМ (г. Москва) по инструкции производителя.
2.2.2. ПЦР-РВ для оценки уровня экспреcсии цитокинов. Реакцию обратной транскрипции проводили с помощью AMV-ревертазы (Promega, США). Для этого 3 мкл суммарной РНК, 1 мкл праймеров-гексамеров (5 пМ) прогревали при а96?С 1 мин. Затем быстро охлаждали на льду и инкубировали 15 мин. Добавляли 0,5 мкл 10мМ р-ра dNTPs, 5х буфера для обратной транскриптазы и 1 ед. обратной транскриптазы, смесь прогревали при 20?С 25 мин и при 45?С 25 мин.
Для постановки ПЦР РВ использовали ранее опубликованные праймеры (5 пМ) и зонды Taqman (1 пМ) на IFN-гамма и IL-2, 4, 6, 8, 10 [Kaiser P., 2003; Faizal M., 2007]. В качестве внутреннего контроля использовали праймеры и зонд на мРНК белка GAPD-H [Kaiser P., 2003; Markowski-Grimsrud C.J., 2003]. Cостав реакционной смеси: 2,5 мкл буфера 10x c референтным красителем ROX; 2,5 мкл dNTPs 2,5 мМ; 2,5 мкл MgCl2 25 мМ; 0,2 мкл ДНК Taq-полимеразы; 2,5 мкл воды. Температурный режим реакции: 95?С - 5 мин и 40 циклов: 95?С - 20 сек, 58?С - 40 сек и 72?С - 30 сек.
2.2.3. Изготовление образцов вакцин.
Экспериментальные вакцины против НБ cмукозальными адъювантами были следующего композиционного состава:а №1 АГ ВНБ+САР+IL-2 (антиген вируса НБ и иммуностимулирующие вещества: частицы фосфата кальция (САР) + IL-2); №2 АГ ВНБ+хитозан +IL-2; №3 АГ ВНБ+ФБР+IL-2; №4 АГ ВНБ+ФБР. В автореферате отражены данные поа образцам №2 и №3.
Живая вакцина. Живая сухая вакцина против НБ из штамма Ла Сота производства ФБГУ ВНИИЗЖ. Биологическая активностьа 9,75 а 0,3 lg ЭИД50/мл.
Инактивированная эмульсионная вакцина. Вакцинный препарат готовили, диспергируя на лабораторном гомогенизаторе 30 весовых частей инактивированного антигена ВНБ в 70 весовых частях масляного адъюванта Montanide ISA 70 (SEPPIC, Франция).
2.2.4. Реакция торможения гемагглютинации (РТГА). аДля выявления антител к вирусу НБ в РТГА использовали коммерческий набор (ФБГУ ВНИИЗЖ) согласно инструкции по применению. Протективным титром считали разведение сывороток ?1:16.
2.2.5. Непрямой вариант ИФА. Очищенный концентрированный антиген вируса НБ (0,5-1,0 мкг на лунку) в КББ сорбировали в лунках полистироловых планшетов и инкубировали в течение 18 часов апри 4С. После блокирования 1% раствором бычьего сывороточного альбумина вносили контрольные и исследуемые пробы в рабочем разведении. Связавшиеся антитела определяли добавлением иммунопероксидазных препаратов антикуриных антител к IgG, IgM и IgA. В качестве хромогена добавляли субстрат АБТС. Результат учитывали, регистрируя оптическую плотность (ОП) при длине волны 405 нм. Титр антител в испытуемых пробах определяли по конечной точке титрования (отношение оптической плотности пробы к среднему значению отрицательного контроля ? 2 считали положительным).
2.2.6. Выделение лимфоцитов из периферической крови кур.Кровь обрабатывали раствором ЭДТА и центрифугировали в градиенте плотности Ficoll-Paque PLUS. Наслаивали 2 мл крови, разведённой 1:1 раствором среды RPMI 1640, на 3 мл Ficoll-Paque, и центрифугировали 30 мин при 400 g. Выделенную фракцию лимфоцитов отмывали. Осадок ресуспендировали в 200 мкл ФБР. Подсчет клеток проводили в счётчике клеток Countess Automated Cell Counter. Концентрацию лимфоцитов доводили раствором ФБР до 106-107 клеток/мл.
2.2.7. Выделение лимфоцитов из ткани селезёнки кур. аОтобранные в соответствии с правилами асептики селезенки помещали в стерильный холодный ФБР. Далее готовили суспензию,а осторожно пропуская селезенки через стерильное нейлоновое сито в соответствующее количество среды RPMI 1640 (1:10 от массы пробы). Клеточную суспензиюа наслаивалиа на градиент Ficoll-Paque в соотношении 2/3 и центрифугировали при 400 g в течение 30 мин. Дальнейшие этапы идентичны процессу выделения лимфоцитов периферической крови.
2.2.8. Статистический анализ материалов. Для статистической обработки данных использовали компьютерную программу Statistica: Basic Statistics and Tables.
2.3. Результаты собственных исследований
2.3.1. Разработка методов
2.3.1.1. Отбор проб секреторных жидкостей. Для отбора лакримальной жидкости присыпали несколько мелких кристаллов хлорида натрия в глаз птице, через 1 мин собирали накопившуюсяа жидкость в пробирки. Трахеальные смывы отбирали при помощи стерильных ватных тампонов, после чего тампоны помещали в пробирки с 0,5 мл ФБР, затем инкубировали на шейкере-инкубаторе при 160 об/мин в течение 30 мин при комнатной температуре.
2.3.1.2. Оптимизация метода отбора и окрашивания пейеровых бляшек. Для проведения процедуры окрашиванияпромытый участок кишечникаа пережимали корнцангом, заливали 20-30 см3 раствора эозина. Через 1 мин эозин выливали и вводили 10-20 см3 разведенного раствора красителя mCV. Серозные и слизистые поверхности сегмента осматривалиа для определения проявившихся участков красно-розового цвета на фоне фиолетового.
2.3.1.3. Разработка метода выявления специфических к вирусу НБ иммуноглобулинов (IgA, IgM и IgG) в непрямом варианте ИФА. В ходе работы осуществляли подбор оптимальных параметров постановки реакции и определяли позитивно-негативный порог (табл.1). а
Таблица 1
Оптимизация условий постановки реакции
Пробы |
Рабочие разведения проб |
Позитивно - негативный порог реакции |
||
отрицательные |
сомнительные |
положительные |
||
Трахеальные смывы |
1:2 |
<1:2 |
1:2 |
?1:4 |
Слёзная жидкость |
1:20 |
<1:20 |
1:20 |
? 1:40 |
Сыворотки крови |
1:100 |
?1:100 |
1:200 |
? 1:400 |
Чувствительность выявления специфических к вирусу НБ иммуноглобулинов трех классов в секреторных жидкостях и сыворотках крови асоставила 96,0 - 99,3%. Специфичность составила 97,3 - 99,3%. Каждый образец исследовали в непрямом варианте ИФА в трех повторностях. Отклонения в титрах не превышали величину одного 2-кратного разведения, что свидетельствует о воспроизводимости результатов реакции.
2.3.1.4. Разработка метода подготовки проб для иммунофенотипирования и количественной оценки субпопуляций лимфоцитов с использованием проточной цитофлуориметрии. Были оптимизированы параметры пробоподготовки: рабочее разведение моноклональных антител с флуоресцентной меткой (1:25) и режим инкубации специфических компонентов реакции (30 мин при 40С).
Количественный анализ клеток проводили на проточном цитофлуориметре BD FACS Calibur (Becton, Dickinson, США), имеющем лазер с длиной волны 488 нм. Измерение и обработку полученных результатов осуществляли с использованием программного обеспечения Cell Quest Pro 1.0.
2.3.1.5. Разработка метода оценки пролиферативной активности лимфоцитов. Пролиферация лимфоцитов - это ответ клеток памяти на повторное воздействие антигенаа in vitro. Для оценки пролиферативной функции клеток используют митогенную или антигенную стимуляцию in vitro, которая довольно близко воспроизводит активацию специфическими антигенами. В последнее время для оценки клеточной пролиферацииа широко применяется колориметрический метод, основанный на использовании реагента AlamarBlue.
Подбор оптимальных параметров постановки реакции проводили, оценивая пролиферативную активность лимфоцитов крови и селезенки кур, иммунизированных интраназально живой вакциной и инактивированнойа вакциной против НБ с мукозальными адъювантами. При тестировании различных митогенов и антигена в разных концентрациях (КонА, IL-2, PMA, вирус НБ) наибольший индекс стимуляции был отмечен при использовании РМА в концентрации 5 мг/мл и вируса НБа в разведении 1:500. Оптимальное время инкубацииа составило 48 часов.
2.3.1.6. Разработка метода количественного определения куриного гамма-интерферона. IFN-g относится к основным противовоспалительным цитокинам и является индуктором клеточного звена иммунитета. При разработке сэндвич-варианта ИФА в качестве улавливающих антител к IFNЦ? использовали фракцию иммуноглобулинов IgG из гиперимунных сывороток крови кроликов. Были определены рабочие разведения: улавливающих антител - 1:500, детекторных антител - 1:1500 и антивидового конъюгата - 1:3000.
Специфичность метода показана аотсутствием перекрестной реакции с пробами лимфоцитов кролика и моноклональными антителами к другим цитокинам. Чувствительность реакции оценивали по минимально определяемой концентрации IFNЦg, используя панель с калибровочными образцами рекомбинантного интерферона. Она составила не менее 30 пг/мл.
2.3.1.7. Разработка метода анализа экспрессии цитокинов в ПЦР-РРВ. Определение экспрессии цитокиновых генов в исследуемом материале дает возможность на ранних стадиях иммунного ответа определить эффективность вакцины. Для этого был разработана метод количественного анализа экспрессии цитокинов с помощью ПЦР в режиме реального времени. При этом определяли отношение количества копий гена-мишени в исследуемом образце к количеству копий гена-калибратора. В качестве образца-мишени использовали РНК, выделенную из проб лимфоидных органов птиц опытных групп. Образец-калибратор - РНК, выделенная из проб от птиц контрольной группы. Для выявления ложноотрицательных результатов и нормализации значений Сt использовали эндогенный внутренний контроль (GAPDH). Используемые праймеры:а IFN- g, IL-1, IL-6, IL-15 [Kaiser P. et al., 2000, 2004], IL-2 [Choi K.D. et al., 2000], IL-10 [Rothwell L. et al., 2004].
2.3.2. Применение разработанных методов для комплексной оценки иммунного ответа
Была проведена апробацияа разработанных методов в экспериментах с применением коммерческой инактивированной эмульсионной вакцины, живой вакцины и инактивированной вакцины с мукозальными адъювантами.
2.3.2.1. Комплексная оценка иммунного ответа после применения коммерческой эмульсионной инактивированной вакцины. 25 цыплят 20-сут возраста 1-кратно привили внутримышечно инактивированной вакциной против НБ в объеме 0,5 см3. 2-я группа птиц такой же численности оставалась интактной а(контрольной). Отбор проб проводили до иммунизации и с интервалом в 1 нед. после нее в течение 10 нед. Через 1, 2, 3, 4 и 8 нед. после вакцинации проводили контрольное заражение цыплят высоковирулентным вирусом аНБ.
При исследовании сывороток крови через 2 нед после вакцинации и до окончания срока наблюдения 100% проб были положительными в РТГА. В ИФА антитела в максимальных титрах выявляли через 8-10 нед. после вакцинации (табл. 2).
Таблица 2
Титры антител к вирусу НБ в сыворотках крови цыплят, привитых инактивированной эмульсионной вакциной а(ИФА и РТГА)
Вводимый инокулянт |
Средний титр антитела к вирусу НБ |
|||||||||||
до вакц. |
недели после вакцинации |
|||||||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|||
ИФА* |
НБ+ISA70 |
215
23 |
618
41 |
1976
143 |
4660
523 |
8000
1201 |
9600
2011 |
11520
1244 |
23040
3455 |
35840
2474 |
30720
3544 |
35840
2055 |
Контроль |
50
21 |
50
12 |
50
21 |
50
11 |
50
16 |
100
32 |
50
21 |
63
22 |
50
6 |
63
10 |
||
РТГА(log2) |
НБ+ISA70 |
2.32
1.5 0% |
6.82
2.3 80% |
8.92
4.5 100% |
10.63
5.4 100% |
10.72
4.7 100% |
10.77
5.2 100% |
10.92
4.6 100% |
10.76
3.3 100% |
9.43
3.1 100% |
9.58
2.1 100% |
8.8
1.1 100% |
Контроль |
0 0% |
0 0% |
0 0% |
0 0% |
0 0% |
0 0% |
0 0% |
0 0% |
0 0% |
0 0% |
||
*титр выражен как среднее арифметическое значение по группе стандартная ошибка среднего.
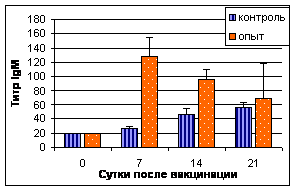
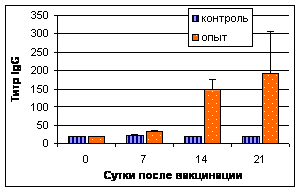
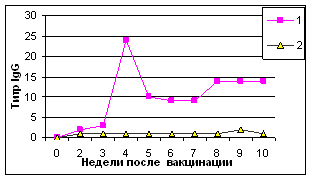
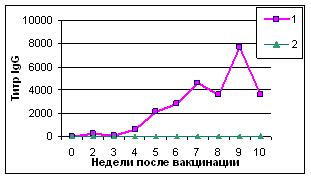
При исследовании секреторных жидкостей ав ИФА максимальные титры антител IgG в трахеальных смывах цыплят опытной группы были установленыа с 4 по 10 нед. В слезной жидкости пик выработки IgGа приходился на 5-9 нед., достигая максимума к 9-й нед. Содержание аIgA и IgM в секреторных жидкостях цыплят опытной и контрольной групп отличалось незначительно (рис. 1).
|
|
аВ |
|
Рис.1. Результаты выявления специфических к вирусу НБ антител (IgG) в трахеальных смывах (А) и слезной жидкости (В)
Примечание: 1-НБ+ISA70;а 2-контроль
Таким образом, инактивированная эмульсионная вакцина против НБ индуцировала гуморальный иммунный ответ в ранние сроки и на высоком уровне. Антитела в РТГА и ИФА (IgG) выявляли уже через 1-2 нед. Секреторные антитела выявляли в более поздние сроки - через 4 нед.
2.3.2.2. Исследование иммунного ответа цыплят на введение мукозальных вакцин против НБ c различными аадъювантами. Для изучения комплексного иммунного ответа цыплят на введение мукозальных вакцин протива НБ c различными адъювантами были сформированы 3 группы по 6 гол из 23-сут. коммерческих цыплят. Птицам 1-йа и 2-й групп вводили экспериментальные образцы вакцин против НБ: №1 - АГ ВНБ+хитозан+IL-2 и №2 - АГ ВНБ+ФБР+IL-2. 3-я группа оставалась интактной и служила контролем. Вакцинацию проводили интраназально в объёме 0,2 см3, 3-кратно с интервалом в 6 сут. Отбор проб крови и трахеальных смывов от цыплят проводили до иммунизацииа и с недельным интервалом после 3-й вакцинации. Через 21 сут. после 3-й вакцинации цыплят заражали высоковирулентным вирусом НБ в/м в область бедра в дозе 10 6 ЭИД50/0,5 мл.
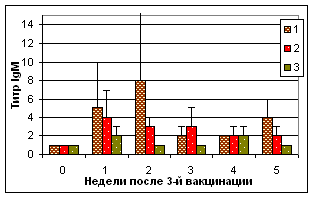
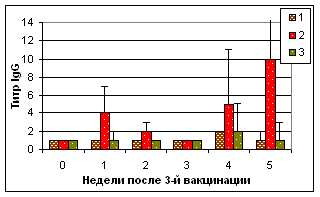
В ходе эксперимента установлено, что рекомбинантный IL-2 повышал уровень гемагглютинирующих антител к антигену ВНБ при их совместном введении цыплятам (табл. 3). В сыворотках крови цыплят опытных групп в ИФА был отмечен низкий уровень IgM и высокие уровни IgG в течение 4 нед после 3-й вакцинации (рис.2).
Таблица 3
аТитры антител к вирусу НБ в сыворотках крови ацыплят,
иммунизированных 3-кратно мукозальными вакцинами
№ |
Вакцина |
Средний титр антитела к вирусу НБ в РТГА,а log2 |
|||||
до вакцинации |
срок после третьей иммунизации, нед. |
||||||
1 |
2 |
3 |
4 |
5 |
|||
1 |
АГ ВНБ + хитозан+IL-2 |
1,6 0,8 (0/5)* |
6,2 2,8 (6/6) |
5,6 1,9 (5/6) |
4,0 1,0 (5/6) |
5,2 0,4 (5/5) |
2,8 1,6 (2/5) |
2 |
АГ ВНБ+ФБР+IL-2 |
9,3 1,2 (6/6) |
6,7 2,1 (6/6) |
5,0 1,3 (6/6) |
6,4 1,1 (5/5) |
5,0 1,2 (5/5) |
|
3 |
Контроль |
0 (0/6) |
0 (0/6) |
0 (0/6) |
0 (0/6) |
1,2 1,6 (0/6) |
|
*положительные пробы/общее количество проб
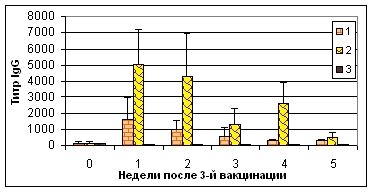
Рис. 2. Результаты выявления специфических к вирусу НБ IgG в ИФА в сыворотках крови цыплят после вакцинации мукозальными препаратами
Примечание: №1 - АГ ВНБ+хитозан+IL-2, №2 - АГ ВНБ+ФБР+IL-2, №3-контроль
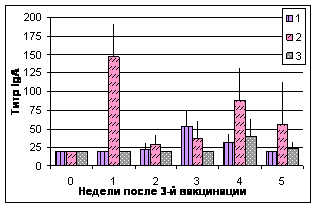
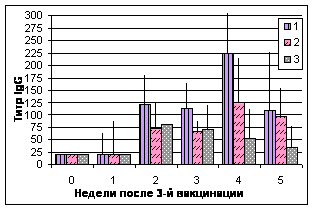
Исследование секреторных жидкостей. Включение в состав вакцин хитозана и IL-2 оказывало влияние на мукозальный иммунный ответ цыплят (рис. 3, 4).
|
|
Рис.3. Динамика титров антител к вирусу НБ ва слезной жидкости
Примечание: №1 - АГ ВНБ+хитозан+IL-2, №2 - АГ ВНБ+ФБР+IL-2, №3-контроль
У цыплят после иммунизации препаратами №1-2 отмечен более высокий уровень титров антител в секреторных жидкостях по сравнению с контролем. IgM в обеих группах регистрировали через 1 нед, IgG - спустя 1-2 нед., IgA - 1-3 нед. после 3-й вакцинации.
|
|
Рис.4. Динамика титров антител к вирусу НБ в трахеальных смывах
Примечание: №1 - АГ ВНБ+хитозан+IL-2, №2 - АГ ВНБ+ФБР+IL-2, №3-контроль
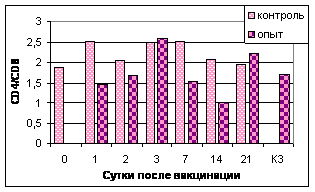
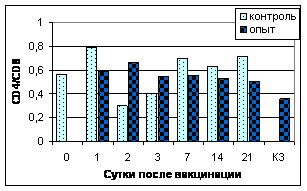
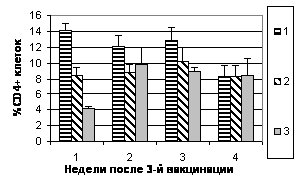
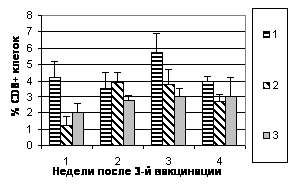
Цитофлуориметрический анализ субпопуляций лимфоцитов. Определение относительного количества субпопуляций CD4+ и CD8+ в периферической крови цыплята проводили еженедельно с 1 по 5 нед. после аа3-й вакцинации (рис.5).
CD4+ |
|
Рис. 5. Динамика уровня субпопуляций CD8+ и CD4+ клеток в лимфоцитах периферической крови цыплят в разные сроки после 3-й вакцинации мукозальными вакцинами
Примечание: №1 - АГ ВНБ+хитозан+IL-2, №2 - АГ ВНБ+ФБР+IL-2, №3-контроль
Иммунизация цыплят препаратами с комбинированными адъювантами индуцировала увеличение продукции CD4+ и CD8+ клеток. Анализируя значения отношения CD4+/CD8+, можно отметить тенденцию к его снижению у цыплят всех групп. Таким образом, введение в состав вакцин IL-2 и комбинированных адъювантов вызывало изменение фенотипа Т-клеток, особенно через 1 нед. после 3-й вакцинации.
Для определения протективных свойств экспериментальных вакцин через 21 сут. после 3-й вакцинации проводили контрольное заражение цыплят. Птицы опытных групп оставались живыми и клинически здоровыми, в контрольной группе гибель цыплят отмечена в течение 4 сут. При исследовании фенотипических изменений в иммунограмме наблюдали увеличение количестваа CD4+ и CD8+ клеток в периферической крови цыплят 2-й группы. У цыплят а1-й группы увеличение объёма CD4+ клеток было менее существенным. Отношение CD4+/CD8+ возросло в обеих группах. Количество CD4+ и CD8+ клеток в спленоцитах цыплят опытных групп после контрольного заражения было примерно на одном уровне (рис.6).
![]()
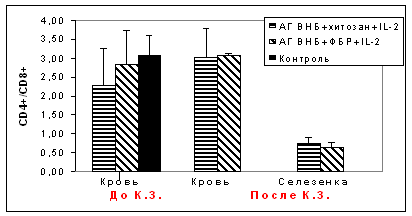
Рис.6. Динамика уровня CD4+/CD8+ до и после контрольного заражения на 21 сутки после 3-й вакцинации мукозальными вакцинами
ВНБ-специфический клеточный иммунный ответ оценивали по определению продукции гамма-интерферона лимфоцитами селезёнки после антигенной активации спленоцитов in vitro. У цыплят двуха групп, иммунизированных мукозальными вакцинными препаратами против НБ, на 8 сут. после контрольного заражения был установлен положительный ответ на специфическую стимуляцию спленоцитов антигеном вируса НБ. По результатам опыта было показано, чтоа IL-2 обладает адъювантной активностью и усиливает мукозальный, гуморальный и клеточный иммунный ответ на антиген вируса НБ при его применении на слизистые оболочки.
2.3.2.1. Комплексная оценка иммунного ответа после применения живой вакцины. Дляа изучения динамики иммунного ответа были сформированы 2 группыа 20-сут. цыплят. Цыплята 1-й группы аабыли иммунизированы 1-кратно интраназально живой вакциной в объёме 0,1 см3. Вторая группа оставалась интактной и использовалась как контрольная.
Для изучения гуморального иммунного ответа использовали РТГА и ИФА. Пик накопления специфических антител в РТГА у птиц опытной группыа был отмечен через 2 нед. после вакцинации (табл. 4).
Таблица 4
Динамика титров антител к вирусу НБ в сыворотках крови цыплят, привитых живой вакциной из штамма Ла Сота
№ |
Группы птиц |
Средний титр антитела к вирусу НБ в РТГА,а log2 |
||||
до вакцинации |
сроки после иммунизации, сут. |
|||||
7 |
14 |
21 |
К.З. |
|||
1 |
Опытная группа |
2,27 + 0,37 |
6,5+ 0,38 |
7,2 + 0,29 |
5,0 + 2,35 |
11,75 + 0,75 |
2 |
Контроль |
1,0 + 0,29 |
0,4 + 0,16 |
0 |
- |
|
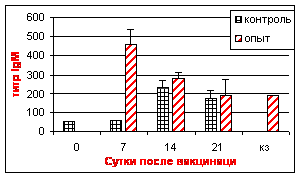
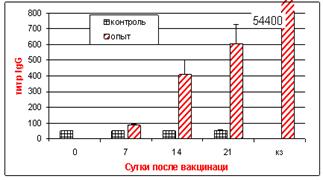
В ИФА пик уровня IgM был отмечен на 7 сут. после вакцинации с последующим снижением. Уровень IgG возрастал, начиная с 7 сут. после вакцинации, достигая максимума к 21 сут. В контрольной группе в течение всего срока наблюдения положительных проб выявлено не было (рис. 7).
|
|
Рис.7. Результаты выявления специфических к вирусу НБ иммуноглобулинов класса G и M в сыворотках крови цыплят
Исследование секреторных жидкостей. аВ слёзной жидкости вакцинированных цыплят вирусспецифические антитела IgM выявляли, начиная с 7, а аIgG и IgA - аc 14 сут. после вакцинации. Пик выработки IgM отмечали на 7 сут., IgA - наа 14, а IgG - на 21 сут. после вакцинации.
В трахеальных смывах вакцинированных цыплят максимальное количество IgM обнаруживали на 7а сут. после вакцинации. Незначительное повышение уровня IgG отмечали на 21 сут. Иммуноглобулины классаа A на протяжении опыта выявленыа не были (рис. 8).
|
|
а аВ
Рис. 8. Выявление специфических к вирусу НБ IgМ(А) и IgG(В) в слёзной жидкости цыплят после вакцинации живой вакциной
Цитофлуориметрический анализ субпопуляций лимфоцитов. Для оценки эффективности стимуляции клеточного иммунитета у цыплята была проведена сравнительная оценка фенотипических изменений в иммунограмме птиц (рис.9).
|
|
а аВ
Рис.9. Динамика отношения CD4+/CD8+ в лимфоцитах крови (А) и селезенки (В) цыплят в разные сроки после вакцинации живой вакциной
Анализируя значения отношения CD4+/CD8+ в лимфоцитах селезенки в течение 1-3 нед. после вакцинации, можно отметить общую тенденцию к его снижению у двух групп. В лимфоцитах периферической крови снижение отношения CD4+/CD8+ отмечали на 7 сут.
Данные иммунофенотипирования лимфоцитов крови цыплят после вакцинации живой вакциной демонстрируют снижениеа иммунорегуляторногоа индекса вследствие повышения уровня CD8+ клеток.
Специфическую активность лимфоцитов после антигенной активации in vitro оценивали по определению продукции гамма-интерферона. В лимфоцитах селезенки продукцию IFN-g в ответ на специфическую стимуляцию начиналиа обнаруживать со 2-й нед. после вакцинации (у 50% ацыплят). К 3-й нед у всех цыплят опытной группы был отмечен высокий уровеньа IFN-g, в 16 раз превышающий таковой у непривитых птиц, что свидетельствует о стимуляции клеточного звена иммунного ответа.
Для определения протективных свойств вакцин проводили контрольное заражение цыплят высоковирулентным вирусом НБ через 3 нед. после вакцинации. Вакцина обеспечила полную защиту привитых птиц. В контрольной группе отмечали гибель всех цыплят на 4-5 сут. после заражения.
Следует отметить, что часть цыплят опытной группы (4/10), не имевших сывороточных антител к вирусу НБ на протективном уровнеа (?4 log2), не погибла при заражении. Это можно объяснить созданием у них устойчивости за счет местных секреторных антител и факторов клеточного иммунитета.
Таким образом, использование предложенных методов для оценкиа поствакцинального иммунитета подтвердило данные о том, что:
- применениеа инактивированной вакцины индуцирует более напряженный гуморальный иммунный ответ (за счет циркуляции иммуноглобулинов класса G и гемагглютинирующих антител);а
- живая вакцина и вакцины с мукозальными адъювантами в большей степени индуцируют выработку секреторных иммуноглобулинов (мукозальный иммунитет), повышение уровня цитотоксических Т-лимфоцитов (СD8+), интерферона-g и вызывают поляризацию дифференцировки T-лимфоцитов по пути Th1.
4. Выводы
- Усовершенствованы методы отбора проб секреторных жидкостей co слизистых оболочек, что позволяет получать качественные образцы для оценки амукозального иммунитета.
- аРазработаны методы комплексной оценки клеточного иммунитета. Иммунофенотипирование лимфоцитов методом проточной цитофлуориметрии и анализ экспрессии цитокинов методом ПЦР-РРВ позволили спрогнозировать тип, динамику и направление иммунного ответа. Для определения функциональной активности лимфоцитов и способности иммунной системы к активации разработан метод количественного определения интерферона в сэндвич-варианте ИФА, минимальная чувствительность которого составила 30 пг/мл.
- Для выявления иммуноглобулинов трех классов (IgА, IgG, IgM) в секреторных жидкостях и специфических иммуноглобулинов класса M в крови разработан непрямой вариант иммуноферментного анализа, обладающий специфичностью (97,3 - 99,3%) аи чувствительностью (96,0 - 99,3%).
- С помощью разработанных методов установлено, что иммунная реакция цыплят на введение живой вакцины против НБ из штамма Ла Сота развивается через 1 нед. и характеризуется преимущественно клеточными факторами защиты, выработкой интерферона и секреторных антител;
- на коммерческие инактивированные эмульсионные вакциныа - через 2 нед., при этом основное звено защиты составляет гуморальная реакция;
- на инактивированные вакцины, содержащие мукозальные адъюванты, - через 1-2 нед. и сочетает клеточные, гуморальные и мукозальные факторы защиты.
- После контрольного заражения птиц, вакцинированных живой вакциной, отмечали следующие иммунные реакции: повышение уровня IFN-g (ва ?16 раз по отношению к контролю); снижение иммунорегуляторного индекса вследствие роста уровня CD8+ клеток и повышение уровня гуморальных антител (с 5 log2а до 11, 75 log2).
- Показано, что цыплята, не имевшие сывороточных антител на протективном уровне, были устойчивы к контрольному заражению вследствие действия факторов клеточного и мукозального иммунитета.
- Оценка иммунного ответа у цыплят, привитых мукозальными вакцинами против ньюкаслской болезни / М. А. Волкова, А. В. Ирза, И. А. Рунина [и др.] // Ветеринария. - 2009. - № 10. - С. 20-25.
- аАдъювантное действие хитозана при интраназальной вакцинации цыплят против ньюкаслской болезни / А.В. Ирза, М.А. Волкова, И.А. Рунина [и др.] // Ветеринария и кормление. - 2010. - № 6. - С. 40-42.
- Применение иммуноферментной тест-системы для выявления специфических IgA, IgM и IgG к вирусу ньюкаслской болезни птиц в секреторных жидкостях и сыворотках крови кур / М. А. Волкова, А.В. Ирза, М.Е. Качалова [и др.] // Труды Федерального центра охраны здоровья животных. - Владимир, 2007. - Т. 5. - С. 176-185.
- Непрямой жидкофазный блокирующий вариант иммуноферментного анализа для выявления и количественного определения антигена вируса ньюкаслской болезни / М. А. Волкова, А.В. Ирза, М.Е. Качалова [и др.] // Ветеринарна медицина: мiжвiд. тем. наук. зб. -Харкiв, 2007.- Вип.88.- C. 42-48.
- Разработка и применение непрямого "сэндвич-варианта" иммуноферментного анализа для количественной оценки уровня интерферона гамма / А. В. Ирза, И. А. Рунина, О. С. Осипова [и др.] // Актуальные проблемы инфекц. патологии вет. медицины: материалы конф. молодых ученых - Покров, 2009. - С. 168-173.
- Иммуногенность мукозальных вакцин против ньюкаслской болезни / М. А. Волкова, И. А. Рунина, А. В. Ирза [и др.] // Ветеринарна медицина: мiжвiд. тем. наук. зб. - Харкiв, 2010. - Вип. 94. - аС. 201-203.
- аИзучение адъювантного действия рекомбинантного интерлейкина-2 при интраназальной вакцинации цыплят против ньюкаслской болезни / М. А. Волкова, А. В. Ирза, С. В. Фролов [и др.] // Ветеринарна медицина. мiжвiд. тем. наук. зб. - аХаркiв, 2011. - Вип. 95. - аС. 279-282.
- Иммунный ответ у цыплят после введения мукозальных инактивированных вакцин против ньюкаслской болезни / М. А. Волкова, И. А. Рунина, А. В. Ирза [и др.] а// Птахiвництво: ЦМатериалы IV Мiжнар. науч.-практ. конф. - Харкiв, 2008. - Вип. 62, ч.2. - ааС. 266-275.
- Колабская Л.С. Иммуноглобулины птицы // Птицеводство. - 1987. № 9. - С. 35-36.
- Основы инфекционной иммунологии / В.В. Макаров, А.А. Гусев, Е.В. Гусева, О.И. Сухарев. - Владимир: Фолиант, 2000. - 176 С.
- Ройт А., Бростофф Дж., Мейл Д. // Иммунология. - М.: Мир, 2000. - 592 C.
- Assessment of the cell-mediated immune response in chickens by detection of chicken interferon-gamma in response to mitogen and recall Newcastle disease viral antigen stimulation / B. Lambrecht, M. Gonze, G. Meulemans, T.P. van den Berg а// Avian Pathology. - 2004. - аVol. 33, №4. - аP. 343-350.
- Chitosan as a novel delivery system for vaccines / L. Illum, I. Jabbal-Gill, M. Hinchcliffe [et al.] // Adv. Drug Deliv. Rev. - 2001. - Vol. 51, №3 - P. 81-96.
- аDifferential cytokine expression in avian cells in response to invasion by Salmonella typhimurium, Salmonella enteritidis and Salmonella gallinarum / P. Kaiser,а L. Rothwell, E. E. Galyov [et al.] а// аMicrobiology. - а2000. - Vol. 12. - P. 3217-3226.
- Flow cytometric assessment of antigen-specific proliferation in peripheral chicken T cells by CFSE dilution / T.S. Dalgaard, L.R. Norup, D. Rubbenstroth [et al] // Veterinary Immunology and Immunopathology.-2010. - Vol. 138. - P. 85-94.
- Immunoglobulin>
- Immunophenotyping of chicken peripheral blood lymphocyte subpopulations: individual variability and repeatability / J.M.
- Kapczynski D., Kogut M. Measurement of avian cytokines with real-time RT-PCR following infection with the avian influenza virus // аAvian Influenza аVirus - Athens, GA. - 2008. - P. 127Ц134.
- T lymphocyte subpopulations diverge in commercially raised chickens / B.W. Bridle, R. Julian, P.E. Shewen [et al.] // Can.J.Vet.Res.-2006.-Vol. 70.-P.183-190.
- The positive adjuvant effect of chitosan on antigen-specific cell-mediated immunity after chickens vaccination with live Newcastle disease vaccine / F. Rauw, Y. Gardin, V. Palya [et al.] // Veterinary Immunology and Immunopathology. - 2010. - Vol. 134. - P. 249-258.
5. Практические предложения
На основании результатов экспериментальных исследований по теме диссертации разработаны, одобрены учёным советом и утверждены директором ФГБУ ВНИИЗЖ следующие нормативные документы:
Методические указания по выявлению специфических к вирусу ньюкаслской болезни иммуноглобулинов IgА, IgМ и IgG в секреторных жидкостях кура в непрямом варианте иммуноферментного анализа (утверждены 23.11.2006 г.);
Методические рекомендации по отбору проб лакримальной жидкости, смывов зоба и респираторного тракта (утверждены 08.05.2008 г.);а
Методические рекомендацииа по отбору и окрашиванию пейеровых бляшек (утверждены 08.06.2008 г.);а
Методические рекомендации для количественного определения куриного интерферона -gа в биологических жидкостях и культуральных суспензиях методом ИФА (утверждены 16.12.2008 г.); а
Методические рекомендации по подготовке проб для иммунофенотипирования и количественной оценке субпопуляций лимфоцитов с использованием проточной цитофлуориметрии (утверждены 12.09.2008 г.); а
Методика анализа экспрессии цитокинов кур с помощью ПЦР в режиме реального времени при автоматизации сбора реакционной смеси (утверждена 16.12.2008 г.);
Методические рекомендации по оценке пролиферативной активности лимфоцитов, выделенных из крови и селезенки кур, с использованием Alamar Blue (утверждены 23.11.2010 г.)
Разработанные методические указания и рекомендации используются в лабораторной практике при проведении исследований по оценке мукозальногоа и клеточного иммунитета.
6. Список работ, опубликованных по теме диссертации
7. Список литературы
8. Список обозначений и сокращений
АЭЭИ - димер аминоэтилэтиленимина
АГ - антиген
АБТС - 2,2Цазино-ди-(-3-этилбензтиазолинсульфонат)
ВНБ - вирус ньюкаслской болезни
ИФА - иммуноферментный анализ
КББ - карбонатно-бикарбонатный буфер
К.З. - контрольное заражение
КЭ Цкуриный эмбрион
KoнA - конканавалин А
НБ - ньюкаслская болезнь
ПЦР-РРВ - полимеразная цепная реакция в реальном времени
РТГА - реакция торможения гемагглютинации
СПФ - животные, свободные от специфических патогенов
ФБР - фосфатно-буферный раствор
ЭДТА Ца этилендиаминтетрауксусная кислота
BСA а - бычий сывороточный альбумин
CD - кластер дифференциации
Ct - пороговый цикл
dNTP - дезоксирибонуклеозидтрифосфат
Ig - иммуноглобулин
IL - интерлейкин
IFN - интерферон
mCV - модифицированный кристалл виолет
PMA - афорбол-12-миристат-13-ацетат
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]

 аCD8+
аCD8+