Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Закономерности фазовых равновесий в системах AIIS - FeS, AIIS - FеS - Ln2S3, AIIS - Cu2S - Ln2S3 (AII = Mg, Ca, Sr, Ba; Ln = La - Lu)
Автореферат кандидатской диссертации
На правах рукописи

Соловьёва Анна Владимировна
ЗАКОНОМЕРНОСТИ ФАЗОВЫХ РАВНОВЕСИЙ В СИСТЕМАХ
AIIS - FeS, AIIS - FеS - Ln2S3, AIIS - Cu2S - Ln2S3
(AII = Mg, Ca, Sr, Ba; Ln = La - Lu)
02.00.04-физическая химия
Автореферат диссертации на соискание ученой степени кандидата химических наук
Тюмень - 2012
Работа выполнена в Федеральном государственном бюджетном образовательном учреждении высшего профессионального образования Тюменский государственный университет
Научный руководитель: доктор химических наук, профессор
Андреев Олег Валерьевич
Официальные оппоненты: Бамбуров Виталий Григорьевич,
доктор химических наук, профессор, член-корр. РАН, Федеральное государственное бюджетное учреждение науки Институт химии твердого тела Уральского отделения Российской академии наук, главный научный сотрудник
Жихарева Ирина Георгиевна,
доктор химических наук, профессор, Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования Тюменский государственный нефтегазовый университет, профессор кафедры общей и физической химии
Ведущая организация: Федеральное государственное автономное образовательное учреждение высшего профессионального образования Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
Защита состоится л11 мая 2012 г. в 16 часов 30 минут на заседании диссертационного совета ДМ212.274.11 при Федеральном государственном бюджетном образовательном учреждении высшего профессионального образования Тюменский государственный университет по адресу: 625003, ааг. Тюмень, ул. Перекопская, 15а, аудитория 410.
С диссертацией можно ознакомиться в информационно-библиотечном центре Федерального государственного бюджетного образовательного учреждения высшего профессионального образования Тюменский государственный университет.
Автореферат разослан л апреля 2012 года.

Ученый секретарь диссертационного совета
![]()
![]() кандидат химических наука Ларина Н.В.
кандидат химических наука Ларина Н.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы.
Получение новых сложных сульфидных соединений, содержащих катионы ns2-, 3d-, 4f-элементов, установление их структуры и свойств перспективно для расширения видов новых материалов. Наличие в катионной подрешетке сложных сульфидов различных типов ионов, создает предпосылки для формирования у соединений свойств с необходимыми количественными значениями.
В концентрированном виде информация о новых соединениях представлена в фазовых диаграммах систем. Скудность данных по свойствам, и в частности термодинамическим, простых и сложных сульфидов существенно ограничивает возможность использования расчетных методов при построении диаграмм. Основным методом изучения подобных систем является экспериментальное исследование фрагментов тетраэдров АII - Fe(Cu) - Ln - S с использованием методов и методик физико-химического анализа и построение зависимостей состав - свойство. Последовательность и периодичность заполнения 3d-, 4f-орбиталей, изменение размеров и характеристик атомов и ионов ns2-, 3d-, 4f-элементов определяют проявление закономерностей в изменении фазовых равновесий в рядах систем. Целесообразно изучать обоснованно выбранные системы и использовать методы прогноза. Экстремум свойств на атоме гадолиния (гадолиниевый излом), у которого 4f-электронная оболочка заполнена наполовину Gd 4f75d16s2, определяет проявление в образованных элементом системах фазообразований, характерных для элементов цериевой и иттриевой подгрупп. В связи с чем системы, образованные полуторным сульфидом гадолиния, выбраны для исследования.
Из литературных данных известно об образовании в системах AIIS - FeS - Ln2S3, AIIS - Cu2S - Ln2S3 сложных сульфидов AIILn2FeS5 [1], AIILnCuS3 [2, 3]. По набору катионов соединения AIILnCuS3 подобны составу оксидных сверхпроводящих керамик. Сведений об изучении фазовых равновесий в системах AIIS - FeS, AIIS - FeS - Ln2S3, AIIS - Cu2S - Ln2S3 не обнаружено. Не определено, для каких редкоземельных элементов (РЗЭ) образуются сложные сульфиды и как изменяются их характеристики в ряду РЗЭ. Не установлены области гомогенности соединений, температура и характер плавления, не определены методы и условия получения образцов соединений для установления их свойств.
Построение фазовых диаграмм ранее неизученных систем, установление закономерностей их трансформации, получение и определение структуры новых соединений определяют актуальность настоящей работы.
Цель работы состоит в установлении закономерностей фазовых равновесий в системах AIIS - FeS, AIIS - FеS - Ln2S3, AIIS - Cu2S - Ln2S3 (AII = Mg, Ca, Sr, Ba; Ln = La - Lu), в определении структуры и физико-химических характеристик образующихся сложных сульфидов.
Задачи исследования:
1. Построение фазовых диаграмм и установление закономерностей фазовых равновесий в системах AIIS - FeS - Ln2S3, AIIS - Cu2S ЦLn2S3 (AII = Mg, Ca, Sr, Ba; Ln = La - Lu).
2. Изучение фазовых равновесий в системах AIIS - FeS - Ln2S3, AIIS - Cu2S - Ln2S3 (AII = Mg, Ca, Sr, Ba; Ln = La - Lu). Определение положения коннод при 1070 К.
3. Определение рентгенометрических и кристаллохимических параметров соединений BaLnCuS3 (Ln = La - Lu) и их физико-химических характеристик.
4. Рассмотрение закономерностей фазовых равновесий в изученных системах на основе характеристик ионов и кислотно-основных свойств исходных сульфидов.
Научная новизна:
1. Впервые построены фазовые диаграммы систем: AIIS - FeS (AII = Mg, Ca, Sr, Ba). Закономерности трансформации диаграмм коррелируют с соотношением эффективных ионных радиусов rA2+ и rFe2+. Система MgS - FeS (?r = 15 %) перитектического типа с протяженной областью твердого раствора на основе MgS а(58 мол. % FeS апри а1170 К). Системы аСаS - FeS, SrS - FeS а(?r = 39 %, ?r =а 45 %) - эвтектического типа. В системе BaS - FeS (?r = 55 %) образуются сложные сульфиды BaFe2S3, BaFeS2 и Ba3Fe2S5.
2. Установлено положение коннод в системах AIIS - FeS - Gd2S3 (AII=Mg, Сa, Sr, Ba); BaS - FeS - Ln2S3 (Ln = La, Се, Pr, Nd); AIIS - Cu2S - Gd2S3 (AII = Mg, Са, Ba) при 1070 К. Сложные сульфиды BaGdCuS3, BaLn2FeS5 (Ln = La, Се, Pr, Nd) находятся в равновесии с простыми и сложными сульфидами, образующимися в системах. Построены фазовые диаграммы полностью или частично квазибинарных разрезов: FeS - AIIGd2S4 (AII = Ca, Sr, Ba), FeS - BaLn2FeS5 (Ln = La - Nd), BaS - CuGdS2, Gd2S3 - BaGdCuS3, BaGd2S4 - BaGdCuS3, Cu2S - BaGdCuS3. Все диаграммы эвтектического типа. Фазовая диаграмма системы Cu2S - MgS перитектического типа.
3. Впервые получены соединения BaLnCuS3 (Ln = Pr, Nd, Sm, Gd, Dy, Lu) ромбической сингонии, структурный тип (СТ) KZrCuSe3, пр.гр. Сmсm; сложный сульфид Ba3Fe2S5.
Практическая значимость. Впервые установленные температуры и характер плавления сложных сульфидов BaFeS2, Ba3Fe2S5, BaLn2FeS5 (Ln = La, Се, Pr, Nd) и BaLnCuS3 (Ln = La, Pr, Sm, Nd, Gd, Dy, Lu) позволяют целенаправленно определять условия получения литых образцов соединений для изучения их свойств. Данные по фазовым ааравновесияма ав асистемах аAIIS - FeS - Gd2S3, ааBaS - FeS - Ln2S3, AIIS - Cu2S - Gd2S3 является основой для получения многофазных образцов и создания возможных гетероструктур.
Впервые установлены рентгенометрические характеристики соединений BaLnCuS3 (Ln = Pr, Nd, Sm, Gd, Dy, Lu). Рентгенометрические характеристики соединений BaGdCuS3, BaLuCuS3 представлены в картотеку PDF-4.
Достоверность результатов обеспечивается применением физико-химических методов анализа с использованием современного, поверенного оборудования, согласованностью результатов в параллельных опытах, современным программным обеспечением. Научные положения и выводы соотносятся и подтверждаются теоретическими и экспериментальными данными, полученными в работе.
На защиту выносятся:
1. Фазовые диаграммы систем AIIS - FeS (AII = Mg, Ca, Sr, Ba) и закономерности аих изменений ав аряду аЩЗЭ, афазовая адиаграмма системы MgS - Cu2S.
2. Фазовые равновесия в системах AIIS - FeS - Gd2S3 (AII = Mg, Ca, Sr, Ba), BaS - FeS - Ln2S3 (Ln = La, Сe, Pr, Nd), AIIS - Cu2S - Gd2S3 (AII = Mg, Ca, Ba), положение аконнод при 1070 К, фазовые диаграммы разрезов FeS - AIIGd2S4 (AII = Ca, Sr, Ba), FeS - BaLn2FeS5 (Ln = La - Nd), BaS - CuGdS2, Gd2S3 - BaGdCuS3, BaGd2S4 - BaGdCuS3, Cu2S - BaGdCuS3.
3. Рентгенометрические и кристаллохимические характеристики соединений BaLnCuS3 (Ln = Pr, Nd, Sm, Gd, Dy, Lu).
4. Закономерности фазовых равновесий в изученных системах, рассмотренные, исходя из соотношения ионных радиусов катионов, кислотно- основных свойств простых сульфидов.
- Апробация работы. Результаты работы были представлены на: I Всероссийской конференции Физико-химические процессы в конденсированном состоянии и на межфазных границах - Фагран-2002 (Воронеж, 11-15 ноября 2002); Четвертой международной конференции Благородные и редкие металлы. БРМ - 2003 (Донецк, 22-26 сентября 2003); Всероссийской конференции Химия твердого тела и функциональные материалы - 2004 и IV семинаре СО РАН - УрО РАН Термодинамика и материаловедение (Екатеринбург, 25-28 октября 2004); Всероссийской конференции Менделеевские чтения (Тюмень, 26-28 мая 2005); Russian International Conference Chemical Thermodynamics (Moscow, 27 June - 2 July 2005); VI международной конференции Химия твердого тела и современные микро- и нанотехнологии (Кисловодск, 17-22 сентября 2006); Шестом семинаре СО РАН - УрО РАН Термодинамика и материаловедение (Екатеринбург, 17-19 октября 2006); Общероссийской с международным участием научной конференции Полифункциональные химические материалы и технологии (Томск, 23-25 мая 2007); Всероссийских научных чтениях с международным участием, посвященных 75-летию член-корреспондента АН СССР М.В.Мохосоева, (Улан-Удэ, 25-29 июня 2007); VII международной научной конференции Химия твердого тела и современные микро- и нанотехнологии (Кисловодск, 17-22 сентября 2007); Всероссийской конференции Химия твердого тела и функциональные материалы - 2008 (Екатеринбург, 21-24 октября 2008); V Всероссийской конференции Физико-химические процессы в конденсированном состоянии и на межфазных границах - Фагран-2010 (Воронеж, 3-8 октября 2010); Всероссийской конференции Химия твердого тела и функциональные материалы - 2012 (Екатеринбург, 6-10 февраля 2012).
- Публикации. По теме диссертации опубликовано 23 научных работы: 6 статей в рецензируемых научных журналах, статьи в трудах конференций, в сборниках трудов университета, тезисы докладов в материалах международных и всероссийских конференций.
- Работа выполнена при финансовой поддержке гранта РФФИ 01-03-33322а; гранта Университеты России № 05.01.001 2002-2003; ФЦП Научные и научно-педагогические кадры инновационной России на 2009-2013 гг., ГК 6к/143-09 (П 646), НИР государственного задания (шифр 3.3763. 2011 (7-12)).
- ичный вклад автора. Автором выполнен весь объем экспериментальной работы, представленный в диссертационном исследовании. Совместно с научным руководителем определена цель работы и задачи исследования. Самостоятельно написаны все главы диссертационной работы и автореферата, которые обсуждены с научным руководителем.
- Структура и объем работы. Диссертация состоит из введения, трех глав, списка литературы, приложения. Работа изложена на 152 страницах, включая 68 рисунков и 14 таблиц. Список литературы насчитывает 185 наименований. Приложение включает 28 рисунков и 11 таблиц.
СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность темы диссертации, сформулированы цель работы, задачи исследования, научная новизна, практическая значимость работы, основные положения, выносимые на защиту.
В первой главе обобщены литературные данные по фазовым равновесиям в системах AII - S (AII = Mg, Ca, Sr, Ba), Fe - S, Cu - S, Ln - S, AIIS - Ln2S3, FeS - Ln2S3, Cu2S - Ln2S3 (Ln = La - Lu), структуре и свойствам простых и сложных сульфидов. Описаны методы синтеза сульфидов.
Во второй главе представлены установки синтеза сульфидов, физико-химические методы анализа. Исходные сульфиды MgS, FeS, Cu2S получены ампульным методом из элементов S лос. ч. 16-5, Mg Mг-95 (99,95 мас. % Mg), карбонильного Fe лос. ч. 13-2 Cu лос. ч. 11-4 по стандартным методикам. Чистоту полученных веществ MgS, FeS и Cu2S контролировали дифференциальным термическим, химическим и рентгенофазовым методами анализа.Моносульфиды CaS, SrS, BaS получены из соответствующих сульфатов CaSO4, SrSO4, BaSO4 марки лос.ч. 11-2 в потоке водорода или сульфидирующих агентов CS2 и H2S при температуре 1050Ц1250 К; полуторные сульфиды РЗЭ синтезированы из оксидов марок В, Г при температуре 1270 - 1370 К. Синтезы проведены по стандартным методикам.
Образцыа ав аасистемах ааAIIS - FeS аа(AII = Mg, Ca, Sr, Ba), ааCu2S - MgS, аAIIS - FeS - Gd2S3 (AII = Mg, Ca, Sr, Ba), аBaS - FeS - Ln2S3 (Ln = La, Сe, Pr, Nd), AIIS - Cu2S - Gd2S3 (AII = Mg, Ca, Ba) получали двумя методами: 1) сплавлением исходных компонентов, помещенных в графитовые тигли, на установке токов высокой частоты в атмосфере аргона и паров серы при общем давлении 1 атм.; 2) в графитовом тигле, в вакуумированной запаянной кварцевой ампуле. Образцы отжигались при температурах 770 К, 1070 К, 1170 К, 1470 К.
Физико-химические методы анализа (ФХА). Рентгенофазовый анализ (РФА) применяли для определения фазового состава образцов, определения кристаллохимических параметров элементарных ячеек, характеристик структуры, протяженности областей гомогенности. Проводили РФА (метод порошка) на дифрактометре Дрон-6, Дрон-7 в фильтрованном Cu Ka-излучение, Ni - фильтр; Co K? - излучении, Fe - фильтр. Параметры элементарных ячеек (э.я.) определяли из рефлексов в области углов дифракции 10?2??125 для кубической сингонии с точностью (0.0001-0.0002) нм, параметры элементарных ячеек структур ортогональных сингоний с точностью (0.001Ц0.003) нм. Использованы программные комплексы РФА Powder 2.0 и PDWin 4.0. Микроструктурный (МСА) и дюрометрический (ДМА) анализы применяли для определения фазового состава образцов, установления метрических характеристик фазовых диаграмм, изменения свойств фаз. Исследования проводили на полированных или протравленных шлифах на микротвердомере МЕТАМ РВ-22, МС 5000, ПМТ-3М. Измерения микротвердости проводили по стандартной методике (метод Виккерса, погрешность определения 5 % от измеряемой величины). Дифференциальный термический анализ (ДТА) использовали для определения температур фазовых превращений в твердом состоянии, а также определения температур плавления фаз в низкоплавких системах. Исследования проводили на установке ДТА-1. Погрешность измерения температуры 0.2 % от измеряемой величины. Дифференциальную сканирующую калориметрию (ДСК) применяли для определения температур фазовых превращений. ДСК проводили на установке Setsys Evolution 1750 (TGA - DSC 1600), используя программный комплекс Setsoft Software 2000, с термопарой PtRh/PtRh, Pt/PtRh. Разделение накладывающихся пиков осуществлялось в программе Thermogram Analyser. Визуально-политермический (ВПТА) использовали для установления положений линий солидуса и ликвидуса при более высоких температурах. Пробу массой 50-70 мг помещали в молибденовый тигель, устанавливаемый на спай термопары ВР 5/20, в атмосфере аргона (предварительное вакуумирование). Погрешность определения температур 1.5 % от измеряемой величины. Установки градуировали по реперам. Химический анализ использовали для определения содержания в образцах сульфидной серы.
В третьей главе описываются фазовые равновесия в системах AIIS - FeS, AIIS - FеS - Ln2S3, AIIS - Cu2S - Ln2S3 (AII = Mg, Ca, Sr, Ba; Ln = La - Lu).
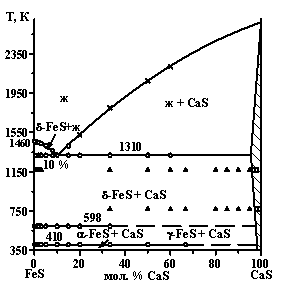
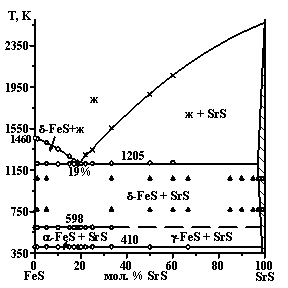
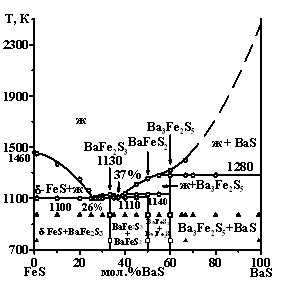
Впервые построены фазовые диаграммы систем AIIS - FeS (AIIS = Mg, Ca, Sr, Ba) (рис. 1).
|
|
|
|
Рисунок 1. Фазовые диаграммы систем AIIS - FeS (AII = Mg, Sr, Ca, Ba)
Система MgS - FeS. Система MgS - FeS перитектического типа с образованием ограниченных областей твердых растворов (ТР) на основе MgS и FeS. При температуре перитектики 1470 К величина растворимости на основе ?-FeS достигает 2 мол. % MgS. Микротвердость FeS в пределах твердого раствора изменяется от 3200 до 3100 МПа. На основе MgS образуется протяженный твердый раствор. Величина растворимости при 1470 K составляет 75 мол. % FeS, при 1170 K - 68 мол. % FeS, при 770 K - 35 мол. % FeS. Параметр кубической э.я. фазы MgS структуры типа NaCl изменяется от 0.5196 нм (MgS) до 0.5164 нм (65 мол. % MgS, 770 K), 0.5127 нм (42 мол. % MgS, 1170 K), микротвердость увеличивается от 2600 МПа до 3040 МПа. DНпл (ТР FeS) = 9 Дж/г.
Система CaS - FeS. Фазовая диаграмма системы CaS - FeS эвтектического типа с ограниченной растворимостью на основе CaS. Протяженность твердого раствора составляет 4 мол. % FeS при 1310 К. Заметного ТР на основе FeS не обнаружено. Между фазами CaS и FeS образуется эвтектика с координатами: 10 мол. % CaS и 1310 К. Состав эвтектики, рассчитанный по формулам Воздвиженского-Ефимова, Васильева, Кордеса для ТЭ = 1310 К, составляет 10 мол. % CaS. Балансное уравнение плавления эвтектики: 0.89FeS + 0.11ТР CaS (0.05FeS; 0.95CaS) - Ж (0.90FeS; 0.10CaS)), DНпл = 51 Дж/г.
Система SrS - FeS эвтектического типа с ограниченной растворимостью на основе SrS. Протяженность твердого раствора составляет 3 мол. % FeS при 1070 К. На основе всех полиморфных модификаций FeS заметных областей ТР не образуется. Между фазами SrS и FeS образуется эвтектика при 19 мол. % SrS и 1205 К. Состав эвтектики совпадает с рассчитанным - 19 мол. % SrS. Совпадение результата свидетельствует о том, что фазовые равновесия в системе подчиняются общим закономерностям для систем эвтектического типа. Балансное уравнение плавления эвтектики: 0.80FeS + 0.20ТРSrS(0.03FeS; 0.97SrS) л Ж(0.81FeS; 0.19SrS); DНпл = 45 Дж/г.
Система BaS - FeS. В системе образуются три сложных сульфида: BaFe2S3, BaFeS2, Ba3Fe2S5. Соединение Ba3Fe2S5 получено впервые. В доступных версиях картотеки PDF не удалось найти структурного аналога соединения Ba3Fe2S5. Соединение BaFe2S3 кристаллизуется в ромбической сингонии с параметрами э.я. а = 0.8784 нм, b = 0.1122 нм, с = 0.5286 нм; пр. гр. Сmcm. Микротвердость кристаллов фазы составляет 2350 МПа. Соединение BaFe2S3 плавится конгруэнтно. Эвтектики образуются между соединениями FeS и BaFe2S3 (26 мол. % BaS, 1100 К); между BaFe2S3 и BaFeS2 (37 мол. % BaS, 1110 К). Микротвердость BaFeS2 составляет 1600 МПа, Ba3Fe2S5 - 1400 МПа. BaFeS2 плавится инконгруэнтно при температуре 1140 К по реакции: BaFeS2(0.50BaS; 0.50FeS) - 0.50Ba3Fe2S5(0.60BaS; 0.40FeS) + 0.50Ж(0.40BaS; 0.60FeS). Фаза Вa3Fe2S5 плавится инконгруэнтно: Ba3Fe2S5(0.60BaS; 0.40FeS) - 0.85Ж(0.53BaS; 0.47FeS) + 0.15BaS. Температура плавления 1280 К. В системе не обнаружено заметных областей твердых растворов как на основе простых, так и сложных сульфидов, что согласуется со значительным различием в эффективных ионных радиусах для координационного числа (КЧ) 6: rBa2+ = 0.135 нм и rFe2+(LS) = 0.061 нм, rFe2+(HS) = 0.078 нм (LS, HS - низко- и высокоспиновое состояние).
Закономерности фазовых равновесий в системах AIIS - FeS.
В системах AIIS - FeS происходит постоянная трансформация диаграмм от образования протяженных твердых растворов (MgS - FeS), через диаграммы эвтектического типа (СaS - FeS, SrS - FeS), до диаграммы, характеризующейся образованием трех сложных сульфидов. Различие в электроотрицательностях c(Fe) = 1.95 и ns2-элементов c(Mg) = 1.17, c(Ca) = 0.92, c(Sr) = 0.92, c(Ba) = 0.96 являются значительными для всех систем - 40 %, 52 %, 52 % и 51 % соответственно. Наиболее вероятно, что данный фактор не является определяющим в формировании фазовых равновесий. Закономерности изменений фазовых диаграмм коррелируют с различием в ионных радиусах (?r) Fe2+ и А2+. Различие в ионных радиусах rMg2+ = 0.072 нм и rFe2+ (LS)=0.061 нм составляет 15 %, и по правилу Юм-Розари способствует образованию протяженных ТР. Соотношение радиусов ионов rCa2+ = 0.100 нм, rSr2+ = 0.118 нм и иона Fe2+ не приводит к необходимым различиям в кислотно-основных свойствах сульфидов и образованию новых соединений в системах. В системе BaS - FeS ион Fe2+ по отношению к иону Ba2+ по своим свойствам подобен комплексообразователю. Значительные различия в электроотрицательностях и эффективных ионных радиусах rBa2+ = 0.135 нм и Fe2+ позволяют считать сульфид FeS кислотным по отношению к BaS. Взаимодействие различных по кислотно-основным свойствам сульфидов определяет образование в системе трех сложных сульфидов.
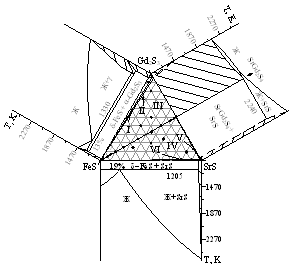
Система MgS - FeS - Gd2S3. В системе не обнаружено образование сложных соединений (рис. 2). В концентрационном треугольнике образуются три области ограниченных твердых растворов на основе исходных сульфидов. В системе (I) (крайний состав ТР на основе MgS (в системе MgS - FeS) - ТР на основе Gd2S3 (в тройной системе MgS - FeS - Gd2S3) - крайний состав ТР на основе Gd2S3 (в системе MgS - Gd2S3) - крайний состав ТР на основе MgS (в системе MgS - Gd2S3)) в равновесии находятся составы из областей ТР на основе MgS и Gd2S3, которые идентифицированы методами РФА, МСА.
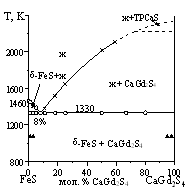
Система CaS - FeS - Gd2S3. Новые соединения не образуются. Определено положение коннод при 1070 К. В равновесии находятся составы из областей твердых растворов на основе сульфидов CaS, FeS и Gd2S3. Выделены пять подчиненных систем Изучен политермический частично квазибинарный разрез FeS - CaGd2S4 эвтектического типа (рис. 3). Координата эвтектики: 8 мол. % CaGd2S4, 1330 К. ТР на основе исходных фаз не найдено.
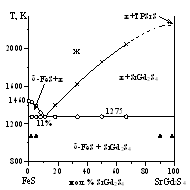
Система SrS - FeS - Gd2S3. В системе присутствуют ТР на основе исходных сульфидов. Выделены пять подчиненных систем. Построена фазовая диаграмма FeS - SrGd2S4 эвтектического типа. Состав эвтектики 11 мол. % SrGd2S4; температура 1275 К. Разрез частично квазибинарный.
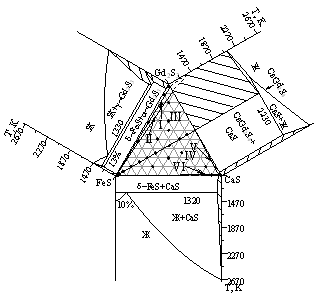
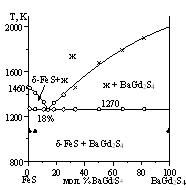
Система BaS - FeS - Gd2S3. Фазовые равновесия изучены по изотермическому сечению при 1070 К и по политермическим разрезам. В системе не образуется новых сложных соединений. При 1070 К соединение BaGd2S4 находится в равновесии с FeS, BaFe2S3, BaFeS2, Ba3Fe2S5. Выделено шесть подчиненных треугольников. Во всех составах разреза FeS - BaGd2S4 в равновесии находятся фазы FeS и BaGd2S4, между которыми образуется эвтектика с координатами: 18 мол. % BaGd2S4, 1270 К. Диаграмма системы BaGd2S4 - BaFe2S3 является квазибинарным сечением треугольника BaS - FeS - Gd2S3. В равновесии находятся только сопряженные фазы. Характер равновесия - эвтектический. Координаты эвтектики: 21 мол % BaGd2S4; 1120 K. Системы BaGd2S4 - BaFeS2, BaGd2S4 - Ba3Fe2S5 эвтектического типа.
|
|
|
|
Рисунок 2. Положение коннод в системах AIIS ЦFeS ЦGd2S3 (AII = Mg, Са, Sr, Ba) при 1070 К
|
|
|
Рисунок 3. Фазовые диаграммы систем FeS - AIIGd2S4 (AII = Ca, Sr, Ba)
Закономерности фазовых равновесий в системах AIIS - FeS - Gd2S3.
В системе MgS - FeS - Gd2S3 конноды располагаются между областями ТР на основе MgS и Gd2S3. В остальных системах AIIS - FeS - Gd2S3 (AII = Са, Sr, Ba) конноды расположены между FeS и сложными сульфидами AIIGd2S4. Разрезы FeS ЦAIIGd2S4 являются частично квазибинарными. Во всех системах во внутренней части концентрационных треугольников не образуются сложные сульфиды. Наиболее вероятной причиной являются близкие кислотно-основные свойства сульфидов FeS и Gd2S3. Оба сульфида по отношению к BaS проявляют кислотные свойства, что приводит к образованию сульфида ВаGd2S4 и сложных сульфидов BaFe2S3, BaFeS2, Ba3Fe2S5. Предполагалось, что различия в кислотно-основных свойствах BaS, а также FeS и Gd2S3, а в сочетании с различием в эффективных ионных радиусах rFe+2(LS) = 0.061 нм и rGd+3 = 0.0938 нм вызовет образование сложных сульфидов, что не подтвердилось.
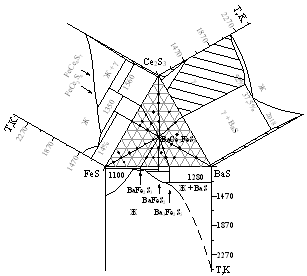
Фазовые равновесия в системах BaS - FeS - Ln2S3 (Ln = La - Nd).
В системах BaS - FeS - Ln2S3 (Ln = La, Ce, Pr, Nd) образуется сложный сульфид BaLn2FeS5, который находится в равновесии с простыми и сложными сульфидами.
Система BaS - FeS - Lа2S3. BaLa2FeS5 инконгруэнтно плавится по реакции: BaLa2FeS5 - ж + g-фаза при температуре 1540 К. При 1070 К соединение BaLa2FeS5 находится в равновесии с простыми и сложными сульфидами из систем, образующих треугольник BaS - FeS - Lа2S3 (рис. 4). Изучен политермический разрез FeS - BaLa2FeS5 эвтектического типа. Состав эвтектики 15 мол. % BaLa2FeS5, эвтектическая температура 1200 К. Образование ТР на основе исходных фаз не обнаружено. Характер взаимодействия в разрезах BaLa2FeS5 - BaFeS2, BaLa2FeS5 - BaFe2S3 эвтектический.
|
|
Рисунок 4. Положение коннод в системах BaS - FeS - Ln2S3 (Ln = Се, Nd)
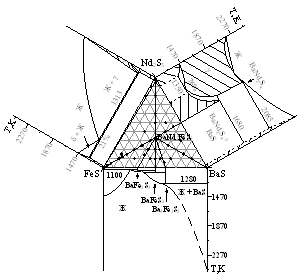
Система BaS - FeS - Ce2S3. Соединение BaCe2FeS5 плавится перитектически при 1525 К. Проведены конноды: Ce2S3 - BaFeS2, BaCe2FeS5? - FeS, FeСе2S4 - BaS, BaCe2FeS5 - BaFe2S3, BaCe2FeS5 - Ba3Fe2S5, BaCe2FeS5 - FeСе4S7. Разрез Ce2S3 - BaFeS2 перитектического типа, между соединением BaCe2FeS5 и BaFeS2 образуется эвтектика, состав которой смещен к соединению BaFeS2. Построен политермический разрез FeS - BaСе2FeS5, состав эвтектики 17 мол. % BaСе2FeS5, эвтектическая температура 1160 К.
Система BaS - FeS - Pr2S3. При 1070 К фаза BaPr2FeS5 находится в равновесии с фазами, образующими треугольник, и фазами, находящимися на боковых сторонах тройной системы. В разрезе BaPr2FeS5 - FeS между исходными соединениями образуется эвтектика, состав 20 мол. % BaPr2FeS5, температура эвтектики 1140 К. В системе BaS - FeS - Pr2S3 можно выделить треугольник BaPr2FeS5 - Pr2S3 - конечный состав ТР на основе ?-Pr2S3. В данном треугольнике в равновесии находятся всегда только две фазы: BaPr2FeS5 и состав из области твердого раствора ?-фазы.
Фазовые равновесия в системе BaS - FeS - Nd2S3 подобны фазовым равновесиям системы BaS - FeS - Pr2S3. Соединение BaNd2FeS5 плавится перитектически при 1460 К. Построен политермический разрез BaNd2FeS5 - FeS, состав эвтектики 26 мол. % BaNd2FeS5, 1130 К.
В системах BaS - FeS - Sm2S3, BaS - FeS - Er2S3 соединение состава BaLn2FeS5 не образуется. На микроструктуре отожженного образца присутствуют зерна фазы BaLn2S4 и эвтектика между BaLn2S4 и FeS.
Закономерности фазовых равновесий в системах BaS - FeS - Ln2S3 (Ln = La, Ce, Pr, Nd, Gd, Sm, Er).
Фазовые равновесия в системах BaS - FeS - Ln2S3 (Ln = La, Ce, Pr, Nd) подобны. В равновесии при 1070 К находится сульфид BaLn2FeS5 (Ln = La, Ce, Pr, Nd) с исходными сульфидами и сульфидами, образующимися в двойных системах. Определено положение коннод:
в системе BaS - FeS - Lа2S3: BaS - FeLa2S4, La2S3 - BaFeS2, BaLa2FeS5 - BaFe2S3, BaLa2FeS5 - FeS, BaLa2FeS5 - Ba3Fe2S5, BaLa2FeS5 - ТР на основе La2S3, BaLa2FeS5 - FeLa4S7;
в системе BaS - FeS - Ce2S3: BaS - FeCe2S4, Ce2S3 - BaFeS2, BaCe2FeS5 - BaFe2S3, BaCe2FeS5 - FeS, BaCe2FeS5 - Ba3Fe2S5, BaCe2FeS5 - ТР на основе Ce2S3, BaCe2FeS5 - FeCe4S7;
в системе BaS - FeS - Pr2S3: BaS - BaPr2FeS5, Pr2S3 - BaFeS2, BaPr2FeS5 - BaFe2S3, BaPr2FeS5 - FeS; BaPr2FeS5 - FePr4S7, BaPr2FeS5 - Ba3Fe2S5, BaPr2FeS5 - ТР на основе Pr2S3;
в системе BaS - FeS - Nd2S3: BaS - BaNd2FeS5, Nd2S3 - BaFeS2, BaNd2FeS5 - BaFe2S3, BaNd2FeS5 - Ba3Fe2S5, BaNd2FeS5 - BaNd2S4, BaNd2S4 - FeS.
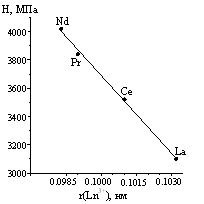
В ряду систем BaLn2FeS5 - FeS (Ln = La, Ce, Pr, Nd) наблюдается понижение температуры плавления эвтектики и смещение ее состава к BaLn2FeS5, связанное с уменьшением температуры плавления данных соединений. Сложный сульфид состава BaLn2FeS5, образующийся в системах, плавится инконгруэнтно согласно реакции: BaLn2FeS5 л ?-фаза + ж. В ряду соединений BaLn2FeS5 (Ln = La, Ce, Pr, Nd) наблюдается уменьшение температуры инконгруэнтного плавления, что позволяет отнести соединения к тиоферратам с общей формулой BaLn2(FeS5). Микротвердость закономерно увеличивается с уменьшением объема э.я. (рис. 5). В системах Ln = Sm, Gd, Er фаза BaLn2FeS5 не образуется.
а |
б |
в |
Рисунок 5. Зависимость температур инконгруэнтного плавления соединений BaLn2FeS5 (Ln=La - Nd) (а), микротвердости (б), объема э.я. (в) от ионного радиуса Ln
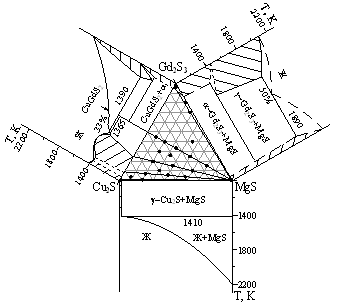
Фазовые равновесия в системах AIIS - Cu2S - Gd2S3 (AII = Mg, Ca, Ba).
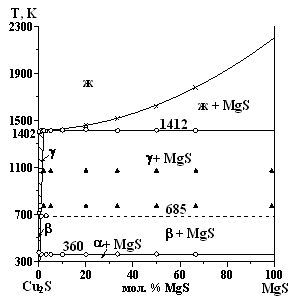
Система Сu2S - MgS перитектического типа с образованием ограниченного твердого раствора на основе ?-, ?-, и ?-модификаций Cu2S (рис. 6).
a |
б |
Рисунок 6. а) Фазовая диаграмма системы Cu2S - MgS. б) Положение коннод в системе аMgS - Cu2S - Gd2S3 при 1070 К
Образование твердого раствора на основе Cu2S, протяженностью менее 1 мол. % MgS, подтверждается понижением температуры полиморфных переходов до температур эвтектоидных реакций: ТР ?-Cu2S + MgS л ТР ?-Cu2S; ТР ?-Cu2S + MgS л ТР ?-Cu2S, установленных методом ДТА. Температуры реакций составляют а680 К и а360 К асоответственно. аВ апределах аТР амикротвердость ?-Cu2S увеличивается от 870 до 930 МПа. На основе MgS образование заметной растворимости не зафиксировано.
В системе MgS - Gd2S3 - Cu2S при 1070 К проведены конноды, выделено шесть подчиненных треугольников (рис. 6). Разрез CuGdS2 - MgS, является частично квазибинарным, эвтектического типа. В треугольнике MgS - крайние составы фазы C0 в равновесии находятся две фазы: MgS и C0. Характер фазовых равновесий системы CaS - Gd2S3 - Cu2S подобен системе MgS - Gd2S3 - Cu2S (рис. 7).
|
|
Рисунок 7. Изотермическое сечение систем AIIS - Cu2S - Gd2S3, (AII = Ca, Ba) при 1070 К
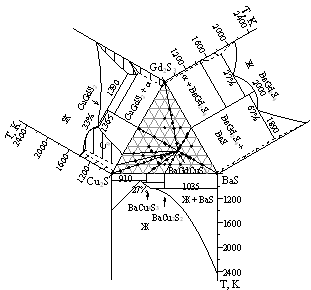
Система BaS - Cu2S - Gd2S3.
В системе BaS - Сu2S - Gd2S3 образуется сложный сульфид ВаGdCuS3, кристаллохимические параметры определены при использовании программ "GSAS" и "Роwdеr2", соединение имеет ромбическую э.я. типа КZгСuSе3, (пр. гр. Стcm) с параметрами э.я. а = 0.40529(2), b= 1.34831(6), с = 1.02940(5) нм (рис. 8). Достоверность полученных результатов подтверждается высокими значениями критериев Де-Вольфа и Смита-Снайдера: М20 = 176.90 (1.8769, 30), Р30 = 150.65 (0.0034, 58).
Соединение плавится конгруэнтно при 1685 К. ВаGdCuS3 находится в равновесии с сульфидами ВаS, ВаGd2S4, Gd2S3, CuGdS2, Сu2S, ВаСu4S3, ВаСu2S2 и фазой С0 системы Сu2S - Gd2S3, что позволило провести соответствующие коноды при 800 К (рис. 7).
Система BaS - CuGdS2 является частично квазибинарным сечением системы BaS - Сu2S - Gd2S3. Отклонение от квазибинарности происходит только вблизи фазы СuGdS2, выше температуры ее инконгруэнтного плавления. Фазовая диаграмма системы BaS Ц CuGdS2 (рис. 9) характеризуется образованием сложного сульфида ВаGdCuS3.
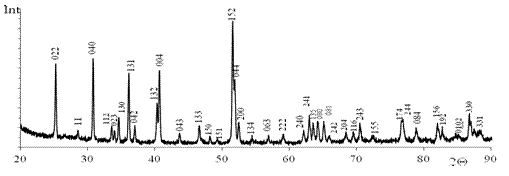
Рисунок 8. Дифрактограмма пробы образца BaGdCuS3
|
|
|
|
Рисунок 9. Фазовые диаграммы квазибинарных разрезов системы BaS - Cu2S - Gd2S3
Заметных областей растворимости на основе соединений ВаGdCuS3 и CuGdS2, не зафиксировано. На основе ВаS образуется ограниченный ТР, протяженность которого достигает 2 мол. % CuGdS2 апри 1625 К, параметр э.я. ВаS уменьшается от 0.6386 до 0.6372 нм. В подсистеме ВаGdCuS3 - CuGdS2, образуется эвтектика: 7 мол. %ВаS, Т=1325 К. В подсистеме ВаGdCuS3 - ВаS координаты эвтектики: 64 мол. % ВаS, Т=1625 К.
Система Cu2S - ВаСdCuS3 эвтектического типа. Координаты эвтектики: 8 мол. % ВаСdСuS3, 1125 К. Растворимость в Сu2S при температуре 1125 К составляет 2 мол. % ВаСdСuS3. Заметного изменения параметров ячейки ?-Сu2S не зафиксировано. На основе сульфида ВаСdСuS3 область твердого раствора не обнаружена.
Разрез ВаСdСuS3 - Gd2S3 является квазибинарным, эвтектического типа, с координатами эвтектической точки: 35 мол. % Gd2S3, Т = 1495 К. На основе ?- и ?-модификаций Gd2S3 образуются области ТР. Радиусы ионов r(Ва2+) = 0.1350 нм больше, чем радиус иона гадолиния rGd3+ = 0.0938 нм. Параметр э.я. в пределах ТР при 1495 К увеличивается от а = 0.8375 нм (Gd2S3) (90 мол. % ?-Gd2S3) до а = 0.8456 нм. Понижение температуры полиморфного перехода ?-Gd2S3 - ?-Gd2S3 (1475 К) до температуры эвтектоидного превращения ТР?-Gd2S3 + ВаGdCuS3 - ТР ?-Gd2S3 (1440 К) подтвердило наличие области ТР на основе ?-Gd2S3 и ?-Gd2S3, линия сольвуса проходит через 95 и 96 мол. % Gd2S3 при 1350 и 1100 К.
Фазовая диаграмма системы ВаСdСuS3 - ВаGd2S4 эвтектического типа без заметных областей растворимости на основе исходных сульфидов. Координаты эвтектики: 35 мол. % ВаGd2S4, Т= 1620 К.
Закономерности фазовых равновесий в системах AIIS Ц Cu2S Ц Gd2S3 (AII = Mg, Ca, Ba).
В системах AIIS - Cu2S - Gd2S3 (AII = Mg, Ca) при 1070 К проявляются подобные фазовые взаимодействия. Конноды проходят от сульфидов MgS и CaS к сульфидам, образующимся в системе Cu2S - Gd2S3.
В системе BaS - Cu2S - Gd2S3 образуется конгруэнтно плавящаяся фаза при соотношении исходных сульфидов 2BaS:1Cu2S:1Gd2S3. Соединение BaGdCuS3 ромбической сингонии, СТ KZrCuSe3, пр.гр. Сmсm (табл. 1). Получен BaNdCuS3 СТ КZгСuSе3, в [2] для данного соединения приведен СТ BaLaCuS3, пр.гр. Pmcn, что может указывать на существование соединения в различных полиморфных модификациях. В ряду соединений BaLnCuS3 (Ln = Pr, Nd, Sm, Gd, Dy, Lu) прослеживаются следующие закономерности:
увеличение термической стабильности конгруэнтно плавящейся фазы BaLnCuS3 связано с возрастанием кислотных свойств Ln2S3. Степень кислотности Ln2S3 возрастает с ростом электроотрицательности и уменьшением радиуса в ряду Ln3+. Cоединения BaLnCuS3 можно отнести к тиолантанатам с формулой BaCu(LnS3);
уменьшение объема э.я. в соответствии с уменьшением в ряду РЗЭ радиуса Ln3+;
возрастание микротвердости связано с уменьшением объема элементарной ячейки (рис. 10).
Излом на зависимостях температуры плавления, микротвердости, объема элементарной ячейки от ионного радиуса Ln3+ связан с изменением структурного типа соединения BaLnCuS3 при переходе от La к Pr.
Таблица 1
Кристаллохимические характеристики и свойства фаз BaLnCuS3
BaLnCuS3 |
СТ |
Параметры э.я., нм |
Характер плавления |
Тпл, К |
Н, МПа |
||
а |
b |
с |
|||||
BaLaCuS3 |
BaLaCuS3 |
0.423 |
1.173 |
1.133 |
конгруэнтный |
1640 |
1320 |
BaPrCuS3 |
КZгСuSе3 |
0.416 |
1.350 |
1.042 |
1620 |
1060 |
|
BaNdCu S3 |
КZгСuSе3 |
0.412 |
1.349 |
1.038 |
1650 |
1100 |
|
BaSmCuS3 |
КZгСuSе3 |
0.408 |
1.351 |
1.034 |
1670 |
1270 |
|
BaGdCuS3 |
КZгСuSе3 |
0.405 |
1.138 |
1.029 |
1685 |
1400 |
|
BaDyCuS3 |
КZгСuSе3 |
0.404 |
1.348 |
1.026 |
1740 |
1740 |
|
BaLuCuS3 |
КZгСuSе3 |
0.399 |
1.341 |
1.008 |
1770 |
2200 |
|
а |
б |
в |
Рисунок 10. Зависимость температур конгруэнтного плавления соединений BaLnCuS3 (Ln = La, Pr, Nd, Sm, Gd, Dy, Lu) (а), микротвердости (б), объема э.я. (в) от ионного радиуса РЗЭ
Выводы:
1. Установлены закономерности изменений в ряду впервые построенных фазовых диаграмм систем AIIS - FeS (AII = Mg, Ca, Sr, Ba). Система MgS - FeS перитектического типа с ограниченными областями твердых растворов; системы СаS - FeS, SrS - FeS аэвтектического типа. Образование в асистеме ВаS - FeS трех сложных сульфидов BaFe2S3 BaFeS2, Ba3Fe2S5 коррелирует со значительным различием радиусов Ba2+ и Fe2+ (?r = 55 %). Протяженность твердого раствора на основе AIIS уменьшается пропорционально соотношению ионных радиусов катионов: ?r(rMg2+, rFe2+) = 15 % (протяженность твердого раствора 0-75 мол. % при 1470 K); ?r(rCa2+, rFe2+) = 39 % (0-4.5 мол. % при 1310 K); ?r(rSr2+, rFe2+) = 48 % (0-3 % мол. % при 1250 K).
2. Изучены фазовые равновесия в системах AIIS - FeS - Ln2S3, AIIS - Cu2S ЦLn2S3 (AII = Mg, Ca, Sr, Ba; Ln = Gd; Ln = La - Lu). В системах AIIS - FeS - Gd2S3 (AII = Mg, Са, Sr, Ba); BaS - FeS - Ln2S3 (Ln = La, Се, Pr, Nd); AIIS - Cu2S - Gd2S3 (AII = Mg, Са, Ba) установлено положение коннод при 1070 К. Сложные сульфиды BaGdCuS3, BaLn2FeS5 (Ln = La, Се, Pr, Nd) находятся в равновесии с простыми и сложными сульфидами, образующимися в системах. Построены фазовые диаграммы полностью или частично квазибинарных разрезов: FeS - AIIGd2S4, (AII = Ca, Sr, Ba), FeS - BaLn2FeS5, (Ln = La - Nd), BaS - CuGdS2, Gd2S3 - BaGdCuS3, BaGd2S4 - BaGdCuS3, Cu2S - BaGdCuS3. Все диаграммы эвтектического типа. Система Сu2S - MgS перитектического типа с образованием ограниченного твердого раствора на основе Cu2S. Изучение фазовых равновесий в системах позволяет определить условия получения гомогенных образцов и гетероструктур.
3. Впервые синтезированы соединения Ba3Fe2S5 и BaLnCuS3 (Ln = Pr, Nd, Sm, Gd, Dy, Lu), определены их рентгенометрические характеристики. Соединения BaLnCuS3 кристаллизуются в ромбической сингонии СТ КZгСuSе3 (пр. гр. Стcm). В ряду РЗЭ объем э.я. соединений BaLnCuS3 уменьшается пропорционально величине rLn3+.
4. Закономерности фазовых равновесий в изученных системах рассмотрены исходя из соотношения кристаллохимических и энергетических характеристик атомов, ионов и кислотно-основных свойств исходных сульфидов. Установлены закономерности изменения температур плавления в ряду соединений. Уменьшение температур плавления в ряду соединений BaLn2FeS5 (Ln = La, Се, Pr, Nd) и исчезновение фазы для Ln = Sm, Gd, Er позволяет отнести соединения к тиоферратам BaLn2(FeS5). В ряду сложных сульфидов BaLnCuS3 происходит монотонное увеличение температуры плавления, коррелирующее с возрастанием степени кислотности соединений Ln2S3. Cоединения BaLnCuS3 отнесены к тиолантанатам BaCu(LnS3).
Цитируемая литература
- Ino K. Synthesis and crystal structure of new quaternary sulfides BaLn2FeS5 (Ln = La, Ce, Pr, Nd, Sm) / K. Ino, M. Wakeshima, Y. Hinatsu // Mat. Researh Bull. - 2001. - Vol. 36. - P.2207-2213.
- Christuk A.E. New Quaternary Chalcogenides BaLnMQ3 (Ln = Rare Earth; M = Cu, Ag; Q = S, Se). Structures and Grinding-lnduced Phase Transition in BaLaCuQ3 / A.E. Christuk, P. Wu, J.A. Ibers // J. of Solid State Chem. - 1994. - Vol. 110. - P.330-336.
- Wu P. New Quaternary Chalcogenides BaLnMQ3 (Ln = Rare Earth; M = Cu, Ag; Q=S, Se). Structure and Property Variation vs Rare-Earth Element / P. Wu, A.E. Christuk, J.A. Ibers // J. of Solid State Chem. - 1994. - Vol. 110. - P.337-344.
Список публикаций по теме диссертации.
статьи в рецензируемых научных журналах
1. Андреев О.В. Фазовые равновесия в системах AS - Cu2S - Gd2S3 (A = Ca, Sr, Ba) / О.В. Андреев, А.В. Соловьёва, Н.В. Сикерина, А.С. Коротков // Вестник Тюменского государственного университета. - 2003. - № 2. - С. 248-253.
2. Андреев О.В. Фазовые диаграммы систем Cu2S - AIIS (AII = Mg, Ca, Sr, Ba) / О.В. Андреев, Н.В. Сикерина, А.В. Соловьёва // Журн. неорг. химии. - 2005. - Т. 50. - № 10. - С. 1697-1701.
3. Бурханова Т.М. Фазовые равновесия в системах AIIS - FeS - Gd2S3 (AII = Mg, Ca, Sr) / Т.М. Бурханова, А.В. Соловьёва, Л.Н. Монина, О.В. Андреев // Вестник Тюменского государственного университета. - 2006. - № 3. - С. 8-15.
4. Андреев О.В. Фазовая диаграмма системы MgS - FeS / О.В. Андреев, А.В. Соловьёва, Т.М. Бурханова // Журн. неорг. химии. - 2006. - Т. 51. - № 11. - С. 1938-1941.
5. Сикерина Н.В. Фазовые равновесия в системе BaS - Cu2S - Gd2S3 / Н.В. Сикерина, А.В. Соловьёва, Е.Н. Торощин, О.В. Андреев // Журн. неорг. химии. - 2007. - Т. 52. - № 12. - С. 2099-2103.
6. Бурханова Т.М. Фазовые равновесия в системах BaS - FeS ЦLn2S3 (Ln = La, Ce, Pr, Nd, Sm, Gd) / Т.М. Бурханова, А.В. Соловьёва, О.В. Андреев // Вестник Тюменского государственного университета. - 2011. - № 5. - С. 168-173.
статьи, тезисы докладов
7. Сикерина Н.В. Фазовые равновесия в системах AIIS - Ln2S3 - Cu2S (AII = Sr, Ba, Ln = La, Gd, Dy) / Н.В. Сикерина, П.Ю. Орлов, А.В. Соловьёва, О.Ю. Митрошин // Физико-химические процессы в конденсированном состоянии и на межфазных границах Фагран-2002: Материалы I Всерос. конф. г. Воронеж 11-15 ноября 2002. - Воронеж, РИ - ЕФ ВГУ, 2002. - С. 343.
8. Сикерина Н.В. Синтез фаз, фазовые равновесия в системах AIIS - Cu2S - Ln2S3 (AII = Mg, Ca, Sr, Ba; Ln = La - Lu) / Н.В. Сикерина, А.В. Соловьёва, Э.С. Абдрахманов, О.В. Андреев // Благородные и редкие металлы: Труды четвертой Межд. конф. БРМ - 2003 г. Донецк 22-26 сентября 2003. - Донецк, 2003. - С. 400-401.
9. Соловьёва А.В. Фазовые диаграммы систем CaS - FeS и SrS - FeS / А.В. Соловьёва, Т.М. Бурханова, О.В. Андреев // Менделеевские чтения: Труды Всерос. конф. г. Тюмень 26-28 мая 2005. - Тюмень, изд-во ТюмГУ, 2005. - С. 396-398.
10. Бурханова Т.М. Фазовые равновесия в системе BaS - FeS - La2S3 / Т.М. Бурханова, А.В. Соловьёва // Полифункциональные химические материалы и технологии: Материалы Общерос. с межд. участием науч. конф., посвящ. 75-летию хим. факультета Томск. гос.ун-та г. Томск 23-25 мая 2007. - Томск, изд-во ФГУ Томский ЦНТИ, 2007. - Т.1. - С. 306-308.
11. Соловьёва А.В. Фазовые равновесия в системах BaS - FeS ЦLn2S3 (Ln = Ce, Pr) / А.В. Соловьёва, Т.М. Бурханова, О.В. Андреев // Синтез и свойства химических соединений: сб. ст. - Тюмень, изд-во ТюмГУ, 2007. - С. 133-139.
12. Бурханова Т.М. Фазовые равновесия в системе BaS - FeS - Nd2S3. / Т.М. Бурханова, А.В. Соловьёва // Физико-химический анализ природных и технических систем: сб. ст. - Тюмень, изд-во ТюмГУ, 2008. - С. 46-51.
13. Соловьёва А.В. Фазовые равновесия в системе BaS - FeS - Gd2S3 / А.В. Соловьёва, Т.М. Бурханова // Физико-химический анализ природных и технических систем: сб. ст. - Тюмень, изд-во ТюмГУ, 2008. - С. 172-177.
14. Соловьёва А.В. Фазовые равновесия в системах AIIS - Cu2S - Gd2S3 (AII = Mg, Ca) / А.В. Соловьёва, О.В. Андреев, Т.М. Бурханова // Химия твердого тела и функциональные материалы: Тез. докл. Всерос. конф. и IV семинара СО РАН - УрО РАН Термодинамика и материаловедение г. Екатеринбург 25-28 октября 2004. - Екатеринбург, ИХТТ УрО РАН, 2004. - С. 378.
15. Soloviova A.V. The legitimancus of phase eguilibria in systems AIIS - FeS - Gd2S3 / A.V. Soloviova, T.M. Burhanova, O.V. Andreev // Russian International Conference on chemical Thermodynamics 27 June - 2 July 2005. - Moscow. - V II. - P. 272.
16. Соловьёва А.В. Фазовая диаграмма системы MgS - FeS. / А.В. Соловьёва, Т.М. Бурханова, Л.Н. Монина // Химия твердого тела и современные микро- и нанотехнологии: Тез. докл. VI межд. конф. г. Кисловодск 17-22 сентября 2006. - Кисловодск, изд-во СевКавГТУ, 2006. - С. 189-190.
17. Соловьёва А.В. Фазовые равновесия в системе MgS - FeS - Gd2S3 / А.В. Соловьёва, Т.М. Бурханова, Л.Н. Монина // Термодинамика и материаловедение: Тез. докл. Шестого семинара СО РАН - УрО РАН г. Екатеринбург 17-19 октября 2006. - Екатеринбург, ИХТТ УрО РАН, 2006. - С. 157.
18. Бурханова Т.М. Фазовые равновесия в системе СаS - FeS - Gd2S3 / Т.М. Бурханова, А.В. Соловьёва, Л.Н. Монина // Термодинамика и материаловедение: Тез. докл. Шестого семинара СО РАН - УрО РАН г. Екатеринбург 17-19 октября 2006. - Екатеринбург, ИХТТ УрО РАН, 2006. - С. 29.
19. Бурханова Т.М. Фазовые равновесия в системе SrS - FeS - Gd2S3 / Т.М. Бурханова, А.В. Соловьёва // Материалы Всерос. науч. чтений с межд. участием, посвящ. 75-летию член-корреспондента АН СССР М.В. Мохосоева г. Улан-Удэ - Улан-Удэ, изд-во БН - СО РАН, 2007. - С. 30.
20. Бурханова Т.М. Фазовые равновесия в системе BaS - FeS - Gd2S3 / Т.М. Бурханова, А.В. Соловьёва, О.В. Андреев // Химия твердого тела и функциональные материалы - 2008: Тез. докл. Всерос. науч. конф. г. Екатеринбург 21-24 октября 2008. - Екатеринбург, УрО РАН, 2008. - С. 341.
21. Бурханова Т.М. Фазовая диаграмма системы FeS - BaS / Т.М. Бурханова, А.В. Соловьёва // Химия твердого тела и функциональные материалы - 2008: Тезисы докладов Всерос. науч. конф. г. Екатеринбург 21-24 октября 2008. - Екатеринбург, УрО РАН, 2008. - С. 54
22. Бурханова Т.М. Фазовая диаграмма системы CaS - FeS / Т.М. Бурханова, А.В. Соловьёва, О.В. Андреев // Физико-химические процессы в конденсированных средах и на межфазных границах (ФАГРАН-2010): Материалы V Всерос. конф. г. Воронеж 3-8 октября 2010. - Воронеж, Научная книга, 2010. - С. 512-514.
23. Соловьёва А.В. Фазовые равновесия в системе BaS - Cu2S - Dy2S3 / А.В. Соловьёва, Т.М. Бурханова, Э.Ф. Казакова // Химия твердого тела и функциональные материалы - 2012: Тезисы докладов Всерос. конф. г. Екатеринбург 6-10 февраля 2012. - Екатеринбург, УрО РАН, 2012. - С. 168.
![]()
![]()
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]