 Все авторефераты докторских диссертаций
Все авторефераты докторских диссертаций
Изучение механизмов лекарственной устойчивости ВИЧ-1 к ингибиторам обратной транскриптазы
Автореферат докторской диссертации
На правах рукописи
Николенко Галина Николаевна
ИЗУЧЕНИЕ МЕХАНИЗМОВ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ ВИЧ-1 К ИНГИБИТОРАМ ОБРАТНОЙ ТРАНСКРИПТ АЗЫ
03.01.03 -молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора биологических наук
Кольцово- 2012
2
Работа выполнена в Национальном Институте Рака Национальных Институтов Здоровья (США) и ФБУН Государственный научный центр вирусологии и биотехнологии Вектор.
Научный консультант:
Доктор биологических наук, профессор Ильичев Александр Алексеевич.
Официальные оппоненты:
Воевода Михаил Иванович - член-корреспондент РАМН, доктор медицинских наук, профессор, директор НИИ терапии СО РАМН;
Карпова Галина Георгиевна - доктор химических наук, профессор, Институт химической биологии и фундаментальной медицины СО РАН, заведующая лабораторией структуры и функции рибосом;
Щелкунов Сергей Николаевич - доктор биологических наук, профессор, ФБУН ГНЦ ВБ Вектор, заведующий отделом геномных исследований и разработки методов ДНК-диагностики поксвирусов.
Ведущая организация:
Институт цитологии и генетики СО РАН, г. Новосибирск.
Защита состоится 8 июня 2012 года в 9.00 часов на заседании диссертационного совета Д 208.020.01 при ФБУН ГНЦ ВБ Вектор по адресу: р.п. Кольцово, Новосибирской области, Новосибирского р-на, 630559, тел. (383) 336-74-28.
С диссертацией можно ознакомиться в библиотеке ФБУН ГНЦ ВБ Вектор.
Автореферат разослан а _______________ 2012 года.
Ученый секретарь диссертационного совета
Трошкова Г.П.
3
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Вирус иммунодефицита человека 1 типа (ВИЧ-1) - инфекционный агент, вызывающий Синдром Приобретенного Иммунодефицита человека (СПИД). Глобальная эпидемия СПИДа, которая распространяется вот уже более 30 лет, вовлекая в ряды инфицированных ежегодно более 2 миллионов человек, является серьезной проблемой мирового здравоохранения. По последним данным Всемирной Организации Здравоохранения, в мире число ВИЧ-инфицированных составляет около 34 млн. человек, причем количество вновь инфицированных продолжает расти и в 2010 году составило 2.7 млн., а число умерших Ч1.8 млн. человек (
4 жизненного цикла вируса,а обусловливающими высокуюа скоростьа егоа адаптации.а Вирус
10
размножается в организме взрослого человека с высокой скоростью Ч до 10 вирусных частиц в день (Perelson et al., 1996). При этом уровень ошибок при обратной транскрипции
-5
достигает 5x10 , Ч что приводит примерно к одной мутации на каждый цикл репликации (Mansky, 1996; Svarovskaia et al, 2003). He стоит забывать, что ВИЧ-1 обладает весьма высокой частотой рекомбинации (Ни et al., 2003). Учитывая размер генома вируса (около 10000 нуклеотидов) при выполнении простых вычислений, можно предположить, что каждый день в организме взрослого пациента могут генерироваться все возможные точечные мутации, и в присутствии противовирусного препарата неизбежно произойдет отбор лекарственно-устойчивых вариантов вируса (Coffin, 1995). Дополнительные трудности в борьбе с инфекцией возникают из-за трансмиссии лекарственно-устойчивых штаммов ВИЧ, причем в отдельных регионах 10Ч20% вновь инфицированного контингента заражено именно такими штаммами (SPREAD Programme, 2008).
Около половины всех лекарственных препаратов против ВИЧ-1 ингибируют полимеразную активность обратной транскриптазы. Разработка лекарственных препаратов, направленных на специфическое блокирование активности вирусной РНКазы, продолжается не один год, но до сих пор не увенчалась успехом из-за их высокой токсичности (Schultz and Champoux, 2008). Используемые ингибиторы обратной транскриптазы подразделяют на две группы: нуклеозидные аналоги (NRTI), и ненуклеозидые аналоги (NNRTI).
Интенсивные исследования механизмов лекарственной устойчивости к ингибиторам обратной транскриптазы начались в 1987 году вскоре после внедрения первых антиретровирусных препаратов в клиническую практику. К началу данной работы было описано два основных механизма лекарственной устойчивости к нуклеозидным аналогам -дискриминация (Gao et al., 2000; Sarafianos et al, 1999) и фосфоролиз (Arion et al, 1998; Meyer et al., 1998). В соответствии с механизмом дискриминации лекарственно-устойчивые мутации образуют пространственные препятствия для включения трифосфорилированной формы ингибитора, NRTI-TP, в растущую ДНК-цепь. В соответствии с механизмом фосфоролиза лекарственно-устойчивые мутации обратной транскриптазы способствуют удалению 3'-терминирующего NRTI в присутствии физиологических концентрациий пирофосфата или АТР, который служит акцепторным субстратом реакции.
Несмотря на то, что описанные механизмы лекарственной устойчивости представляли обоснованнуюаа теоретическую и практическую базу, всеаа предыдущиеаа исследования
5
ограничивались только ?-концевым участком фермента, содержащим его полимеразный домен. С-концевой район фермента при этом оставался мало изученным с этой точки зрения. Отчасти это было обусловлено ограничениями коммерческих генотипических и фенотипических тест-систем, не включающих этот район в стандартные тесты (Petropoulos et al, 2000; Shafer et al., 2001; Turai et al., 2002), вследствие чего исследователям была доступна весьма ограниченная информация о последовательности этого района обратной транскриптазы. Таким образом, для прогнозирования результатов лечения и развития антивирусных препаратов нового поколения, которые позволят значительно усовершенствовать стратегии лечения ВИЧ- инфицированных, необходимо понимание функционирования обратной транскриптазы как единого целого, поэтому более углубленное исследование свойств обратной транскриптазы и механизмов, лежащих в основе лекарственной устойчивости, является актуальной задачей.
Цель и задачи исследования
Настоящая работа посвящена изучению свойств обратной транскриптазы ВИЧ-1, обеспечивающих высокую адаптогенность вируса, а именно способности генерировать мутации и активно рекомбинировать, а также исследованию механизмов лекарственной устойчивости ВИЧ-1 к нуклеозидным и ненуклеозидным ингибиторам обратной транскриптазы, позволяющих вирусу избегать воздействия лекарственных препаратов.
Для достижения поставленной цели необходимо было решить следующие основные задачи:
- Разработать ПЦР анализ, позволяющий определять количество копий специфической цепи ДНК вируса, реплицирующегося в культуре клеток и первичных лимфоцитах человека.
- Проанализировать с его использованием ранее недоступные для анализа параметры обратной транскрипции ВИЧ-1: скорость синтеза минус-цепи вирусной ДНК, переноса минус- и плюс-цепи ДНК, инициации синтеза плюс-цепи ДНК.
- Проанализировать влияние ингибиторов обратной транскриптазы ВИЧ-1 на синтез минус- и плюс-цепи ДНК.
- Разработать новые тесты для определения частоты смены матрицы и частоты мутирования обратной транскриптазой ВИЧ-1 на культуре клеток.
- Сконструировать мутантные вирусы и выявить функциональные и структурные детерминанты изменения частоты смены матрицы и частоты мутирования.
6
- Исследовать влияние мутаций С-концевого района обратной транскриптазы на лекарственную устойчивость ВИЧ-1.
- Сравнить лекарственную устойчивость референс-формы ВИЧ-1, принадлежащего подтипу В и CRF01AE.
- Сконструировать вирусы, содержащие обратную транскриптазу из вирусов пациентов, прошедших антиретровирусную терапию и наивных относительно лечения.
- Проанализировать эти вирусы на чувствительность к ингибиторам обратной транскриптазы и провести сравнительный анализ последовательности обратной транскриптазы.
- Идентифицировать мутации С-концевого района обратной транскриптазы из вирусов пациентов, ответственные за усиление лекарственной устойчивости.
- Провести теоретическое обоснование механизма лекарственной устойчивости, обеспечиваемое новыми мутациями обратной транскриптазы.
- Проверить основные положения предложенного механизма лекарственной устойчивости в экспериментах на культуре клеток и биохимических экспериментах.
Научная новизна и практическая значимость работы
Разработан новый ПЦР анализ для определения количества копий специфической ДНК цепи, представляющий собой уникальный подход к анализу репликации ВИЧ-1. С его использованием впервые определена скорость синтеза минус-цепи ДНК для ВИЧ-1 в культуре клеток и первичных CD4+T клетках, а также скорость переноса минус- и плюс-цепи ДНК и инициации синтеза плюс-цепи ДНК; впервые показано ex vivo, что инициация плюс-цепи ДНК ВИЧ-1 осуществляется на множественных сайтах. Впервые показано влияние ингибиторов обратной транскриптазы на кинетику синтеза минус-цепи ДНК.
Впервые исследованы структурные детерминанты обратной транскриптазы ВИЧ-1, отвечающие за изменение частоты смены матрицы и частоты мутирования. Показано, что замедление полимеризации как путем воздействий химическими соединениями, так и при мутации определенных участков фермента, участвующих в связывании с субстратом, приводит к увеличению частоты смены матрицы; снижение активности РНКазы снижает частоту смены матрицы. Показана корреляция между изменением частоты смены матрицы и частоты мутирования.
Предложен и обоснован новый механизм лекарственной устойчивости к нуклеозидным иаа ненуклеозиднымаа аналогам,аа обусловленныйаа мутациямиаа С-концевогоаа районаа обратной
7
транскриптазы, который отражает важную роль в лекарственной устойчивости ВИЧ-1 баланса между деградацией РНК-матрицы и NRTI-фосфоролизом /NNRTI-диссоциацией.
Впервые идентифицированы мутации в коннекторе обратной транскриптазы из вирусов пациентов, проходящих антивирусную терапию, которые обладают лекарственной устойчивостью как к NRTI, так и к NNRTI. Показано, что мутации коннектора ответственны за различия в лекарственной устойчивости референс-форм вируса, принадлежащего подтипу В и CEF01AE.
Новый механизм лекарственной устойчивости прошел тестирование и подтверждение на культуре клеток с использованием модельных мутаций вируса, мутаций, идентифицированных в обратной транскриптазе от вирусов пациентов, а также на биохимическом уровне.
Положения, выносимые на защиту:
- Новый ПЦР анализ позволяет определять количество копий специфической цепи ДНК ВИЧ-1, реплицирующегося в культуре клеток и первичных лимфоцитах человека.
- Скорость синтеза минус-цепи вирусной ДНК ex vivo составляет 68-70 нуклеотидов в минуту, перенос минус-цепи ДНК - 4 минуты, инициации синтеза плюс-цепи ДНК на полипуриновом тракте - 9 минут, и перенос плюс-цепи ДНК - 26 минут.
- Инициация синтеза плюс-цепи ДНК ВИЧ-1 осуществляется на множественных сайтах.
- Ингибиторы обратной транскриптазы ВИЧ-1 замедляют синтез минус-цепи ДНК.
- Созданные нами новые тесты на культуре клеток позволяют определять частоту смены матрицы и частоту мутирования обратной транскриптазы ВИЧ-1.
- Замедление полимеризации как путем воздействий химическими соединениями, так и при мутации определенных участков фермента, участвующих в связывании с субстратом, приводит к увеличению частоты смены матрицы; снижение активности РНКазы снижает частоту смены матрицы.
- Мутации в захватывающем праймер участке РНКазы ВИЧ-1 не меняют частоту мутирования за исключением позиции Q475A (увеличение частоты мутирования в 2 раза), в то время как четыре аминокислотные замены (S557A, A558V, Q559L и Y586F) в обратной транскриптазе другого ретровируса - вируса лейкемии мыши (MLV), увеличивают частоту мутирования от 2.1 до 5.4 раз.
- Мутации каталитически важных аминокислотных остатков РНКазы, а также захватывающегоаа праймераа участк РНКазыаа существенноаа снижаютаа чувствительность
8
вируса к ингибиторам обратной транскриптазы; сочетание этих мутаций с классическими лекарственно-устойчивыми мутациями ТАМ полимеразного домена приводит к кооперативному эффекту в увеличении лекарственной устойчивости к NRTI.
-а Мутации коннектора обратной транскриптазы селектируются в ответ на лечение NRTI и
NNRTI и усиливают лекарственную устойчивость.
- Мутации коннектора отвечают за различия в уровне лекарственной устойчивости референс-формы вируса подтипа В и CRF01AE.
- Мутации коннектора обратной транскриптазы обуславливают перекрестную устойчивость к разным классам ингибиторов обратной транскриптазы.
- Молекулярный механизм лекарственной устойчивости к нуклеозидным и ненуклеозидным ингибиторам обратной транскриптазы, обусловленный мутациями С-концевого района обратной транскриптазы, отражает важную роль в лекарственной устойчивости ВИЧ-1 баланса между деградацией РНК-матрицы и 1ЖТ1-фосфоролизом/№ЖТ1-диссоциацией.
Апробация работы
Представленные в диссертации результаты были доложены на различных конференциях и симпозиумах, в том числе на: Международных симпозиумах HIV DRP Symposium on Antiviral Drug Resistance (США, 2002, 2003, 2004, 2005, 2006, 2007, 2008), International HF/ Drug Resistance Workshop: Basic Principles & Clinical Implications (США, Испания 2004, 2005, 2006, 2007, 2008, 2009); 5th International Workshop on HIV Transmission (2009, Cape Town, South Africa); 13th HIV Dynamics and Evolution Meeting (2006, Woods Hole, MA, USA); Международных конференциях Cold Spring Harbor Retroviruses Meeting (США 2002, 2003, 2004, 2005, 2006, 2007, 2008, 2009), 47th InterScience Conference on Antimicrobial Agents and Chemotherapy (2007, Chicago, IL, USA), The Eleventh East Coast Retrovirus Meeting (2004, Palm Spring, CA, USA).
Работа выполнена в 2001-2011 годах в Национальном Институте Рака Национальных Институтов Здоровья США в рамках научного обмена и по грантам государственных научно-технических программ, а также в отделе биоинженерии ФБУН ГНЦ ВБ Вектор. На разных этапах ее выполнения в ней приняли участие как научные консультанты V.K. Pathak, заведующий подразделением вирусных мутаций (Chief of Viral Mutation Section, HF/ Drug Resistance Program, National Cancer Institute), J.M. Coffin, академик, профессор, советник директора программы лекарственной устойчивости ВИЧ-1 (Special Advisor to Director, Center
9
for Cancer Research, National Cancer Institute), S.H. Hughes, директор программы лекарственной устойчивости ВИЧ-1 (Director, HIV Drug Resistance Program National Cancer Institute), а также K.A. Delviks-Frankenberry, E.C. Сваровская, D.A. Thomas, J.L. Mbisa, E.A. Воронин, R. Barr, R. B. Lengruber и другие сотрудники, которым автор приносит искреннюю благодарность. По материалам диссертации опубликовано 20 работ в научных журналах, две из которых были названы в числе 5 ключевых публикаций в данной области исследований (PLOS Medicine, 2007 V 4(12), е346, р.2). Настоящая работа была отмечена дважды как выдающаяся Комитетом Национального Института Здоровья в 2007 и 2008 годах (Fellows Award for Research Excellence in Recognition of Excellence in Biomedicai Research, National Institutes of Health), а также завоевала награды за лучшую презентацию в 2006 и 2007 годах (10th and 11th Spring Research Festival, NCI-Frederick, 2006 and 2007).
Структура и объем диссертации
Диссертационная работа состоит из семи разделов: Общая характеристика работы, Обзор литературы, Материалы и методы, Результаты, Обсуждение, Выводы и Список литературы. Работа изложена на 182 станицах машинописного текста и включает 68 рисунков, 13 таблиц и список литературы, содержащий 308 ссылок.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Разработка нового ЦС-ПЦР анализа для определения количества копий
специфической ДНК цепи. Приложение разработанной технологии к обратной транскрипции ВИЧ-1 и механизму действия антивирусных препаратов.
Ретровирусы имеют сложный процесс репликации, преобразуя геномную РНК вируса в двуцепочечную ДНК, содержащую последовательности для контроля транскрипции и ДНК интеграции. Обратная транскриптаза - это фермент, который осуществляет репликацию генома ВИЧ-1, используя в качестве матрицы как РНК, так и ДНК, и расщепляя РНК в составе РНК-ДНК гибрида. Репликация генома ВИЧ-1 включает в себя синтез минус- и плюс-цепи нуклеиновой кислоты, которые невозможно было различить с помощью доступных на данный момент методов ПЦР. Мы разработали новый метод количественного ПЦР анализа, ЦС-ПЦР (Цепь Специфичная ПЦР) для детальной характеризации процесса
ЦС-ПЦР анализ основан на использовании одноцепочечных замок-проб, устроенных по принципу висячего замка (padlock), которые сначала специфически гибридизуются к ДНК цепи-мишени своими 3'- и 5'- концами, затем концы сшиваются, формируя кольцевую ДНК-пробу, которая далее амплифицируется в каскадной реакции амплификации - RCA (rolling-circle amplification). Количество копий продукта этой реакции определяется методом ПНР в реальном времени с использованием меченной флуоресцентной пробы (рис. 1 а).
В нашей работе было разработано 12 замок-проб, позволяющих измерять различные параметры репликации ВИЧ-1: кинетику переноса минус-цепи ДНК (проба 1 и 2), элонгации минус-цепи ДНК (проба 3, 4, 5 и 6), инициации синтеза плюс-цепи ДНК с полипуринового тракта - РРТ (polypurine tract; проба 2 и 7), и альтернативного центрального полипуринового тракта- сРРТ (central polypurine tract; проба 5 и 7), переноса плюс-цепи ДНК (проба 6 и 8), элонгации плюс-цепи ДНК (проба 8,9,11 и 12) и количественный анализ синтеза ДНК в районе центрального ДНК-флэпа (central DNA flap; проба 10), критичного для транспорта вирусной ДНК в клеточное ядро (рис. 1 б).
11
Эффективность и фоновый сигнал определяли в ЦС-ПЦР для каждой пробы индивидуально. Количество копий специфического ДНК-продукта достигало максимума к 6 часам после инфекции (2 х10 - 6x10 ) для всех проб. Фоновый сигнал для точки 0 часов составлял 100-1000 копий ДНК и не превосходил 1% специфического сигнала для всех проб. Для контроля эффективности и воспроизводимости очистки ДНК из каждого образца, использовали коррекцию на количество копий клеточного генома (PBDG ген). Воспроизводимость ЦС-ПЦР анализа была достаточно высока, и для большинства экспериментов разброс не превышал 20%. Для анализа и сравнения данных, полученных в независимых экспериментах, использовались стандартные кривые, генерируемые путем амплификации известного количества ДНК. Коэффициент корреляции стандартной кривой был > 0.99 для всех проб. Это говорит о том, что исходящий сигнал находится в линейной зависимости от количества внесенной в реакцию ДНК. Количества копий ранних продуктов синтеза вирусной ДНК, соответствующих району R-U5, были одинаковыми для ЦС-ПЦР и традиционного ПЦР в реальном времени. Исключение составляла точка 0 ч. Это связано с тем, что фоновый сигнал нашего теста варьировал от 100 до 1000 копий, а его чувствительность не позволяла определить менее 1000 копий ДНК.
Для изучения кинетики обратной транскрипции ex vivo культуру клеток инфицировали вирусом. Инфицированные клетки собирали каждые 30 минут в течение 6 часов для последующего выделения клеточной ДНК и анализа продуктов обратной транскрипции. В качестве контроля фонового сигнала использовали временную точку 0 ч. Количество продукта обратной транскрипции выражали относительно 6-часовой точки, принятой за 100%. Те значения, которые соответствовали менее чем 1%, принимали за 1% при построении графика в логарифмическом масштабе. Расстояние между кривыми для соответствующих пар проб, отражающими кинетику накопления продуктов обратной транскрипции, представляет оценку среднего времени, необходимого для копирования матрицы между двумя пробами. Среднее расстояние между линейными участками кривых определяли путем измерения расстояния при накоплении продукта в количествах 5, 10, 20 и 30% относительно максимального.
Характерный график кинетики синтеза минус-цепи ДНК показан на рис. 2. Горизонтальные линии между двумя кривыми соответствуют времени, необходимому для синтеза продукта размером в 7031 нуклеотид, которое составляет в среднем 104-105 минут, т.о. средняя скорость синтеза вирусной ДНК для данного примера составляет 67-68 нуклеотидов в минуту.
12
В результате анализа обратной транскрипции с использованием описанных выше проб, мы определили скорость синтеза минус-цепи ДНК в клетках 293Т и активированных человеческих CD4+ Т-лимфоцитах, которые являются главной мишенью ВИЧ-1. По результатам трех и более независимых экспериментов скорость синтеза составляла 6817 и 703 нуклеотидов в минуту, соответственно. При определении времени переноса
Данные по измерению скорости синтеза плюс-цепи ДНК явились для нас основанием четко заявить о наличии множественных сайтов инициации синтеза плюс-цепи ДНК, что подтверждает более ранние наблюдения (Klarmann et al., 1997; Miller et al, 1995). Принято, что существует два основных сайта инициации синтеза плюс-цепи ДНК: РРТ и сРРТ. Мы пранализировали скорость накопления продуктов синтеза плюс-цепи ДНК на участке генома между пробами 11 и 12, прилежащими к РРТ и пробами 8 и 9, прилежащими к сРРТ. Она была очень схожа, хотя расстояние между пробами существенно отличается и составляет 4000 н.о. и 2700 и.о., соответственно. Это говорит о наличии дополнительных сайтов инициации. Подтверждением этому служит также тот факт, что для вируса с мутированным сРРТ скорость накопления продуктов синтеза плюс-цепи ДНК упала только для пробы, расположенной в непосредственной близости от сРРТ, но не для более отдаленной,
13
для которой не существует классических сайтов инициации. По-видимому, праймерами дополнительных сайтов инициации плюс-цепи ДНК служат фрагменты РНК достаточной длины, которые все еще остаются связанными с минус-цепью ДНК. Однако в настоящее время остается неизвестным, сколько дополнительных сайтов инициации существует, представляют ли они специфические последовательности или РНК фрагменты, случайным образом ассоциированные с минус-цепью ДНК, и каким образом они избегают вытеснения ДНК синтезом, инициированным с вышенаходящихся сайтов.
Проба 10 была разработана для анализа центрального ДНК-флэпа, который участвует в транспорте преинтегразных комплексов в клеточное ядро (Sirven et al., 2000; Zennou et al., 2000). Мы продемонстрировали, что продукт ДНК, соответствующий пробе 10, синтезируется в количестве, превышающем остальные исследованные районы в 2-3 раза, что согласуются с формированием ДНК-флэпа. Эти данные подтверждают то, что разработанный нами новый тест является количественным методом детекции центрального ДНК-флэпа и может быть использован для анализа эффективности вытесняющего ДНК-синтеза в других районах генома ВИЧ-1.
В нашей работе мы впервые показали влияние антивирусных агентов на синтез плюс- и минус-цепи ДНК в клетках. Мы проанализировали три нуклеозидных аналога AZT, d4T и ddl и ненуклеозидный ингибитор EFV в концентрациях ингибирования вирусной репликации до 97-99%. Все использованные в этом исследовании ингибиторы оказывали минимальный эффект на ранний продукт синтеза минус-цепи ДНК (определенный с помощью пробы 3). В противоположность, поздний продукт синтеза минус-цепи ДНК (определенный с помощью пробы 6) накапливался по-разному: при обработке AZT и d4T, наблюдалось только 5% продукта относительно контроля, для ddl и EFV- 55 и 15%, соответственно. Таким образом, синтез минус-цепи ДНК значительно ингибировался AZT и d4T, в средней степени EFV, и минимально ddl. Ингибирование вирусной репликации было 97-99% для изученных ингибиторов, причем для AZT и d4T 95% ингибирования происходило при синтезе минус-цепи ДНК. Для ddl и EFV ингибирование при синтезе минус-цепи ДНК составляло 45% и 85%, соответственно, указывая на то, что эти соединения также в значительной степени должны ингибировать и синтез плюс-цепи ДНК.
ЦС-ПЦР анализ обратной транскрипции ВИЧ-1, разработанный нами в данном исследовании, представляет собой новый инструмент для изучения ранее недоступных для анализа аспектов вирусной репликации, связанных со специфической цепью ДНК. Этот метод значительноаа дополняетаа возможностиаа всехаа ранееаа разработанныхаа количественныхаа ПНР
14
технологий для измерения числа копий вируса (Cesaire et al., 2001; Palmer et al., 2003), копий интегрированного вирусного генома (Butler et al., 2001) и кинетики обратной транскрипции (Butler et al, 2001; Karageorgos et al, 1995; Victoria et al, 2003). Ha примере данного
ППч 7031 но. Ч>ж[а ]
PBS cPPTаа PPT

Время, часы Время, часы
Рис.3. Влияние ингибиторов обратной транскриптазы на синтез минус-цепи ДЬЖ. Показано накопление продуктов обратной транскрипции, определенных с помощью проб 3 и 6 в течение 6 часов, в отсутствии ингибитора и в присутствии ингибиторов в концентрациях блокирующих инфекцию на 95-99%.
исследования мы видим, что разработанный нами анализ открывает широкие перспективы для изучения влияния на кинетику обратной транскрипции специфических мутаций в вирусных белках (RT, NC, Vif, Vpr, Nef и т.д.), а также cis-элементов ( PBS, PPT, cPPT, CTS и т.д.). Он также может быть успешно использован для детального изучения репликации других вирусов.
2.аа Структурные и функциональные детерминанты обратной транскриптазы, влияющие на частоту смены матрицы и частоту мутирования.
Обратная транскриптаза не имеет корректирующей активности в процессе элонгации, поэтому ВИЧ-1 обладает высоким уровнем мутирования, что приводит к формированию генетического разнообразия внутри ретровирусной популяции. Другим важных механизмом возникновения генетического разнообразия и эволюции ретровирусной популяции является рекомбинация во время вирусной репликации (Burke, 1997; Temin, 1991). В результате рекомбинации и селективного давления значительная часть циркулирующих штаммов ВИЧ-1 являются рекомбинантами (Ни et al, 2003; McCutchan et al, 1992; Peeters and Sharp, 2000; Robertson et al., 1995). Рекомбинация приводит к быстрому возникновению вирусов, несущих множественные лекарственно-устойчивые мутации (Kellam and Larder, 1995; Moutouh et al, 1996; Zhuang et al., 2002). Рекомбинация происходит во время обратной транскрипции, когда обратная транскриптаза перепрыгивает с одной упакованной РНК на другую в процессе
В нашей работе мы проанализировали ряд факторов, которые могут влиять на частоту смены матрицы и частоту мутирования ВИЧ-1. Сначала было проанализировано влияние мутаций в каталитически активном сайте обратной транскриптазы, которые осуществляют ряд важных контактов с субстратом, на частоту смены матрицы. Связывание обратной транскриптазы с входящим dNTP и надлежащее спаривание с матрицей важны для формирования фермент-субстратного комплекса. Вирусы с такими мутациями в гене обратной транскриптазы, обладающие лекарственной устойчивостью, можно выделить как из пациентов в ответ на лечение, а также путем селекции in vitro. Наши результаты показали, что снижение связывания с субстратом посредством введения мутаций в фермент увеличивает частоту смены матрицы (рис. 5 а). Мы протестировали также одиночные мутации лекарственной устойчивости к нуклеозидным аналогам и их комбинации, которые расположеныаа ваа отдаленииаа отаа dNTP-связующегоаа сайта.аа Большаяаа частьаа изаа нихаа также
16
увеличивала частоту смены матрицы (рис. 5 б). Это указывает на то, что селекция лекарственно-устойчивых мутаций может влиять на уровень рекомбинации и эволюцию вируса. Мутации в каталитическом сайте РНКазы, наоборот, приводили к снижению частоты смены матрицы (рис. 5 в).
о4а а |а К|>5а | о^а Б о4аа В

Рис. 5. Влияние мутаций обратной транскриптазы ВИЧ-1 на частоту смены матрицы. А. Частота смены матрицы, наблюдаемая для обратной транскриптазы, содержащей мутации аминокислот, участвующих в непосредственном контакте с праймером, матрицей или входящим dNTP в районе каталитического сайта полимеразы. Контакты аминокислот с субстратом показаны на вставке. Б. Частота смены матрицы, наблюдаемая для лекарственно устойчивых мутаций к тимидиновым аналогам и M184V. В. Частота смены матрицы для мутаций каталитического сайта РНКазы.
Чтобы напрямую продемонстрировать, как изменение количественного соотношения полимеразной и РНКазнои активности влияет на способность обратной транскриптазы к смене матрицы, мы сконструировали фенотипически смешанные вирионы с измененным соотношением полимеразной и РНКазнои активностей, как было описано ранее (Brincat et al., 2002). Для продукции таких вирусных частиц использовали разные пропорции вирусной плазмидной ДНК, кодирующей обратную транскриптазу дикого типа и содержащую мутацию каталитически важной аминокислоты полимеразного или РНКазного каталитического сайта (D110E и E478Q, соответственно). Анализ таких вирионов показал, что снижение полимеразной активности приводит к увеличению частоты смены матрицы, а РНКазнои - к снижению. Воздействие на процесс полимеризации гидроксимочевиной, которая истощает нуклеотидный пул, а также использование ингибитора обратной транскрипции AZT и d4T (данные не представлены), приводило к увеличению частоты смены матрицы (рис. 6), как и в случае снижения полимеразной активности в описанных выше экспериментах. Таким образом, в данной работе мы продемонстрировали, что существует взаимосвязь между полимеразной и РНКазнои активностями, иа соотношение количества этих активностей является важным
17
фактором, определяющимаа частотуаа сменыаа матрицы, что согласуется саа механизмом динамического выбора матрицы (Svarovskaia et al, 2000).
v= 80 |
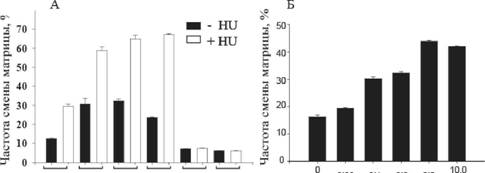 WT M184VK65R L74V D549NH539N
WT M184VK65R L74V D549NH539N
0.0Eаа 0.1аа 0.5аа 5.0
Концентрация AZT (??)
Рис. 6. Влияние гидроксимочевины (А) и ??? (Б) на частоту смены матрицы ВИЧ-1. А. Черные столбцы представляют собой среднюю частоту смены матрицы в отсутствии гидроксимочевины, а белые - в присутствии 0.2 мМ гидроксимочевины для 2-6 независимых экспериментов. В эксперименте использовали фермент дикого типа (WT), а также содержащий мутации полимеразного (M184V, K65R и L74V) и РНКазного (D549N, ?539?) доменов. Б. Изменение частоты смены матрицы в присутствии возрастающих концентраций ??? для обратной транскриптазы дикого типа.
С использованием теста для определения частоты мутирования мы выявили, что изменение соотношения активностей полимеразы и РНКазы также влияет на частоту мутирования. Снижение доли полимеразной активности приводило к снижению частоты мутирования ВИЧ-1, а снижение доли РНКазной активности не оказывало на нее влияния (рис. 7 а).
При выполнении этой части работы мы нашли высокую степень отрицательной корреляции между частотой смены матрицы и частотой мутирования для вирусов, содержащих мутации в каталитическом сайте полимеразы. Например, мутации Q151N, K65R и Ml 841 увеличивали частоту смены матрицы в 6, 2.7 и 2 раза, соответственно, при этом снижали частоту мутирования в 13, 8.1 и 4 раза, соответственно. Уровень корреляции между изменением частоты смены матрицы и частоты мутирования in vivo и in vitro составлял 89% и 88%, соответственно (рис. 7 б). Таким образом, снижение эффективности полимеризации увеличивает частоту смены матрицы и снижает частоту мутирования.
Мы сравнили захватывающий праймер участок РНКазы двух ретровирусов - ВИЧ-1 и вируса лейкемии мыши (MLV) - в тесте, определяющем частоту мутирования. Замены аминокислот захватывающего праймер участка РНКазы ВИЧ-1 не приводили к изменению частоты мутирования, за исключением мутации Q475A, в присутствии которой частота мутирования возрастала в 2 раза. Наоборот, замены четырех аминокислот захватывающего праймер участк РНКазыаа MLVаа приводили к существенномуаа увеличению частоты
18
мутирования от 2.1 до 5.4 раз. Исследование природы мутаций, вызываемых двумя мутантами MLV - Y586F и S557A, обнаружило большое количество замен в пределах 18 нуклеотидов от последовательностей А, ТТТТ или ААТТ,
называемых также A-тракт последовательности. Кроме того, большое количество мутаций было связано с прыжками обратной транскриптазы, включая значительную пропорцию делеций между PBS (primer binding site) и нижележащими последовательностями. Используя ПНР в реальном времени мы показали, что мутанты Y586F и S557A обладают дефектом при переносе плюс-цепи ДНК на другой конец генома, что приводит к возникновению делеций в процессе их репликации.
Повышенная склонность к ошибкам, проявляемая MLV мутантами Y586F и S557A, по-видимому, вызвана специфической конформацией субстрата, на котором обратная транскриптаза не способна функционировать корректно. Этот субстрат представляет собой РНК-ДНК-сшивку, согнутую в районе стыка ДНК и РНК, которая приводит к преждевременной терминации полимеризации этими мутантами. Это предположение подкрепляется тем фактом, что подобная же согнутая конформация свойственна протяженным последовательностям A-трактов (А, ТТТТ, ААТТ) (Crothers et al, 1990). Количество ошибок, совершаемых изученными мутантами в пределах 18 нуклеотидов от А-трактов, было значительно увеличено до 69% и 60% по сравнению с диким типом (50%) и случайным распределением (39%).
ВИЧ-1 и MLV значительно различаются между собой в отношении связывающего праймер участка РНКазы и его роли в точности копирования. Причиной таких различий, по-
19
видимому, служит структура обратной транскриптазы, которая является гетеродимером у ВИЧ-1 и мономером у MLV. ВИЧ-1 менее чувствителен к изменениям структуры связывающего праймер участка РНКазы, поскольку малая субъединица обратной транскриптазы ВИЧ-1 служит дополнительным структурным компонентом, обеспечивающим корректную третичную структуру. По-видимому, она также способствует коррекции различных конформаций нуклеиновых кислот и минимизации их влияния на конечный продукт обратной транскрипции. Интересно отметить, что частота встречаемости A-трактов в геноме MLV существенно ниже, чем в геноме ВИЧ-1, что, по-видимому, связано с различными способностями полимераз этих вирусов безошибочно преодолевать подобные последовательности.
Таким образом, разработанная нами система позволяет тестировать влияние различных факторов на частоту смены матрицы и частоту мутирования in vivo, которые являются важными свойствами обратной транскриптазы, влияющими на рекомбинацию и эволюцию вируса. Измерения частоты смены матрицы позволяют также оценить, полимеразная или РНКазная активности изменены относительно друг друга в интересующем нас условии или мутантном варианте вируса. Мы продемонстрировали, что изменение баланса между полимеразной и РНКазной активностью является причиной изменения частоты смены матрицы и частоты мутирования; снижение полимеризации увеличивает как частоту смены матрицы, так и точность копирования.
3. Новый механизм лекарственной устойчивости к NRTI и NNRTL
Обратная транскриптаза - многофункциональный фермент, в котором не только полимеразная, но и РНКазная активность выполняет важную роль в осуществлении и завершении репликации. Совокупность литературных данных о роли РНКазы в обратной транскрипции, а также результаты, полученные нами при изучении цепь-специфических аспектов репликации ВИЧ-1 и исследовании частоты смены матрицы привели нас к гипотезе, что РНКазная активность должна играть роль в развитии лекарственной устойчивости к ингибиторам обратной транскриптазы. Мы обнаружили, что такие ингибиторы как AZT и d4T, более подверженные фосфоролизу, терминируют вирусную репликацию в основном во время РНК-зависимой ДНК полимеризации. Мы также показали, что присутствие AZT и d4T увеличивает частоту смены матрицы, что означает изменение баланса между скоростью полимеризации и деградации РНК. Мы выдвинули гипотезу о том, что взаимодействие между включением ингибитора в ДНК-цепь, его фосфоролизом и активностью РНКазы критично как
20
для прерывания ВИЧ-1 репликации, так и продолжения репликации, или устойчивости к NRTI.
Нами был предложен новый механизм, который утверждает, что баланс между полимеризацией, РНКазной активностью и фосфоролизом является важной детерминантой лекарственной устойчивости (рис. 8). Согласно предложенной гипотезе, действию NRTI противостоят мутации обратной транскриптазы, работающие в соответствии с механизмом фосфоролиза, и тогда баланс между активностью РНКазы и эффективностью фосфоролиза становится важной детерминантой лекарственной устойчивости к этим препаратам. Реакция фосфоролиза включенного в ДНК нуклеозидного аналога - это критическая стадия, определяющая дальнейший успех обратной транскрипции в присутствии NRTI и, как следствие, выживаемость вируса. Поскольку фосфоролиз Ч это кинетически медленная реакция, обратная транскрипция останавливается до момента ее завершения, а в это время РНКаза продолжает разрушать РНК-матрицу. В зависимости от конкретного соотношения между активностью РНКазы и эффективностью фосфоролиза события могут развиваться по следующим сценариям.
Если РНК разрушена до такой степени, что фермент уже не может оставаться связанным с субстратом Ч РНК-ДНК-дуплексом Ч и реинициировать полимеризацию, то дуплекс диссоциирует и полимеризация прекращается, что приводит к гибели вируса (рис. 8, левая панель Ч чувствительный фенотип). Если фермент содержит мутации, ускоряющие фосфоролиз, то при завершении фосфоролиза полимераза еще связана с РНК-ДНК-дуплексом и полимеризация продолжается после разблокирования 3'-конца праймера, что приводит к устойчивому фенотипу для фермента, содержащего ТАМ. Мутации, снижающие активность РНКазы, увеличивают время жизни РНК-ДНК-дуплекса и тем самым позволяют продолжать полимеризацию после разблокирования праймера (рис. 8, правая панель - устойчивый фенотип). Таким образом, снижение активности РНКазы увеличивает пребывание блокированного полимеризационного комплекса в необходимой для возобновления полимеризации конформации - вплоть до завершения реакции фосфоролиза.
Для тестирования предложенного механизма были использованы модельные мутации каталитического сайта РНКазы обратной транскриптазы D549N и H539N, которые снижали активность РНКазы. Кроме этого, мы проверили нашу гипотезу с использованием фенотипически смешанных вирусных частиц, в которых активность РНКазы была снижена относительно полимеразной активности.
Мутации в коннекторе усиливают лекарственную устойчивость в присутствии ТАМ, а в отсутствии ТАМ их влияние на лекарственную устойчивость невелико (увеличение в 2-3 раза) в экспериментальных условиях, обеспечивающих один раунд репликации вируса в культуре клеток. Несмотря на это, даже относительно небольшое увеличение устойчивости может быть биологически значительным, если эти мутации возникают в начале лечения и до появления ТАМ. При анализе комбинированной группы из 920 последовательностей полноразмерной обратной транскриптазы, мы нашли, что мутации N3481 (Р=0.0464), A360V/T (Р=0.0219), N377V (Р=0.0192) и D488E (Р=0.0057) строго ассоциированы с лечением, и не зависят от присутствия ТАМ. Их возникновение в начале лечения может обеспечивать селективные преимущества во множественных циклах репликации вируса и способствовать последующей селекции ТАМ.
Вопрос о том, каким образом мутации в коннекторе обратной транскриптазы влияют на активность РНКазы или эффективность фосфоролиза (как в случае Т-ЗА) включенного нуклеозидного аналога, остается открытым. Для этого необходимы детальные исследования трехмерной структуры мутантных белков. Тем не менее, мы можем предположить, что аффинность обратной транскриптазы к гетеродуплексу матрица-праймер и точное положение гетеродуплекса относительно полимеразного и РНКазного каталитических сайтов может влиять на их активность. Кроме того возможно, что мутации могут также влиять и на формирование р66-р51 гетеродимера обратной транскриптазы и как следствие этого, оказывать воздействие на полимеразный и РНКазный сайты.
Важно отметить, что основная работа по дизайну лекарственных препаратов, исследованию клинических результатов и пониманию механизмов устойчивости проводится с использованием ВИЧ-1 варианта, принадлежащего к группе М, подтипу В, который распространен в США, Западной Европе и других развитых странах. Однако его глобальное представительство ограничено только десятью процентами. Для сравнения, подтип С составляет 50%, А - 12%, F, G, Н, К - 7%, CRF01_AE- 5%, CRF02_AG- 5%, D-3%, остальные - 8% (Hemelaar et al., 2006). Многочисленные данные указывают на то, что генетические барьеры для возникновения лекарственной устойчивости (Dumans et al., 2004), развитие
устойчивости при вертикальной трансмиссии (Eshleman et al., 2006; Eshleman et al., 2005), модуляция альтернативными мутациями, приспособленность и адаптационные свойства мутантных вирусов, а также успех лечения могут варьировать в зависимости от группы и подтипа вируса (Atlas et al., 2005; Ruelle et al., 2008). Хотя стандартные мутации устойчивости одинаковы, вклад новых мутаций, описанных для не В подтипов, нуждается в дальнейшем исследовании.
В нашей работе мы выявили, что подтип CRF01AE менее чувствителен к AZT, чем подтип В. Кроме того, мы впервые показали, что вирус CRF01AE, содержащий ТАМ, в 6 раз
31
более устойчив к ??? по сравнению с таким же вирусом подтипа В и что увеличение устойчивости главным образом происходит из-за присутствия треонина в позиции 400 коннектора подтипа CRF01AE. Для вируса подтипа В ранее было показано, что треонин в позиции 400 более часто встречается в вирусах выделенных пациентах, прошедших NRTI терапию: он присутствует в 43% вирусов от наивных относительно лечения и в 69% от прошедших NRTI терапию пациентов (Santos et al, 2008). Селекция Т400 в подтипе В ассоциирована с приобретением NRTI-устойчивых мутаций полимеразного домена. Мы проанализировали 140 доступных последовательностей обратной транскриптазы подтипа CRF01AE (база данных Стэнфордского университета; Stanford University HIV Drug Resistance Database, Мы исследовали молекулярный механизм, с помощью которого Т400 увеличивает устойчивость к AZT и нашли, что в присутствии Т400 обратная транскриптаза обладает усиленной способностью к фосфоролизу и синтезу полноразмерного продукта в сопряженной реакции фосфоролиза-элонгации, причем как на РНК-ДНК, так и на ДНК-ДНК субстрате. Это указывает на то, что эта мутация непосредственно влияет на фосфоролиз. Однако, и снижение активности РНКазы также может способствовать устойчивости, поскольку замена треонина 400 на аланин приводила к снижению активности РНКазы. Интересно отметить, что обратная транскриптаза вируса одного из пациентов (Т-3) обнаруживала аналогичные свойства относительно фосфоролиза и активности РНКазы.
Чтобы понять, каким образом замена Т400 может непосредственно усиливать фосфоролиз, мы проанализировали ее расположение в обратной транскриптазе подтипа В. Аминокислота 400 большой субъединицы фермента довольно удалена от каталитического сайта полимеризации (50В), каталитического сайта РНКазы (32В), матрицы (20В) и праймера (24В). Однако та же самая аминокислота в позиции 400 малой субъединицы фермента находится на расстоянии только 5В от К395 и 2.8В от Е396, которые принадлежат захватывающему праймер участку РНКазы иа способствуют правильному расположению
32
субстрата в активном сайте РНКазы (Sarafianos et al., 2001). Основываясь на местоположении аминокислоты 400 относительно аминокислот захватывающего праймер участка РНКазы, мы полагаем, что Т400 малой субъединицы влияет на расположение Е396 и возможно К395 относительно цепи праймера, и в результате смещает расположение субстрата как в полимеразном, так и в РНКазном сайте. Мы полагаем, что изменение расположения субстрата может приводить как к более эффективному фосфоролизу, так и уменьшенной активности РНКазы, что в конечном итоге увеличивает резистентность вируса к AZT.
Коммерческие тесты на лекарственную устойчивость включают только полимеразный домен из вируса пациента, который клонирован в составе вектора, содержащего коннектор и РНКазный домен обратной транскриптазы подтипа В (Petropoulos et al, 2000; Shafer et al, 2001; Turai et al., 2002). Как следствие, потенциальный вклад в резиситентность С-концевого района РНКазы не учитывается. Наш результат показал, что смешивание в одном вирусе полимеразного домена от вируса одного подтипа с коннектором и РНКазным доменом из вируса другого подтипа может привести к недооценке уровня устойчивости к AZT. Эти наблюдения указывают на то, что для правильной оценки лекарственной устойчивости необходима разработка генотипического и фенотипического анализа специфичного для подтипа вируса.
Мы идентифицировали мутации коннектора, которые усиливают устойчивость к NRTI, мы также обнаружили, что те же самые мутации усиливают устойчивость к NNRTI (рис. 16). Модельные мутации в РНКазном каталитическом сайте и в захватывающем праймер участке РНКазы также усиливали устойчивость к NNRTI. Кроме того, группами независимых исследователей было найдено несколько дополнительных мутаций С-концевого района, имеющих перекрестную устойчивость к обоим классам ингибиторов: АЗбОУЯ, G335C, Q475A, Y501 A, D549N (Nikolenko et al., 2010), N3481 (Gupta et al, 2006; Hachiya et al, 2008; Hachiya et al, 2009; Nikolenko et al, 2010; Yap et al, 2007), A376S (Hachiya et al, 2009; Nikolenko et al, 2010), Q509L (Hachiya et al, 2009), T369I (Gupta et al, 2006), E399D (Gupta et al., 2006; Poveda et al, 2008).
Основываясь на экспериментальных данных и ранее предложенном нами механизме лекарственной устойчивости к NRTI, обусловленном мутациями коннектора, мы предложили новый универсальный механизм устойчивости к NRTI и NNRTI (рис. 17). Мы полагаем, что существуют аналогичные этапы в обратной транскрипции, на которые влияют как NRTI так и NNRTI, и оба класса ингибиторов блокируют обратную транскриптазу путем формирования некомпетентногоаа каа полимеризацииаа комплекс обратнойаа транскриптазы,аа ингибитор и
33
субстрата, который после деградации РНК матрицы распадается, что приводит к прерыванию процесса обратной транскрипции. Чтобы полимеризация продолжилась, включенный NRTI должен претерпеть фосфоролиз, а связанный NNRTI - диссоциировать. Увеличение эффективности фосфоролиза, или снижение аффинности приводят к резистентности.
С другой стороны, снижение активности РНКазы также приводит к резистентности, поскольку субстрат остается недеградированным более длительное время и обратная транскриптаза способна реинициировать полимеризацию после высвобождения блокированного комплекса путем диссоциации или фосфоролиза ингибитора. Более существенный вклад в устойчивость вносит комбинация мутаций обратной транскриптазы, усиливающих фосфоролиз или снижающих аффинность и снижающих РНКазную активность. Таким образом, предлагаемый механизм объясняет, как одни и те же мутации С-концевого участка обратной транскриптазы, влияющие на активность РНКазы обеспечивают перекрестную устойчивость.
Анализ модельных мутаций, снижающих активность РНКазы, и их комбинации с мутациями NNRTI-связующего кармана (NNRTI-BP) показал, что аффинность NNRTI является важным фактором, определяющим, будет ли уменьшение активности РНКазы влиять на устойчивость. Так, мы показали, что дефектный в активности РНКазы мутант D549N увеличивал устойчивость к делавирдину и невирапину (низкоаффинные соединения), но не к эфавирензу и этравирину (высокоаффинные соединения). Однако при его комбинации с мутациями полимеразного домена, снижающими аффинность к эфавирензу и этравирину, наблюдалось еще большее увеличение устойчивости к эфавирензу и этравирину (рис. 18). Таким образом, баланс между аффинностью ингибитора к обратной транскриптазе и деградацией РНК-матрицы является важным фактором лекарственной устойчивости.
Влияние снижения активности РНКазы на уровень лекарственной устойчивости к разным классам ингибиторов отличается. Например, только 2 из 10 мутаций захватывающего праймер участка РНКазы увеличивали устойчивость к NNRTI (Q475A и Y501A), по сравнению с NRTI (G359A, А360К, К390А, К395А, Е396А, Т473М, Q475A, К476А, Y501A и I505A). Мы показали, что для мутантов захватывающего праймер участка РНКазы существует корреляция увеличения уровня устойчивости с частотой смены матрицы, или снижением активности РНКазы. Мутанты Q475A и Y501A, которые проявляли устойчивость к NNRTI, обладали самым высоким уровнем устойчивости к AZT, указывая на то, что для усиления NNRTI устойчивости необходимо существенное снижение активности РНКазы. Увеличение устойчивости к NNRTI мутациями коннектора намного ниже влияния
Таким образом, в нашей работе мы впервые целенаправленно обратились к поиску мутаций С-концевого участка обратной транскриптазы, ассоциированных с лечением и обладающих резистентностью к ингибиторам обратной транскриптазы. Мы впервые показали, что мутации коннектора селектируются в ответ на антиретровирусное лечение и это приводит к усилению лекарственной устойчивости. Следует отметить, что выбор группы пациентов, прошедших лечение и наивных относительно терапии, был случайным, тем более интересно то, что в пяти случаев из семи, нами было обнаружено увеличение лекарственной устойчивости, обусловленное мутациями С-концевого района обратной транскриптазы. Присутствие этих мутаций в коннекторе, а не в РНКазном домене, может объясняться, во-первых, небольшой выборкой пациентов, а во-вторых тем, что этот район, по-видимому, менее критичен для потери вирусом жизнеспособности, что благоприятствует селекции мутаций. С другой стороны, селекция мутаций в этом районе не противоречит предложенному механизму. В коннекторе расположены аминокислоты захватывающего праймер участка РНКазы, важные для правильного расположения субстрата в сайте РНК-гидролиза. Одна из привлекательных гипотез, каким образом эти мутации влияют на активность РНКазы - это изменение ими прямо или опосредованно захватывающего праймер участка РНКазы, который корректно устанавливает субстрат в активном сайте РНКазы. Так, исследование аланиновых замен 11 аминокислот захватывающего праймер участка РНКазы
37
показало, что 10 из них усиливают устойчивость к ??? в контексте полимеразного домена, содержащего ТАМ, достигая превышения в устойчивости до 243 раз по сравнению с ТАМ контролем, который был лишь в 9 раз более резистентным, чем вирус дикого типа.
Предлагаемый нами механизм перекрестной устойчивости к NRTI и NNRTI объясняет, каким образом те же самые мутации С-концевого района обратной транскриптазы увеличивают устойчивость к структурно и функционально различным ингибиторам обратной транскриптазы. Новый механизм лекарственной устойчивости отражает важную роль в обеспечении лекарственной устойчивости баланса между деградацией РНК-матрицы и NRTI-фосфоролизом/NNRTI-диссоциацией. Это подчеркивает важность взаимодействий между разными функциональными доменами обратной транскриптазы, которые играют значительную роль в эволюции лекарственной устойчивости.
ВЫВОДЫ
1.аа Разработан новый ЦС-ПЦР анализ для определения количества копий специфической
цепи ДНК ВИЧ-1, который позволяет установить ранее недоступные для анализа
параметры обратной транскрипции ВИЧ-1 на культуре клеток, с использованием
которого впервые показано, что:
- скоростьаа синтезаа минус-цепиа ДНКа дляа ВИЧ-1аа ва культуреа клетока 293Таа и первичных CD4+T-лимфоцитах составляет 68-70 нуклеотидов в минуту;
- перенос минус-цепи ДНК составляет 4 минуты, а перенос плюс-цепи ДНК - 26 минут;
- инициации синтеза плюс-цепи ДНК с главного сайта инициации РРТ составляет 9 минут; а с альтернативного сРРТ- 28 минут;
- инициация синтеза плюс-цепи ДНК осуществляется на множественных сайтах;
- ингибиторы обратной транскриптазы ??? и d4T замедляют главныма образом кинетику синтеза минус-цепи ДНК.
2.аа Разработан новый тест на культуре клеток для определения частоты смены матрицы
обратной транскриптазой ВИЧ-1, с использованием которого впервые показано, что
смена матрицы ВИЧ-1 происходит по механизму динамического выбора, согласно
которому снижение полимеразной активности приводит к увеличению частоты смены
матрицы, а снижение РНКазной активности приводит к уменьшению частоты смены
матрицы.
38
- Впервые показано, что лекарственно-устойчивые мутации обратной транскриптазы ВИЧ-1 увеличивают частоту смены матрицы, что может способствовать приобретению множественных лекарственно-устойчивых мутаций.
- Впервые показана высокая корреляция до 89% между частотой смены матрицы и точностью копирования in vivo и in vitro для мутаций каталитического сайта полимеразы ВИЧ-1.
- Предложен и обоснован новый механизм лекарственной устойчивости к нуклеозидным и ненуклеозидным аналогам, обусловленный мутациями С-концевого района обратной транскриптазы, который отражает важную роль в лекарственной устойчивости ВИЧ-1 баланса между деградацией РНК-матрицы и ]ЧЯТ1-фосфоролизом/№ЖТ1-диссоциацией:
- присоединение NRTI к праймеру/связывание обратной транскриптазы с NNRTI приводит к остановке полимеризации и формированию некомпетентного к полимеризации комплекса;
- снижение активности РНКазы обеспечивает продление времени для осуществления 1Ч]^Т1-фосфоролиза/]Ч]М]^Т1-диссоциацииа иаа дальнейшей реинициации полимеризации;
- аффинность обратной транскриптазы к NNRTI является критическим фактором, определяющим, в какой степени снижение активности РНКазы за счет мутаций может усиливать лекарственную устойчивость.
- Впервые показано, что мутации С-концевого домена обратной транскриптазы, увеличивающие устойчивость к NRTI и NNRTI, селектируются в вирусах пациентов, проходящих антивирусную терапию; идентифицированы новые мутации в коннекторном участке обратной транскриптазы от вирусов пациентов, способствующие лекарственной устойчивости к NRTI: E312Q, G335C/D, N3481, А360УЯ, V365I, A376S, а также и к NNRTI: G335C, N3481, А360УЯ и A376S.
- Впервые показано, что новые мутации в коннекторном участке обратной транскриптазы обладают сниженной активностью РНКазы in vivo и in vitro и усиленной способностью к фосфоролизу на РНК матрице в соответствии с предложенным механизмом лекарственной устойчивости.
- Впервые показано, что в контексте ТАМ лекарственная устойчивость к AZT референс-штамма вируса подтипа CRF01_AE в 6 раз выше чем референс-штамма вируса подтипа В ВИЧ-1, что обусловлено присутствием мутации коннектора А400Т.
39
9. Впервые показано, что мутации N3481, A360V/T, N377V и D488E ассоциированы с лечением, а мутации N3481, R358K, G359S, A360V, V365I, А371V, K451R и K512R - с присутствием ТАМ в группе прошедших терапию пациентов.
Список работ, опубликованных по материалам диссертации
- Г.Н. Николенко, А.Т. Котелкин, С.Ф. Орешкова, А.А. Ильичев. Механизмы лекарственной устойчивости ВИЧ-1 к нуклеозидным и ненуклеозидным ингибиторам обратной транскриптазы.//Мол. Биология. 2011; 45(1):108-26.
- R. В. Lengmber, K.A. Delviks-Frankenberry, G. N. Nikolenko, J. Baumann, A. F. Santos, V. K. Pathak, and M. A. Soares. Phenotypic characterization of drug resistance-associated mutations in HTV-1 RT connection and RNase H domains and their correlation with thymidine analogue mutations. //J. Antimicrob. Chemotherapy. 2011. 66(4): 702-8.
- G.N. Nikolenko, K. A. Delviks-Frankenberry, and V.K. Pathak. A Novel Molecular Mechanism of Dual Resistance to Nucleoside and Nonnucleoside reverse transcriptase inhibitors. //J.Virol. 2010. 84(10), p. 5238-49.
- K. A. Delviks-Frankenberry, G. N. Nikolenko, and V. K. Pathak. The "Connection" Between FHV Drug Resistance and RNase H.// Viruses. 2010. 2(7). p. 1476-1503.
- K.A. Delviks-Frankenberry, G. N. Nikolenko, F. Maldarelli, S. Hase, Y. Takebe, and V. K. Pathak. Subtype-specific differences in the HTV-1 reverse transcriptase connection subdomain of CRFOIAE are associated with higher AZT resistance.// J.Virol. 2009. 83(17). p. 8502-13.
- G.N. Nikolenko, K.A. Delviks-Frankenberry, and V.K. Pathak. A Novel Molecular Mechanism of Dual Resistance to Nucleoside and Nonnucleoside Reverse Transcriptase Inhibitors.// Antiviral Therapy 2009;14: S123.
- K.A. Delviks-Frankenberry, G.N. Nikolenko, F. Maldarelli, S. Hase, Y. Takebe, and V.K. Pathak. Subtype-Specific Amino Acid Polymorphisms in the HTV-1 Reverse Transcriptase Connection Subdomain of CRFOIAE are Associated with Higher 3'-Azido-3'-Deoxythymidine Resistance.// Antiviral Therapy 2009;14: S124.
- K. A. Delviks-Frankenberry*, G. N. Nikolenko*, P.L. Boyer, S.H. Hughes, J.M. Coffin, A. Jere, and V. K. Pathak. HIV-1 reverse transcriptase connection domain mutations reduce template RNA degradation and enhance NRTI excision.// Proc. Nati. Acad. Sci. USA 2008, 105(31), p. 10943-8 * K.A.D-F. and G.N.N. share co-authorship of this paper.
- G. N. Nikolenko, K. A. Delviks-Frankenberry , AJere, and V. K. Pathak. Mutations in the reverse transcriptase connection and RNAse H domains exhibit dual resistance to nucleoside and non-nucleoside reverse transcriptase inhibitors. // Antiviral Therapy 2008;13: A55.
- G. N. Nikolenko, K. A. Delviks-Frankenberry, P.L. Boyer, S.H. Hughes, J.M. Coffin, A. Jere, and V. K. Pathak. HIV-1 reverse transcriptase connection domain mutations reduce template RNA degradation and enhance NRTI excision. // Antiviral Therapy 2008;13: A60.
- G. N. Nikolenko*, K.A. Delviks-Frankenberry*, S. Palmer, F. Maldarelli, M. J. Fivash Jr., J.M. Coffin, and V. K. Pathak. Mutations in the connection domain of HrV-1 reverse transcriptase increase 3'-azido-3'-deoxythymidine resistance.// Proc. Nati. Acad. Sci. USA 2007. 104(1). P. 317-322. *G.N.N. and K.A.D-F. share co-authorship of this paper.
40
- К. A. Delviks-Frankenberry, G. N. Nikolenko, R. Barr, and V. К. Pathak. Probing the Mechanism by Which Connection Domain Mutations Enhance AZT Resistance: Mutational Analysis of the RNase H Primer Grip. // Antiviral Therapy 2007;12: S125.
- K. A. Delviks-Frankenberry, G. N. Nikolenko, R. Barr, and V. K. Pathak. Mutations in human immunodeficiency virus type-1 RNase H primer grip enhance 3'-azido-3'-deoxythymidine resistance.//J. Virol. 2007. v.81 (13). P.6837-45.
- D.C. Thomas, Y.A.Voronin, G. N. Nikolenko, J. Chen, W. S. Hu, and V. K. Pathak. Determination of the ex vivo rates of HTV-1 reverse transcription using novel strand-specific amplification (SSA) analysis.// J. Virol. 2007. v.81 (9). P.4798-807.
- G. N. Nikolenko, K. A. Frankenberry, S. Palmer, F. Maldarelli, J.W Mellors, J.M. Coffin, and V. K. Pathak. The HTV-1 reverse transcriptase connection domain from treatment-experienced patients contributes to AZT resistance.// Antiviral Therapy 2006; 11 :S142.
- G. N. Nikolenko, S. Palmer, F. Maldarelli, J.W Mellors, J.M. Coffin, and V. K. Pathak. Mechanism for nucleoside analog-mediated abrogation of HTV-1 replication: balance between RNase H activity and nucleotide excision. // Proc. Nati. Acad. Sci. USA 2005. V. 102 (6). P. 2093-2098.
- J.L. Mbisa, G.N. Nikolenko, and V.K. Pathak. Mutations in the RNase H primer grip domain of murine leukemia virus reverse transcriptase decrease efficiency and accuracy of plus-strand DNA transfer.// J Virol. 2005. V. 79 (1). P. 419-427.
- G. N. Nikolenko, K. A. Frankenberry, S. Palmer, F. Maldarelli, J.W Mellors, J.M. Coffin, and V. K. Pathak. RNase H domains obtained from treatment-experienced patients increase resistance to AZT. // Antiviral Therapy 2005; 10:S89.
- G. N. Nikolenko, S. Palmer, F. Maldarelli, J.W Mellors, J.M. Coffin, and V. K. Pathak. Mutations in HTV-1 RNase H domain confer high-level resistance to nucleoside reverse transcriptase inhibitors and provide novel insights into the mechanism of nucleotide excision-mediated drug resistance. // Antiviral Therapy 2004; 9:S26.
- G N. Nikolenko, E.S. Svarovskaia, K. A. Delviks, and V. K. Pathak. Antiretroviral drug resistance mutations in human immunodeficiency virus type 1 reverse transcriptase increase template-switching frequency.// J. Virol. 2004. V. 78 (16) p. 8761-8770.
 Все авторефераты докторских диссертаций
Все авторефераты докторских диссертаций
