 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Разработка методов и средств обеспечения микробиологической безопасности объектов ветеринарного надзора
Автореферат кандидатской диссертации
аа На правах рукописи
Артемов Артем Валерьевич
Разработка методов и средств обеспечения микробиологической безопасности объектов ветеринарного надзора
06.02.05 - ветеринарная санитария, экология, зоогигиена и
ветеринарно-санитарная экспертиза
06.02.02 - ветеринарная микробиология, вирусология, эпизоотология, микология с микотоксикологией и иммунология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Москва - 2012
Работа выполнена в отделе технического регулирования, стандартизации и сертификации Государственного научного учреждения Всероссийский научно-исследовательский институт ветеринарной санитарии, гигиены и экологии Российской академии сельскохозяйственных наук (ГНУ ВНИИВСГЭ Россельхозакадемии).
Научные руководители: аа
доктор биологических наук,а профессор
Светличкин Вячеслав Владимирович,
адоктор биологических наук
Ярков Сергей Петровичаа
Официальные оппоненты: аБутко Михаил Павлович
заслуженный деятель науки РФ,
доктор ветеринарных наук, профессор. а
ГНУ ВНИИВСГЭ Россельхозакадемии, а
заведующий лабораторией ветсанитарииа а
на госгранице, транспорте
и мясоперерабатывающих предприятиях
Хоменец Николай Геннадиевич
кандидат биологических наук,а ааа
ФГБОУ ВПО РУДН, старший
преподаватель кафедры стандартизации,
сертификации и аветсанэкспертизы
Ведущая организация: ФГБОУ ВПОа Московский государственный университет пищевых производств (ФГБОУ ВПОа МГУ ПП)
Защита состоится л__________ 2012 г. в ____ часов на заседании диссертационного советаа Д. 006.008.01. при ГНУ Всероссийский научно-исследовательский институт ветеринарной санитарии, гигиены и экологии Россельхозакадемии (ГНУ ВНИИВСГЭ Россельхозакадемии) по адресу: 123022, г. Москва, Звенигородское шоссе, 5.
С диссертацией можно ознакомиться в библиотеке ГНУ Всероссийский научно-исследовательский институт ветеринарной санитарии, гигиены и экологии Россельхозакадемии (ГНУ ВНИИВСГЭ Россельхозакадемии) по адресу: 123022, г. Москва, Звенигородское шоссе, 5.
Автореферат разослан л___ _____________ 2012 г.
Ученый секретарь
диссертационного совета,
кандидат биологических наука аКрутько Н.С.
1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Среди различных аспектов обеспечения безопасности объектов ветеринарного надзора значительная роль принадлежит контролю микробных контаминаций и биоцидной обработке этих объектов.
Разработка и совершенствование методов и средств указанных элементов безопасности cвязаны с достижениями различных сопряженных наук, в том числе с молекулярной биологией, иммунологией, нанотехнологией и ее разделом бионанотехнологией.
В современном представлении нанотехнология - это наука и технология коллоидных систем, коллоидная химия, коллоидная физика, молекулярная биология, микроэлектроника. Функционирование систем нанотехнологии отличается от функционирования истинных растворов и расплавов и от объектов макромира благодаря высокоразвитой поверхности. Такие эффекты начинают проявляться, когда размер частиц лежит в диапазоне 1 - 100 нанометров.
Бионанотехнология является разделом
Определенные перспективы бионанотехнологии связаны с обеспечением здоровья животных и безопасности объектов ветеринарного контроля. Широко применяемые в настоящее время антибиотики, в том числе и при откорме животных, способствуют распространению устойчивых штаммов бактерий. Остаточные количества антибиотиков накапливаются в тканях животных и в дальнейшем, попадая с пищей к человеку, оказывают негативное влияние на его здоровье. Используемые в ветеринарии дезинфектанты на основе различных химических соединений могут также отрицательно влиять на здоровье животных, человека и окружающую среду. В связи с этим актуальным является поиск новых экологичных биоцидных средств. Новые бактерицидные средства создаются на основе использования наночастиц. Так, например, показано применение наночастиц серебра при очистке воды и воздуха, или при дезинфекции одежды и спецпокрытий. Бионанотехнология имеет весьма значительные перспективы в ветеринарии (Смирнов А.М. и др., 2011). Наносеребро использовалось при создании лекарственных средств для животных (Уша Б.В. и др., 2011). Получены экспериментальные электронно-микроскопические данные по изучению механизма действия наносеребра на бактериальные клетки (Павлова И.Б. и др. 2010). Иммунохроматографические элементы применялись при ветеринарно-санитарном контроле производства мясных консервов (Горобчук Е.А., 2010).
Дальнейшее изучение возможности применения достижений бионанотехнологии в ветеринарии, создание новых методов и средств обеспечения и контроля безопасности объектов ветеринарного надзора, их адаптация к конкретным объектам весьма актуально для науки и практики.
Цель исследования
Цель настоящей работы - разработка методов и средств для обеспечения микробиологической безопасности некоторых объектов ветеринарного надзора.
Задачи исследования
- Изучить возможность отечественного экспериментального препаратаа кластерного серебра Серебряный щит для применения его в качестве биоцидного средства в ветеринарии.
- Разработать тест-систему индикации сальмонелл различных серогрупп с помощью иммунохроматографических индикаторных элементов (ИИХЭ) с наночастицами коллоидного золота, определить чувствительность и специфичность тест-системы.
- Разработать методику и тест-систему индикации возбудителей бактериальных инфекций на основе ПЦР и биочипов, определить чувствительность и специфичность методики и тест-системы.
- Разработать методические рекомендации по применению индикаторных иммунохроматографических элементов для выявления возбудителей инфекционных заболеваний в объектах ветеринарного надзора.
а Основные положения, выносимые на защиту
1. Биоцидные характеристики отечественного экспериментального препарата Серебряный щит на основе кластерного серебра.
2. Тест-система индикации сальмонелл различных серогрупп с помощью иммунохроматографических индикаторных элементов (ИИХЭ) с наночастицами коллоидного золота.
3.а Тест-система и методикаа индикации возбудителей бактериальных инфекций на основе ПЦР и биочипов.
Научная новизна
Проведенными опытами изучено бактериостатическое, бактерицидное действие отечественного экспериментального препарата кластерного серебра Серебряный щит на грамположительные и грамотрицательные бактерии (Staphylococcus aureus, Esсherichia coli, Proteus vulgaris, Proteus mirabilis, Pseudomonas aeruginosa, Salmonella enteritidis), а также дезинфицирующее действие препарата в отношении золотистого стафилококка и кишечной палочки, искусственно нанесенных на поверхности различных материалов (керамическая, кафельная плитки, резина).
На основе проведенных исследований разработана тест-система индикации сальмонелл серогрупп (А, В, С, D, Е) с помощью иммунохроматографических индикаторных элементов (ИИХЭ) с наночастицами коллоидного золота. Определены чувствительность (1х107 м.к./мл) и специфичность тест-системы, позволяющая проводить индикацию сальмонелл различных серогрупп при наличии сопутствующей микрофлоры (шигеллы, эшерихии).
На основе проведенных исследований разработаны тест-система и модифицированная методика на основе ПЦР и ДНК-чипов для индикации возбудителей бактериальных инфекций (Salmonella typhimurium, Escherichia coli, Yersinia enterocolitica, Staphylococcus aureus). Определена чувствительность методики (102 - 103 клеток в пробе) и специфичность (возможность проведения анализа без предварительного обогащения и при наличии сопутствующей микрофлоры).
Экспериментально обоснована возможность применения препарата кластерного серебра Серебряный щит и разработанных тест-система по индикации патогенной микрофлоры для обеспечения ветеринарно-санитарной безопасности предприятий мясоперерабатывающей промышленности (хладокомбинатов, цехов), а также хранящегося мяса.
Практическая ценность
На основании результатов исследований разработаны:
- Методические рекомендации по применению индикаторных иммунохроматографических элементов для выявления возбудителей инфекционных заболеваний в объектах ветеринарного надзора, утвержденные Отделением ветеринарной медицины Россельхозакадемии 30.09.2009 г.
Публикации
По теме диссертации опубликовано 5 работ, 4 из них - в журналах, рекомендованных ВАК РФ.
Апробация работы. Материалы диссертации доложены и обсуждены:
- на Международной научной конференции студентов и молодых ученых Экологически безопасные ресурсосберегающие технологии и средства переработки сельскохозяйственного сырья и производства продуктов питания, МГУПБ (2009 г.);
- на заседании Ученого совета ГНУ ВНИИВСГЭ (2011 г.);
- на расширенном совещании сотрудников лабораторий ГНУ ВНИИВСГЭ Россельхозакадемии (2011 г.).
Структура и объем работы
Диссертация изложена на 110 страницах машинописного текста, содержит 10 таблиц, 8 рисунков. Диссертация состоит из введения, обзора литературы, собственных исследований и их результатов, обсуждения результатов, выводов, списка литературы, включающего 156 источников (51 отечественных, 105 зарубежных) и приложения.
2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
- аа2.1. Материалы и методы исследований
Исследования проводили в период с 2008 г. по 2012 г.
Работа выполнена в отделе технического регулирования, стандартизации и сертификации ГНУ ВНИИВСГЭ Россельхозакадемии. Часть экспериментальных исследований была проведена с использованием материально-технической базы ФГУП ГосНИИ БП.
В работе использовались препараты наносеребра с размерами частиц аа7 - 10 нм (производства Фрактал-М, Россия), иммунохроматографические индикаторные элементы на сальмонеллы, система для выделения ДНК Silico. В опытах были использованы музейные штаммы культур ГНУ ВНИИВСГЭ. При разработке иммунохроматографической тест-системы использовались инактивированные нагреванием бактериальные культуры сальмонелл различных серологических типов: S. paratyphi A 225, S. typhimurium, S. heidelberg 1150, S. cholerasuis 595, S. newport, S. typhi 33, S. enteritidis 17, S. anatum 161 из коллекции Санкт-Петербургского НИИ вакцин и сывороток, а также культуры S. paratyphi B yava 04 №4839, S. paratyphi B 4219, S. typhimurium 04 № 4836 из коллекцииа ГНЦа прикладной микробиологии и биотехнологии Роспотребнадзора. Для контроля специфичности теста использовали инактивированные суспензии микробных клеток шигелл в буфере для хроматографического анализа: Sh. sonnei, Sh. dysenteriae 214662, Sh. flexneri 3a 1289, Sh. flexneri 2a 1270, Sh. flexneri 1a 8516, Sh. flexneri 6, Sh. newcastle 8655, Sh. flexneri 5x(-) 199, Sh. flexneri 4a 1032 а(Санкт-Петербургский НИИ вакцин и сывороток), микробные клетки кишечной палочки (E. coli, штамм WATCC 9637 Sigma, кат. № ЕС-9637) в концентрации а1 х 107 м.к./мл, а также холерную вакцину ФС 42-3676-98 производства ФГУЗ РосНИПЧИ Микроб (Саратов).
Амплификацию проводили на термоциклире Mastercycler epgradient S eppendorf realpleax2, использовали праймеры, дезоксинуклеозидтрифосфаты и ДНК-полимераза фирмы Интерлабсервис (Россия). Для методов бактериологического анализа использовали хромогенные питательные среды RidaCount (Германия).
Статистическая обработка результатов проводилась по Стьюденту.
2.2. Результаты исследований
2.2.1. Изучение биоцидных свойств препаратов кластерного серебра Серебряный щит
Целью первого этапа наших исследований было изучение биоцидных свойств препарата наносеребра отечественного производства (кластерное серебро Фрактал-М). Бактерицидную активность препарата определялиа методом диффузии в агар.
Для определения бактерицидной активности препарата использовали следующие тест-культуры: Staphylococcus aureus, Esherichia coli, Proteus vulgaris, Proteus mirabilis, Pseudomonas aeruginosa, Salmonella enteritidis.
Выбор перечисленных микроорганизмов был продиктован теми обстоятельствами, что в качестве тест-культуры для бактерий рекомендована Esherichia coli, для вирусов - Staphylococcus aureus. Кроме того, безусловный интерес представляла оценка бактерицидной активности препарата в отношении протея и синегнойной палочки, так как они часто присутствуют на объектах окружающей среды и представляют потенциальную угрозу для макроорганизмов. Также актуальным является выбор экологически безопасных дезинфицирующих средств в отношении сальмонелл, так как продовольственное сырье, особенно мясо птицы, нередко контаминированы этими бактериями.
Культуры микроорганизмов выращивали на скошенном мясо-пептонном агаре при 37 С в течение 24 часов. Готовили серийные разведения культур в физиологическом растворе до 106а м.к./мл. По 1 мл каждой культуры смешивали с 10 - 12 мл расплавленного и остуженного до 45 С мясо-пептонного агара и выливали в чашку Петри (глубинный посев). В лунки агара вносили испытуемые растворы, содержащие различные концентрации серебра. Учет производили по зоне задержки роста культуры, спустя 24 часа инкубирования посевов при 37 С. Опыты проводились в пяти повторностях.
Препарат Серебряный щит в концентрациях 5 - 10 мг/л оказывал бактериостатическое действие и при более высоких концентрациях 20 - 40 мг/л - бактерицидное действие в отношении грамположительной и грамотрицательной микрофлоры (Staphylococcus aureus, Esherichia coli, Proteus vulgaris, Proteus mirabilis, Pseudomonas aeruginosa, Salmonella enteritidis).
Дезинфицирующие свойства препарата определяли в опытах с искусственно контаминированными бактериями золотистого стафилококка и кишечной палочки тест-объектами из различных материалов. Тест-объекты представляли собой стерильные пластины размером 10 х 10 см2 из дерева, керамической плитки, кафельной плитки и резины. Суточные культуры перечисленных выше микроорганизмов в концентрации 106 м.к./мл наносили в количестве 1 мл на указанные поверхности и подсушивали при комнатной температуре в стерильных условиях. После полного высыхания на поверхность искусственно контаминированных тест-объектов наносили по 5 мл препарат Серебряный щит, что составляет расход при влажной дезинфекции 0,5 л/м2. Время воздействия составило 3 часа. По окончании экспозиции производили смыв стерильными ватными тампонами с каждого тест-объекта в стерильный физиологический раствор с последующим десятикратным разведением материала для прекращения действия препарата кластерного серебра, т. е. нейтрализации. Контролем при этом служили смывы с искусственно контаминированных тест-объектов, обработанных водой. Затем производили высев опытного и контрольного материала в мясо-пептонный бульон, посевы инкубировали в течение 5 суток при 37 С, просматривая посевы каждые сутки. В таблицах 1 и 2 представлены данные по дезинфицирующей активности препаратов кластерного серебра. а
Таблица 1
Дезинфицирующая активность в отношении золотистого стафилококка препарата Серебряный щит, содержащего кластерное серебро в концентрации 40 мг/л
Тест-объекты |
Результаты бактериологического анализа (наличие роста в мясо-пептонном бульоне) |
|||
аа ааВремя наблюденияа |
||||
24 часа |
48 часов |
72 часа |
5 суток |
|
Дерево |
_ |
+ |
+ |
+ |
Кафельная плитка |
_ |
_ |
_ |
_ |
Керамическая плитка |
_ |
_ |
_ |
Снижена интенсивность роста |
Резина |
_ |
_ |
_ |
Снижена интенсивность роста |
Таблица 2
Дезинфицирующая активность в отношении Esсherichia coli препарата Серебряный щит, содержащего кластерное серебро в концентрации
40 мг/л
Тест-объекты |
Результаты бактериологического анализа (наличие роста в мясо-пептонном бульоне) |
|||
а Время наблюденияа |
||||
24 часа |
48 часов |
72 часа |
5 суток |
|
Дерево |
_ |
+ |
+ |
+ |
Керамическая плитка |
_ |
_ |
_ |
_ |
Кафельная плитка |
_ |
_ |
_ |
_ |
Резина |
_ |
_ |
_ |
Снижена интенсивность роста |
Примечание: в смывах с контрольных тест-объектов, обработанных водой, роста в мясо-пептонном бульоне наблюдали через 24 часа.
Как видно из представленных данных, препарат Серебряный щит, содержащий кластерное серебро в концентрации 40 мг/л, в течение 3-часового воздействия обеззараживал тест-объекты из различного рода плитки и резины, искусственно контаминированные бактериями золотистого стафилококка и кишечной палочки. На деревянных поверхностях обеззараживание не было достигнуто.
Таким образом, кластерное серебро обладает дезинфицирующим действием, которое наиболее выражено проявляется на гладких поверхностях и не проявляется на шероховатых.
Ингибирование роста Staphylococcus aureus, рекомендованного в качестве модельной тест-культуры для вирусов, свидетельствует о возможности применения кластерного серебра в качестве биоцида для возбудителей вирусной природы.
В ранее проведенных электронно-микроскопических исследованиях было также показано пролонгированное бактериостатическое действие растворов кластерного серебра (Власов А.А., 2010).
Для изучения возможности использования средств и методов на основе нанобиотехнологии для обеспечения безопасности объектов ветеринарного надзора создавали модельную систему, включающую две холодильные камеры, одну из которых обрабатывали наносеребром путем опрыскивания препаратом в концентрации 50 мг/мл. Холодильники предварительно дезинфицировали средством Саносил Супер 25 согласно инструкции.
Эффективность обработки камер определяли с помощью тест-культур. Как видно из данных, представленных в таблице 3, повторная обработка холодильных камер обеспечивала санитарную пригодность их для хранения продукции в течение 12 месяцев.
Кроме того, при хранении мяса после двукратной обработки камер наносеребром, возбудителей инфекций обнаружено не было.
Таблица 3
Наличие микроорганизмов в холодильных камерах
Микробио-логические показатели |
Интервал определения после дезобработки |
|||||
0 месяцев |
6 месяцев |
12 месяцев |
||||
без применения нано-серебра |
с примене-нием нано-серебра |
без приме-нения нано-серебра |
с примене-нием нано-серебра |
без примене-ния наносеребра |
с примене-нием нано-серебра |
|
КМАФАнМ (КОЕ/г) |
0 |
0 |
200-250 |
100 - 150 |
3,50+0,16105 |
100-150 |
S. typhimurium |
- |
- |
- |
- |
- |
- |
E.coli |
- |
- |
- |
- |
+ |
- |
Таким образом, кластерное серебро оказывало бактериостатическое и бактерицидное влияние на различные микроорганизмы. Показано дезинфицирующее действие препарата на различных объектах (керамическая, кафельная плитки, а также резина). Препарат на основе наносеребра может использоваться в качестве биоцидного средства в отношении грамположительных и грамотрицательных бактерий. Он представляется наиболее экологичным и имеет перспективу использования в ветеринарной практике при разработке дезинфектантов и ветеринарных препаратов.
2.2.2 Разработка тест-системы индикации сальмонелл различных серогрупп на основе ИИХЭ с наночастицами коллоидного золота
Культуральный метод выявления сальмонелл, безусловно, надежен и дает однозначные результаты, но и достаточно длителен - его постановка занимает до 72 часов. Весьма привлекательными являются экспресс-методыа выявления микроорганизмов, в том числе основанные на иммунохимических реакциях, такие как иммуноферментный анализ, латекс-агглютинация. Однако разнообразие антигенной структуры бактерий сальмонеллезной группы, т. е. существование различных серологических типов, делает идентификацию сальмонелл с помощью иммунохимическиха тестов непростой задачей.
Целью следующего этапа работы явилось изучение аналитических возможностей отечественного иммунохроматографического теста для выявления сальмонелл серогрупп А, В, С, D, Е. В задачи исследования входилиа определение чувствительности, наличия перекрестных реакций с другими микроорганизмами семейства Enterobacteriaceae.
Для определения порога детекции использовали инактивированные нагреванием бактериальные культуры сальмонелл различных серологических типов.
Для контроля специфичности анализа использовали суспензии клеток шигелл в буфере для хроматографического анализа.
Иммунохроматографию проводили при комнатной температуре.а аНаносили различные концентрацииа клеток микроорганизмов, суспендированных в буфере для проведения иммунохроматографического анализа, в отверстие для внесения образца теста. Время анализаа составило 20 мин. Регистрацию результатов проводилиа кака визуально, наблюдая образование окрашенных зон в зависимости от концентрации клеток микроорганизмов, так и с помощью видеоцифрового анализатора Рефлеком (Россия), который позволял измерять окрашенность зона иммунохроматограммы в условных единицах. Положительным результатом считали появление в аналитической зоне различимой глазом окрашенной полосы вишнево-красного цвета, что соответствовало показаниям прибора Рефлеком не менее (0,9 0,2) усл. ед., а также появление окрашенной полосы в контрольной зоне. Среднеквадратичное отклонение показаний прибора рефлектометра при 95% доверительной вероятности не превышало 0,2 усл. ед. При нанесении отрицательного контроля, или гетерологичных микроорганизмов, на поверхности аналитической мембраны индикаторного элемента появлялась одна окрашенная полоса в контрольной зоне. Измерения для каждой концентрации микробных клеток и отрицательных контролей проводили пятикратно, вычисляли среднее арифметическое показаний прибора.
Иммунохроматографический тест для выявления сальмонелл представляет собой пластиковую оправу с двумя отверстиями (рисунок 1). Одно из отверстий служит для нанесения анализируемого образца, другое для наблюдения результатов анализа. Внутри оправы помещена сборка из нескольких пористых мембран с высушенными иммунокомпонентами. На одной из мембран были нанесены конъюгаты наночастиц коллоидного золота с поликлональными антителами к сальмонеллам. В аналитическую зону теста наносили поликлональные антитела к сальмонеллам в виде узкой линии. Жидкая проба, содержащая сальмонеллы, в буфере анализа растворяет иммунокомпоненты в мембранаха и взаимодействует с ними на аналитической мембране. В результате этого взаимодействия на аналитической мембране образуются окрашенные полосы, свидетельствующие о наличии сальмонелл. Наночастицы коллоидного золота и их конъюгаты с антителами имеют яркую выраженную вишнево-красную окраску и являются прекрасным маркером, хорошо видимым глазом. Иногда для регистрации результатов анализа применяюта приборы - рефлектометры.
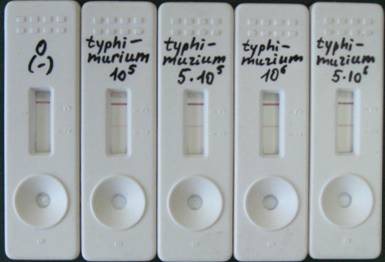
2
а3
а1
а
а аа0а 1х105аа 5х105аа 1х106а 5х106 м.к./мл
Рисунок 1. Внешний вид тестаа после проведения иммунохроматографического анализаа клеток Salmonella typhimurium, взятых в различных концентрациях. Стрелкамиа указаны:а 1 - отверстие для внесения образца, 2 - аналитическая зона,а 3 - контрольная зона.
Для удобства нами была предложена шкала оценки интенсивности окраски аналитической и контрольной зон теста при визуальном наблюдении оператором: отрицательный результат анализа (-) - в образце отсутствуют клетки сальмонелл, либо они присутствуют в концентрации ниже чувствительности теста; положительный результат анализа (+) - в образце присутствуют клеткиа сальмонелл - слегка заметная окрашенная линия в аналитической зоне; (++) - хорошо заметная окрашенная линия в аналитической зоне; (+++) - интенсивная окрашенная линия в аналитической зоне. Для создания иммунохроматографического теста нами были применены кроличьи и козьи пансальмонеллезные антитела, содержащие специфические иммуноглобулины к антигенным рецепторам соматического О-антигена клеток сальмонелл различных серогрупп.а Результаты, полученные с помощью теста для выявленияа сальмонелл,а различных серогрупп приведены в таблице 4. Чувствительность теста по отношению ка сальмонеллама различных серогрупп значительно отличается. Так, наиболее чувствительным тест был для культуры Salmonella typhimurium (1х105 м.к./мл) - серогруппа В, а наименее чувствительным - 1х107 м.к./мл адляа Salmonella anatum 161 серогруппа E.
Визуальная оценка результатов иммунохроматографического анализа, в целом, коррелировала с показаниями видеоцифрового рефлектометра - Рефлеком. Применение рефлектометрической регистрации не увеличилоа чувствительности обнаруженияа сальмонелл, по сравнению с визуальным наблюдением результата оператором. Тем не менее, рефлектометрия позволяет уменьшить такие факторы субъективности при оценке результата человеком, как освещенность рабочего места, усталость оператора или индивидуальные особенности восприятия цветов и насыщенности линий иммунохроматограммы.
Специфичность иммунохроматографического теста по отношению к некоторым другима микроорганизмам кишечной группыа показана в таблице 5. Как следует из экспериментальных данных шигеллы и эшерихии в концентрации 1х107 м.к./мл не приводили к появлению окраски аналитической зоны иммунохроматографического теста. Холерная вакцина, содержащая холероген-анатоксин и соматический О-антиген возбудителя холеры, также не дает перекрестных реакций с разработанным нами иммунохроматографическим тестом для выявления сальмонелл.
Таблица 4
Выявление клеток сальмонелл иммунохроматографическим методом
Серогруппа |
Наименование микроорганизма |
Чувствительность, м.к./мл |
Интенсивность окрашивания зон теста, определенная рефлектометрически, усл. ед. |
|
Аналитическая зона |
Контроль-ная зона |
|||
А |
Salmonella paratyphi А 225 |
5х106 |
1,3 |
15,3 |
В |
Salmonella paratyphi B yava 04 №4839а |
1х105 |
1,3 |
14,2 |
Salmonella paratyphi В 4219а |
5х106 |
1,2 |
13,0 |
|
Salmonella typhimurium 04 №4836 |
1х105 |
1,1 |
12,7 |
|
Salmonella typhimurium |
1х105 |
1,0 |
13,5 |
|
Salmonella heidelberg 1150 |
1х105 |
1,0 |
12,1 |
|
С |
Salmonella choleraesuis 595 |
5х106 |
1,0 |
14,9 |
C |
Salmonella newportа |
1х107 |
1,0 |
13,8 |
D |
Salmonella typhi 33 а |
1х107 |
0,8 |
14,1 |
D |
Salmonella enteritidis 17а |
1х106 |
0,8 |
12,4 |
Е |
Salmonella anatum 161 а |
1х107 |
0,7 |
13,0 |
аа а
Таблица 5
Результаты оценки специфичностиа иммунохроматографического теста
Наименование микроорганизма |
Интенсивность окрашивания зон теста |
|||
Визуальная оценка |
Рефлектометрические измерения, усл. ед. |
|||
Аналитичес-кая зона |
Контроль-ная зона |
Аналитичес-кая зона |
Контроль-ная зона |
|
Отрицательный контроль |
0 |
+3 |
0 |
11,8 |
Sh. sonnei |
0 |
+3 |
0,4 |
11,3 |
Sh. dysenteriae 214662 |
0 |
+3 |
0 |
13,5 |
Sh. flexneri 1a 8516 |
0 |
+3 |
0 |
10,9 |
Sh. flexneri 2a 1270 |
0 |
+3 |
0,4 |
10,7 |
Sh. flexneri 3a 1289 |
0 |
+3 |
0,4 |
11,8 |
Sh. flexneri 4a 1032 |
0 |
+3 |
0,4 |
12,9 |
Sh. flexneri 5x(-) 199 |
0 |
+3 |
0,4 |
12,4 |
Sh. flexneri 6 |
0 |
+3 |
0 |
11,7 |
E. coli штамм W ATCC 9637 |
0 |
+3 |
0 |
12,5 |
Вакцина холерная, 1,0 мкг/мл |
0 |
+3 |
0 |
12,7 |
В результате проведенных исследований разработан чувствительный и специфичный иммунохроматографический тест для выявления сальмонелл серогрупп А, В, С, D, E. Его чувствительность не уступает тесту Singlepatha-Salmonella производства фирмы Merck. Исключительная простота постановки анализа с помощью иммунохроматографических тестов позволяет использовать их в лабораториях с низкой технической оснащенностью.а Прямой анализ экстракта гомогенатов пищевых продуктов методом иммунохроматографии возможен только при чрезвычайно высоком уровне контаминации продуктов или сырья сальмонеллами, что является редким случаем. Длительность такой схемы анализа, включая пробоподготовку, не превышает 1,0 ч. Пробоподготовка предусматривает гомогенизирование продукта, экстракцию клеток буфером анализа, фильтрацию или центрифугирование в мягких условиях, а затема последующее нанесение фильтрата или супернатанта на иммунохроматографический тест (рисунок 2).
Гомогенизирование образца
v
Экстракция бактерий
v
Удаление дебриса фильтрацией или центрифугированием
vаа v
Осадокаа фильтрат или супернатант
v
ИИХЭ
Рисунок 2.а Схема проведения иммунохроматографического анализа
Предварительное обогащение контаминированных сальмонеллами серогруппы В образцов сырья и продуктов питания в хлористо-магниевой среде в течение 17 - 18 ч. при температуре 37 С и последующий иммунохроматографический анализ позволяет выявить до 102 - 103 м.к./мл сальмонелл, находившихся в исходных образцах. Другая схема обогащения при анализе проб сырья и продуктов содержащих сальмонеллы предусматриваета применениеа вначале неселективных среда (забуференная пептонная вода, +37 С, 21 ч), затем селективных - среда Раппопорта-Василиадиса, (+41 С, 21 ч) микробиологических сред для роста сальмонелла до конечной концентрации 106 - 107 м.к./мл с последующим иммунохроматографическим анализом. Применение схем обогащенияа позволяет существенно сократить время выявления сальмонелл даже при невысокой микробной контаминации, а такжеа повысить надежность анализа за счет включения иммунохимической стадии идентификации сальмонелл.
2.2.3 Разработка методики и тест-системы индикации возбудителей бактериальных инфекций на основе биочипов
Для определения возбудителей инфекций на основе биочипов нами разработана модифицированная методика, включающая амплификацию исследуемых ДНК с последующей ДНК-гибридизацией на чипах.
Исследуемые образцы гомогенизировали, элюировали микроорганизмы и подращивали в течение 6 часов в жидких питательных средах. Из аликвоты выделяли и очищали ДНК с помощью детергента Silico. Полученную ДНК амплифицировали с неспецифическими гексануклеотидными праймерами и дезоксинуклеозидтрифосфатами, меченными биотином. Ампликоны гибридизовали с иммобилизованными на нитроцеллюлозных чипах специфичными ДНК-зондами. ДНК-зондыа получали предварительно в реакции амплификации с использованием специфичных праймеров: Stn гена основного токсина Salmonella typhimurium; fimA структурного гена Escherichia coli. ДНК-зонды на Yersinia enterocolitica получали в реакции амплификации с использованием коммерческих тест-систем. После проведения гибридизации добавляли конъюгат стрептавединфосфатазу, субстрат и краситель. Результаты определяли по окрашиванию точек с гибридными молекулами.
Как видно из данных, представленных в таблице 6, реакция гибридизации наблюдалась только в гомологичных системах (меченные ампликоны и ДНК-зонд одного и того же микроорганизма).
Таблица 6 Результаты идентификации микроорганизмова с применением биочипов |
|||
Исследуемые микроорганизмы |
Результаты окрашивания биочипов с гибридными молекулами |
||
E. coli |
Salmonella аtyphimurium |
Yersinia entero-colitica |
|
E. coli |
++++ |
Ц |
Ц |
Salmonella typhimurium |
Ц |
++++ |
Ц |
Yersinia enterocolitica |
Ц |
Ц |
++++ |
Bac. subtilis |
Ц |
Ц |
Ц |
E. coli +а аYersinia enterocolitica (1:1) |
++++ |
Ц |
++++ |
Salmonella typhimurium + E. coli (1:1) |
++++ |
++++ |
Ц |
E. coli + ааYersinia enterocolitica + аSalmonella аtyphimurium (1:1:1) |
++++ |
++++ |
++++ |
Примечание: ++++ - максимальная степеньа окрашивания гибридных молекул - - отсутствие окрашивания гибридных молекул |
|||
Перекрестных реакций не наблюдалось. Кроме того, бактерии определялись в смеси с другими микроорганизмами, что указывало на высокую специфичность реакции.
Таким образом, разработанная модифицированная методика позволяла с высокой специфичностью выявлять микроорганизмы различных видов и проводить анализ в течение 17 - 18 часов.
В процессе исследований была разработана тест-система для индикации возбудителей инфекций с помощью биочипов. Она включала:
1. система для выделения и очистки ДНК с детергентом Silico; 2. иммобилизованные в виде точек на мембранном биочипе ДНК-зонды на следующие бактерии: Salmonella typhimurium, Escherichia coli, Yersinia enterocolitica; 3. гексануклеотидные праймеры, меченные биотином; 4. дезоксинуклеозидтрифосфаты, меченные биотином; 5. холодные дезоксинуклеозидтрифосфаты; 6. термостабильная ДНК-полимераза; 7. буфер для амплификации; 8. центрифужная микроколонка для очистки меченных ампликонов от не включившегося биотина;9. буфер для гибридизации; 10. конъюгат стрептавидинфосфатаза; 11. краситель тетразолий синий.
ВЫВОДЫ
1. Установлено бактериостатическое и бактерицидное действие отечественного препарата кластерного серебра Серебряный щит на грамположительные и грамотрицательные бактерии в концентрациях 5 - 10 и 20 - 40 мг/л соответственно.
2. Дезинфицирующий эффект препарата Серебряный щит на тест-микроорганизмы, нанесенные на поверхности из различных материалов (керамическая, кафельная плитки, резина) достигался при воздействии в течение 3 часов в концентрации 40 мг/л.
3. Разработанная тест-система на основе иммунохроматографических индикаторных элементов (ИИХЭ) с наночастицами коллоидного золота позволяет проводить индикацию сальмонелл различных серогрупп (А, В, С, D, Е) при наличии сопутствующей микрофлоры (шигеллы, эшерихии) в течение 1,0 ч с чувствительностью 107 м.к./мл, и с предварительным обогащением на селективных питательных средах с чувствительностью 102 - 103 м.к./мл в течение 24 ч.
4. Разработанные тест-системы и методика на основе ДНК-биочипов позволяет проводить индикацию возбудителей инфекций (Salmonella typhimurium, Escherichia coli, Yersinia enterocolitica) с чувствительностью 102 - 103 м.к./мл без предварительного обогащения и при наличии сопутствующей микрофлоры.
5. Разработанные методы и средства на основе бионанотехнологии могут быть использованы для обеспечения микробиологической безопасности объектов ветеринарного надзора (мясоперерабатывающих предприятий).
ПРЕДЛОЖЕНИЯ ДЛЯ ПРАКТИКИ
На основании результатов исследований разработаны:
- Методические рекомендации по применению индикаторных иммунохроматографических элементов для выявления возбудителей инфекционных заболеваний в объектах ветеринарного надзора, утвержденные Отделением ветеринарной медицины Россельхозакадемии 30.09.2009 г. (п.п. 2.3., 2.4.).
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ
1. Артемов А. В. Определение бактерицидной активности препаратов кластерного серебра Серебряный щит // Материалы международной научной конференции студентов и молодых ученых Экологически безопасные ресурсосберегающие технологии и средства переработки сельскохозяйственного сырья и производства продуктов питания, МГУПБ 2009, С. 258.
2. Смирнов А.М, Светличкин В.В., Кононенко А.Б., Бритова С.В., Артемов А.В., Голубев В.Н. Ветеринарно-санитарные аспекты использования наносеребра // Ветеринария и кормление, 2011, № 3,а С.аа 18 - 19.
3. Артемов А.В. Биоцидные свойства кластерного серебра и перспективы его использования в ветеринарии // Ветеринарная патология, 2011, № 3, С. 115 - 118.
4. Шиленко И.В., Ярков С.П.,а Артемов А.В., Кононенко А.Б., Смирнов А.М. Отечественный иммунохроматографический тест для выявления сальмонелл различных серогрупп // Ветеринарияа и кормление,а 2011, № 4, С. 12 - 13.
5. Смирнов А.М.,а Уша Б.В., Светличкин В.В., Ярков С.П., Концевова А.А., Артемов А.В., Ярова О.А. Применение средств и методов на основе нанобиотехнологии в ветеринарии // Ветеринария, 2012,а № 2, С. 53 - 54.
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
