 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
ОСОБЕННОСТИ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЙ КОЖИ У ЖИВОТНЫХ (клинико-экспериментальное исследование)
Автореферат кандидатской диссертации
На правах рукописи
ГРИГОРЬЕВ
Георгий Евгеньевич
Особенности Лечения повреждений кожи у животных
(клинико-экспериментальное исследование)
06.02.02 - Ветеринарная микробиология, вирусология, эпизоотология, микология
с микотоксикологией и иммунология
06.02.01 - Диагностика болезней и терапия животных, патология, онкология и
морфология животных
АВТОРЕФЕРАТ
на соискание ученой степени
кандидата ветеринарных наук
Барнаул 2012
Работа выполнена в ФГБОУ ВПО Иркутская государственная сельскохозяйственная академия на кафедре анатомии, физиологии, патофизиологии, акушерства, гинекологии и биотехнике размножения животных; Учреждении Российской академии медицинских наук Научном центре реконструктивной и восстановительной хирургии Сибирского отделения РАМН в научном отделе экспериментальной хирургии с виварием (г. Иркутск)
Научный руководитель:
доктор ветеринарных наук, профессор аа аа Ильина Ольга Петровнаа
Научный консультант:
доктор биологических наук епехова Светлана Александровна а аа а
Официальные оппоненты:
доктор ветеринарных наук, доцента Медведева Лариса Вячеславовна а
кандидат ветеринарных наукаа Бокова Татьяна Владимировна
Ведущее учреждение:
Государственное научное учреждение Научно-исследовательский институт ветеринарии Восточной Сибири Российской академии сельскохозяйственных наук
Защита состоится л29 марта 2012 г. в 1000 часов на заседании диссертационного совета ааД 220.002.02 при Алтайском государственном аграрном университете на факультете ветеринарной медицины по адресу: 656922, Алтайский край, г. Барнаул, ул. Попова 276, тел./факс 8(3852)31-39-70
С диссертацией можно ознакомиться в библиотеке Института ветеринарной медицины Алтайского государственного аграрного университета
Автореферат разослан л______________2012 года
Ученый секретарь
диссертационного совет аа аа П.И. Барышников
1. Общая характеристика работы
Актуальность проблемы.
Тактика лечения инфицированных повреждений кожи относится к числу важных разделов ветеринарии, так как эта патология наносит значительный экономический ущерб крупным специализированным и фермерским хозяйствам. Расходы на лечение, потери молока, мяса, особенно преждевременная выбраковка животных, влияют на формирование стада и его воспроизводство (Елисеев А.Н. с соавт., 2000; Потапова А.Н., 2008; Новиков П.В., 2010; Архипов А.А., 2011).
В условиях специализированных животноводческих комплексов, фермерских хозяйств и личных подворий с определенным уровнем механизации и конструктивными недостатками помещений, а также при неподготовленности скота к групповому содержанию наиболее частой причиной повреждений кожи является травматизм, осложненный полиинфекцией. Раневая инфекция является, как правило, постонянным спутником каждого механического повреждения тканей животного. При развитии раневой инфекции возможно не только нарушение регенерации и эпителизации повреждений кожи, но и осложнение сепсисом (Елисеев А.Н. с соавт., 2000; Веремей Э.И. с соавт., 2004; Гимранов В.В. с соавт., 2006).
Клинический опыт, накопленный в области теории и практики лечения повреждений кожи, свидетельствует о том, что даже применение самых эффективных средств не снижает риск возникновения различных осложнений (Даценко Б.М., 1995; Алексеева И.В., 2006).
Широкое применение антибиотиков, эффективность которых в начале была высокой, в дальнейшем, привело к возникновению ряда сложных проблем, мутагенное действие антибиотиков на патогенную микрофлору обусловило изменение, как этиологической структуры гнойной инфекции, так и биологических свойств микробной клетки с появлением антибиотикорезистентных штаммов (Киричек Л.Т., 2003; Фадеева Т.В., 2007; Потапова А.Н., 2008).
Эта проблема указывает на необходимость пересмотра мнения о монопольном положении антибиотиков и переходе на более обоснованную стратегию и тактику лечения гнойносептических инфекций, включая интерес к забытой группе антибактериальных препаратов - антисептиков (Страчунский Л.С. с соавт., 2000; Григорьев Е.Г., 2005; Фадеева Т.В., 2007).
Исходя из этого, были определены цель и задачи исследования.
Цель работы: изучить антибактериальную активность антисептика Анавидин in vitro и обосновать его применение для профилактики и лечения повреждений кожи у сельскохозяйственных животных.
Задачи исследования:
1. Разработать модель инфицированного повреждения кожи у крыс, которая позволит изучать антибактериальные и биологические свойства новых препаратов. Установить количественные изменения микробного состава на модели, инфицированного повреждения кожи при обработке Анавидином в динамике исследования.
2. Изучить антибактериальные свойства антисептика Анавидин in vitro.
3. Оценить влияние антисептика Анавидин на изменения в иммунологическом ответе показателей 1-го порядка, при заживлении инфицированных повреждений кожи.
4. Дать морфологическую оценку заживления инфицированных повреждений кожи под влиянием антисептика Анавидин.
5. На основании проведённых экспериментальных исследований разработать рекомендации для патогенетически обоснованного метода профилактики и лечения инфицированных повреждений кожи у сельскохозяйственных животных.
Научная новизна
Разработан способ моделирования инфицированного повреждения кожи с контролируемыми параметрами, включающими бактериальную обсемененность раны, глубину и площадь повреждения, которая может быть использована в хроническом эксперименте для изучения антибактериальных и биологических свойств новых препаратов.
Выявлено, что Анавидин обладает стимулирующим регенерацию и заживление инфицированного повреждения кожи, вследствие антибактериального и противовоспалительного действия. Показано, что преобладание фибробластов в грануляционной ткани у животных опытной группы обеспечивает более быстрый темп созревания соединительной ткани, чем в контроле, на 3Ц4 дня.
Получены данные об антибактериальных свойствах антисептического препарата Анавидин в исследованиях in vitro и in vivo.
Установлено, что 0,02% водный раствор Анавидина обладает выраженным ранозаживляющим действием при инфицированных повреждениях кожи, способствуя заживлению их в более ранние сроки.
Показано, что при использовании водного раствора Анавидина на молочной ферме КРС после обработки помещений фермы и оборудования контактирующего с выменем коровы, позволило снизить обсемененность обследованных предметов микроорганизмами с 60% до нулевых величин.
Исследование инфицированных повреждений кожи у КРС выявило следующий видовой состав бактерий чувствительных к антисептику Анавидин: (104) КОЕ была выявлена Ps. aeruginosa, Klebsiella spp., Fusobacterium necrophorum; Enterobacter agglomerans; Proteus mirabilis; Acinetobacter baumanii; Acinetobacter lwoffi; Bacillus spp; (103) КОЕ была выявлена Enterobacter aerogenes, St. epidermidis, St. aureus, Cl. perfringens, E. coli.
Теоретическая и практическая значимость работы
Антисептик Анавидин стимулирует регенерацию и заживление инфицированной кожной раны, путем активации пролиферации фибробластов и обеспечивает быстрый темп созревания грануляционной ткани в оформленную соединительную ткань и эпителизацию повреждения.
В исследовании in vitro определена минимальная концентрация раствора Анавидина, которая обладает бактерицидным действием в отношении (109) КОЕ E. coli и микста Ps. aeruginosa и E. coli.
Экспериментально обоснована возможность применения 0,02% водного раствора антисептика Анавидин для профилактики и лечения гнойных ран сельскохозяйственных животных в ветеринарной клинике.
Внедрение результатов научных исследований
Разработанная модель инфицированной кожной раны у животных, позволяющая изучать новые методы лечения инфицированных ран, внедрена в научном отделе экспериментальной хирургии с виварием НЦРВХ СО РАМН.
Материалы диссертационного исследования используются в учебном процессе кафедры госпитальной хирургии Иркутского государственного медицинского университета, Научного центра реконструктивной и восстановительной хирургии СО РАМН и кафедры анатомии, физиологии, патофизиологии, акушерства и биотехники размножения животных ИрГСХА.
Положения, выносимые на защиту
- Водный раствор Анавидина в концентрации 0,02% эффективен в лечении инфицированных повреждений кожи, путем активации репаративных процессов в соединительной ткани и эпителии, оказывает антибактериальное, противовоспалительное действие.
- Инфицированное повреждение кожи с контролируемыми параметрами бактериального обсеменения раны, глубиной и площадью повреждения, позволяет оценивать антибактериальную активность антисептика Анавидин.
- Концентрация 0,0015% раствора Анавидина обладает антибактериальной активностью в отношении антибиотикорезистентных штаммов микроорганизмов in vitro. Применение раствора Анавидина позволило снизить контаминацию помещений и оборудования фермы до нулевых значений.
Апробация основных положений работы
Основные результаты проведенного исследования доложены и обсуждены на: I съезде хирургов Сибири и Дальнего Востока (Улан-Удэ, 22Ц24 июня 2005 г.); Международной научно-практической конференции Актуальные вопросы электрофизиологии и незаразной патологии животных (Улан-Удэ, 26Ц28 июня 2009); II сибирском ветеринарном конгрессе Актуальные вопросы ветеринарной медицины (Новосибирск, 25Ц26 февраля 2010); II научно-практической конференции молодых ученых Сибирского и Дальневосточного федеральных округов (Иркутск, 7Ц8 октября 2010); XI Международной Байкальской научно-практической конференции по проблемам ветеринарной медицины (Иркутск, 15Ц16 марта 2011).
Основные положения диссертационной работы доложены и обсуждены на заседаниях ученого совета НЦРВХ СО РАМН (сентябрь, 2010). По материалам диссертационного исследования опубликовано 8 работ, в т.ч. 6 статей в журналах рекомендованных ВАК Минобразования и науки, получен патент на изобретение Российской Федерации, разработаны методические рекомендации. В опубликованных работах изложены основные положения диссертации.
Структура и объем диссертации
Диссертация состоит из введения, обзора литературы, главы о материалах и методах исследования, трех глав собственных наблюдений, заключения, выводов, практических рекомендаций, указателя литературы.
Текст изложен на 126 страницах, иллюстрирован 22 таблицами и 14 рисунками. Библиография включает 136 источников, из них 127 отечественных и 9 иностранных авторов.
2. Материалы и методы исследования
Работа является итогом научных исследований, выполненных автором в соответствии с планом научно-исследовательской работы, проводимой сотрудниками НЦРВХ СО РАМН (номер государственной регистрации 01200951068).
Работа выполнена на основании стендовых экспериментов in vitro; двух серий хронических экспериментов in vivo на белых крысах-самцах линии Вистар 6-месячного возраста с массой тела 200Ц250 г. В клинический фрагмент исследования вошли результаты лечения гнойных повреждений кожи у КРС (коровы).
Общая характеристика экспериментального материала in vitro
Экспериментальные микробиологические исследования выполнены в лаборатории бактериологии (лицензия № 99-01-001275 от 10.03.05 г. выдана Федеральной службой по надзору в сфере здравоохранения и социального развития) НЦРВХ СО РАМН (зав. лабораторией - д.б.н. Т.В. Фадеева).
Исследования in vitro в количестве 192-х стендовых опытов, выполнены для подбора наименьшей концентрации антисептиков с высокой антимикробной активностью, в отношении штамма E. coli и микста E. coli + Ps. aeruginosa выделенных из инфицированных повреждений кожи больных коров. В первой серии экспериментов проведено сравнительное исследование антибактериальной активности Анавидина и хлоргексидина биглюконата в отношении E. coli 109 КОЕ/мл.
Использовали следующие концентрации водного раствора Анавидина и водного раствора хлоргексидина биглюконата: 0,1, 0,05, 0,02, 0,01, 0,005, 0,003, 0,0015, 0,001%.
В третьей серии исследований in vitro проведено бактериологическое исследование объектов внешней среды в помещениях фермы и доильной аппаратуры на все виды микроорганизмов до и после обработки антисептиком Анавидин для выявления уровня микробной контаминации и определения видового состава бактерий.
Приготовление суточной культуры микроорганизмов
Культуры E. coli и Ps. aeruginosa сохраняли на твердых питательных средах с периодическим пассированием на средах обогащения в термостате при температуре 37С в течение 18-24 часов. Полученную культуру смывали теплым стерильным раствором натрия хлорида и стандартизировали до 109 КОЕ в миллилитре (КОЕ/мл) по стандарту мутности (методика Института стандартизации и контроля биологических препаратов им. Л.А. Тарасевича, Москва).
Общая характеристика экспериментального материала in vivo.
Исследование проводили в научном отделе экспериментальной хирургии с виварием НЦРВХ СО РАМН (зав. - док. биол. наук С.А. Лепехова) под руководством д.б.н. С.А. Лепеховой, на белых крысах-самцах линии Вистар 6-месячного возраста с массой тела 200-250 г.
Животных содержали в условиях вивария при свободном доступе к воде и пище, что соответствует нормативам ГОСТа Содержание экспериментальных животных в питомниках НИИ (виварий I категории, вет. удостоверение 238 № 0015220 от 25 марта 2009 г, служба ветеринарии Иркутской области). Опыты на животных выполняли в соответствии с правилами гуманного обращения с животными, регламентированными Правилами проведения работ с использованием экспериментальных животных, утвержденными Приказом МЗ СССР № 742 от 13.11.84 г. Об утверждении правил проведения работ с использованием экспериментальных животных и № 48 от 23.01.85 г. О контроле за проведением работ с использованием экспериментальных животных. Все оперативные вмешательства проводили в стерильных условиях под общим обезболиванием.
Способ моделирования инфицированного повреждения кожи
Предложена модель инфицированного повреждения кожи (патент на изобретение Рос. Федерации № 2431890 Способ моделирования инфицированной кожной раны, от 20.10.2011 г. / авт.: Григорьев Г.Е., Лепехова С.А., Гольдберг О.А., Коваль Е.В.).
В асептических условиях и под общей анестезией животное фиксировали на столике А.И. Сеченова в положении на животе. После подготовки операционного поля, в области спины выполняли иссечение кожи и подкожно-жировой клетчатки площадью 4 см? (рис.1). Края дефекта подшивали к подлежащим тканям атравматичной иглой с рассасывающейся лигатурой 4/0, с шагом 5 мм (рис. 1). Дополнительно каждый угол дефекта был прошит отдельным диагональным швом (рис. 2). Через 3-е суток после нанесения повреждения иссекали образовавшийся струп, некротизированные ткани. Затем рану обрабатывали раствором антисептика и промывали физиологическим раствором. На обработанную поверхность повреждения кожи, с размещением под угловые диагональные швы, устанавливали полупроницаемую мембрану. Под установленную полупроницаемую мембрану вводили бактериальную суспензию, содержащую 0,5 мл E. coli 109 и 0,5 мл Ps. aeruginosa 109 КОЕ (выделенных из раневого отделяемого коров).
 Рис. 1. Нанесение кожного дефекта размером 4 см? (А), подшивание краев дефекта (Б)
Рис. 1. Нанесение кожного дефекта размером 4 см? (А), подшивание краев дефекта (Б)
А
аБ
аа
 Рис 2. Дополнительные диагональные швы (А), установка полупроницаемой мембраны и введение инфекта (Б).
Рис 2. Дополнительные диагональные швы (А), установка полупроницаемой мембраны и введение инфекта (Б).
аЧерез сутки после инфицирования повреждения кожи животных относили к экспериментальным группам методом случайного распределения, таким образом, в исследование вводили животных с инфицированным повреждением кожи. Отправной точкой эксперимента была обработка инфицированного повреждения кожи препаратом, определяющим в дальнейшем их групповую принадлежность. Работа выполнена на основании 2-х серий хронических экспериментов.
аВ первой серии опытов (30 крыс) у животных изучали влияние на микрофлору инфицированных повреждений кожи и площадь раневой поверхности в динамике эксперимента на 1-е, 3-и, 7-е, 9-е, 11-е, 19-е сутки обработок физиологическим раствором (КГ-1), 0,02% раствором хлоргексидина биглюконата (КГ-2) , 0,02% водным раствором антисептика Анавидин (ОГ). Санацию инфицированного повреждения кожи выполняли каждый день, на протяжении 19-и суток. Планиметрию раны проводили по методу К.М. Фенчина (1979).
Во второй серии экспериментов (124 животных) проводили исследование по разработке модели и изучению показателей гомеостаза (иммунологические тесты, ОАК) и морфологии участка кожного дефекта с прилегающими неповрежденными тканями под воздействием физиологического раствора (КГ-1), 0,02% раствора хлоргексидина биглюконата (КГ-2), 0,02% водного раствора антисептика Анавидин (ОГ).
Методика забора материала
Животных во всех группах выводили из эксперимента на 1-е, 3-и, 5-е, 7-е, 9-е, 11-е, 19-е сутки (по 6 животных в каждой группе). Проводили забор крови для оценки выбранных показателей, аутопсию и забирали участок поврежденной кожи с окружающими тканями для последующего гистологического исследования.
Забор материала проводили у всех крыс в утренние часы.
аОбщая характеристика клинического материала
Клинический раздел исследования выполнен в учебном хозяйстве Молодежный (гл. зоотехник - Р.И. Бидогаева) ИрГСХА (ректор - к.э.н., Ю.Е. Вашукевич) под руководством д.в.н., профессора О.П. Ильиной, на основании анализа результатов лечения 18-и коров. Критерием включения в данное исследование явились: наличие гнойного кожно-мышечного повреждения не более 10 см2, с локализацией на латеральной поверхности бедра. Распределение КРС на группы в зависимости от выбранного лечебного воздействия, представлено в табл. 1.
Таблица 1
Распределение КРС на группы.
Номер группы |
Характер воздействия |
Количество животных |
КГ-1 |
Кожно-мышечное повреждение на бедре КРС с ежедневной обработкой ран физиологическим раствором. |
6 |
КГ-2 |
Кожно-мышечное повреждение на бедре КРС с ежедневной обработкой ран 0,02% раствором хлоргексидина биглюконата. |
6 |
ОГ |
Кожно-мышечное повреждение на бедре КРС с ежедневной обработкой ран 0,02% водного раствора Анавидина. |
6 |
Итого: |
18 |
а Выполняли бактериологические исследования на 1-е, 3-и, 7-е, 14-е сутки от начала санации повреждений кожи выбранным препаратом.
Характеристика методов исследования
Бактериологические методы исследований
Комплекс бактериологических методов исследования предусматривал в первую очередь посевы материала на твердые и жидкие питательные среды в соответствии с инструкцией.
В качестве объектов микробиологических исследований при инфицированных повреждениях кожи исследовали гнойное отделяемое, для выявления уровня микробной контаминации и определения видового состава бактерий. Материал отбирали при строгом соблюдении правил асептики. Образцы помещали в пробирки с виноградно-сахарным бульоном и сразу доставляли в лабораторию. Пересев на твердые питательные среды (5% кровяной агар, молочно-желточно-солевой агар, среда Эндо, Сабуро) осуществляли стандартной петлей методом секторальных посевов (метод Gould в модификации Рябинского-Родомана). Чашки инкубировали при температуре 37?С в течении 18-24 часов, после чего подсчитывали число колоний, выросших в разных секторах.
Вид, биохимический профиль выделенных микроорганизмов, определение резистентности микроорганизмов к различным антибактериальным препаратам (метод серийных разведений) осуществляли с помощью автоматизированных бактериологических анализаторов Autosceptor (Becton Dickinson, США) и ATB Expression фирмы Biomerieux (Франция) согласно прилагаемым к анализаторам инструкциям по их эксплуатации. Баканализаторы определяют более 800 видов микроорганизмов и более 9000 их биохимических профилей (большинство из них недоступны для определения классическими методами).
В качестве объектов микробиологических исследований в клинике исследовали отделяемое из ран коров. В помещениях фермы проведено бактериологическое исследование объектов внешней среды, доильной аппаратуры на все виды микроорганизмов до и после обработки новым сибирским антисептиком Анавидин для выявления уровня микробной контаминации и определения видового состава бактерий.
Иммунологические и общеклинические методы исследований
Иммунологические исследования проводили в лабораторном отделе Центральной научно-исследовательской лаборатории (зав. - канд. мед. наук, доцент А.В. Стародубцев) Иркутского государственного института усовершенствования врачей (ректор - д-р мед. наук, профессор В.В. Шпрах). Для определения параметров фагоцитарной реакции нейтрофилов крови использовали убитые при температуре 80Ц90С клетки дрожжей Saccharomyces cerevisiae. Оценивали фагоцитарный показатель (фагоцитарная активность или фагоцитарный индекс) - процент фагоцитов из числа сосчитанных нейтрофилов, и фагоцитарное число - среднее число дрожжей, поглощенных одним активным нейтрофилом. Для оценки степени антигенной раздраженности неактивных in vitro гранулоцитов крови исследовали спонтанный тест восстановления нитросинего тетразолия (НСТ-тест), выражая результаты в процентах. Активированный НСТ-тест (%) проводили для оценки функционального кислородозависимого механизма бактерицидности фагоцитов. Определение циркулирующих иммунных комплексов (ЦИК) - проводили по стандартной методике Гриневича.
Общий анализ крови выполняли стандартными методами с подсчетом количества эритроцитов, лейкоцитов и лейкоцитарной формулы.
Планиметрическое исследование
Планиметрию дефектов кожи проводили по методу К.М. Фенчина. На дефект накладывали прозрачную пленку и на ней чернилами обрисовывали контуры. Зная массу 1см пленки, рассчитывали площадь повреждения по формуле:
S = (Si х М) / Mi, где S - площадь повреждения; Si - площадь 1 см2; Mi - масса 1 см2 пленки ; М - масса очерченной пленки.
Повторное исследование площади повреждения позволяет определить динамику регенеративных процессов и установить процент уменьшения площади повреждения за сутки по следующей формуле:
V = (S - Sn) х 100 / St, где: V - % уменьшения повреждения за сутки; S - площадь повреждения при предыдущем измерении; Sn - площадь повреждения при данном измерении; t - число дней между измерениями
Методы морфологического исследования
Исследование проведено на базе лаборатории патоморфологии НЦРВХ СО РАМН (зав. лаб. - канд. мед. наук О.А. Гольдберг). Заготовленный материал фиксировали в 10%-ном нейтральном формалине. Проводка материала проводилась в автомате для вакуумной проводки VIP-E150F фирмы Sacura, Япония. Заливка в системе для автоматической заливки материала в парафин TEC-IV фирмы Sacura, Япония.
Резка стандартных серийных срезов толщиной 3 мкм проводилась на полуавтоматических роторных микротомах CM-502 фирмы Microm (Германия) с использованием одноразовых ножей на трех уровнях (перпендикулярно оси кожного дефекта).
Покраска срезов гистологическими методиками осуществлялась в автомате для покраски срезов DRS-601A фирмы Sacura, Япония.
Покрытие срезов на предметных стеклах покровными стеклами в автомате Cover Tech фирмы Microm, Германия.
Микроскопическое исследование препаратов проводилось с помощью компьютерной микроскопической видеосистемы Quantimet 550IW фирмы Leica (Англия) для цифрового анализа патоморфологического и цитологического материала и углубленной диагностики с камерой высокого разрешения, позволяющей проводить количественный анализ изображения по реальным цветам или оптическим плотностям с форматом изображения 6000х4000 пикселей.
Срезы окрашивали гематоксилином и эозином, азуром и эозином, гематоксилином и пикрофуксином [81].
Методы статистической обработки результатов
Данные представляли в виде медианы с нижним и верхним квартилями (25-й и 75-й процентили). При нормальном распределении в выборке данные представлены в средних величинах со средней квадратической ошибкой.
Величины, выраженные в процентах, приведены в тексте с ошибкой процента. Определение значимости различий полученных данных (р) в сравниваемых выборках проведено по критериям Манна-Уитни (U), Вилкоксона (W).
Корреляционный анализ данных в выборках с ненормальным распределением проводили с применением непараметрического коэффициента корреляции Спирмена (Rs).
Критический уровень значимости при проверке статистических гипотез в данном исследовании принимался равным 0,05.
Статистическая обработка результатов произведена с помощью статистического пакета программ.
3. Результаты исследованиЙ
Целью нашего исследования стало изучение антибактериальной активности антисептика Анавидин in vitro и обоснование его применения для профилактики и лечения повреждений кожи у сельскохозяйственных животных.
На первом этапе данного исследования в эксперименте in vitro мы изучали антибактериальную активность антисептика Анавидин для подбора минимальной концентрации антисептика, которая бы подавляла рост антибиотикорезистентных штаммов микроорганизмов полученных из отделяемого ран коров.
Для сравнения антимикробного действия применяли весьма близкий аналог Анавидину - хлоргексидина биглюконат. Он так же является производным гуанидина, но вместо фосфатных ионов (как у анавидина) содержит хлорфенильные радикалы.
Эксперимент выполнен на основании проведения трех серий опытов in vitro. В первой серии экспериментов проведено сравнительное исследование антибактериальной активности Анавидина и хлоргексидина биглюконат в отношении E. coli 109 КОЕ/мл.
Согласно литературным данным, в инфицированных повреждениях кожи животных, наиболее часто встречаются грамотрицательные возбудители - 90 %, среди которых эшерихии составляют 32,5 %, синегнойная палочка - 30,2 %.
Концентрации 0,1, 0,05, 0,02, 0,01, 0,005, 0,003, 0,0015% водного раствора Анавидина и водного раствора хлоргексидина биглюконата, снижали количество микроорганизмов с 109 до нулевых значений КОЕ/мл, пробы становились стерильными (рис. 3).
Однако концентрация антисептиков 0,001% не подавляла рост микроорганизмов, при добавлении водного раствора анавидина - количество E.coli достоверно снижалось с 109 до 103 КОЕ/мл (pU ? 0,05); водного раствора хлоргексидина биглюконата до 104 КОЕ/мл. Следует отметить, что водный раствор 0,001% Анавидина подавлял рост микроорганизмов более эффективно, чем водный раствор 0,001% хлоргексидина биглюконата (pU = 0,003).

Рис. 3 Результаты антибактериальной активности антисептика Анавидин в отношении штамма E. coli
Во второй серии стендовых экспериментов проведено сравнительное исследование антибактериальной активности Анавидина и хлоргексидина биглюконат в отношении микста E. coli + Ps. aeruginosa 109 КОЕ/мл, так как согласно литературным данным наиболее часто во всех пораженных тканях крупного рогатого скота регистрируют полиинфекцию.
Выявлено, что при концентрации антисептиков 0,0015% и 0,001% отмечается рост микроорганизмов. Использование водного раствора 0,0015% Анавидина позволяет достоверно снизить количество E. coli с 109 до нуля, а Ps. aeruginosa с 109 до 103 КОЕ/мл (pU ? 0,05). Водный раствор хлоргексидина биглюконата в концентрации 0,0015% снижает количество E. coli с 109 до 103, а Ps. aeruginosa с 109 до 104 КОЕ/мл (pU ? 0,05). Следует отметить, что Анавидин подавлял рост микроорганизмов более эффективно, чем хлоргексидин биглюконат (pU ? 0,05). Дальнейшее снижение концентрации приводит к увеличению бактериальной контаминации (рис.4).
 Рис. 4 Результаты антибактериальной активности антисептика Анавидин в отношении микста E. coli + Ps. aeruginosa
Рис. 4 Результаты антибактериальной активности антисептика Анавидин в отношении микста E. coli + Ps. aeruginosa
 аВ доступных литературных источниках мы не встретили данных о бактериологических исследованиях объектов внешней среды ферм, доильной аппаратуры на все виды микроорганизмов с использованием автоматизированных бактериологических анализаторов. Баканализаторы определяют более 800 видов микроорганизмов и более 9000 их биохимических профилей (большинство из них недоступны для определения классическими методами).
аВ доступных литературных источниках мы не встретили данных о бактериологических исследованиях объектов внешней среды ферм, доильной аппаратуры на все виды микроорганизмов с использованием автоматизированных бактериологических анализаторов. Баканализаторы определяют более 800 видов микроорганизмов и более 9000 их биохимических профилей (большинство из них недоступны для определения классическими методами).
Рис. 5 Микробная обсемененность молочной фермы
В третьей серии исследований in vitro проведено бактериологическое исследование объектов внешней среды в помещениях фермы, доильной аппаратуры (рис.5) на все виды микроорганизмов до и после обработки антисептиком Анавидин с использованием автоматизированных бактериологических анализаторов Autosceptor (Becton Dickinson, США) и ATB Expression фирмы Biomerieux (Франция).
После обработки 1% водным раствором Анавидина объектов внешней среды фермы, как зоны наиболее высокого риска передачи инфекции, показали, что в целом по обследуемым помещениям процент высеваемости микроорганизмов достоверно снизился в 4 раза (pU = 0,001). Выявлено полное исчезновение санитарно-показательных микроорганизмов с 32,6 % до нуля (табл. 2).
Таблица 2
Результаты исследования антимикробной активности Анавидина в помещениях фермы
Виды |
До и после обработки |
Кол-во Исследований |
Кол-во положительных результатов (%Sp ) |
Кол-во авидов микроорганизмов |
|
всего |
из них санитарно-показательных |
||||
ферма |
до после |
48 46 |
33(68,7 2,9) 8 (17,3 3,0) (p=0,001) |
16 (32,62,0) 0 (p=0,002) |
20 3 |
бидоны |
до после |
20 20 |
7 (352,7) 1 (51,4) (p=0,003) |
1 (12,51,4) 0 (p=0,62) |
7 2 |
Доильные стаканы |
до после |
10 10 |
6 (607,9) 0 (p=0,0001) |
2 (255,5) 0 (p=0,002) |
14 |
Применение 1%-го водного раствора Анавидин для влажной уборки помещений фермы и оборудования контактирующего с выменем коровы, позволяет снизить обсемененность обследованных предметов, что является эффективным методом деконтаминации для профилактики заболеваемости маститами.
При бактериологическом исследовании обсемененности доильных стаканов после обработки 1% водным раствором Анавидина, удалось снизить контаминацию микроорганизмов с 60% до нулевых значений.
Дальнейшим этапом экспериментального раздела работы было изучение антибактериальных свойств антисептика Анавидин в условиях инфицированного повреждения кожи у экспериментальных животных в отношении микста Ps. aeruginosa + E. coli в концентрации 1х109 КОЕ/мл. При постановке опытов на крысах был использован предложенный нами способ моделирования инфицированного повреждения кожи.
Обсуждая результаты исследования на животных, прежде остановимся на формировании экспериментальных групп. Животные были распределены на группы так, что в КГ-2 инфицированные повреждения кожи обрабатывали 0,02% водным раствором хлоргексидина биглюконата, в ОГ - инфицированные повреждения кожи обрабатывали 0,02% водным раствором Анавидина. Контролем служили крысы, которым инфицированные повреждения кожи обрабатывали физиологическим раствором (КГ-1). Санацию дефектов выполняли каждый день, на протяжении 19-и суток.
Так, при бактериологическом исследовании (рис. 6) на первые сутки исследования микробное обсеменение инфицированного повреждения кожи в группе КГ-1 составляло 107, а в группе ОГ этот показатель был значимо ниже и составлял 105 (РU = 0,007; РU = 0,02). При обработке инфицированного повреждения кожи хлоргексидина биглюконатом в КГ-2 показатель не имел существенных отличий от КГ-1 (РU = 0,138).
На третьи сутки в КГ-1 количество микроорганизмов составило 105, что значимо ниже по сравнению с предыдущими сутками исследования (РW = 0,01). В ОГ отмечали монотонное снижение микробной обсемененности инфицированного повреждения кожи до 104. В КГ-2 также отмечали снижение микробной обсемененности инфицированного повреждения кожи до 104, что значимо ниже по сравнению с предыдущими сутками (pw = 0,001). При межгрупповом сравнении ОГ, КГ-1, КГ-2 достоверных различий на третьи сутки не выявлено (pU ? 0,05).
 аНа 5-е сутки эксперимента в группе КГ-1 количество микроорганизмов составило 105, что существенно выше, чем в ОГ (pU = 0,001). В ОГ с обработкой инфицированного повреждения кожи антисептиком Анавидин, микробная обсемененность была прежней по сравнению с предыдущими сутками и составляла 104, что значимо ниже по сравнению с группой КГ-2 (pU = 0,0026).
аНа 5-е сутки эксперимента в группе КГ-1 количество микроорганизмов составило 105, что существенно выше, чем в ОГ (pU = 0,001). В ОГ с обработкой инфицированного повреждения кожи антисептиком Анавидин, микробная обсемененность была прежней по сравнению с предыдущими сутками и составляла 104, что значимо ниже по сравнению с группой КГ-2 (pU = 0,0026).
Рис. 6. Влияние антисептика Анавидин на микробную контаминацию инфицированного повреждения кожи в эксперименте in vivo.
На 9-е сутки эксперимента в группе КГ-1 количество микроорганизмов составило 105, достоверных различий с этим показателем в предыдущие сутки исследования не выявлено (pu ? 0,05), но значимо выше, чем в группе ОГ (PU=0,0013). В ОГ с обработкой антисептиком Анавидин показатель был равен нулю, что существенно ниже при сравнении с группой КГ-2 (РU = 0,01). В группе КГ-2 микробная обсемененность составляла 103. В динамике 11Ц19-х суток выявленная закономерность сохранялась.
Таким образом, выявлено, что микробная обсемененность инфицированного повреждения кожи достоверно снижается уже к 3-м суткам исследования, при обработке 0,02% водным раствором антисептика Анавидин и 0,02% раствором хлоргексидина биглюконата, достигая нулевых значений в группе ОГ к 9-м суткам исследования, что существенно ниже показателя в КГ-1 и КГ-2 (pU?0,05), в КГ-2 санация хлоргексидина биглюконатом приводит к нулевым значениям только к 19-м суткам исследования, при промывании дефектов физиологическим раствором количество микробных тел сохраняется высоким до 19-х суток эксперимента, а преобладающим микроорганизмом в развитии раневого процесса выявлена синегнойная палочка.
Полученные данные свидетельствуют о выраженном антибактериальном действии антисептика Анавидин в концентрации 0,02% в отношении микста E. coli 109 КОЕ/мл + Ps. aeruginosa 109 КОЕ/мл внесенного в повреждение кожи.
При клиническом исследовании микробной контаминации кожно-мышечных повреждений у коров (табл. 3) был выявлен следующий видовой состав бактерий: (104) КОЕ была выявлена Ps. aeruginosa, Klebsiella spp., Fusobacterium necrophorum; Enterobacter agglomerans; Proteus mirabilis; Acinetobacter baumanii; Acinetobacter lwoffi; Bacillus (103) КОЕ была выявлена Enterobacter aerogenes, St.epidermidis, St. aureus, Cl. perfringens, E. coli.
Таблица 3
Микробная контаминация повреждений кожи у коров
Видовой состав бактерий |
Концентрация |
Ps. Aeruginosa |
104 |
Klebsiellaspp. |
104 |
Fusobacterium necrophorum |
104 |
Enterobacter agglomerans |
104 |
Proteus mirabilis |
104 |
Acinetobacter baumanii |
104 |
Acinetobacter lwoffi |
104 |
Bacillus spp. |
104 |
St.epidermidis |
103 |
St. aureus |
103 |
Cl. Perfringens |
103 |
E. coli |
103 |
В 100% случаях микробная контаминация повреждений кожи у КРС была выявлена в ассоциациях: Ps. aeruginosa (15,2 %), St. epidermidis (30,0 %), Klebsiella spp (10 %), E. coli (43,5 %), Fusobacterium necrophorum (1,3 %).
Показана высокая устойчивость к широко применяемому сегодня гентамицину (43Ц75 %). Существенной оказалась резистентность к оксациллину (31Ц38 %), наибольшая антибиотикорезистентность была выявлена к пенициллину (89Ц90 %).
Множественно-резистентными оказались Ps. aeruginosa и Enterobacter agglomerans. Препаратами выбора для них являются имипенем, сульперазон, амикацин. К широко используемым антибиотикам цефтриаксону, пефлоксацину, ципрофлоксацину выявлена высокая резистентность.
Таким образом, выявлена, высокая антибиотикорезистентность к наиболее используемым антибиотикам, таким как пенициллин, ампициллин, цефазолин, эритромицин.
Анализ микробиологической структуры раневых инфекций, верифицированных у коров показал, что основными возбудителями, которые встречаются во всех пробах, являются штаммы St. epidermidis, Ps. aeruginosa, Enterobacter agglomerans и E. coli. Обработки инфицированного повреждения кожи 0,02% водным раствором антисептика Анавидин, позволили снизить микробную контаминацию всех видов микробных тел в ране до нулевых значений, на 1-е сутки после обработки, что говорит о высокой чувствительности раневых штаммов микроорганизмов к антисептику Анавидин и пролонгированному действию антисептика.
Прежде, чем рассмотреть результаты биологических свойств антисептика Анавидин, остановимся подробнее на результатах по разработке способа моделирования инфицированного повреждения кожи с заданным микробным пейзажем, а так же с контролируемой глубиной и площадью повреждения. Эти условия необходимы для стандартизации раны и возможности объективной оценки влияния новых препаратов на рану. В литературе описано большое количество способов моделирования инфицированных повреждений кожи. Наиболее близкой является модель И.Ю. Сахарова (1993), отличительными приемами предлагаемого нами способа являются:
- подшивание краев дефекта к подлежащим тканям после иссечения кожного покрова;
- каждый угол дефекта дополнительно прошивают отдельным диагональным швом;
- иссечение струпа и некротизированных тканей в пределах здоровых тканей;
- обработка инфицированного повреждения кожи антисептиком с последующим промыванием её физиологическим раствором;
- закрытие обработанной поверхности раны полупроницаемой мембраной, концы которой вставляют под угловые диагональные швы;
- введение под полупроницаемую мембрану бактериальной взвеси, содержащей 0,5 мл E. coli 109 и 0,5 мл Ps. aeruginosa 109.
Таким образом, разработана модель инфицированного повреждения кожи, с контролируемыми параметрами, включающими как бактериальную обсемененность раны, так глубину и площадь повреждения, которая может быть использована в хроническом эксперименте для изучения антибактериальных и биологических свойств новых препаратов.
Для оценки системной воспалительной реакции на индукцию инфицированного повреждения кожи, под влиянием антисептика Анавидин, был проведен сравнительный анализ уровня лейкоцитов и формулы периферической крови.
При исследовании лейкоцитоза венозной крови (рис. 7) оказалось, что максимальным проявлением системной воспалительной реакции на 1-е сутки исследования в КГ-1, КГ-2 и ОГ закономерно наблюдался лейкоцитоз, при этом уровень лейкоцитов в КГ-1 был максимальным по сравнению с КГ-2 (pU = 0,02), ОГ (pU = 0,004), а в ОГ был наименьшим, но достоверно выше нормы (pD = 0,03). От нормальных величин так же не отличалось количество лейкоцитов у КГ-2, но было статистически меньше по сравнению с КГ-1 (pU = 0,02) и больше, чем в ОГ (pU = 0,04). Высокие показатели лейкоцитоза сохранялись во всех группах до 9-х суток, однако наименьший показатель среди групп был выявлен в ОГ с санацией инфицированного повреждения кожи антисептиком Анавидин.
Таким образом, выявлено, что показатель лейкоцитоза у животных с обработкой инфицированного повреждения кожи антисептиком Анавидин был наименьшим по сравнению с группами контроля на протяжении всех 19-ти суток исследования, но был существенно выше нормальных значений до 11-х суток, с нормализацией на 19-е сутки. Однако отметим, что выбранный для контроля антисептик хлоргексидина биглюконат, так же ограничивал лейкоцитоз, показатели в этой группе были существенно ниже, чем в контрольной группе, где инфицированные повреждения кожи просто промывали физиологическим раствором, но были существенно выше, чем в опытной группе.
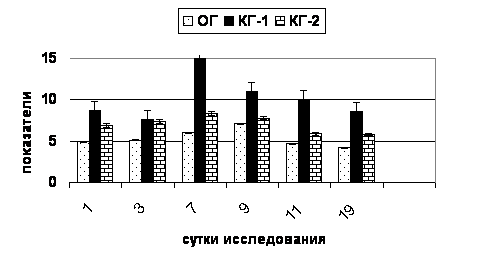
Рис. 7. Динамика уровня лейкоцитов в группах.
Обработка инфицированного повреждения кожи антисептиком Анавидин приводит к уменьшению воспалительного ответа, что подтверждается нормализацией к 19-м суткам уровня лейкоцитов, сегментоядерных нейтрофилов, моноцитов и лимфоцитов (рис. 8Ц11).
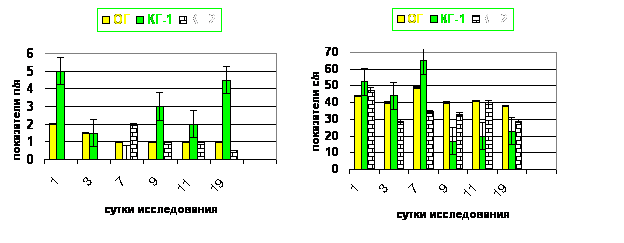
Рис. 8. Количество палочкоядерных лейкоцитов в динамике исследованияа |
Рис. 9 Количество сегментоядерных лейкоцитов в динамике исследования. аа |
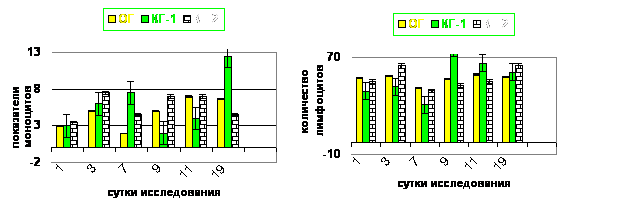
Рис. 10. Количество моноцитов в динамике исследованияа |
Рис. 11. Количество лимфоцитов в динамике исследования. аа |
Динамика уровня лейкоцитов периферической крови согласуется с данными микробиологического исследования, где максимальное снижение КОЕ прослеживалось в ОГ, и в меньшей степени в КГ-2 и КГ-1, особенно на первые, 9-е сутки эксперимента.
При исследовании показателей фагоцитарной активности нейтрофильных лейкоцитов, обнаружено, что во всех группах экспериментальных животных на 1-е сутки имело место повышение фагоцитарного индекса. На 7-ые сутки имелось несущественное снижение ФИ у ОГ и КГ-2, но показатель сохранялся выше нормы во всех группах (pD ? 0,05). Максимальным показатель был в группе КГ-1, что по срокам совпадает с максимальным лейкоцитозом в этой группе. При сравнении показателя в группах ОГ и КГ-1 выявлено, что в ОГ показатель существенно ниже (pU = 0,03). Эти данные указывают на активацию фагоцитарного звена иммунного ответа на инфекцию.
На 9-ые сутки эксперимента ФИ был минимальным в КГ-1 по сравнению с нормой (pD = 0,002) и КГ-2 (pU = 0,009), а так же по сравнению с 7-ми сутками (pw = 0,0001). В ОГ отмечался также повышенный фагоцитарный индекс по сравнению с КГ-1 (pU = 0,005). Однако отметим, что показатель ФИ в группах КГ-2 и ОГ сохранялся существенно более высоким по сравнению с нормой (pD ? 0,05).
Существенное снижение ФИ к 9-м суткам у животных контрольной группы 1 совпадает с литературными данными об угнетении фагоцитоза при гнойно-некротических поражениях тканей.
К девятнадцатым суткам ФИ нормализовался в КГ-2 и ОГ, тогда как в КГ-1 показатель оставался существенно ниже нормы (pD = 0,0001) КГ-2 и ОГ (pU ? 0,05).
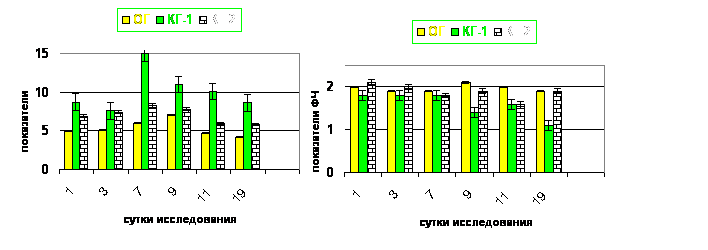
а
Рис. 12. Показатели фагоцитарного индекса в динамике исследованияа |
Рис. 13. Показатели фагоцитарного числа в динамике исследования. аа |
Нами подтверждено, что санация инфицированных повреждений кожи Анавидином не оказывают подавляющего влияния на фагоцитоз. Выявленная динамика ФИ совпадает с изменениями ФЧ (рис. 12, 13).
Таким образом, установлено ограничение системной воспалительной реакции, сохранность неспецифической резистентности и отсутствие сенсибилизации при инфицированном повреждении кожи под воздействием антисептика Анавидин. Тогда, как в контрольной группе 1 отмечали прогрессирующие расстройства неспецифической резистентности реакции организма, характерные для течения гнойных ран без лечебных воздействий.
В результате проведенных планиметрических исследований (рис. 14) установлено, что применение антисептика Анавидин способствует ускорению заживления дефекта, о чем свидетельствует существенное уменьшение площади инфицированного повреждения кожи уже на 3-и сутки, уменьшение площади дефекта в 2 раза на 9-е сутки и нулевое значение показателя к 19-м суткам. Использование антисептика хлоргексидин биглюконата (КГ-2) способствовало уменьшению площади инфицированного повреждения кожи в 2 раза на 11-е сутки, а в КГ-1 с обработкой ран физиологическим раствором позволило уменьшить площадь инфицированного повреждения кожи в 2 раза к 15-м суткам исследования.
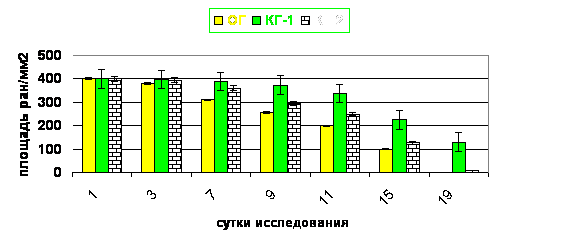 Рис. 14. Влияние антисептика Анавидин на заживление инфицированного повреждения кожи.
Рис. 14. Влияние антисептика Анавидин на заживление инфицированного повреждения кожи.
Клиническая картина инфицированного повреждения кожи во всех группах животных до начала лечения была одинаковой.
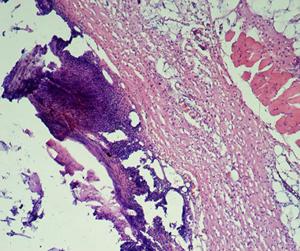
Раны характеризовались подрытыми, рубцово-фибринозными краями, вялыми и тусклыми грануляциями, с очагами некротических изменений, при гистологической оценке препаратов животных всех групп в области раны на 1-е сутки (4-е сутки с момента нанесения кожного дефекта) выявлено (рис. 15): поверхностно колонии микробов, некротизированная ткань, лейкоциты, детрит, фибрин. В подлежащих тканях выявляли: отек, плазматическое пропитывание, диффузно распределенные лейкоциты в подлежащей соединительной ткани.
При гистологическом исследовании на 3-и сутки у животных опытной группы с обработкой антисептиком Анавидин, выявляли на поверхности дефекта фибрин и лейкоциты, в глубине раны грануляционная ткань с новообразованными капиллярами, фибробластами и лейкоцитами.
Таким образом, под поврежденным слоем идет процесс созревания грануляционной ткани. В ней фибробласты, с разнонаправленной ориентировкой. В контрольной группе - 1 с обработкой ран физиологическим раствором грануляционная ткань находится на разных стадиях резорбции клетками воспалительного инфильтрата, с формирующимися микроабсцессами. В тканях, прилежащих к ране, наблюдается нарушение кровообращения, сопровождающееся полнокровием сосудов.
1
а2
а2
аБ
аА
а1
а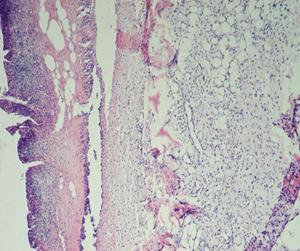
2
а1
аВ
а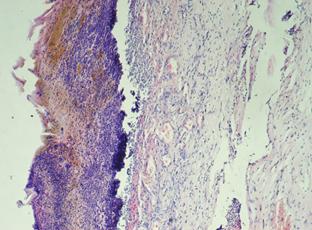
Рис. 15. Крыса. 1-е сутки после инфицирования дефекта (4-е сутки от момента нанесения дефекта) А - ОГ; Б - КГ-1; В - КГ-2. 1 - некротизированная ткань, лейкоциты, детрит, фибрин; 2 - отек, плазматическое пропитывание, диффузно распределенные лейкоциты в подлежащей соединительной ткани. Окраска гематоксилином и эозином; А, Б, В (Об. 4х.; Ок. 10х).
Таким образом, преобладание в грануляционной ткани фибробластов у животных опытной группы обеспечивает более быстрый темп созревания соединительной ткани, чем в контроле, на 3Ц4 дня, с закрытием раневого дефекта эпителием к 19-м суткам (рис. 16), тогда как, у животных контрольных групп раны находились под струпом до 19-х суток исследования. У животных КГ-1 ни в одном случае эпителий полностью не закрывал поверхность инфицированного повреждения кожи.
Результаты нашего исследования показали, что использование водного раствора Анавидина, в условиях микробноконтаминированой инфицированного повреждения кожи приводит к элиминации возбудителей гнойной инфекции и ускоряет темп созревания соединительной ткани, чем в контроле, на 3Ц4 дня, с закрытием раневого дефекта эпителием к 19-м суткам.
1
а2
а3
а3
а4
аБ
аА
а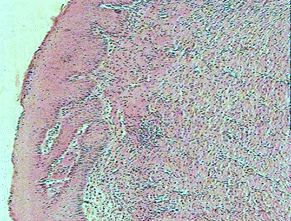 а
а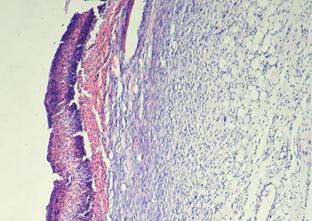
3
а2
а1
аВ
а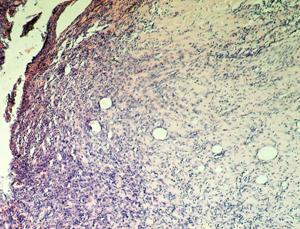
Рис. 16. Крыса. 19-е сутки после инфицирования дефекта А - ОГ; Б - КГ-1; В - КГ-2; 1 - некротизированная ткань (струп) на поверхности раны; 2 - созревающая соединительная ткань; 3 - сформированная соединительная ткань; 4 - эпителий, закрытие раны; Окраска гематоксилином и эозином; А, Б, В, Г (Об. 4х.; Ок. 10х).
Выводы
1. Созданная модель инфицированной кожной раны, заключающаяся в иссечении кожного покрова, удалении струпа и введении инфекта в рану, является легко воспроизводимой, с контролируемыми параметрами заданным бактериальным обсеменением раны (0,5 мл E. coli 109 и 0,5 мл Ps. aeruginosa 109), глубиной и площадью повреждения, позволила изучить антибактериальные и биологические свойства антисептика Анавидин. В опытах in vivo, при обработке инфицированных кожных повреждений 0,02% водным раствором антисептика Анавидин микробная обсемененность достоверно снижается уже к 3-м суткам, достигая нулевых значений к 9-м суткам в динамике до 19-х суток исследования.
2. В опытах in vitro выявлено, что 0,0015% раствор Анавидина обладает бактерицидным действием в отношении E. coli и микста Ps. aeruginosa и E. coli, его использование позволяет достоверно снизить количество E. coli с 109 до нулевых значений, а Ps. aeruginosa с 109 до 103 КОЕ/мл (pU ? 0,05).
3. Обработка инфицированных повреждений кожи антисептиком Анавидин приводит к ограничению системной воспалительной реакции, сохранности неспецифической резистентности и отсутствию сенсибилизации.
4. Применение антисептика Анавидин способствует ускорению заживления инфицированных повреждений кожи, о чем свидетельствует существенное уменьшение площади дефекта уже на 3-и сутки, уменьшение площади ран в 2 раза на 9-е сутки и нулевое значение показателя к 19-м суткам. Анавидин обладает стимулирующим регенерацию и заживление инфицированного кожного повреждения, вследствие антибактериального и противовоспалительного действия. Показано, что преобладание фибробластов в грануляционной ткани у животных опытной группы обеспечивает более быстрый темп созревания соединительной ткани, чем в контроле, на 3Ц4 дня, с закрытием кожного дефекта эпителием к 19-м суткам.
5. Использование водного раствора Анавидина на молочной ферме КРС для обработки помещений фермы и оборудования, контактирующего с выменем коровы, позволило снизить обсемененность обследованных предметов микроорганизмами с 60 % до нулевых значений. При микробиологическом исследовании инфицированных повреждений кожи у КРС был выявлен следующий видовой состав бактерий чувствительных к антисептику Анавидин: (104) КОЕ - Ps. aeuruginosa, Klebsiella spp., Fusobacterium necrophorum; Enterobacter agglomerans; Proteus mirabilis; Acinetobacter baumanii; Acinetobacter lwoffi; Bacillus spp.; (103) КОЕ - Enterobacter aerogenes, St.epidermidis, St. aureus, Cl. perfringens, E. coli.
Практические рекомендации
- Модель инфицированного повреждения кожи можно использовать для экспериментальной оценки новых методов лечения инфицированных повреждений кожи.
- Для улучшения репаративных процессов в зоне раневого дефекта в условиях инфицированного повреждения кожи рекомендовано использование 0,02% водного раствора антисептика Анавидин.
- Для подавления роста E. coli и микста Ps. aeruginosa и E. coli рекомендуется использовать раствор Анавидина в минимальной концентрации 0,0015%.
- С целью снижения обсемененности на молочной ферме КРС для обработки помещений фермы и оборудования контактирующего с выменем коровы целесообразно применение 1% водного раствора Анавидина.
- Наибольшее количество видов микроорганизмов выделенных из отделяемого у КРС, имело высокую чувствительность к нитрофурантоину, рифампицину, амикацину (в среднем 80Ц90 %), умеренную активность показали пефлоксацин и ципрофлоксацин (57Ц64 %).
Список работ, опубликованных по теме диссертации
- *Григорьев Г.Е., Ильина О.П., Лепехова С.А., Коваль Е.В., Рой Т.А., Батёха В.И Динамика бактериологической обсеменённости хронической раны под влиянием Анавидина // Бюл. ВСН - СО РАМН - 2005. - №3. - С. 216Ц217.
- *Григорьев Г.Е., Ильина О.П., Лепехова С.А., Фадеева Т.В., Коваль Е.В., Рой Т.А. Антисептик Анавидин для профилактики маститов у коров // Молочная промышленность - 2009. - № 4. - С. 79Ц80.
- Григорьев Г.Е., Ильина О.П., Лепехова С.А., Коваль Е.В., Фадеева Т.В. Сравнительная характеристика чувствительности микрофлоры инфицированной раны к антисептику Анавидин // Актуальные вопросы электрофизиологии и незаразной патологии животных: материалы международной практической конференции - Улан-Удэ, 2009. - С. 113 - 115.
- *Григорьев Г.Е., Ильина О.П., Лепехова С.А. Новые возможности в лечении гнойно-некротических ран у животных // Вестник КрасГАУ. - 2009. - № 11. - С. 146Ц151.
- Григорьев Г.Е., Ильина О.П., Коваль Е.В., Лепехова С.А. Влияние антисептика Анавидин на динамику бактериологической обсемененности гнойной раны // Актуальные вопросы ветеринарной медицины: матер. II Сибирского ветеринарного конгр. - Новосибирск, 2010. - С. 314Ц315.
- *Григорьев Г.Е., Гольдберг О.А., Лепехова С.А., Ильина О.П., Коваль Е.В., Суворикова В.А. Влияние нового сибирского антисептика Анавидин на заживление кожной инфицированной раны // Бюл. ВСН - СО РАМН. - 2010. - № 6 (76), Ч. 1. - С. 160Ц163.
- *Патент на изобретение Рос. Федерации № 2431890 Способ моделирования инфицированной кожной раны, от 20.10.2011 г. / авт.: Григорьев Г.Е., Лепехова С.А., Гольдберг О.А., Коваль Е.В.
- *Григорьев Г.Е., Гольдберг О.А., Лепехова С.А., Ильина О.П., Коваль Е.В. Морфологическая оценка заживления инфицированных повреждений кожи под влиянием антисептика Анавидин // Вестник КрасГАУ. - 2011. - № 12 - С. 191Ц195.
- *Григорьев Г.Е., Лепехова С.А., Зарицкая Л.В., Ильина О.П., Коваль Е.В., Гольдберг О.А., Постовая О.Н., Батунова Е.В.Влияние антисептика Анавидин на показатели неспецифической резистентности при заживлении инфицированных повреждений кожи // Вестник КрасГАУ. - 2012. - № 1. - С. 139-142.
- Григорьев Г.Е., Ильина О.П., Лепехова С.А., Фадеева Т.В., Шелупаев А.В., Савинова А.С. Применение антисептика Анавидин для профилактики и лечения инфицированных повреждений кожи в животноводстве: метод. рек. - Иркутск: НЦРВХ СО РАМН, 2011. - 28 с.
Примечание: * издания, рекомендованные ВАК для публикации результатов исследований
СПИСОК СОКРАЩЕНИЙ
КГ-2 |
- контрольная группа 2 |
КГ-3 |
- контрольная группа 3 |
КОЕ/г (мл) |
- колониеобразующие единицы в грамме (миллилитре) |
КРС |
- крупный рогатый скот |
ОАК |
- общий анализ крови |
ОГ |
- опытная группа |
ФИ(%) |
- фагоцитарный индекс |
ФЧ |
- фагоцитарное число |
ЦИК |
- циркулирующие иммунные комплексы |
НСТ-тест |
- спонтанный тест восстановления нитросинего тетразолия |
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
