 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
ОСОБЕННОСТИ ВЗАИМОДЕЙСТВИЯ BACILLUS ATROPHAEUS В - 9918 С РАСТЕНИЯМИ И ФИТОПАТОГЕННЫМИ ГРИБАМИ
Автореферат кандидатской диссертации
На правах рукописи

Коряжкина Мария Федоровна
особенности взаимодействия BacillusatrophAeus
В - 9918 срастениями и фитопатогенными грибами
03.02.03 - микробиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Саратов-2012
Работа выполнена в научно-исследовательской лаборатории микробиологического мониторинга ФГБОУ ВПО Астраханский государственный технический университет
Научный руководитель: |
доктор биологических наук, профессор Дзержинская Ирина Станиславовна |
|
Официальные оппоненты: |
доктор биологических наук, профессор Карпунина Лидия Владимировна доктор биологических наук, профессор Мелентьев Александр Ивановича |
|
Ведущая организация: |
Государственное научное учреждение Всероссийский научно-исследовательский институт сельскохозяйственной микробиологии Российской академии сельскохозяйственных наук (г. Пушкин) |
|
Защита состоится л14 марта 2012 года в 14 часов на заседании диссертационного совета Д 002.146.01 при Институте биохимии и физиологии растений и микроорганизмов Российской академии наук (410049, г. Саратов, просп. Энтузиастов, 13).
Автореферат диссертации размещен на официальном сайте Минобрнауки РФ и на сайте ИБФРМ РАН:
С диссертацией можно ознакомиться в научной библиотеке ИБФРМ РАН.
Автореферат разослана л а февраля 2012 г.
![]() Ученый секретарь диссертационного советаа
Ученый секретарь диссертационного советаа
доктор биологических наук, профессора В.Е. Никитина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Аэробные спорообразующие бактерии рода Bacillus имеют широкое распространение в биосфере, входят в состав сапротрофов и занимают различные экологические ниши в почвенных и водных экосистемах, однако по своей совокупной биомассе превалируют в почвенном покрове (Vargas-Ayala et al., 2000; McSpadden Gardener, 2004; Мелентьев, 2007; Современная микробиологияЕ, 2009).
Представители рода Bacillus способны заселять ризосферу и ризоплану растений, используя питательные вещества, продуцируемые растениями в виде корневых экзометаболитов. Они могут также синтезировать необходимые для растений биоконтрольные вещества, фитогормоны и витамины (Martin et al., 1987; Foldes et al., 2000; Мелентьев, 2007; Idris et al., 2007; Ortiz-Castro et al., 2008; Ahmed, Hasnain, 2010; Chen et al., 2010). Все вышеперечисленные свойства позволяют отнести их, наряду с ризобиями, псевдомонадами и микоризными грибами к группе PGPR (Schippers, 1992).
Бациллы участвуют во всех формах взаимоотношений с растениями: могут являться возбудителями заболеваний (Hosford, 1982; Пересыпкин, 1989; George N. Agrios, 2005); способствовать устойчивому росту и развитию растения; защищать растение от фитопатогенов (Nielsen, Sorensen, 1997; Широков и др., 2002; Harsh et al., 2004; Мелентьев, 2007; Чеботарь, 2007; Halalisani Gumede, 2008; Saharan, Nehra, 2011).
На природном явлении антагонизма микроорганизмов по отношению к фитопатогенам основан микробиологический способ защиты растений от болезней, который является одним из самых перспективных в связи с эго эффективностью и экологичностью.
На протяжении последних двадцати лет рядом исследователей (Filippi, 1987; Kim et al., 1997; Кузьмина, 1998; Новикова, 2004; Мелентьев, 2007; Gacitua et al., 2009; Patent US № 8025875, 2009) проводится работа по поиску бациллярных штаммов для создания эффективных биопрепаратов и средств защиты растений. Такие препараты перспективны, так как штаммы, входящие в их состав, продуцируют БАВ, гормоны и витамины, а также обладают пластичным метаболизмом и смешанной жизненной стратегией, сочетающей элементы r-, L- и K- стратегов (Новикова, 2005). Это позволяет им приспосабливаться к различным почвенным условиям, в том числе влажности (Backman et al., 1997; Мелентьев, 2000). Бациллярные биопрепараты совместимы с протравителями семян, гербицидами и инсектицидами (Кузьмина, 1998; Захарова, 2006; Фомина, 2009). У них выше срок хранения, благодаря наличию эндоспор, позволяющих сохранить культуру в жизнеспособном состоянии длительное время (Алехин, Злотников, 2006; Lolloo et al., 2010), что является важным условием при использовании их в интегрированной защите растений.
Современный ассортимент биопрепаратов позволяет осуществлять защиту сельскохозяйственных культур от наиболее опасных заболеваний. Однако их эффективность зависит от множества факторов, например: конкурентоспособности штаммов, входящих в состав биопрепарата по отношению к аборигенным микроорганизмам и возбудителям заболеваний растений, почвенно-климатических и других региональных условий (Захарова, 2006; Хайруллин и др., 2010). Биопрепаратов и микробиологических средств защиты, максимально адаптированных к условиям аридной зоны России в настоящее время не разработано.
Таким образом, поиск среди представителей рода Bacillusштаммов, выделенных из агроэкосистем аридной зоны, и обладающих биоконтрольными свойствами является весьма актуальным.
Цель исследований. Исследование особенностей взаимодействия Bacillusatrophаeus В - 9918с растениями и фитопатогенными грибами для использования штамма в агротехнологиях.
Задачи исследований:
1. Выделить представителей рода Bacillus из агроэкосистемы и изучить их морфологические, культуральные и физиолого-биохимические свойства.
2. Исследовать взаимодействие выделенных штаммов с растениями и фитопатогенными грибами.
3. Идентифицировать штамм с наибольшей фунгицидной и фитостимулирующей активностью и определить его способность к колонизации растений.
4. Изучить влияние штамма на рост томатов в вегетационных условиях.
5. Изучить влияние штамма на рост и устойчивость растений к заболеваниям в полевых опытах на томатах и арбузах.
Научная новизна работы. Из агроэкосистемы аридной зоны выделено 16 бациллярных штаммов и изучено их взаимодействие с микромицетами. Впервые установлено, что штамм Bacillusatrophaeus В - 9918 обладает фунгицидной активностью к широкому спектру фитопатогенов, фитостимулирующей активностью и способностью к эффективной колонизации ризосферы и ризопланы растений (на примере томата).
Показана зависимость фунгицидной и фитостимулирующей активности штамма Bacillusatrophaeus B-9918 от фазы роста культуры.
Впервые показана перспективность применения суспензии штамма Bacillusatrophaeus B-9918 как средства защиты сельскохозяйственных растений на примере томатов и арбузов.
Практическая значимость. Штамм Bacillusatrophaeus B-9918 предложен в качестве средства для стимуляции роста сельскохозяйственных растений и защиты их от болезней. Полученная лабораторная партия средства апробирована в вегетационных и полевых опытах. Разработана технология применения средства, включающая бактеризацию семян, инокуляцию под корень и опрыскивание.
ШтаммB. atrophaeus помещен в ВКПМ под номером B-9918. Подана заявка на изобретение Штамм Bacillusatrophaeus B-9918 в качестве средства для стимуляции роста и защиты растений от грибных болезней (заявка № 2010111829 (заявл. 26.03.2010)).
Результаты исследований являлись частью научной работы по госконтракту: Разработка микробного препарата для борьбы с заболеваниями сельскохозяйственных культур Астраханской области в 2010 - 2011 гг. Материалы диссертации использованы при подготовке курсовых и дипломных работ студентами специальности Микробиология, бакалаврами направления Биология и магистрами магистерской программы Микробиология и вирусология института рыбного хозяйства, биологии и природопользования АГТУ.
Основные положения, выносимые на защиту:
- Из агроэкосистемы выделен и идентифицирован штамм Bacillusatrophaeus, обладающий фунгицидными, фитостимулирующими свойствами и способностью к колонизации растений.
- Штамм Bacillusatrophaeus B-9918 подавляет рост F. culmorum, F. graminearum, F. poae, F. sporotrichoides, Aspergillusniger, Alternariatenuissima, Cladosporiumsp., Myceliasterilia, Phytiumultium, ивызываетаутолиз мицелия у Alternariasp.
- Фитостимулирующие свойства и способность к колонизации растений подтверждены в лабораторных экспериментах, вегетационных и полевых опытах активизацией ростовых процессов растений.
- Показана, что фунгицидная и фитостимулирующая активность штамма Bacillusatrophaeus B-9918 зависит от фазы роста культуры. Максимум антифунгальной и стимулирующей рост и развитие растений активности приходится на экспоненциальную фазу роста.
- Выявлена оптимальная концентрация клеток B. atrophaeus В-9918 в суспензии (107КОЕ/мл), при обработке которой наблюдается наибольший эффект стимуляции роста и развития арбузов в полевых и томатов в полевых и вегетационных опытах, а также снижение развития фузариоза и альтернариоза.
Апробация работы. Основные положения диссертационной работы и результаты исследований докладывались на: научно-практической конференции, посвященной 100-летию со дня рождения К.В. Горбунова Фундаментальные аспекты биологии в решении актуальных экологических проблем (Астрахань, 2008); 13-й, 14-й Пущинских международных школах-конференциях молодых ученых Биология - наука XXI века (Пущино, 2009, 2010); Всероссийской научной конференции с международным участием Физиология и генетика микроорганизмов в природных и экспериментальных системах (Москва, 2009); Всероссийской школе-семинаре для студентов, аспирантов и молодых ученых Нанобиотехнологии: проблемы и перспективы (Белгород, 2009); Всероссийском симпозиуме с международным участием Современные проблемы физиологии, экологии и биотехнологии микроорганизмов (Москва, 2009); Первых Международных Беккеровских чтениях (Волгоград, 2010), Всероссийской научно-практической конференции с международным участием Актуальные проблемы современной науки и образования (Уфа, 2010); Международной научной конференции: Инновационные технологии в управлении, образовании, промышленности АСТИНТЕХ - 2010 (Астрахань, 2010); Международной отраслевой научной конференции профессорско-преподавательского состава АГТУ, посвященной 80-летию основания АГТУ (Астрахань, 2010); Международной конференции молодых ученых: Биология: от молекулы до биосферы (Харьков, Украина, 2010), на Международной конференции с элементами научной школы для молодежи: Экокультура и фитобиотехнологии для улучшения качества жизни на Каспии (Астрахань, 2010).
Работа выполнена в лаборатории микробиологического мониторинга Астраханского государственного технического университета в соответствии с плановой темой НИР: Скрининг микроорганизмов с полезными свойствами для использования в экологической и сельскохозяйственной биотехнологии (№ гос. регистрации 01201051559, научный руководитель зав. лаб., д.б.н., проф. Дзержинская И.С.). Работа поддержана госконтрактом с министерством сельского хозяйства Астраханской области на выполнение научно-исследовательских и фундаментально-прикладных работ в 2010 - 2011 гг.: Разработка микробного препарата для борьбы с заболеваниями сельскохозяйственных культур Астраханской области (№ гос. регистрации 01.2.009.00158, научный руководитель зав. лаб., д.б.н., проф. Дзержинская И.С.).
ичный вклад соискателя. Представленные экспериментальные результаты получены лично автором. Определение концентрации цитокининов и ауксинов в культуральной жидкости определялось в Институте биологии Уфимского научного центра РАН совместно с к.б.н. Веселовым Д.С., нитрогеназную активность штамма B. atrophaeus B-9918 исследовали совместно с сотрудниками ВНИИ сельскохозяйственной микробиологии РАСХН. Соискатель принимал непосредственное участие в постановке всех задач исследования, подготовке и проведении экспериментов, вегетационных опытов и полевых исследований, обработке и обсуждении полученных результатов, подготовке публикаций.
Публикации. По материалам диссертации опубликовано 15 работ, в том числе 3 - в ведущих рецензируемых научных журналах ВАК. Подана заявка № 2010111829 (заявл. 26.03.2010) на выдачу патента РФ Штамм Bacillus atrophaeus B-9918 в качестве средства для стимуляции роста и защиты растений от грибных болезней / Дзержинская И.С., Коряжкина М.Ф.
Структура и объем работы. Диссертационная работа состоит из введения, обзора литературы, описания объектов и методов исследования, изложения результатов исследований и их обсуждения, выводов, списка литературы и приложений. Материалы диссертации изложены на 154 страницах машинописного текста, иллюстрированы 27 таблицами и 29 рисунками.
Работа выполнялась под руководством д.б.н., проф. И.С. Дзержинской которой автор выражает особую признательность и благодарность. Автор выражает глубокую благодарность к.б.н. Т.С. Фоминых за методическую помощь в постановке полевых экспериментов и ценные советы; к.б.н. В.К. Чеботарю за ценные советы и помощь в работе; д.с.-х. н. Ш.Б. Байрамбекову и к. с.-х. н. Е.В. Поляковой за методическую помощь в постановке полевых экспериментов; всему коллективу кафедры Прикладная биология и микробиология АГТУ за помощь и поддержку в процессе работы.
Содержание работы
Обзор литературы
Глава посвящена описанию особенностей взаимодействия бацилл с растениями и фитопатогенами. Рассмотрены механизмы защитного и стимулирующего воздействия бацилл на растения. Выявлена перспективность бацилл для создания эффективных биопрепаратов и средств защиты растений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В работе использовались микроорганизмы родаBacillus, выделенные из агроэкосистемы Ахтубинского района Астраханской области; штамм B. subtilis Ч13, фитопатогенные микромицеты Fusariumculmorum, F. graminearum, F.poae, F. sporotrichoides, Phytiumultium, Alternariatenuissima предоставленные лабораторией технологий микробных препаратов ВНИИ сельскохозяйственной микробиологии РАСХН имикромицетыAspergillusniger, Alternariasp., Cladosporiumsp., Myceliasterilia из коллекции кафедры Прикладная биология и микробиология АГТУ, семена кресс-салата Весенний, растения томата сортов Победитель, Новичок и Рио-Гранде Оригинал, растения арбуза сорта Васко.
Пробы почвы и воды для выделения микроорганизмов отбирались непосредственно в агроценозе (станция №1) и во фрагментах естественных агроэкосистем (водоеме - станция №2 и дубовом лесу - станция №3), входящих в состав агроэкосистемы.
Пробы почвы и воды из исследуемой агроэкосистемы отбирались общепринятыми методами (Родина, 1965; Теппер, 2004; Практикум по микробиологии, 2005) в соответствии с требованиями ГОСТ Р 51592-2000, ГОСТ 17.4.3.01-83; ГОСТ 28168-89. Отбор образцов растительного материала для фитопатологических анализов осуществлялся в соответствии с практикумами по фитопатологии (Попкова, 1988; Головин и др., 2002). Отбор проб для агрохимических анализов проводили классическими методами в соответствии с практикумами по агрохимии (Минеев, 1989; Практикум по агрохимии, 2001) и учебным пособием Основы научных исследований в агрономии (Моисейченко, 1996).
Микробиологические методы исследования включали: выделение и учет численности сапротрофных споровых и бесспоровых форм микроорганизмов (Родина, 1965; Теппер, 2004; Практикум по микробиологии, 2005; Зимоглядова др., 2007), исследование морфологических, культуральных и физиолого-биохимических свойств микроорганизмов (Руководство к практическим занятиям по микробиологии, 1983; 1995; Избранные задачи большого практикума по микробиологии, 1991; Теппер, 2004; Практикум по микробиологии, 2005), определение фунгицидной активности штаммов (Руководство к практическим занятиям по микробиологии, 1983), определение фитотоксичности и фитостимулирующей активности микроорганизмов (Методы экспериментальной микологии, 1982; Берестецкий, 1982; Методы почвенной микробиологии и биохимии, 1991; Ганнибал, 2007). Предварительную идентификацию микроорганизмов проводили по культурально-морфологическим и физиолого-биохимическим признакам, используя монографию Скворцовой И.Н. Идентификация почвенных бактерий рода Bacillus (1983), а также определители бактерий Берги (1980; 1997). Видовую идентификацию штамма B. atrophaeus В-9918 проводили путем секвенирования фрагментов гена 16S рРНК в ФГУП ГосНИИГенетика. Для определения способности штаммов к колонизации томатов в лабораторных условиях использовали гнотобиотическую установку (Simons et al., 1996) и методику стерилизации семян разработанную Н.В. Мальфамновой (Мальфамнова, 2008). Определение концентрации цитокининов и ауксинов в культуральной жидкости определяли методом твердофазного иммуноферментного анализа (Veselov et al., 1992).
Биотехнологические методы исследования включали: получение маточной культуры и суспензии штамма B. atrophaeusВ - 9918, а также определение кинетики роста микроорганизмов (Промышленная микробиология, 1989; Практикум по микробиологии, 2005).
Агрохимические анализы почв проводили по общепринятым методам: pH солевой вытяжки (ГОСТ 26483-85); влажность почвы, количество легкогидролизуемого азота, фосфора и калия (Практикум по агрохимии, 1989; Практикум по агрохимии, 2001). Постановку и проведение вегетационных и полевых опытов, фенологических наблюдений, снятие биометрических показателей, учет урожая вели в соответствии с практикумами по агрохимии (Ягодин, 1987; Практикум по агрохимии, 1989) и учебным пособием Основы научных исследований в агрономии (Моисейченко, 1996).
В работе также были использованы методы фитопатологии: определение видового состава комплекса плесневых грибов (Пидопличко, 1977; Саттон, 2001), развитие альтернариоза (Котова, 1986), развитие фузариоза (Попкова, 1988; Головин и др., 2002).
В вегетационных опытах проводили исследование влияния на томаты сорта Победитель бактеризации семян суспензией штамма B. atrophaeus В -9918 с титром клеток 109 КОЕ/мл, а также однократной и двукратной инокуляции под корень суспензией штамма с титром от 107 до 109 КОЕ/мл.
Полевые испытания были проведены в Астраханской области в Енотаевском районе (2009 г) на гибриде арбуза первого поколения Васко и в Харабалинском районе (2010 г) на томате Рио-Гранде Оригинал. Для бактеризации семян использовался рабочий раствор с концентрацией клеток штамма B. atrophaeusВ -9918 - 107 КОЕ/мл. В опытах проводили фенологические наблюдения, снятие биометрических показателей, определение степени поражения растений заболеваниями.
Анализ достоверности данных вели стандартными биометрическими методами (Доспехов, 1985; Ягодин, 1987; Практикум по агрохимии,1989; Платонов, 2000) с использованием пакета статистической обработки данных Excel.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Исследование взаимодействия представителей рода Bacillus с растениями и фитопатогенными грибами
Изучение представителей рода Bacillus, выделенных из агроценоза и фрагментов естественных агроэкосистем. Учет численности и оценка микробного разнообразия в сапротрофных сообществах проводились с целью исследования аэробных споровых форм.Исследования показали, что среди этой группы были выделены бактерии, актиномицеты и микромицеты (таблица 1). Численность аэробных спорообразующих бактерий в агроценозе составляет 8% , в почве дубового леса - 64%, в эвтрофированном водоеме - 21% от общей численности споровых форм.а а
Таблица 1. Численность некоторых групп микроорганизмов в сапротрофном сообществе агроэкосистемы
Место отбора проб |
Численность сапротрофов, lg x |
||||
Общая численность |
Споровые формы |
Аэробные спорообразующие бактерии |
Актиномицето - подобные формы |
Плесневые грибы |
|
Агроценоз (1 станция) |
9,2749,26 |
7,1304,81 |
5,7285,67 |
6,6535,70 |
6,3016,00 |
Дубовый лес (2 станция) |
9,021 8,98 |
6,875 6,40 |
6,6026,00 |
6,0975,88 |
6,0065,99 |
Эвтрофный водоем (3станция) |
5,1704,90 |
4,3983,70 |
3,7323,66 |
4,1763,70 |
3,7323,66 |
Аэробные спорообразующие бактерии выделяли чашечным методом с использованием питательных сред, селективным агентом в которых являлись соединения фосфора.а
Среди выросших колоний были отобраны бактерии с типичными для микроорганизмов рода Bacillus признаками: палочковидной формой клеток, грамположительные, спорообразующие, имеющие фермент каталазу. Всего было выделено 16 аэробных спорообразующих бактерий и получены их чистые культуры.
Исследование морфологических свойств чистых культур показало, что все исследуемые штаммы - грамположительные прямые палочки размером 1,5-6,3?0,6-2,5 мкм, с овальными или круглыми эндоспорами. Изучение культуральных и физиолого-биохимические свойства штаммов подтвердило, что все они являются представителями рода Bacillus.
По совокупности изученных свойств, штамм № 4 можно отнести к B. megaterium, штаммы № 6,8,11,13 и 15 к B. cereus, штамм №14 - к B. macerans. Штаммы № 1, 2, 3, 5, 7, 9, 10, 12, 16 не имеют совокупности физиолого-биохимических свойств, характерных для видов, описанных в определителях Скворцовой (1983) и Берги (1980; 1997).
Исследование взаимодействия выделенных штаммов с фитопатогенными грибами
Среди полученных 16 чистых фосформобилизующих штаммов бацилл был проведен первичный скрининг по фунгицидной активности. В качестве тест-культур использовались фитопатогенные микромицеты F. culmorumи F. graminearum.
Таблица 2. Фунгицидная активность исследуемых чистых культур бацилл
№ чистой культуры |
Диаметр зоны ингибирования, мм |
|||||
Fusarium graminearum |
Fusarium culmorum |
Aspergillus niger |
Alternaria sp. |
Cladosporium sp. |
Mycelia sterilia |
|
Bacillus sp.1 |
19,51,0*** |
0 |
- |
- |
- |
- |
Bacillussp.2 |
0 |
21,51,1*** |
- |
- |
- |
- |
Bacillussp.3 |
18,50,9*** |
21,51,1*** |
17,02,7*** |
24,00,1** |
28,51,4*** |
22,00,1*** |
Bacillussp.4 |
0 |
0 |
- |
- |
- |
- |
Bacillussp.5 |
0 |
20,01,0* |
- |
- |
- |
- |
Bacillussp.6 |
20,01,0*** |
21,51,1*** |
17,02,7*** |
30,04,1** |
23,00,1*** |
27,05,5*** |
Bacillussp.7 |
11,00,6*** |
17,00,9** |
- |
- |
- |
- |
Bacillussp.8 |
15,00,8*** |
0 |
- |
- |
- |
- |
Bacillussp.9 |
16,50,8*** |
0 |
- |
- |
- |
- |
Bacillussp. 10 |
22,51,1*** |
25,01,3*** |
15,51,4** |
26,02,7** |
29,54,1** |
22,04,1*** |
Bacillussp. 11 |
0 |
0 |
- |
- |
- |
- |
Bacillussp.12 |
0 |
20,01,0** |
- |
- |
- |
- |
Bacillussp. 13 |
13,50,7* |
20,01,0*** |
- |
- |
- |
- |
Bacillussp. 14 |
16,00,8* |
19,51,0* |
- |
- |
- |
- |
Bacillussp.15 |
22,01,1*** |
21,01,1*** |
15,51,4** |
22,00,1* |
19,56,9** |
17,50,1*** |
Bacillussp.16 |
18,50,9*** |
0 |
- |
- |
- |
- |
Примечание: жирным шрифтом обозначены штаммы с высокой фунгицидной активностью одновременно к F. culmorum и F. graminearum; * - усиленное спороношение, ** - аутолиз мицелия, *** - полное подавление роста, л- - свойство не исследовалось.
Анализ данных представленных в таблице 2 показал, что фунгицидной активностью по отношению к F. graminearum обладают 11, к F. culmorum - 10 из 16 исследуемых штаммов, 2 штамма (№ 4 и 11) не проявляли фунгицидной активности ни к одной из тест-культур. Штаммы № 3,6,7,10,13,14,15 ингибировали рост одновременно двух тест-объектов. Исследуемые антагонисты отличались по характеру воздействия на мицелиальные грибы, которое проявлялось в аутолизе мицелия (№7), усиленном спороношении (№13,14), полном подавлении прорастания конидий (№ 3,6,10,15). У штаммов № 3,6, 10 и 15 также были обнаружены наибольшие зоны ингибирования роста фитопатогенов (18,5-25 мм).
Таким образом, для вторичного скрининга отобраны штаммы № 3,6,10,15. Данные штаммы исследовались на наличие фунгицидной активности по отношению кAspergillusniger, Alternariasp., Myceliasterilia и Cladosporiumsp. Результаты исследований представлены в таблице 2.
Установлено, что аутолиз мицелия Aspergillusniger и Cladosporiumsp. вызывают штаммы № 10 и 15, полностью подавляют рост данных микромицетов штаммы № 3 и 6. К усиленному спороношению Alternariasp. приводят штаммы 3,6, 10, штамм № 15 вызывает аутолиз его мицелия. Все исследуемые штаммы подавляют рост Myceliasterilia.
Проведенное исследование подтверждает мнение А.И. Мелентьева (2007) о том, что действие бацилл может быть избирательным и специфически проявляется по отношению к определенным видам грибов. По нашим данным (таблица 2) наиболее устойчивой к воздействию исследуемых бацилл является Alternariasp., наиболее чувствительной - Myceliasterilia.
Вторичный скрининг показал, что штаммы № 3 и 6 обладают наибольшими зонами ингибирования микромицетов и полностью подавляют их рост. Для исследования взаимодействия этих штаммов с растениями кроме них для сравнения использовали штаммы № 10 и 15.
Изучение взаимодействия выделенных штаммов с растениями
Взаимодействие выделенных штаммов с растениями изучали на основании проявлениями ими фитотоксичности и фитостимулирующей активности в эксперименте на прорастание семян кресс-салата Весенний. Семена замачивали в суспензии штаммов с титром клеток 109-1010КОЕ/мл. Токсичными считали культуры, вызывающие снижение всхожести семян или угнетение роста проростков и корней более чем на 30% по сравнению с контролем (Методы экспериментальной микологии, 1982). Количество проросших семян, а также длина корня и побега в контроле были приняты за 100 %. Результаты эксперимента приведены в таблице 3.
Таблица 3. Фитотоксичность и фитостимулирующая активность исследуемых штаммов.
№ чистой культуры |
Всхожесть семян, в % |
Количество проросших семян |
Длина проростков кресс- салата |
||||
в абс. величинах, шт. |
в % к контролю |
в абс. величинах, мм |
в % к контролю |
||||
корень |
побег |
корень |
побег |
||||
контроль |
82 |
412,1 |
100 |
44,44,5 |
23,51,0 |
100 |
100 |
Bacillussp. 3 |
96 |
482,4 |
117 |
47,83,6 |
26,10,9 |
107,7 |
111,1 |
Bacillus sp. 6 |
88 |
442,2 |
107 |
41,93,9 |
26,00,9 |
94,4 |
110,6 |
Bacillus sp. 10 |
86 |
432,2 |
104 |
55,04,8 |
24,01,1 |
123,9 |
102,1 |
Bacillus sp. 15 |
96 |
482,4 |
117 |
26,62,9 |
20,81,0 |
59,9 |
88,5 |
Анализ ростовых показателей и всхожести семян выявил, что штамм № 15 фитотоксичен, штаммы № 3, 6, и 10 являются не токсичными для растений и стимулируют их рост. Наибольшее положительное воздействие на всхожесть и ростовые процессы растения оказывает штамм № 3 (таблица 3).
По совокупности выявленных фунгицидных и фитостимулирующих свойств штамм №3 может быть использован в агроэкологии как средство защиты растений от грибных заболеваний и стимуляции их роста. Идентификация штамма Bacillussp. 3 путем секвенирования фрагментов гена 16S рРНК позволила отнести его к Bacillusatrophaeus. Штамм депонирован ВКПМ под коллекционным номером В - 9918.
Изучение взаимодействия Bacillusatropheus В - 9918 с растениями и фитопатогенными грибами
Установлено, что B. atrophaeus B-9918 (Bacillussp. 3) проявляет фунгицидную активность по отношению к следующим микромицетам:F. сulmorum, F. graminearum, Aspergillusniger, Alternariasp., Cladosporiumsp. и Myceliasteriliа. Фунгицидные свойства штамма проявлялись вполном подавлении прорастания F. culmorum, F. graminearum, Aspergillusniger, Cladosporiumsp, и в аутолизе мицелия Alternariasр. Для исследования более широкого спектра фунгицидных свойств штамма B. atropheus B-9918 использовались тест-культуры: F. poaе, F. sporotrichoides, Phytiumultium, Alternariatenuissima.
Исследования показали, что штамм B. atrophaeus B-9918 обладает выраженной фунгицидной активностью по отношению к исследуемым тест-объектам и подавляет прорастание конидий, что связано, по видимому, с высокой концентрацией антибиотических веществ, выделяемых антагонистом в среду. На рисунке 1 представлен полный спектр фунгицидного действия B. atrophaeus B-9918 и характер его воздействия на все исследуемые фитопатогенные грибы.
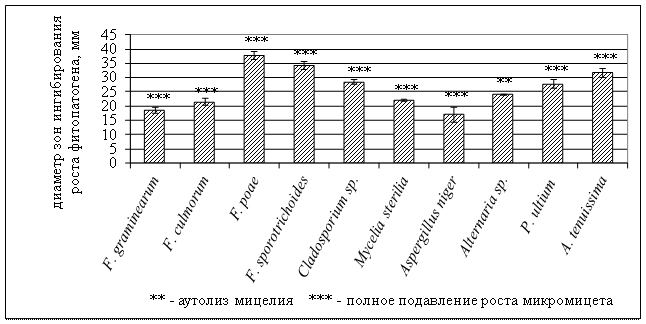 Рисунок 1 - Фунгицидная активность Bacillus atrophaeus B-9918
Рисунок 1 - Фунгицидная активность Bacillus atrophaeus B-9918
Штамм B. atrophaeus B-9918 оказывает фунгицидное воздействие на следующие фитопатогенные грибы: F. сulmorum, F. graminearum, F. poaе, F. sporotrichoides, Aspergillusniger, Alternariatenuissima, Alternariasp., Cladosporiumsp., Myceliasterilia, Phytiumultium. У всех исследуемых тест-объектов, кроме Alternariasp., B. atrophaeus B-9918 вызывает полное подавление роста (рисунок 1). У Alternariasp. штамм вызывает аутолиз мицелия.
Исследование способности штамма B. atrophaeus В -9918 к эффективной колонизации томатов в лабораторных условиях. Микроорганизмы проявляют комплекс положительных эффектов на рост и развитие растений, в том числе фитостимуляцию, только при успешной колонизации корней и способности поддерживать свою численность в ризосфере (Benizeri et al., 2001). Положительный эффект на рост и развитие растений достигается при поддержании в ризоплане минимальной концентрации бактериальных клеток > 104 КОЕ/см2 корня (Соколов, 1990).
Ранее показана фитостимулирующая активность штамма, что вызывает необходимость подтверждения этого эффекта исследованием способности штамма к колонизации и поддержанию численности в ризосфере растения.
Способность штамма B. atrophaeus В -9918 к эффективной колонизации ризосферы и ризопланы растений исследовали на томатах сорта Новичок. В качестве эталона использовался штамм B. subtilis Ч13, обладающий фунгицидной активностью, рост-стимулирующими свойствами и являющийся активным колонизатором ризосферы и ризопланы растений (Кравченко и др., 2002; Чеботарь 2007).
Для получения проростков томата использовали методы поверхностной стерилизации семян и гнотобиотическую установку, разработанную Симонсом с коллегами (Simons et al., 1996). Поверхностно стерилизованные семена томата обрабатывали суспензией штаммов B. atrophaeus В -9918 и B. subtilis Ч13 с титром клеток 107 и 106 КОЕ/мл в течение 1 ч при комнатной температуре. Семена помещали в стерильный кварцевый песок, предварительно смоченный питательным раствором для растений, на глубину 1,0 см и проращивали в течение 14 - 35 суток при температуре 200C в люминостате. Затем определяли количество микроорганизмов в ризосферной почве и численность микроорганизмов ризопланы. Результаты исследования представлены на рисунке 2.
Численность В. atrophaeusВ -9918 в ризосфере томата на 14 сутки при обработке семян суспензией с титром 106 КОЕ/мл составляла 5?108 КОЕ/г. При обработке семян суспензией с титром 107КОЕ/мл - 3?108 КОЕ/г. Численность B. subtilis Ч-13 в ризосфере при обработке семян суспензией штамма с титром 107 КОЕ/мл была несколько выше (5?109 КОЕ/г) (рисунок 2).
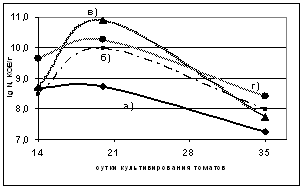
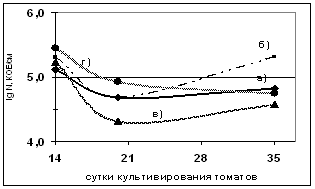
а)аа б)
Примечание - а) В. atrophaeusВ -9918 с титром 106 КОЕ/ мл; б) В. atrophaeusВ -9918 с титром 107 КОЕ/ мл; в)B. subtilisЧ13 с титром 106 КОЕ/ мл; г)B. subtilisЧ13 с титром 107 КОЕ/ мл
Рисунок 2 - Динамика численности исследуемого штамма в а) ризосфере и б) ризоплане томата в гнотобиотических системах.
На 20 сутки в ризосферной почве растений, бактеризованных суспензией B. atrophaeus B-9918 с титром 106 КОЕ/мл, численность клеток штамма осталась на прежнем уровне (5?108 КОЕ/г). В ризосфере растений, бактеризованных суспензией штамма с титром 107 КОЕ/мл, численность клеток B. atrophaeus B-9918 на 20 сутки увеличилась до 1010 КОЕ/г. Численность эталонного штамма в ризосфере томатов, бактеризованных суспензией с титром 106 КОЕ/мл, увеличилась до 1011 КОЕ/г, а в ризосфере растений, бактеризованных суспензией с титром 107 КОЕ/мл, составила 1010 КОЕ/г.
На 35 сутки после бактеризации численность всех штаммов интродуцентов в ризосфере томата снижается до 108 КОЕ/г. Следовательно, B. atrophaeus B-9918 стабильно присутствует в ризосферной почве исследуемых томатов в течение эксперимента.
В наших экспериментах установлено, что штамм B. atrophaeusВ -9918 заселяет не только ризосферу растения, но и поверхность корня (ризоплану) (рисунок 2).
В ризоплане в течение всего эксперимента численность клеток штаммов B. atrophaeus B-9918 и B. subtilis Ч-13 колебалась незначительно в приделах 104-105 КОЕ/см2 корня (рисунок 2).
Таким образом, еще раз подтверждена колонизирующая способность эталонного штамма B. subtilis Ч-13 и показано, что численность B. atrophaeus B-9918 на протяжении всего эксперимента была не ниже 104 КОЕ/см2 корня, что необходимо для проявления положительных эффектов на рост и развитие растений.
Изучение взаимодействия BacillusatrophaeusВ - 9918 с растениями и фитопатогенными грибами в условиях вегетационных и полевых опытов
Фунгицидная и фитостимулирующая активность штамма в различные фазы культивирования. Для исследования фунгицидной и фитостимулирующей активности B. atrophaeusВ -9918 в процессе культивирования использовали оптимальные для роста штамма жидкие среды: бобовый отвар и среду ВКМ-1. Штамм культивировали при температуре 280С и непрерывном перемешивании на качалке (120 об/мин). В качестве тест-объекта использовался микромицет F. graminearum. Фунгицидная активность суспензии штамма определялась каждые 24 часа в течение 10 суток с помощью модификации метода диффузии в агар с использованием лунок на среде Чапека с титром F. graminearum - 106 спор/мл (Руководство к практическим занятиям по микробиологии, 1983; ГОСТ 9.048-89). Полученные результаты представлены на рисунке 3 (а, б).
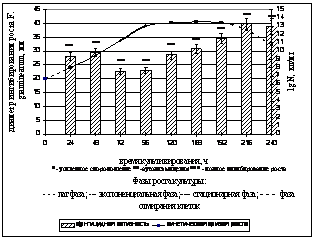
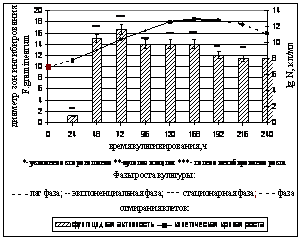
а) б)
в)
Рисунок 3. Фунгицидная и фитостимулирующая активность B. atrophaeus В -9918в динамике: а) фунгицидная активность на бобовом отваре; б) фунгицидная активность на жидкой среде ВКМ-1; в) фитостимулирующая активность на бобовом отваре.
Установлено, что пики фунгицидной активности B. atrophaeus B-9918при его культивировании на бобовом отваре приходятся на экспоненциальную фазу роста с титром клеток 5*109 КОЕ/мл (48ч культивирования) и на фазу отмирания с титром клеток 1012 КОЕ/мл (216 ч культивирования). Наличие двух максимумов фунгицидной активности при культивировании B. atrophaeus В-9918 на бобовом отваре, по-видимому, связано с выделением первичных метаболитов в экспоненциальной фазе роста, а также вторичных метаболитов (антибиотики) в фазе отмирания. Полученные данные соответствуют мнению Г.Э. Актуганова с соавторами (Актуганов и др., 2003) о комплексном механизме подавления роста грибов штаммами рода Bacillus, заключающемся во взаимодействии гидролитических ферментов с антибиотическими веществами.
При культивировании штамма на жидкой питательной среде ВКМ-1 пик фунгицидной активности приходится на экспоненциальную фазу роста (72 ч) с титром клеток в суспензии - 1010 КОЕ/мл (рисунок 3 (б)).
Установлено, что максимум фунгицидной активности штамма при культивировании на бобовом отваре приходится на 48 ч культивирования, а на ВКМ-1 на 72 часа культивирования. При культивировании штамма на среде ВКМ-1 физиологическое действие штамма заключается как в полном подавлении роста фитопатогена (48-148 ч), так и в аутолизе мицелия (24 ч, 192-216ч) и усилении спороношения микромицета (240 ч). При культивировании B. atrophaeus В-9918 на бобовом отваре фитопатоген чувствительнее к суспензии штамма, что проявляется в полном подавлении роста микромицета, а также в большем, чем на среде ВКМ-1 диаметре стерильных зон.
Таким образом, бобовый отвар по сравнению со средой ВКМ-1 является средой наиболее оптимальной для культивирования B. atrophaeus B-9918 и проявления им фунгицидных свойств. Поэтому для исследования фитотоксичности и фитостимулирующих свойств, проявляемых в процессе культивирования штамма, использовался бобовый отвар.
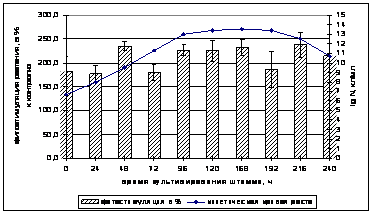
Фитотоксичность и фитостимулирующую активность штамма определяли каждые 24 часа с помощью бактеризации семян кресс-салата Весенний. Зависимость длины проростков кресс-салата от фазы роста штамма B.atrophaeus В-9918 представлена на рисунке 3 (в). а
Исследования показали, что максимумы стимуляции роста проростков приходятся на 48 и 216 часов культивирования при титре клеток 109 и 1012 КОЕ/мл соответственно (рис. 3 (в)).
Таким образом, суспензию штамма B. atrophaeusB-9918 с активными антифунгальными свойствами и фитостимулирующей активностью можно получить через 48 часов культивирования на бобовом отваре, при этом титр клеток составляет 109 КОЕ/мл.
Вегетационные опыты с томатами сорта Победитель. Изучение влияния на рост томатов бактеризации семян и однократной и двукратной корневой инокуляции растений суспензией штамма B. atrophaeus B-9918 проводилось в вегетационных опытах на томатах сорта Победитель.
В опыте по бактеризации семян использовалась суспензия штамма в экспоненциальной фазе роста с титром клеток 109 КОЕ/мл. В эксперименте по изучению влияния однократной и двукратной инокуляции использовался интервал значений титра клеток от 107 до 109 КОЕ/мл. Полученные данные представлены в таблице 4.
При бактеризации семян суспензией штамма B. atrophaeus B-9918 с титром клеток 109КОЕ/мл высота растения и длина корня соответствуют данным контроля (таблица 4). Биомасса растений в опыте была ниже, чем контроле.
Таблица 4. Влияние бактеризации и корневой инокуляции суспензией штамма BacillusatrophaeusВ-9918 на ростовые показатели томата.
Титр клеток в суспензии, КОЕ/г (количество обработок) |
возраст растений (сут.) |
средняя высота растений, мм |
средняя длина корня, мм |
биомасса растений, г |
Контроль |
||||
- |
15 |
67,615,4 |
61,31,3 |
1,20,21 |
25 |
132,816,6 |
|||
40 |
183,330,3 |
|||
Бактеризация |
||||
109 |
15 |
59,25,3 |
46,51,5 |
0,650,07 * |
25 |
102,17,2 |
|||
40 |
132,03,1 |
|||
Корневая инокуляция |
||||
107 а(однократно) |
15 |
128,49,5* |
41,59,8 |
1,940,1 (61%) |
25 |
184,024 |
|||
40 |
214,25,8 |
|||
107 (двукратно) |
15 |
113,11,9* |
60,010,0 |
1,600,10 (33%)* |
25 |
167,518,0 |
|||
40 |
240,05,8* |
|||
5*107 (однократно) |
15 |
72,89,0 |
44,27,5 |
1,270,25 |
25 |
106,113,6 |
|||
40 |
133,119,2 |
|||
5*107 (двукратно) |
15 |
98,36,8* |
43,31,7 |
0,650,08 (-46%)* |
25 |
124,88,9 |
|||
40 |
150,318,1 |
|||
108 (однократно) |
15 |
90,24,1* |
48,51,0 |
1,140,41 |
25 |
114,07,7 |
|||
40 |
155,815,9 |
|||
108 (двукратно) |
15 |
89,28,8* |
37,57,5 |
0,730,04 (-39%)* |
25 |
123,613,0 |
|||
40 |
158,72,8 |
|||
5*108 (однократно) |
15 |
75,316,8 |
62,517,5 |
1,270,41 |
25 |
119,329,3 |
|||
40 |
190,339,4 |
|||
5*108 (двукратно) |
15 |
67,94,5 |
43,97,6 |
0,640,15 (-47%)* |
25 |
106,116,6 |
|||
40 |
150,318,1 |
|||
109 (однократно) |
15 |
82,811,2 |
50,010,0 |
0,960,1 |
25 |
128,618,6 |
|||
40 |
155,529,3 |
|||
109 (двукратно) |
15 |
65,512,4 |
40,01,1 |
0,600,1 (-45%) |
25 |
104,015,0 |
|||
40 |
135,720,1 |
|||
Примечание: * различия с контролем существенны при p=0,95, в скобках указан % стимуляции или ингибирования роста по отношению к контролю
Анализ данных эксперимента (40 суток) показал, что инокуляция под корень суспензии штамма B. atrophaeus B-9918 может не оказывать влияния, ингибировать или стимулировать рост томатов в зависимости от титра клеток и от варианта обработки. Суспензия с титром >107 КОЕ/мл при однократной инокуляции не оказывает влияния на ростовые процессы томатов, при двукратной инокуляции ингибирует прирост биомассы. Угнетение роста томатов, возможно,связано с высокой концентрацией метаболитов в суспензии, что согласуется с мнением А.И. Мелентьева (Мелентьев, 2007), о том, что микроорганизмы рода Bacillus при высоких концентрациях подавляют рост растений, а при низких - активируют защитные реакции организма, и тем самым стимулируют их рост. Последнее наблюдается при однократной и двукратной инокуляции суспензией клеток с титром 107 КОЕ/мл. При этом прирост биомассы составляет 61% и 33 % соответственно.
Таким образом, наиболее выраженное положительное влияние на томаты оказывают однократная и двукратная инокуляция суспензией штамма с титром 107 КОЕ/мл под корень растения.
Полевые опыты. Изучение влияния штамма B. atrophaeusB-9918 на рост и устойчивость арбузов к фузариозу проводилось в открытом грунте на гибриде арбуза первого поколения Васко. Для инокуляции семян использовался рабочий раствор с концентрацией клеток штамма B. atrophaeusB-9918 - 107 КОЕ/мл. В полевом опыте определяли нарастание биомассы, количество настоящих листьев, симптомы фузариоза и влияние интродукции штамма на аборигенную микрофлору ризосферы арбуза.
Установлено, что бактеризация семян суспензией B.atrophaeusB-9918не оказывает негативного влияния нааборигенную микрофлору ризосферы арбуза. В контроле количество растений с симптомами фузариоза составляет 9%, у растений, обработанных суспензией штамма, симптомы фузариоза отсутствуют. При этом прирост биомассы по сравнению с контролем составляет 79%.
Изучение влияния штамма B. atrophaeus B-9918 на рост и устойчивость томатов к альтернариозу проводили на томате Рио-Гранде Оригинал. В опыте использовался рабочий раствор с концентрацией клеток B. atrophaeusB-9918 - 107 КОЕ/мл. Схема опыта включала следующие варианты: 1) контроль; 2) бактеризация семян; 3) бактеризация семян + 2-х кратный пролив растений под корень; 4) бактеризация семян + 2-х кратное опрыскивание.
Установлено, что бактеризация семян штаммом B. atrophaeus B-9918 с титром клеток 107 КОЕ/мл не оказывает ингибирующего воздействия на основные ростовые показатели томатов в фазу 1-4 настоящего листа и фазу цветения, при этом наблюдается более раннее образование первой цветочной кисти.
Исследование ростовых показателей томатов в фазу цветения при обработке рабочим раствором показало, что высота растений, общая длина побегов и площадь листовой поверхности зависят от вариантов опыта. Наиболее эффективным вариантом является бактеризация + опрыскивание, при котором высота растений превышает контрольную на 33%, площадь листовой поверхности - на 72%.
Исследования биометрии томатов в фазу плодообразования показало, что все варианты обработки растений рабочим раствором оказывают стимулирующее воздействие на высоту растений (12-22%) и количество плодов (121-182%). В варианте бактеризация + опрыскивание кроме того наблюдается увеличение площади листовой поверхности на 54,8%.
Анализ развития альтернариоза в фазу плодообразования показал, что альтернариоз отмечен как в контроле, так и во всех вариантах опыта. Сопоставимые результаты получены в контроле и в варианте бактеризация + пролив. Биологическая эффективность суспензии штамма B. atrophaeus B-9918 против альтернариоза отмечена в вариантах бактеризация (8,1%) и бактеризация + опрыскивание (34,6%).
По совокупности положительных эффектов можно отметить вариант бактеризация + опрыскивание, при котором наблюдается стимуляция роста томатов, на фоне которой фунгицидные свойства штамма B. atrophaeus B-9918 способствуют снижению развития альтернариоза.
Таким образом, суспензию штамма B. atrophaeus B-9918 с титром 107КОЕ/мл можно рекомендовать для разработки средства для стимуляции роста и защиты растений от грибных болезней.
ВЫВОДЫ
1. Из агроэкосистемы аридной зоны выделено 16 штаммов аэробных спорообразующих бактерий, которые по морфологическим, культуральным и физиолого-биохимическим свойствам отнесены к роду Bacillus.
2. В результате скрининга по фунгицидной активности отобрано 14 штаммов, действие которых по отношению к исследуемым микромицетам является избирательным и специфичным. Наибольшей антифунгальной активностью обладают 4 штамма, из них один - фитотоксичен, три - способны к фитостимуляции.
3. Штамм, обладающий наиболее выраженной фунгицидной активностью к представителям рода FusariumиAlternaria, фитостимулирующей активностью и способностью к колонизации растений идентифицирован как Bacillusatrophaeus. Штамм B. atrophaeus В-9918 способен поддерживать численность в ризосфере томата в приделах 2*107-1010 КОЕ/ г а.с.п.; в ризоплане - в приделах 4,8*104-4,6*105 КОЕ/ см2 корня, что достаточно для проявления положительных эффектов на рост и развитие растений.
4. Наиболее эффективной концентрацией клеток в суспензии при корневой инокуляции томатов в вегетационных экспериментах является титр 107 КОЕ/мл, стимулирующий прирост биомассы растения на 61% и 33% при однократной и двукратной инокуляции соответственно.
- В полевых опытах на арбузах показано, что бактеризация семян суспензией штамма B. atrophaeus В-9918 с титром 107 КОЕ/мл стимулирует прирост биомассы растения на 79% и подавляет развитие фузариоза на 100%.
- В полевых опытах на томатах во всех вариантах обработки (бактеризация семян, бактеризация + опрыскивание, бактеризация + пролив под корень) суспензией штамма B. atrophaeus В-9918 с титром 107 КОЕ/мл стимулируются ростовые процессы растения: увеличивается высота растений (12-33%), площадь листовой поверхности (38-72%). Наиболее эффективным вариантом обработки, снижающим развитие альтернариоза на 34,6%, является бактеризация + опрыскивание.
РАБОТЫ, ОПУБЛИКОВАННЫЕ ПО ТЕМЕ ДИССЕРТАЦИИ
- Коряжкина М.Ф. Исследование фунгицидной активности представителей рода Bacillus // Фундаментальные аспекты биологии в решении актуальных экологических проблем: Материалы Международной научно-практической конференции, посвященной 100-летию со дня рождения К.В. Горбунова. - Астрахань, 2008.- С. 121-124.
- Дзержинская И.С., Коряжкина М.Ф. Исследование фунгицидной активности представителей рода Bacillus // Естественные науки. - 2009.- № 2. - С. 16-20.
- Коряжкина М.Ф., Дзержинская И.С. Полифункциональный комплекс микроорганизмов для повышения эффективности биоремедиации прибрежных нефтезагрязненных территорий // Защита окружающей среды в нефтегазовом комплексе. - 2009. - №9. - С. 59-61.
- Коряжкина М.Ф. Фунгицидные и фитостимулирующие свойства Bacillus atrophaeus // Биология - наука XXI века: Тезисы 13-й Пущинской международной школы-конференции молодых ученых. - Пущино, 2009. - С. 168.
- Дзержинская И.С., Коряжкина М.Ф. Фунгицидные свойства Bacillus atrophaeus // Бюллетень Московского Общества испытателей природы. Отдел биологический. Приложение 1 Физиология и генетика микроорганизмов в природных и экспериментальных системах. - Москва, 2009. - Том 114. - Выпуск 2. -С. 229-231.
- Коряжкина М.Ф. Метаболиты, участвующие в формировании фунгицидной активности Bacillus atrophaeus // Нанобиотехнологии: проблемы и перспективы: тезисы Всероссийской школы-семинара для студентов, аспирантов и молодых ученых. - Белгород, 2009. - С. 21-23.
- Коряжкина М.Ф., Дзержинская И.С.Bacillus atrophaeus B-9918 - перспективный штамм для разработки биопрепарата для защиты растений и стимуляции их роста // Современные проблемы физиологии, экологии и биотехнологии микроорганизмов: Материалы Всероссийского симпозиума с международным участием. - М.:МАКС Пресс, 2009. - С. 55.
- Коряжкина М.Ф. Исследование фунгицидных и фитостмулирующих свойств штамма B. atrophaeus B-9918 в лабораторных и полевых экспериментах // Биология - наука XXI века: Тезисы 14-й Пущинской международной школы-конференции молодых ученых. - Пущино, 2010. - С. 260-261.
- Коряжкина М.Ф. Использование культуры Bacillus atrophaeus SKD - 1 для разработки биопрепарата с фунгицидными свойствами // Первые Международные Беккеровские чтения (Волгоград, 27-29 мая 2009 года). Сборник научных трудов по материалам конференции. Часть 2. - Волгоград, 2009. - С. 123-125.
- Коряжкина М.Ф. Исследование эффекта колонизации арбузов (CITRULLUS VULGARIS) штаммом Bacillus atrophaeus B-9918 // Актуальные проблемы современной науки и образования. Биологические науки: Материалы Всероссийской научно-практической конференции с международным участием. Том 2.-Уфа: РИ - БашГУ, 2010. - С. 234-239.
- Коряжкина М.Ф. Новый микробный препарат для борьбы с заболеваниями сельскохозяйственных культур и оздоровления почв сельскохозяйственного назначения // Инновационные технологии в управлении, образовании, промышленности АСТИНТЕХ- 2010: Материалы. Международной научной конференции (Астрахань, 11-14 мая 2010 года). Том 3. - Астрахань, 2010. - С. 33 - 34.
- Дзержинская И.С., Коряжкина М.Ф. Штамм Bacillus atrophaeus B-9918Ч перспективный объект сельскохозяйственной микробиологии и биотехнологии // Международная отраслевая научная конференция профессорско-преподавательского состава АГТУ, посвященная 80-летию основания АГТУ. - Астрахань, 2010. - С. 19-20.
Коряжкина М.Ф. Bacillusatrophaeus SKD - 1 как перспективный штамм для разработки биопрепарата // Юг России: экология, развитие. -2010. - № 4. - С. 80-83.
14. Коряжкина М.Ф. Изучение хозяйственно-ценных свойств штамма Bacillus atrophaeus // Материалы V Международной конференции молодых ученых (Харьков, Украина, 22-25 ноября 2010 года).- Х.: Оперативная полиграфия, 2010. - С. 224-225.
15. Коряжкина М.Ф. Изучение фунгицидных и фитостимулирующих свойств штамма Bacillusatrophaeus B-9918 в условиях лабораторного эксперимента // Экокультура и фитобиотехнологии улучшения качества жизни на Каспии: Материалы Международной конференции с элементами научной школы для молодежи. - Астрахань: Издательский дом Астраханский университет, 2010. - С. 368 - 371.
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
