 Все авторефераты докторских диссертаций
Все авторефераты докторских диссертаций
Репродуктивная биология и экология размножения представителей родов Cerasus, Microcerasus и Amygdalus (Rosaceae)
Автореферат докторской диссертации
На правах рукописи

Яндовка Людмила Федоровна
РЕПРОДУКТИВНАЯ БИОЛОГИЯ И ЭКОЛОГИЯ РАЗМНОЖЕНИЯ ПРЕДСТАВИТЕЛЕЙ РОДОВ CERASUS, MICROCERASUS
И AMYGDALUS(ROSACEAE)
03.02.01 - ботаника
03.02.08 - экология (биология)
Автореферат диссертации на соискание ученой степени доктора
биологических наук
а
Пермь - 2012
Работа выполнена в ФГБОУ ВПО Тамбовский государственный университет имени Г.Р. Державина
Научные консультанты: доктор биологических наук, профессор,
Шамров Иван Иванович
доктор биологических наук, профессор,
Тарбаева Вероника Михайловна
Официальные оппоненты:
Круглова Наталья Николаевна, доктор биологических наук, профессор, ФГБУН Институт биологии Уфимского научного центра РАН, заведующая лабораторией экспериментальной эмбриологии растений
Силаева Татьяна Борисовна, доктор биологических наук, профессор, ФГБОУ ВПО Мордовский государственный университет им. Н.П. Огарева, профессор кафедры ботаники и физиологии растений
Колясникова Надежда Леонидовна, доктор биологических наук, доцент, ФГБОУ ВПО Пермская государственная сельскохозяйственная академия имени академика Д.Н. Прянишникова, заведующая кафедрой ботаники, генетики, физиологии растений и биотехнологий
Ведущая организация ФГБОУ ВПО Санкт-Петербургский государственный аграрный университет
Защита состоится 25 мая 2012 г. в 13 часов 30 минут на заседании диссертационного совета Д 212.189.02 при Пермском государственном национальном исследовательском университете, 614990, г. Пермь, ул. Букирева, 15
Адрес сайта: //www.psu.ru
Факс: (342)2371611
E-mail: novoselova@psu.ru
С диссертацией можно ознакомиться в библиотеке Пермского государственного национального исследовательского университета
Автореферат разослан 15 марта 2012 г.
Ученый секретарь а
диссертационного совета аа![]() Новоселова Л.В.
Новоселова Л.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы.
Многие косточковые растения имеют большое практическое значение. В настоящее время длительно культивируемые растения вишни и черешни в ряде регионов выводятся из сельскохозяйственного производства в связи с гибелью их насаждений. Разработка теоретических основ размножения растений, выявление пластичности систем репродукции являются залогом успеха новых нестандартных технологий в генетике, селекции и семеноводстве (Батыгина, 1974, 1987; Кордюм, 1978; Boesewinkel, Bouman, 1984; Терехин, 1996, и др.). В связи с практической необходимостью получения более продуктивных форм, к которым относятся косточковые растения, важно выявить причины, вызывающие нарушения в протекании репродуктивных процессов и приводящие к снижению семенной продуктивности.
Сем. Rosaceae включает от 110 до 115 родов и более 3500 видов. Система розоцветных перестраивается, ранги семейства постоянно меняются. Существуют разные мнения о систематическом положении видов вишни, черешни и миндаля, относящихся к подсем. Prunoideae(Камелин, 2006), или Amygdaloideae(Takhtajan, 1997). В качестве диагностических признаков могут использоваться особенности процессов формирования и развития генеративной сферы у растений, а также основные параметры, определяющие репродуктивный успех. Кроме того, перспективными могут быть результаты антэкологических исследований (системы опыления и системы скрещивания, качество пыльцы и восприимчивость к ней рыльца пестика).
В последние десятилетия проблема изучения действия экологических факторов на растительные организмы становится все более актуальной. Стрессовое состояние растений приводит к функциональным расстройствам и нарушениям генеративных процессов. Оценить в полной мере значимость внутренних (особенности строения и функционирования семязачатка и семени) и внешних факторов в реализации программы развития зародышевого мешка и зародыша можно лишь в условиях эксперимента. Для управления отдельными этапами онтогенеза растений необходимы теоретические разработки, которые могут быть успешно выполнены только после изучения критических периодов морфогенеза (Batygina, Vasilyeva, 2003; Шамров, 2008). При изучении мутантов Arabidopsis thaliana было показано, что остановка в развитии семян происходит именно во время критических стадий эмбриогенеза (Meinke, 1985, 1986, 1991; Health et al., 1986; Franzmann et al., 1989). Под действием различных стрессовых факторов (избыток или недостаток влаги, крайне высокая или слишком низкая температура окружающей среды) во время мейоза и цветения происходят структурные и физиологические нарушения, оказывающие сильное влияние на формирование гамет и последующее развитие зародыша и эндосперма (Сказкин, 1971; Спицын, 1994; Saini, Lalonde, 1998; Saini, Westgate, 2000).
Таким образом, изучение процессов, определяющих основные параметры биологии размножения, поможет в решении многих проблем практической селекции. Это направление исследований приобретает особую актуальность в связи с выявлением механизмов воздействия внешних неблагоприятных факторов на репродуктивные структуры и в аспекте общей проблемы сохранения биологического разнообразия.
Цель и задачи исследования. Цель настоящей работы - изучение эмбриологии, репродуктивной биологии и семенной продуктивности и влияния на них некоторых экологических факторов для разработки общих принципов биологии размножения при проведении селекционной работы и создании перспективных форм у представителей родов Cerasus, Microcerasusи Amygdalus. Исходя из этого, определены следующие задачи исследования:
- Изучить строение цветка в динамике, определить суточную ритмику цветения и провести сравнительное изучение процессов формирования и развития мужских и женских генеративных органов для выявления основных параметров репродуктивной биологии и диагностических черт у Cerasus fruticosa, C. vulgaris, C. avium, Microcerasus tomentosa и Amygdalus nana.
- Изучить у них этапы формирования андроцея, пыльника, гинецея, семязачатка и семени и провести сравнительный анатомо-морфологический анализ структур семени для оценки роли эмбриологических процессов в биологии размножения.
- аВыявить системы скрещивания, определить семенную продуктивность, жизнеспособность семян, а также разработать некоторые эффективные технологии вегетативного размножения у представителей, взятых для исследования.
- Оценить эффективность репродукционных процессов у растений изученных видов под влиянием некоторых эндогенных и экзогенных факторов.
Основные положения, выносимые на защиту.
- Cerasus fruticosa, C. vulgaris, C. avium, Microcerasus tomentosa и Amygdalus nana характеризуются единой последовательностью заложения частей цветка, чертами сходства в строении и развития андроцея, гинецея, пыльника, семязачатка и семени. Различия, выявленные между ними, могут быть использованы в качестве таксономических диагностических признаков.
- Изученные виды характеризуются разными системами скрещивания и показателями потенциальной семенной продуктивности, но имеют одинаковыеа структурные характеристики плодов и семян, сроки стратификации семян и состав почвенного субстрата. Величина реальной семенной продуктивности, количество полноценных семян и их всхожесть при пересчете на растение являются достаточно высокими.
- На эффективность репродукционных процессов растений Cerasusfruticosa, C. vulgaris, C. avium, Microcerasustomentosaи Amygdalusnana влияют эндогенные (генетическое происхождение растений, местоположение цветка в кроне растения) и экзогенные (вода, температура, облучение, УНМ Таунит) факторы. Различия между видами наиболее четко проявляются после воздействия на растения комплекса разных факторов.
- В биологии размножения косточковых растений важную роль играет вегетативный способ репродукции. На примере Cerasusvulgaris создана оригинальная абиотехнология, позволяющая повысить эффективность микроразмножения путем использования черенков для прививки из верхнего и среднего ярусов кроны дерева (особенно во время летней прививки), а также обработки ультразвуком.
Научная новизна и теоретическая значимость работы. Впервые дана подробная характеристика процессов (от заложения почек возобновления до формирования семян и новых растений), охватывающих основные этапы репродукции видов Cerasusvulgaris, C. avium, C. fruticosa, Microcerasustomentosa, Amygdalusnana. Их репродуктивная стратегия включает половой и бесполый способы репродукции. Реализация семенного пути развития обеспечивается такими особенностями биологии размножения как: нормальное прохождение процессов в семязачатке и пыльнике, способность к автогамии у Cerasusfruticosaи Microcerasustomentosaи к аллогамии у C. vulgaris, C. aviumи Amygdalusnana,а высокая потенциальная семенная продуктивность, обеспечивающая образованиеа значительного количества полноценных семян.
С использованием комплекса различных методов дана оценка эффективности репродукционных процессов растений у изученных видов, на которые влияют не только эндогенные (генетическое происхождение растений, местоположение цветка в кроне растения), но и экзогенные (вода, температура) факторы. Созданы оригинальные технологические подходы, позволяющие повысить жизнеспособность пыльцы (УФ-облучение), прорастание семян (увеличение сроков стратификации до 210 дней) и аоптимизировать вегетативное размножение у Cerasus vulgaris (обработка ультразвуком черенков из верхнего и среднего ярусов кроны дерева). Выявленные радикалы биологии размножения позволяют подойти к управлению определенными этапами репродукции как дикорастущих, так и культивируемых косточковых растений.
Сходство по антэкологическим, цитогенетическим и эмбриологическим характеристикам подтверждает близкое филогенетическое родство видов Cerasus fruticosa, C. vulgaris, C. avium, Microcerasus tomentosa и Amygdalus nana. Особенности, характеризующие процессы формирования и развития цветка (форма гипантия, размеры и цвет околоцветника, характер края зубцов и угол их отгиба в чашечке), андроцея (число тычинок и длина тычиночных нитей), пыльника (число рядов клеток сформированной стенки пыльника, характер и частота типичных и нетипичных нарушений в мейозе), гинецея (размеры ножки и расположение фертильного плодолистика), семязачатка (соотношение высоты и ширины семязачатков, форма и размеры клеток постамента и подиума) и семени (его форма и масса, соотношение размеров семени, длины зародыша и эндосперма), могут быть использованы в качестве диагностических признаков при характеристике видов.
Практическая значимость работы. Результаты сравнительного анализа фертильности пыльцы и системы скрещивания разных видов могут иметь практическое значение при выборе растений-опылителей в генетико-селекционной работе.
Данные по влиянию экологических факторов на прохождение репродукционных процессов, выявленные причины абортивности и поиск способов предотвращения опадения завязипутем регулирования условий выращивания позволяют подойти к управлению некоторыми этапами онтогенеза, решению вопросов разработки агротехнических приемов возделывания и повышения урожайности изученных видов. Полученные результаты по определению сроков и среды стратификации семян необходимо учитывать при оптимизации семенного размножения растений в генетико-селекционной работе.
Выработанная методика повышения интенсивности каллусообразования из изолированных тканей растений ультразвуком является новым направлением в биотехнологии плодовых, ягодных и декоративных растений, которое может повысить эффективность селекционной работы.
Апробация работы. Материалы, содержащиеся в диссертационной работе, были представлены на около 40 научных вузовских, региональных, общероссийских и международных конференциях: на ежегодных научных конференциях в Тамбовском государственном университете им. Г.Р. Державина Державинские чтения (1996-2010гг), на международных конференциях л17, 18, 20 Мичуринские чтения (г. Мичуринск, 1997, 1998, 2000), III, IV и V региональной научно-технической конференции Вопросы региональной экологии (Тамбов, 1998, 2000, 2002), международной научно-практической конференции молодых ученых Интенсивное садоводство (Мичуринск, 2000), VIII международном семинаре-совещании Фитофизиология: перспективные исследования, связь с другими науками (Тамбов, 2001), международной научной конференции Экологическая ботаника: наука, образование, прикладные аспекты (Сыктывкар, 2002), международной конференции по отдаленной гибридизации (Москва, 2003), VIII и IX международных научных конференций по морфологии растений, посвященных памяти И.Г. и Т.И. Серебряковых (Москва, 2004, 2009), VII всероссийской научно-практической конференции Инновационные технологии в экологическом образовании, пути, формы и методы их реализации (Тобольск, 2003), VIII молодежной научной конференции ботаников в С.-Петербурге (2004), научно-практической конференции Физиологические аспекты продуктивности растений (Орел, 2004), I международной экологической конференции Роль экологического пространства в обеспечении функционирования живых систем (Елец, 2005), международной научно-практической конференции Новации и эффективность производственных процессов в садоводстве (Краснодар, 2005), международной научно-практической конференции Проблемы биологии, экологии и образования: история и современность (С.-Петербург, 2006), I (X) международной конференции молодых ботаников в С.-Петербурге (2006), Всероссийской научно-практической конференции Проблемы научной, обучающей и просветительской деятельности в биологических центрах вузов и хозяйствах зоопаркового типа (Тамбов, 2007), международной конференции, посвященной памяти Левиной Современные проблемы морфологии и репродуктивной биологии семенных растений (Ульяновск, 2008), международной научно-практической конференции Проблемы биоэкологии и пути их решения (II Ржавитинские чтения) (Саранск, 2008), XII съезде русского ботанического общества Фундаментальные и прикладные проблемы ботаники в начале XXI века (Петрозаводск, 2008), II международной научной конференции Разнообразие почв и биоты Северной и Центральной Азии (Улан-Уде, 2011). Результаты исследований докладывались автором лично на 20 конференциях.
Полученные в работе результаты использованы в программах по повышению процента завязываемости семян и оптимизации технологических процессов выращивания косточковых плодовых растений в ОАО Дубовое Тамбовской области, Экологическом научно-образовательном центре ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина.
Разработанная методика Способ повышения интенсивности каллусообразования из изолированных тканей растений ультразвуком была отправлена в Федеральный институт промышленной собственности г. Москвы 10 ноября 2010г для получения патента на изобретение (авторы Папихин Р.В., Муратова С.А., Яндовка Л.Ф.).
Выявленные особенности репродуктивного цикла, материалы цито-эмбриологических исследований Cerasus fruticosa, C. vulgaris, C. avium, Microcerasus tomentosa и Amygdalus nana использованы при чтении лекций и составлении методических рекомендаций к практическим занятиям по дисциплинам Анатомия и морфология растений и Систематика растений для студентов 1 и 2 курсов отделения Биология Института естествознания Тамбовского государственного университета им. Г.Р. Державина, лекций для иностранных студентов (англоязычных и франкоязычных) по дисциплине Биология с экологией в Медицинском институте Тамбовского государственного университета им. Г.Р. Державина.
Публикации. Материалы исследования представлены в 75 опубликованных работах, из них 1 монография, 22 статьи в журналах из перечня ВАК, 10 статей в тематических сборниках научных трудов, 27 статей и 11 тезисов в сборниках материалов международных конференций, Всероссийских съездов, научных и научно-практических конференций. Доля участия в совместных публикациях составляет от 50 до 80 %.
Структура и объем диссертации. Диссертация состоит из введения, семи глав, заключения, выводов, списка литературы (838 наименований, в том числе 306 на иностранных языках) и приложения. Работа изложена на 414 страницах, включает 31 таблицу и 41 рисунок.
ГЛАВА I. ОБЗОР ЛИТЕРАТУРЫ
В настоящее время после опубликования многотомных изданий Сравнительная эмбриология цветковых растений (1981-1990) (под ред. М.С. Яковлева и Т.Б. Батыгиной), Embryology of Angiosperms (ed. B.M. Johri, 1984), Comparative Embryology of Angiosperms (Johri et al., 1992), Эмбриология цветковых растений. Терминология и концепции (1994-2000, под ред. Т.Б. Батыгиной) накопился большой фактический материал по строению и разнообразию основных эмбриологических структур цветковых растений. Однако невыясненными остались вопросы влияния некоторых факторов среды на строение цветка, его органы и процессы.
При исследовании развития пыльника и, особенно, микроспорогенеза и формирования пыльцевого зерна некоторые исследователи рассматривали их с целью поиска критических периодов, когда факторы среды снижают урожай (Батыгина, 1987). На микроспорогенез косточковых растений влияют весенние заморозки (Волошина, 1970), ?-облучения (Пахомова, 1969), гибридное происхождение (Харитонова, 1972). Некоторые исследователи в ходе микроспорогенеза отмечали явление цитомиксиса, который может быть индуцирован разными воздействиями (Deysson et al., 1965; Миляева, 1965; Шкутина, 1969; Романов, Орлова, 1971; Горбань, Шулындин, 1973; Tarkowska, 1973; Чувашина и др., 1986; Орлова, 1994). Изучаются различные аспекты по выявлению качества пыльцы (Куприянов, 1989; Круглова, Куксо, 2006). Круглова (2008) аномалии пыльцы делит на 4 группы: клеточные, ядерные,а цитоплазматические, структурно-архитектонические.
В литературе подробно излагаются проблемы типизации гинецея (Troll, 1928, 1939; Leinfellner, 1941, 1950; Тахтаджян, 1948, 1864, 1980; Eames, 1961, Шамров, 2008), семязачатка, их строение (Кордюм, 1978; Bouman, 1984; Камелина, 1991; Шамров, 1994, 2008; Buzgo, 1999) и значение при решении вопросов систематики и филогении растений (Тахтаджян, 1966; Tobe, Raven, 1985; Камелина, 1991; Dahlgren, 1991; Takhtajan, 1997; Шамров, 2000, 2008; Matthews, Endress, 2005, и др.). В развитии семязачатка и семени, как и пыльника, есть критические периоды и стадии, связанные с чувствительностью растений в эти фазы онтогенеза к факторам среды (Яковлев, 1981; Natesh, Rau, 1984; Mansfield, Briarty, 1991; Batygina et al., 1993; Marilyn et al., 1993; Laux, Jurgens, 1994; Батыгина, 1997; Шамров, 1997; Batygina, 2002; Batygina, Vasilyeva, 2003). Аномалии в развитии семязачатка приводят к появлению аберрантных семян (Шамров, 2005).
При выявлении факторов, влияющих на завязываемость плодов и семян, важная роль отводится системам опыления и скрещивания. Существенное значение в реализации репродуктивных стратегий разных растений придается вопросам антэкологии, полового полиморфизма, способам переноса пыльцы (Faegri, Pijl van der, 1966, 1980; Пономарев, 1969, 1970; Демьянова, 1970, 1981, 2000; Кордюм, Глущенко, 1976, 1979; Вишнякова, 1997; Пономарев, Демьянова, 2000), энергетическим затратам на опыление, которые выражают соотношением пыльцевых зерен и семязачатков (Р/О) (Cruden, 1976a, b, 1977; Шамров, 2000), прорастанию пыльцевых зерен на рыльце и росту пыльцевых трубок (Stanley, Linskens, 1974; Heslop-Harrison, 1979, 1987).
Изучение репродукции цветковых растений в динамике привело к необходимости подразделения семенной продуктивности на два типа: потенциальную (максимально возможное количество семян, которое способно производить растение, популяция или фитоценоз за промежуток времени при условии, что все заложенные в цветках семязачатки сформируют зрелые семена) и реальную (количество полноценных семян, производимое одной особью) (Левина, 1981). Полноценность семян включает их жизнеспособность (способность прорастать и давать всходы), вес семян, лабораторную и полевую всхожести, количество здоровых семян. Семенная продуктивность контролируется факторами: генетическими, определяющими предел возможной плодовитости растения; физиологическими (возрастное и жизненное состояние особей); экологическими (ресурсы и среда обитания); ценотическими (сфера сообитания растений с другими организмами) (Злобин, 2000). Внешне нормальные, спелые и неповрежденные семена могут не прорастать из-за их разнокачественности (Овчаров, Кизилова, 1966; Левина, 1981; Анисимова, 2000).
Изучены биохимические и энергетические связи в прорастающих семенах между зародышем и эндоспермом и между органеллами внутри клеток (Овчаров, 1973). Вклад в разработку проблемы покоя семян внесли многие исследователи (Николаева, 1982, 1989, 1993, 2001; Обручева, 1982, 1991; Николаева, Поздова, 1987; Pinfield, 1987; Далецкая, Земднер, 1989; Baskinа et al., 1993, 1995; Finch-Savage et al., 1995; Обручева, Антипова, 1997, и др.). Затрудненное прорастание семян или его отсутствие при благоприятных условиях связано с особенностями семян (органический покой) или неподходящими для них внешними условиями (вынужденный покой) (Николаева, 1989). Предложен ряд классификаций типов покоя семян, в которых разграничиваются типы (причины) покоя в зависимости от природы факторов, тормозящих прорастание (морфологические, химические, физиологические), и приуроченности этих факторов к зародышу или окружающим его тканям (Либберт, 1976; Николаева, 1977, 1989, 2001).
Наивысшей степени специализации у цветковых растений достигают способы не только семенного, но и вегетативного размножения (Левина, 1981). Во многих исследованиях подробно изучены адаптивные возможности и вопросы репродуктивной стратегии бурачниковых, водноореховых, роголистниковых, лотосовых, вересковых, орхидных и других цветковых растений. Подробно описаны жизненные формы, способы бесполой и половой репродукции, способы реализации путей развития, специфика прохождения эмбриональных процессов, диссеминация и прорастание, культивирование invitro незрелых семян на определенных стадиях развития, а также факторы, определяющие уровень семенной продуктивности видов (генетические, климатические, ценотические, антэкологические) (Фролов, 1976; Юрцев, 1986; Терехин, 1988; Тимошок, Паршина, 1990; Батыгина, 1992; Барыкина, Потапова, 1994; Найда, 1998; Куликов, Филиппов, 2000; Титова, Захарова, 2000, и др.).
В связи с высокой специализацией и практической значимостью многих косточковых растений большой интерес представляет изучение репродуктивных процессов, происходящих на всех этапах их онтогенеза: формирование и развитие цветков, мужской и женской генеративной сферы, экология опыления, развитие полноценных семян, их качество и жизнеспособность, плодоношение. Уточнение таксономического статуса исследуемых видов в системе Rosaceae невозможно без выявления общих закономерностей и различий в развитии их генеративных органов.
Особенности репродуктивной стратегии косточковых растений изучены не достаточно. В литературе приводятся немногочисленные сведения о начальных фазах развития цветка у Cerasusvulgarisи C. avium (Романовская, 1952; Машкин, 1961; Волошина, 1970). Этапы развития стенки микроспорангия у Cerasusvulgaris, C. avium, C. fruticosa, M. tomentosa и A. nana практически не изучены. Имеются лишь фрагментарные, преимущественно дискуссионные, сведения о развитии слоев микроспорангия у Cerasusvulgaris, C. avium и культурных сортов Amygdalus (Березенко, 1965; Согомонян и др., 1974; Мандрик и др., 1978, 1980, 1981; Михайлова, 1982). Изучены особенности прохождения микроспорогенеза и нарушения в ходе его прохождения в связи с низкой фертильностью пыльцевых зерен у ряда сортов и гибридов вишни и черешни (Харитонова, 1971; Машкина, 1983; Назарова, Симонова, 1989; Furucawa, Bucovaс, 1989; Машкин, 1994, и др.), однако у дикорастущих форм эти процессы не исследованы. Фертильность и жизнеспособность пыльцы в основном изучали для выявления сортов-доноров пыльцы или урожайных сортов (Пахомова, 1969; Волошина, 1970; Туровцев, 1972; Харитонова, 1972; Рассветаева, 1982; Назарова и др., 1995, 1996; Грибановская, 2000). Развитие семязачатка у Rosaceaeизучалиряд исследователей (Tukey, 1933; Harrold, 1935; Eaton, Jamont, 1965; Суркова, Скипина, 1966; Березенко, 1982; Pimienta, Polito, 1983; Labrecque, Barabe, 1984; Labrecque et al., 1985; Мандрик, Петрус, 1985). Проведенный анализ выявил почти полное отсутствие данных по роду Cerasus - имеются лишь фрагментарные сведения по строению гинецея, семязачатка, мегаспорогенезу, формированию зародышевого мешка (Bradbury, 1929; Tukey, 1933; Eaton, 1959a, b), а также организации семенной кожуры в зрелом семени (Corner, 1976; Меликян, Бондарь, 1996). Данные по изучению женской генеративной сферы у видов Microcerasus и Amygdalus отсутствуют.
Существуюта немногочисленные данные по опылению и оплодотворению у косточковых растений (Березенко и др., 1965, 1979; Бекетовская, 1968; Рябов, 1970; Удачина, 1976; Ядров, 1982). В литературе имеются сведения прикладного характера, касающиеся урожайности и периодичности плодоношения сортов M. tomentosa, C. vulgaris, C. aviumи C. fruticosa(Рихтер, 1940; Тутаюк, Рзаев, 1961; Симагин, 1978; Назарова и др., 1985, и др.). Авторы статей отмечают их невысокую реальную семенную продуктивность и мало внимания обращают на факторы среды, влияющие на этот показатель. Для Rosaceaeопределен тип покоя и прорастания семян (Николаева, 1985, 1989). Большинство исследователей основным фактором стратификации семян косточковых указывают температуру (Машкин, 1961; Suszka, 1964; Федоров и др., 1966; Руденко, 1972; Николаева, 1985, 1989; Гамор, 2001; Екимова, 2003).
Типичным вариантом естественного вегетативного размножения косточковых растений является сарментация (Темирова, 1955; Поликарпов, 1956; Шитт, 1958; Алексеев, 1963; Барыкина, 1967; Нижников, 1979).В литературе рассматриваются некоторые вопросы искусственного вегетативного размножения зеленым черенкованием косточковых растений (Богушевский, 1940; Спижовый, Ермаков, 1969; Хромова, 1976; Морозова и др., 1998) и окулировкой (Веньяминов, 1955; Спицын, 1969; Емельянов, 1981; Михеев, 1985 и др.; Жуков, 1988). Имеются некоторые сведения о результатах микроклонального размножения C. vulgaris и C. avium(Murashige et al., 1977; Christe, 1978; Drew, 1980; Катаева и др., 1981; Debergh et al., 1981; Деменко и др., 1983; Кириленко и др., 1984; Здруйковская-Рихтер, 1989; Фролова, 2003; Ланская, Федотова, 2006; Фролова, Тибикина, 2006; Майорова, 2009).
Таким образом, у косточковых представителей семейства Rosaceaeмало изученными остаются не только органы размножения, но и процессы их формирования, происходящие на разных этапах онтогенеза. Слабая изученность репродуктивной стратегии C. vulgaris, C. avium, C. fruticosa, M. tomentosaи A. nana, а именно процессов развития мужской и женской генеративной сферы, семян и их проростков, способов размножения под действием внутренних и внешних факторов, определяет актуальность темы.
ГЛАВА II. МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были 5 видов из семейства Rosaceae, относящихся, согласно Н.Н. Цвелеву (2000), к трем родам: CerasusMill. (виды CerasusfruticosaPall. - вишня степная, C. vulgaris Mill.- вишня обыкновенная, сорта Владимирская - сорт народной селекции, вишне-черешневые, вишневые и вишне-черемуховые гибриды, C. avium(L.)Moench - черешня, сорт Итальянка), MicrocerasusM. Roem. (вид M. tomentosa(Thunb.) Wall. Цвишня войлочная), AmygdalusL. (вид Amygdalusnana L. - миндаль низкий).
Материал был собран в Ботаническом саду Экологического научно-образовательного центра ФГБОУ ВПО ТГУ имени Г.Р. Державина (г. Тамбов), в коллекционном саду ВНИИ генетики и селекции плодовых растений им. Мичурина (г. Мичуринск Тамбовской области), а также в местах естественного произрастания (Мичуринский район Тамбовской области) в течение 1996-2010 гг.
Были изучены генеративные почки, бутоны и цветки на разных стадиях развития, взятых из разных ярусов кроны с 3 (древовидные формы) - 7-10 (кустарники) растений. Суточный ритм цветения определяли по общей методике А.Н. Пономарева (1960). Для изучения разных стадий развития мужского и женского гаметофитов использовали метод темпоральных фиксаций, предложенный М.С. Навашиным (1934). Материал фиксировали в смеси Карнуа (96%-й этиловый спирт, ледяная уксусная кислота в пропорции 3:1) и обрабатывали по общепринятой цитоэмбриологической методике (Паушева, 1974; Барыкина и др., 2004) в модификации лаборатории цитогенетики Центральной генетической лаборатории (ЦитологическиеЕ, 1976). Срезы получены с помощью ротационного микротома. Толщина срезов 10-12 мкм. Окрашивали парафиновые срезы гематоксилином по Гейденгайну. Исследование проводили с помощью светооптического микроскопа Amplival, Carl Zeiss Jenamed, Микмед-5; фотографирование осуществляли цифровой камерой DCM-500 с программным обеспечением Scope Photo.
Исследования мейоза проводили на давленых препаратах (Топильская и др., 1975). Фертильность и жизнеспособность пыльцы оценивали с помощью ацетокарминового метода и метода проращивания пыльцы на искусственных питательных средах (Романова и др., 1988). Однократную УФ-обработку пыльцы проводили ртутно-кварцевым облучателем ОКН - 11 М (напряжение 220 В, частота 50 Гц, мощность 950 ВА, F = 6.3 А) на расстоянии 85 см от объекта (5-, 10-, 15-, 20, 30-, 40-, 60- минутные УФ-экспозиции). Электронное облучение пыльцевых зерен производили в вакуумной колонне электронного микроскопа ЭМВ-101Л. Параметры облучения U = 50 kV (кВ), ток I = 100 mА (мкА). Облучение производили в течение 5 сек, 15 сек, 30 сек, 1 мин и 5 мин.Влияние коллоидного водного раствора углеродного наноматериала (УНМ) Таунит на фертильность пыльцы изучали, обработав им во время микроспорогенеза однократно по 10 побегов из разных ярусов кроны растений. Концентрации водных растворов УНМ: 0.1; 0.05; 0.025; 0.01; 0.005; 0.002; 0.001; 0.0005; 0.0001.
Определение показателей потенциальной и реальной семенной продуктивности определяли пересчетом генеративных диаспор - бутонов, цветков и семян. Повторность трехкратная. Количество учетных побегов - не менее 10. Изучение анатомо-морфологических особенностей семян проводили, сделав продольные срезы бритвой. Определение жизнеспособности семян проводили проращиванием с предварительной стратификацией при температуре -10 +40 С на разных субстратах: фильтровальной бумаге, сфагновом мхе, торфяной крошке, песке, древесных опилках. Время стратификации 30 дней, 90 дней, 120 дней и 210 дней. Основным оценочным показателем считали выход здоровых всходов, выраженный в процентах от числа застратифицированных семян.
Прививку срезанных из разных ярусов кроны черенков проводили два раза за вегетационный сезон: до активного сокодвижения весной (10-30 апреля) и летом (1-10 апреля).
Для повышения интенсивности каллусообразования из изолированных тканей растений в культуре invitro был применен новый способ повреждения растительных тканей. Перед помещением на питательную среду MS (Murashige, Skoog, 1962) экспланты растений обрабатывали ультразвуком (УЗ) 3 минуты на ультразвуковой установке УДЗН-21 (частота излучения - 22 кНz, ток - 22 ?А, мощность воздействия 3.0-14.1 Вт). После обработки УЗ экспланты переносили в культуральные сосуды на питательную среду. В качестве регуляторов роста использовали 6-БАП в концентрации 5 мг/л и ИМК в концентрации 0.5 мг/л. Экспланты культивировали в темноте при температуре 240 С. Эксперименты продолжались 10-12 недель (2-3 пассажа по 4-5 недель каждый).
Статистическую обработку данных проводили в программной среде Microsoft Excel.
ГЛАВА III. ЦВЕТОК
Органогенез цветка у Cerasusfruticosa, C. vulgaris, C. avium, Microcerasustomentosaи Amygdalus nanaпротекает сходно. Различия касаются лишь сроков прохождения фаз. Раньше всех эти процессы наступают у черешни (I декада июля). Развитие цветков охватывает два вегетационных периода. Во время первого периода (июльЦоктябрь) в генеративных почках происходят процессы формирования ахеспория в пыльниках и семязачатках. В период покоя растения вступают в конце октября. Развитие цветков возобновляется в марте-апреле следующего года. В течение второго периода (мартЦиюль у Cerasus и Microcerasus; мартЦсентябрь у Amygdalus nana) происходят процессы микро- и мегаспорогенеза, формирования пыльцы, зародышевого мешка, цветения, оплодотворения, развития, созревания семян и плодов.
Начало дифференциации цветковых почек совпадает с окончанием роста побегов (начало-середина июля - у C. vulgaris, C. fruticosa, C. avium, M. tomentosa; середина июляЦначало августа - у A. nana). Формирование цветковых почек начинается с появления на апексе побега 3-4 бугорков (будущих цветков), покровных чешуй и недоразвитых листьев. У C. fruticosa, C. vulgaris, C. avium, M. tomentosaи A. nana соблюдается обычная акропетальная последовательность заложения частей цветка: формируются покровные органы цветка (чашечка и венчик), затем - тычинки и плодолистики(Строчкова, 1959; Машкин, 1961; Алексеев, 1962; Хитрова, 1964; Березенко и др., 1965; Волошина, 1970; Киселева, 1972). У исследуемых видов Cerasus, Microcerasusи Amygdalus основание чашечки возникает когненитально. Свободными оказываются только зубцы чашечки. В октябре развитие гинецея заканчивается. В середине марта оформляются структуры цветка.
У C. aviumпочкигенеративные, тогда как у C. fruticosa, C. vulgaris, M. tomentosaи A. nanaони генеративно-вегетативные. После распускания цветка у растений Cerasusфотосинтезирующие почечные чешуи выполняют функцию прицветников; у M. tomentosa и A. nana почечные чешуи мало увеличиваются во время роста и развития цветка и остаются прижатыми к чашечке.а
Сравнительно-морфологический анализ выявил общий план строения цветков: они актиноморфные, пятимерные, с двойным околоцветником, из четырех кругов; элементы околоцветника сложены створчато; формируется гипантий. Цветки обоеполые, одиночные или собраны в малоцветковые соцветия. Некоторые особенности цветков (размеры, форма, окраска) являются таксоноспецифичными. Наиболее важными видовыми признаками являются: форма гипантия, размеры и цвет околоцветника, характер зазубренности края зубцов чашелистика, угол отгиба зубцов чашечки, число тычинок, опушение плодолистика. Выявлено варьированиеа признаков цветка, особенно характеризующих размеры стерильных частей цветков (чашечки, лепестков) и гинецея (диаметр и высота завязи, общая длина плодолистика). Варьирует длина тычиночных нитей, что, в первую очередь, связано с разделением тычинок в цветке на верхние тычинки и нижние.
В семействе Rosaceae указывают на возможность разных форм полового полиморфизма (Спицын, 1994; Камелин, 2006). У C. fruticosa, C. vulgaris, C. avium, M. tomentosaслучаи гинодиэции единичные, а у Amygdalusnanaона не обнаружена. У C. fruticosa, C. vulgaris, C. aviumандромоноэция выявляется редко, в то время как у Microcerasustomentosaэта половая форма наряду с обоеполыми цветками в нижнем ярусе кроны обнаружена в достаточно большом количестве.
В литературе имеются сведения о наличии у косточковых растений цветков с нарушенным строением (Туз, 1955; Пивоварова, 1964; Серафимов, 1970; Симагин, 1975). Наряду с нормальными у всех исследуемых видов обнаружены аномальные цветки, в которых некоторые структуры были недоразвитыми, отсутствовали или, наоборот, были увеличены. Наиболее часто изменяются стерильные части цветка. Жизнеспособность пыльцы цветков с недоразвитыми лепестками не отличается от жизнеспособности пыльцы нормальных цветков. Процент семян из цветков с нарушениями (в виде изменения формы отдельных лепестков) был почти таким же, как и в нормальных цветках. Аномалии фертильных частей цветка менее часты и в некоторых случаях видоспецифичны: цветки с недоразвитыми плодолистиками (у всех видов); вариабельность числа тычинок (у всех видов), метаморфоз 1-5 тычинок в лепестки (кроме C. fruticosa); гинецей из двух несросшихся плодолистиков (C. fruticosa, C. vulgaris, M. tomentosa); гинецей с двумя свободными стилодиями, каждый со своим рыльцем (A. nana). Завязывамость семян из цветков с нарушениями в строении фертильных и стерильных частей снижена. Выявленные морфологические признаки цветка Cerasus, Microcerasus и Amygdalus могут стать дополнительными признаками при определенииа видов.
В литературе приводятся немногочисленные сведения о ритме цветения а(обычно начало и окончание цветения) растений Cerasusи культурных сортов миндаля (Романовская, 1952; Судакевич, 1962; Волошина, 1970; Симагин, 1978). Наблюдения показали, что у исследуемых видов фазы распускания цветков сходные (I фаза - плотный зеленый бутон, II фаза - белый бутон - IIа - белый плотный бутон и IIб - белый рыхлый бутон, III фаза - начало распускания цветка, IV фаза - полное распускание цветка, V фаза - отцветание), однако время их начала и окончания у разных видов различно.
Цветки распускаются в утреннее и дневное время суток, как у большей части цветковых растений. Ритм цветения видоспецифичен. Различия касаются количества дней после начала цветения и времени суток, когда наблюдается максимальная интенсивность распускания цветков. C. fruticosa, C. vulgaris, C. avium, M. tomentosaи A. nana различаются временем суток, когда распускается максимальное количество цветков. У M. tomentosaнаиболее интенсивный ритм распускания наблюдается после восхода солнца до 800 часов утра; у C. vulgaris, C. avium и C. fruticosa быстрый темп распускания цветков сохраняется дольше - от восхода солнца до 1000 часов утра; у A. nana максимальная интенсивность распускания цветков наблюдается с 800 до 1000 часов. Кроме того, цветки M. tomentosaбыстрым темпом распускаются с 1000 до 1600 часов (второй и третий дни после начала цветения), цветки A. nana быстрым темпом распускаются с 1200 до 1400 часов (первый день цветения) (рис. 1).
5 день
а4 день
а3а день
а2 день
а1 день
а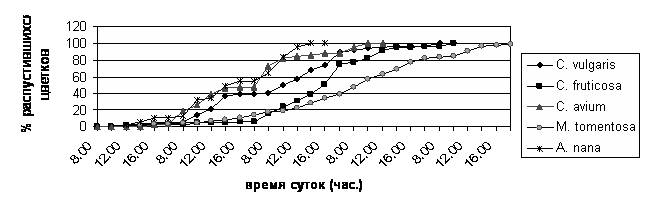
Рис. 1. Суточный ритм распускания цветков Cerasus fruticosa, C. vulgaris, C. avium, Microcerasus tomentosa и Amygdalus nana
У косточковых растений в большинстве районов умеренной зоны довольно часто встречаетсяа повторное (летне-осеннее) цветение (Машкин, 1961; Витковский, 1984). Нами установлено, что оно более характерно для C. vulgaris. Наряду с морфологически сформированными цветками у этого вида имеются аномальные цветки, которые более чем в 50% случаев не распускаются и впоследствии опадают.
Цветки вторичного цветения у C. vulgarisхарактеризуютсяа высокой фертильностью и жизнеспособностью пыльцевых зерен (53.1-82.0 %; 16.3%-59.1 %). Они имеют высокий процент завязавшихся семян. У некоторых сортов C. vulgaris (сорта Владимирская, Харитоновская) выход семян из цветков вторичного цветения выше процента завязавшихся семян из цветков весеннего цветения. Созревшие семена от вторичного цветения вишни обыкновенной некоторые исследователи рекомендовали использовать для создания новых сортов с более коротким вегетационным периодом (Здруйковская, 1954; Буянов, 1956; Нестеров, 1961; Жирнова и др., 1983). Учитывая, что вторичное цветение плодовых растений можно вызвать искусственно, а с помощью метода культуры изолированных зародышей получить жизнеспособное потомство, цветки летне-осеннего цветения целесообразно использовать при отдаленной гибридизации. Однако вторичное цветение растений может привести к негативным последствиям для самого растения: снижению зимостойкости и повреждению растений зимними морозами, снижению урожайности поздно цветущих побегов на следующий год.
ГЛАВА IV. РАЗВИТИЕ И СТРОЕНИЕ МУЖСКИХ
ГЕНЕРАТИВНЫХ СТРУКТУР
У изученных видов наблюдается двухкруговое расположение тычинок и диморфизм тычинок, который проявляется в разной длине тычиночных нитей и незначительной асинхронности в развитии тычинок верхних и нижних кругов. Общее количество тычинок в цветке у видов различается.
Основные процессы формирования стенки микроспорангия, микроспорогенеза и развития пыльцы у косточковых растений изучены недостаточно (Согомонян и др., 1974; Мандрик ааи др., 1978, 1980, 1981; Чолахян, Абрамян, 1980; Михайлова, а1982). Наши исследования показали, что начальные этапы формирования стенки микроспорангия происходят одинаково у всех видов. Формирование стенки микроспорангия у видов происходит по центростремительному (Терехин и др., 1993), атипу однодольных (Davis, 1966). Клетки слоев имеют разную величину у разных видов; слои могут иметь неодинаковое число рядов клеток (средний слой) в пределах одной стенки микроспорангия. Сформированная стенка микроспорангия у всех изученных видов состоит из эпидермиса, эндотеция, среднего слоя и тапетума (рис. 2, 1-3). Наблюдается однорядное расположение клеток тапетума, в отличие от данных Абрамяна (1979), который у C. vulgaris отмечает двухслойный тапетум, и Михайловой (1982), выделяющей в стенке микроспорангия 3 слоя тапетума.
з п
аэп
аэп
аэн
ап п
ас с
ак т
аэн
амксп
ас с
ам
а 1
1  а2
а2  3
3
![]() Рис. 2. Строение пыльника (поперечный разрез; вакуолизация микроспор) (1), стенки микроспорангия в начале мейотического периода (2) и на стадии зрелой пыльцы (3) у Microcerasus tomentosa. п п - проводящий пучок, м - микроспорангий, мксп - микроспороциты, з п - зрелая пыльца, эп - эпидермис, эн - эндотеций, с с - средний слой, к т - клетки тапетума. Масштабная линейка - 1 мкм.
Рис. 2. Строение пыльника (поперечный разрез; вакуолизация микроспор) (1), стенки микроспорангия в начале мейотического периода (2) и на стадии зрелой пыльцы (3) у Microcerasus tomentosa. п п - проводящий пучок, м - микроспорангий, мксп - микроспороциты, з п - зрелая пыльца, эп - эпидермис, эн - эндотеций, с с - средний слой, к т - клетки тапетума. Масштабная линейка - 1 мкм.
Процесс мейоза у изученных видов происходит по общеизвестной схеме. Проходят два деления мейоза, последовательно сменяющие друг друга. Профаза I подготавливает клетку к расхождению гомологичных хромосом. В метафазе I завершается построение веретена деления; биваленты гомологичных хромосом располагаются по экватору клетки. В анафазе I начинается движение гомологичных хромосом к полюсам клетки, которые в телофазе I формируют два ядра. Второе деление мейоза протекает по типу митоза и в телофазе II формируются четыре гаплоидных ядра. После цитокинеза образуются четыре гаплоидные микроспоры. Образование тетрад у всех исследуемых видов происходит симультанно; тип образования тетрад - тетраэдральный. В ряде случаев имеется асинхронность во время мейоза и развития пыльцевого зерна.
Наряду с нормальным течением мейоза обнаружены его нарушения. Hruby (1962), проведя анализ нарушений конфигурации хромосом во время мейоза у C. avium, C. vulgarisи C. gondouinii, сделал вывод об их гибридогенной природе. Результатом нарушения мейоза является образование стерильной пыльцы (Туровцева, 1998). У C. fruticosa, C. vulgaris, C. avium, М. tomentosa и A. nana выявлены типичные и нетипичные нарушения в ходе микроспорогенеза. Типичные нарушения связаны с распределением хроматина. Отставание, забегание вперед, выбросы хромосом за пределы веретена деления и неравномерное расхождение хромосом к полюсам, приводящие к образованию микроядер и нарушениям при образовании тетрад микроспор (образовавшиеся клетки могут различаться по размерам, а их число может быть более четырёх), имеются у всех изученных видов. Нетипичные нарушенияа являются в ряде случаев таксоноспецифичными: разные стадии мейоза, на которых обнаружено явление цитомиксиса; выбросы бивалентов за пределы веретена деления - у C. fruticosaиC. vulgaris; хромосомные мосты - у C. avium; триады - у всех изученных видов, кроме C. fruticosa, а октады - только у C. fruticosa и М. tomentosa.
Частота клеток с нарушениями на разных стадиях мейоза у видов различается. У C. fruticosa частота клеток с нарушениями при делении ядер достаточно высокая. При переходе от метафазы I к анафазе I она возрастает (от 41 до 56 %), но к концу первого деления мейоза снижается (45 %). Во II делении мейоза частота клеток с нарушениями увеличивается, достигая максимальных значений в телофазе II (71 %). Число аномальных тетрад 20 %.
У C. vulgaris частота клеток с нарушенным делением ниже, чем у C. fruticosa. Более всего эта величина (18 %) характерна для М I. Частота нарушений на заключительных стадиях I и всех стадиях II делений составляет 9-14 %. Частота аномальных тетрад 22 %.
M. tomentosaхарактеризуется невысокой частотой аномальных клеток. На начальных стадиях - М I и А I - 14 %, в Т I еще ниже - 7.6 %. Во II делении частота нарушений низкая (от 11.0 % в метафазе II до 10.5 % в телофазе II). На стадии тетрад увеличивается частота аномальных клеток до 20.5 %.
Частота нарушений во время мейоза у C. avium различается. I деление характеризуется высоким процентом нарушений в М I (38 %) и снижением этой величины к Т I - 14 %. В начале II деления частота клеток с нарушениями возрастает (42 %), достигая максимальных значений к концу II деления (54 %). Частота аномальных тетрад 14 %.
A. nanaхарактеризуется высокой частотой клеток с нарушениями на всех стадиях мейоза. Максимальная частота аномальных клеток в I делении - метафаза I и анафаза I (65 %). В телофазе I частота аномальных клеток ниже, чем на предыдущих стадиях (42.5 %). Во II делении частота нарушений снова возрастает, достигая максимальных значений в телофазе II (64.3 %). Частота аномальных тетрад у A. nana невысокая (16 %).
Таким образом, у всех изученных видов в конце первого деления мейоза снижается количество клеток с нарушениями. В то же время, к окончанию телофазы II у видов Cerasus и Amygdalus увеличивается частота нарушений по сравнению с предыдущей стадией. На стадии тетрад у C. fruticosa, C. aviumи A. nanaснижается частота аномальных клеток по сравнению с телофазой II, тогда как у C. vulgarisи M. tomentosa - повышается. Следовательно, каждый вид имеет свои характерные особенности прохождения стадий микроспорогенеза (рис. 3).

Рис. 3. Частота нарушений во время микроспорогенеза у видов Cerasus, Microcerasusи Amygdalus(%)
аВ микроспорогенезе можно выделить критические астадии, на которых происходят наиболее значительные и частые нарушения (более чем на 20-25 %). Изучению вопроса о критических периодах в развитии пыльника посвящен ряд работ (Батыгина, 1987; Batygina, Vasilyeva, 2003; Шамров, Бабро, 2008). В мейотическом периоде Cerasus, Microcerasusи Amygdalusможно выделить стадии, при переходе на которые происходит резкое снижение частоты нарушений. Во время прохождения стадий стабилизации (частота нарушений мейоза снижается более чем на 20-25 %) отставший и выброшенный за пределы веретена деления хроматин подтягивается.
В процессе микроспорогенеза происходит чередование критических стадий и стадий стабилизации. Критическими являются стадии II мейотического деления, при этом некоторые из них являются видоспецифичными. У C. fruticosa, C. aviumи M. tomentosaкритической является М II, у C. vulgaris - А II, C. fruticosa, C. avium и A. nana - Т II. Следует отметить, что у C. fruticosa критическими являются не только стадии II деления, но и анафаза I деления, после которой частота нарушений быстро снижается. Стадиями стабилизации является телофаза I; у C. vulgarisи C. aviumвыброшенный за пределы веретена деления хроматин частично начинает подтягиваться к полюсам еще раньше - на стадии анафазы I. Во время перехода от телофазы II к стадии образования тетрад выброшенный или отставший хроматин у разных видов ведет себя по-разному: либо лизирует, либо накапливается. Поэтому стадия образования тетрад у видов является либо критической (C. vulgaris, M. tomentosa), либо стабилизационной (C. fruticosa, C. avium, A. nana). Чередование критических стадий и стадий стабилизации при микроспорогенезе в онтогенезе является, с одной стороны, приспособительной реакцией генотипов на неблагоприятные условия среды. Резкое повышение частоты нарушений микроспорогенеза в связи с воздействием факторов среды или эндогенных факторов ведёт к мобилизации внутренних механизмов, выражающихся в нормализации всех процессов, происходящих в растениях.
При оценке микроспорогенеза особое внимание было уделено изучению явления цитомиксиса. Цитомиксис у изученных видов происходит двумя путями: 1) перемещением хроматина из одной материнской клетки микроспор в другую на разных стадиях мейоза, 2) перемещением хроматина внутри микроспороцита в поздней телофазе II из одной микроспоры в другую. Шкутина (1969), Чувашина (1976, 1986), Туровцева (1999, 2001) обнаружили цитомиксис у гибридов сливы и C. vulgaris почти на всех стадиях мейоза. Это согласуется с полученными нами результатами. Цитомиксис у изученных растений Cerasus, Microcerasusи Amygdalus обнаруживается на разных стадиях микроспорогенеза, но наиболее часто - в профазах, метафазах I и II делений мейоза. У C. fruticosa, C. avium, и A. nana цитомиксис нами был описан впервые. Последствия цитомиксиса встречаются на разных стадиях. Скорее всего, такие клетки погибают.
Остается не выясненной природа факторов, стимулирующих цитомиксис. Нами установлено, что частота клеток с цитомиксисом не зависит от водообеспечения: между контрольными (70-75 % ППВ) и опытными растениями, произрастающими при избытке влаги (85-90 % ППВ) или ее недостатке (35-45 % ППВ), не выявлено существенных различий по числу клеток с цитомиксисом (Яндовка, 2004). Замечено, что частота цитомиксиса у гибридов C. vulgaris выше, чем у генетически сбалансированных растений C. vulgaris сорта Владимирская (10-15 %).
Постмейотический период в развитии пыльника начинается после выхода из тетрады микроспор и их вакуолизации. Затем следует деление ядра микроспоры и формируется 2-клеточное пыльцевое зерно. Спермии образуются при образовании пыльцевой трубки. Этот вывод согласуется с данными по C. vulgaris сорта Сисианская (Чолахян, Абрамян, 1980) и A. communis(Согомонян и др., 1974).
У изученных растений пыльца округлая и трехбороздная. Наблюдается широкий диапазон изменчивости пыльцевых зерен по размеру, причем даже в пределах одного пыльника, особенно у C. fruticosa. Анатомические различия фертильных и стерильных пыльцевых зерен у косточковых растений приведены во многих работах. Существует мнение (Орел, 1968; Симоненко, 1982; Mariami et al., 1990; Туровцева, 2001), что аномалии часто появляются в постмейотический период. С этим заключением мы не согласны, так как их значительное число происходит в мейотическом периоде, следствием чего является возрастание аномалий пыльцы.
Фертильность и жизнеспособность пыльцы ранее изучали в основном для выявления растений-доноров пыльцы для получния урожайных сортов. Многие авторы (Харитонова, 1958; Волошина, 1976; Рассветаева, 1982; Туровцева и др., 1995; Никифорова, 2001) отмечают, что пыльца косточковых растений активно прорастает на искусственной среде.
Растения C. fruticosa, C. vulgaris, C. avium, M. tomentosaи A. nanaимеют высокий процент морфологически сформированных пыльцевых зерен, определяемый ацетокарминовым методом. Жизнеспособность пыльцы, определяемая проращиванием на искусственной питательной среде, значительно ниже. C. vulgaris и A. nana характеризуются наибольшими показателями прорастания пыльцы на искусственной питательной среде (табл. 1). Соотношение образовавшихся при проращивании пыльцы на питательной среде пыльцевых трубок у видов различается. Наибольшее количество средних и длинных пыльцевых трубок, имеющих оплодотворяющую способность, выявлено при прорастании пыльцы C. vulgaris, что
ТАБЛИЦА 1.
Фертильность пыльцы видов Cerasus, Microcerasus и Amygdalus, определяемая ацетокарминовым методом и методом проращивания (среднее за 2007-2009 гг.)
Вид |
Фертильность пыльцы (%), определяемая ацетокарминовым методом |
Пыльцевые зерна |
Пыльцевые трубки, % |
|||
всего, шт |
не проросшие, % + m |
длинные |
средние |
короткие |
||
Cerasusfruticosa |
79.17 + 1.7 |
524 |
39.50 + 2.1 |
48.15 |
30.18 |
21.67 |
Cerasusvulgaris(сорт Владимирская) |
90.48 + 1.2 |
488 |
51.84 + 2.2 |
7.50 |
36.83 |
55.67 |
Microcerasus tomentosa |
96.81 + 0.7 |
600 |
52.43 + 2.0 |
19.25 |
43.22 |
37.43 |
Cerasusavium (сорт Итальянка) |
86.64 + 1.3 |
768 |
51.30 + 1.8 |
22.15 |
31.33 |
46.52 |
Amygdalusnana |
90.03 + 0.9 |
454 |
40.31 + 2.3 |
20.30 |
47.23 |
32.47 |
согласуется с литературными данными (Курсаков и др., 1976). Аномалии роста пыльцевых трубок имеются у всех видов.
На развитие и качество пыльцевых зерен косточковых растений влияют разные факторы: температура (Волошина, 1970), гибридное происхождение (Харитонова, 1972), физиолого-биохимическое состояние растений (Жуков и др., 1972), условия года и генотип (Рассветаева, 1982; Туровцева и др., 1995), агротехника выращивания (Волошина, 1970; Проценко и др., 1971), аионизирующая радиация, ?-лучиа и УФ-лучи (Рыжков, Остапенко, 1968; Пахомова, 1969; Симагин, 1978; Колесникова, Федотова, 1998), предварительная обработка бором, гиббереллином, фторурацилом (Школьник, 1970; Смирнов, 1971; Симагин, 1978).
Нами было изучено влияние некоторых факторов на процессы формирования и развития пыльцевого зерна.
Генетическое происхождение растений. У генетически сбалансированных растений C. vulgaris (сорт Владимирская) в основном образуются клетки с правильной конъюгацией хромосом во время микроспорогенеза, в то время как у сортов-гибридов C. vulgaris наряду с бивалентами присутствуют униваленты, триваленты и тетраваленты. Следствием высокой частоты нарушений микроспорогенеза у сортов-гибридов C. vulgaris является широкая изменчивость пыльцевых зерен по размеру. Генетически сбалансированные сорта C. vulgarisв основном образуют жизнеспособную пыльцу среднего размера, способную к прорастанию (53-55 %). У гибридных форм часты аномалии роста пыльцевых трубок. Чем отдаленнее систематически исходные родительские растения сортов-гибридов (вишне-черешне-черемуховые гибриды Восторг, вишне-черемуховые гибриды Харитоновская, вишне-черешневые гибриды Фея), тем больше нарушений процессов роста и развития их пыльцевых зерен.
Вода. Водный стресс влияет на все стадии микроспорогенеза и качество пыльцевых зерен. Водный дефицит (30-45 % ППВ) увеличивает частоту (на 16-49 %) и характер нарушений микроспорогенеза у всех изученных видов. Следствием этого является пониженная при почвенной засухе по сравнению с контролем (влажность почвы 70-75 % ППВ) фертильность пыльцы. Избыточное водообеспечение (более 85-90 % ППВ) увеличивает частоту и изменяет характер нарушений микроспорогенеза незначительно и почти не влияет на морфологию пыльцевых зерен и их ажизнеспособность.
У пыльцы всех исследуемых неполиваемых растений обычно при прорастании пыльцевые трубки скручиваются, изменяют направление роста, лопаются и т. д. У поливаемых растений большинство проросших пыльцевых трубок имеют нормальную длину, лишь у сортов-гибридов наблюдается скручивание пыльцевых трубок средней величины. Минимальное снижение процента нарушений микроспорогенеза по сравнению с контролем после влияния водного стресса имеется у вишне-черемуховых гибридов; вишневые гибриды наименее устойчивы к водному стрессу.
Температура. Проведенное исследование показало, что для многолетних растений наиболее важны эффективные - положительные температуры. В разные годы исследования характер нарушений микроспорогенеза остается без изменений. Различаются частота нарушений микроспорогенеза и фертильность пыльцы, которые увеличиваются при отклонениях от нормы или перепадах температуры. Разница в частоте нарушений микроспорогенеза между разными годами составляет 8-17 %. Более всего на процессы развития мужского гаметофита влияет температура весенних месяцев (апрель). Пониженные или слишком высокие температуры апреля, а также их резкие перепады отрицательно влияют на мейотический и постмейотический периоды в развитии пыльника. Температуры летне-осенних месяцев предыдущего года вегетации влияют на процессы формирования мужского гаметофита, но в меньшей степени. Следует отметить отрицательное воздействие повышенных температур августа-сентября.
УФ-облучение. Под влиянием УФ-облучения изменяется соотношение количества типичных и с измененной формой пыльцевых зерен. Облучение небольшими дозами (5Ч30-минутные УФ-экспозиции) увеличивает частоту пыльцевых зерен с измененной формой. После 60-минутной УФ-экспозиции частота нарушений формы в общей массе пыльцы, наоборот, ниже, чем в контроле и после малых доз УФ-облучения (5-30-минутные экспозиции). Облучение большими дозамиа помимо внешней структуры изменяет внутренние характеристики пыльцы, приводящие к ее гибели. Поэтому процент пыльцы с измененной формой среди общего количества пыльцевых зерен оказывается невысоким.
Качество пыльцевых зерен зависит от времени УФ-воздействий и видовой принадлежности растений. Жизнеспособность пыльцы у C. vulgaris и C. avium немного повышается после 30-минутной УФ-экспозиции (на 18 % и 5 %), A. nana - после 20-минутной УФ-экспозиции (на 13.3 %). Остальные варианты УФ-облучения снижают жизнеспособность пыльцы видов. Под влиянием УФ-обучения в основном увеличивается количество пыльцевых зерен, проросших короткими пыльцевыми трубками. У C. fruticosa, C. avium и M. tomentosa 30-минутная УФ-экспозиция понижает количество пыльцы, проросшей короткими пыльцевыми трубками на 6-23 %. Использование выявленных закономерностей может обеспечить возможность направленного влияния УФ-облучения на репродуктивный процесс плодовых растений аи интенсифицировать селекционную работу.
Электронное облучение. Электронное облучение изменяет морфологию и увеличивает процент деформированных пыльцевых зерен. Характер изменения структуры пыльцевого зерна зависит от дозы облучения. Наиболее значительные деформации пыльцы и снижение ее жизнеспособности (в среднем на 50 %) происходят после 1- и 5-минутного электронного облучения. У C. vulgaris, C. fruticosa и A. nana после 15 секунд облучения электронами жизнеспособность пыльцы повышается на 3.0-4.5 %, остальные варианты облучения снижают жизнеспособность пыльцы у всех изученных видов. Под влиянием электронного облучения увеличивается процент пыльцевых зерен, проросших короткими пыльцевыми трубками. Выявленные закономерности нарушения структуры и фертильности пыльцевых зерен после электронного облучения доказывают выводы о неблагоприятном воздействии электронного облучения на живые организмы.
Местоположение цветка в кроне. Самый высокий процент морфологически нормальной пыльцы имеется в верхнем и среднем ярусах кроны. У кустарниковых форм (C. fruticosa, аA. nana, M. tomentosa) максимальный процент жизнеспособной пыльцы имеется в среднем ярусе, у древовидных форм (C. vulgaris, C. avium) - в верхнем ярусе кроны. Выявленные закономерности неравноценности пыльцы из разных ярусов кроны могут также повысить эффективность селекционной работы.
Влияние углеродного наноструктурного материала Таунит. В Тамбовском государственном университете имени Г.Р. Державина на базе специализированной лаборатории (Гусев и др., 2008) проводится экологическая оценка углеродного наноматериала Таунит (УНМ), промышленно производимого ООО НаноТехЦентр (г. Тамбов). Ранее проводились эксперименты по изучению воздействия УНМ на ранние стадии развития проростков яровой пшеницы, гороха, подсолнечника, эспарцета (Гусев и др., 2009). Проведенная нами однократная обработка пыльников водными растворами УНМ в критические периоды развития (микроспорогенез) показала его влияние на фертильность пыльцевых зерен. Фертильность пыльцы снижается у C. avium, C. fruticosa и A. nana(разница между контролем и опытом 3-83 %). У M. tomentosaпроцент пыльцы снижается по сравнению с контролем после воздействия 0.1, 0.01, 0.025 и 0.002% концентрации на 1.7 - 34.0 %; в остальных вариантах фертильность пыльцы не изменяется. У всех изученных нами видов наиболее существенное снижение процента морфологически сформированной пыльцы происходит после обработки почек 0.1 % раствором УНМ. У C. fruticosa, M. tomentosaи A. nana существенное снижение этого показателя происходит также после воздействия раствором 0.025% концентрации. После воздействия раствора 0.05% концентрации существенно снижается процент морфологически сформированной пыльцы у C. avium и A. nana. Соотношение количества образовавшихся пыльцевых зерен мелких, средних и крупных после разных воздействий УНМ у видов различается.
УНМ понижает завязываемость семян, что является таксоноспецифичным показателем. У C. fruticosa завязываемость семян более всего снижается по сравнению с контролем после обработки 0.1, 0.0001, 0.005 и 0.0005 % таунитом. После воздействия таунитом 0.025 и 0.05 % концентраций процент завязавшихся семян у C. fruticosa, наоборот, повышается. У C. avium максимальное снижение завязываемости семян происходит после 0.1 и 0.0005 % концентраций; повышение этого показателя наблюдается после 0.001 % концентрации таунита. M. tomentosa в основном снижает этот показатель по сравнению с контролем после всех вариантов воздействий, кроме 0.0005 % концентрации. У A. nana после концентраций таунита 0.01, 0.0001 и 0.0005 % завязываемость семян понижается; остальные варианты опыта повышают этот показатель. По-видимому, одной из причин снижения процента завязавшихся семян является низкая фертильность пыльцы после воздействий таунита.
ГЛАВА V. РАЗВИТИЕ И СТРОЕНИЕ ЖЕНСКИХ
ГЕНЕРАТИВНЫХ СТРУКТУР
Для большинства видов подсемейства Prunoideae, куда относятся исследуемые виды C. vulgaris, C. avium, C. fruticosa, M. tomentosaиA. nana, указывают на развитие одного плодолистика (Bradbury, 1929; Tukey, 1933, 1936; Harrold, 1935; Алексеев, 1962; Строчкова, 1962; Филимонова, 1962; Березенко и др., 1965; Рихтер, 1972; Михайлова, 1982). Однако у некоторых представителей описано 2 и даже 5 плодолистиков (Melchior, 1964; Пивоварова, 1964; Гладкова, 1981; Takhtajan, 1997). Плод определяют в виде сочной или сухой однокостянки (Тахтаджян, 1966; Меликян, Бондарь, 1996). В завязи отмечают наличие двух висячих семязачатков.
Проведенный анализ литературы выявил полное отсутствие данных по M. tomentosaиA. nana и почти полное отсутствие данных по роду Cerasus - имеются лишь фрагментарные сведения по строению гинецея, семязачатка, мегаспорогенезу, формированию зародышевого мешка. Для сравнения были привлечены данные по видам рода Prunus, поскольку многие виды Cerasus ранее были включены в этот род.
Гинецей у изученных видов является псевдомономерным. Он имеет сходное строение: представлен двумя плодолистиками, различающимися размерами, строением и репродуктивной способностью (рис. 4, 1, 2). Стерильный плодолистик практически лишен плацент, за исключением верхней части завязи, где сохраняются остатки плацент, при этом отсутствуют какие-либо признаки формирования семязачатков. Рыльце стерильного плодолистика дифференцируется только к моменту оплодотворения (рис. 4, 4). В фертильном плодолистике семязачатки формируются на двух угловых плацентах, на которых возникают 2 семязачатка, различающиеся по строению и способности формировать в дальнейшем семя. В верхней части фертильного плодолистика наблюдается лишь разрастание плаценты, а семязачаток останавливается в развитии на стадии примордия. Фертильным является большой плодолистик, в котором формируются 4 семязачатка, при этом 2 из них останавливаются в развитии на стадии примордия. И таким образом, в завязи окончательно развиваются только 2 семязачатка фертильного плодолистика, из которых полностью сформированным становится семязачаток, развивающийся на плаценте лишь в основании завязи (рис. 4, 2).
с сз
а
пр сз
аф сз
ас сз
аг
апд
ам к
аи
аф ч р
аи ч р
а 3
3
2
апц
аф сз
аф пл
ар с пл
аф пл
ас пл
арц ф пл
а 4
4
с пл
а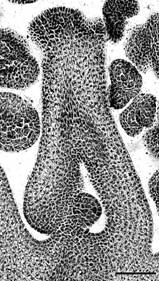
![]()
Рис. 4. Гинецей, плацентация, семязачаток у C. vulgaris, M. tomentosa, C. avium, A. nana.
1 - гинецей из двух неравных плодолистиков (C. vulgaris); 2 - завязи плодолистиков, виден выступ в основании стерильного плодолистика, два семязачатка в полости фертильного плодолистика (M. tomentosa); 3 - положение двух семязачатков в завязи фертильного плодолистика (C. avium); 4 - рыльца фертильного и стерильного плодолистиков (A. nana);
пр сз - примордий семязачатка (стадия археспориальной клетки); пц - плацента; с пл - стерильный плодолистик; ф пл - фертильный плодолистик; рц ф пл - рыльце фертильного плодолистика; р с пл - рыльце стерильного плодолистика с сз - стерильный семязачаток; ф сз - фертильный семязачаток; и ч р - интегументальная часть рафе; ф ч р - фуникулярная часть рафе; и - интегумент; м к - микропилярный канал.
Масштабная линейка - 10 мкм.
Исходя из представлений А.Л. Тахтаджяна (1942, 1964, 1980), гинецей у C. vulgaris, C. avium, C. fruticosa, MicrocerasustomentosaиAmygdalusnana следует определить как синкарпный в большей части завязи и как паракарпный на уровне верхней границы плацент и в месте смыкания стилодиев и рылец.
У всех изученных видов завязь нижняя. В ходе развития она из 2-гнездной становится вторично 1-гнездной, в которой сохраняется стерильный плодолистик. У фертильного плодолистика при полном срастании абаксиальных краев его адаксиальные края остаются раскрытыми, что приводит к формированию косо ориентированного канала, ведущего в полость завязи. Подобный канал был описан для некоторых представителей семейств Nyctaginaceae и Phytolaccaceae (Тимонин, 2005). В меньшем (стерильном) плодолистике семязачатки не образуются, несмотря на наличие рудиментарных плацент в апикальной части завязи. Подобный тип гинецея в литературе определяют как псевдомономерный (Eckard, 1937), или псевдоапокарпный (Тимонин, 2005).
Таким образом, гинецей у C. vulgaris, C. avium, C. fruticosa, M. tomentosaиA. nana представлен не одним плодолистиком, как это указывается в литературе для большинства представителей подсем.Amygdaloideae (Melchior, 1964; Гладкова, 1981; Takhtajan, 1997), в том числе для видов Cerasus и Prunus(Pechoutre, 1902; Bradbury, 1929; Tukey, 1933; Harrold, 1935; Алексеев, 1962; Филимонова, 1962; Хитрова, 1964), A. nana (Киселева, 1972), а двумя плодолистиками. В некоторых случаях (у всех видов) наблюдалось развитие 2 равных плодолистиков, при этом завязь была почти 2-гнездной и в каждом гнезде имелись 2 формирующихся семязачатка. Об этом, по-видимому, свидетельствуют данные, полученные по строению, так называемых, двойных семязачатков у C. avium (Eaton, 1959b). В этом случае в завязи развивалось не 2, а 4 семязачатка, каждые два из которых попарно срастались (подобные семязачатки отмечены в 5-12 % случаев). Подобные факты для этого вида отмечены и в другой работе (Березенко, Радiоненко, 1965). Картины схожего расположения семязачатков на нижней части плацент фертильного плодолистика можно наблюдать у изученных нами видов C. vulgaris, C. avium, C. fruticosa, M. tomentosaиA. nana. Однако при этом общие ткани, связывающие семязачатки попарно, возникают за счет объединения адаксиальных краев плодолистика, а семязачатки располагаются не в билатеральной, а сагиттальной плоскости. Вариант строения гинецея из двух плодолистиков описан в подсемействе у Maddenia. Кроме того, у Oemleria даже при наличии пяти плодолистиков отмечено образование не более двух плодов (Гладкова, 1981). Полученные результаты свидетельствуют, по нашему мнению, о естественности данного подсемейства, что подтверждается данными по строению и развитию гинецея.
Наряду с общими особенностями строения гинецея имеются некоторые видоспецифичные признаки. У C. vulgaris, C. aviumи C. fruticosaзавязь стерильного плодолистика имеет в основании хорошо выраженный выступ, у M. tomentosa и A. nana выступ выражен слабо. У видов различаются размеры завязи. Самая крупная завязь у C. avium, мелкая - у вишни степной. Угол наклона косо ориентированного канала, ведущего в полость завязи, у представителей разных видов также неодинаковый. У изученных видов различаются размеры разрастания плаценты фертильного плодолистика. Различается и положение двух семязачатков друг относительно друга в полости завязи фертильного плодолистика (рис. 4, 2, 3). У вишни войлочной семязачаток, в дальнейшем останавливающийся в развитии, расположен намного выше семязачатка, развивающегося в семя. У миндаля низкого стерильный семязачаток располагается лишь немного выше фертильного семязачатка. У видов рода Cerasusуровеньв положении двух семязачатков в завязи фертильного плодолистика почти одинаков. Поверхность гинецея у растений рода Cerasusгладкая, без опушения. У растений A. nanaзавязь и стилодий опушены, в то время как у M. tomentosaопушены только нижняя часть стилодия и верхняя часть завязи. Выявлены различия в форме и размерах эпидермальных клеток, а также ориентации лопастей рыльца.
Формирование и развитие семязачатка у C. vulgaris, C. avium, C. fruticosa, M. tomentosaиA. nana происходит сходно. В сформированном примордии семязачатка выделяются следующие зоны: периферическая, апикальная, латеральная и базальная (топография и названия зон даны по Шамрову, 2008). Каждая его зона дает начало определенной области семязачатка. Процесс инициации единственного интегумента имеет некоторые особенности (формируется из эпидермальных и субэпидермальных инициалей; инициали располагаются в 4 слоя в эпидерме и в 2 слоя в субэпидерме). Генезис интегумента на ранних стадиях напоминает собой синхронное развитие внутреннего и наружного интегументов битегмального семязачатка на базе общих инициалей в ходе конгениального срастания в единую морфологическую структуру. Такой путь перехода от би- к унитегмальности, вероятно, присущ представителям тех семейств, для которых характерно раннее объединение двух интегументов в один в случае их одинакового происхождения (Bouman, 1984). К таким семействам относится и сем. Rosaceae, для которого характерны семязачатки как с двумя, так и одним интегументом (Schnarf, 1931; Мандрик, Петрус, 1985; Takhtajan, 1997). Для C. vulgaris наличие битегмального семязачатка (Bradbury, 1929; Corner, 1976; Меликян, Бондарь, 1996) не согласуется с полученными в нашем исследовании данными о формировании одного массивного интегумента. Это расхождение, возможно, связано с отсутствием данных по генезису интегумента, а отсутствие внутреннего интегумента в составе семенной кожуры объясняется его ранним исчезновением. Наличие унитегмального семязачатка определено нами и для изученных видов AmygdalusиMicrocerasus.
По строению и развитию нуцеллуса семязачаток у C. vulgaris, C. avium, C. fruticosa, M. tomentosaиA. nana является крассинуцеллятным и характеризуется дифференциацией в нуцеллусе постамента, подиума, париетальной ткани и нуцеллярного колпачка. Поскольку субэпидерма примордия семязачатка является двуслойной, особенности формирования нуцеллуса укладываются в рамки компликатной вариации крассинуцеллятного типа (Шамров, 2002). У P. dulcis (Pimienta, Polito, 1983) также отмечалось образование париетальной ткани. У C. avium (Tukey, 1933) обнаружена, как и у C. vulgaris, 5-7-слойная париетальная ткань. У P. persica (Harrold, 1935) кроме 3-4-слойной париетальной ткани был описан 2-3-нуцеллярный колпачок. У C. avium (Ruhle, 1924; Tukey, 1933) и P. domestica (Суркова, Скипина, 1966) в нуцеллусе выявлены слои удлиненных клеток с крупными ядрами, идущих от мегаспороцита до халазы, что соответствует постаменту (Шамров, 2002).
Несмотря на общий план строения и развития семязачатка, изученные виды различаются формой и размерами клеток в латеральной области нуцеллуса. Клетки постамента и центральной части подиума у видов Cerasusпреимущественно таблитчатые, тогда как в латеральной части подиума они вытянутые. У M. tomentosaклетки как центральной части подиума и постамента, так и латеральной части подиума, почти квадратные (их длина примерно равна ширине). У A. nanaклетки постамента и центральной части подиума преимущественно таблитчатые, в центральной части подиума немного неправильной формы, тогда как в латеральной части подиума они вытянутые. Виды различаются числом слоев париетальной ткани. У Cerasusvulgaris, C. aviumи C. fruticosaона5-7-слойная, у Amygdalusnana и Microcerasustomentosa - 3-5 слойная. Халаза может быть охарактеризована как мезохалаза (Шамров, 2004). Наличие пахихалазы, указанной для представителей подсем. Amygdaloideae (Corner, 1976), для изученных нами видов не характерно. Гипостаза формируется в виде единого инициального слоя в основании нуцеллуса и интегумента на стадии спорогенных клеток. В дальнейшем клетки инициального слоя гипостазы делятся; в сформированном семязачатке гипостаза является 2-3-слойной, приобретая форму чаши. Наличие гипостазы указывается лишь в работе по P. communis (Sarfatti, 1958).
В литературе тип семязачатка в подсем.Amygdaloideae определяют по-разному: анатропный (Гладкова, 1981), анатропный или почти гемитропный (Melchior, 1964), гемитропный (Мандрик, Петрус, 1985) и даже кампилотропный (Тахтаджян, 1966; Takhtajan, 1997). Для изученных видов родов Cerasus и Prunus указывается, что семязачатки у них анатропные (Pechoutre, 1902; Harrold, 1935; Sarfatti, 1958; Pimienta, Polito, 1982, 1983; Березенко, 1982; Labrecque, Barabe, 1984; Labrecque et al., 1985). Результаты нашего исследования по морфологии семязачатка у C. vulgaris, C. avium, C. fruticosa, M. tomentosaиA. nana свидетельствуют о том, что семязачаток у них гемитропный. Фуникулус очень короткий, но достигает в ширину значительных размеров. Для семязачатка характерно образование массивного рафе, однако интегумент не полностью срастается с фуникулусом, о чем свидетельствует наличие выроста в микропилярной части семязачатка.
У C. vulgaris, C. avium, C. fruticosa, M. tomentosaиA. nana развитие археспория, мегаспороцита и зародышевого мешка происходит сходным образом. Археспорийа потенциально многоклеточный (3-6 клеток). Дальнейшее развитие получает обычно одна клетка. В некоторых случаях можно наблюдать формирование 2 мегаспороцитов и как следствие 2 зародышевых мешков. В литературе у растений Prunus из того же подсемейства, что и Cerasus, Microcerasusи Amygdalus, обычно лишь одна спорогенная клетка трансформируется в мегаспороцит (Мандрик, Петрус, 1985). Однако, для некоторых видов (P. armeniaca - Eaton, Jamont, 1965) было отмечено развитие нескольких мегаспороцитов, мегаспор одной тетрады и зародышевых мешков, при этом в большей части семязачатков формируется один зародышевый мешок. Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-типу. Полученные результаты согласуются с имеющимися литературными данными по C. avium (Ruhle, 1924; Tukey, 1933; Eaton, 1959; Чолахянаи др., 1975), C. vulgaris (Bradbury, 1929; Березенко, 1982), P. persica (Harrold, 1935), P. dulcis (Pimienta, Polito, 1983).
В развитии зародышевых мешков в некоторых случаях наблюдали нарушения, связанные с поведением хромосом во время мегаспорогенеза, а также, возможно, индуцированные неблагоприятным воздействием окружающей среды. Изучение женских генеративных структур позволило выявить критические стадии в их развитии. Критическими стадиями являются процессы мегаспорогенеза и начальные этапы развития зародыша. В литературе (Козлова, 1959; Филимонова, 1962; Спицын, 1994, 2001) критическим периодом у C. vulgarisи C. fruticosa называют первые фазы эмбриогенеза.
Наряду с общими особенностями формирования и развития семязачатка, имеются некоторые видоспецифичные признаки. У C. vulgaris семязачатки овальной формы (высота превышает ширину примерно в 1.5 раза), в то время как у C. fruticosa, C. avium и A. nana семязачатки сильнее вытянуты в высоту (высота превышает ширину примерно в 1.7-1.8 раз), у M. tomentosaсемязачатки округлой формы (высота примерно равна ширине) (рис. 4, 2, 3). У C. vulgarisи C. fruticosa завязи фертильных плодолистиков располагаются на разросшемся цветоложе, ножки фертильных плодолистиков не выражены. У C. aviumножка фертильного плодолистика очень короткая. У A. nanaиM. tomentosa ножка фертильного плодолистика имеет значительные размеры. У разных видов различаются форма и размеры клеток постамента и подиума. Клетки постамента и центральной части подиума у видов Cerasusпреимущественно таблитчатые, тогда как в латеральной части подиума они вытянутые в ширину. У M. tomentosaклетки как центральной части подиума и постамента, так и латеральной части подиума, почти квадратные. У A. nanaклетки постамента и центральной части подиума преимущественно таблитчатые, в центральной части подиума немногоа неправильной формы, тогда как в латеральной части подиума они вытянутые в ширину.
ГЛАВА VI. ПЛОД аИ СЕМЯ
Морфологическое строение аплодов и семян у изученных видов Cerasus, Microcerasus и Amygdalus однотипное: сочный плод-костянка состоит из тонкого экзокарпия, мясистого мезокарпия, каменистого эндокарпия и семени. Несмотря на одинаковое строение, плод у разных видов различается размерами и толщиной мезокарпия и эндокарпия. Изученные виды различаются также длиной плодоножки, размерами и массой семян и плодов. Самые тяжелые плоды (в граммах) уа C. avium (4.07+1.9), самые легкие - у C. fruticosa (1.26+1.1) и M. tomentosa (2.13+1.4); самые тяжелые семена обнаружены у A. nana (0.65+0.8), самые легкие семена у M. tomentosa(0.06+0.2) и C. fruticosa(0.04+0.2). Следует отметить, что в некоторых определителях растений указывается средняя масса семян, в то время как размеры семян, их количество на растении, длина плодоножки, как правило, не приводятся. Нами установлено, что размеры и масса отдельных семян, семян с косточками и плодов, а также длина плодоножки различаются не только у разных видов. Эти показатели варьируют у видов и в пределах одного года, особенно ярусах кроны растений Максимальная масса плодов и семян имеется в среднем ярусе кроны.
Растения C. vulgarisспособны к перекрестному опылению и самоопылению, при доминировании первого варианта, при этом свободное опыление более эффективно (Бекетовская, 1968; Березенко, 1979). По степени самоплодности сорта C. vulgarisи C. aviumразделяют на самоплодные, частично самоплодные, самобесплодные (Баранова, 1951; Рябов, 1970; Удачина, 1976). C. avium относится к самобесплодным растениям (Рябов, 1970), C. fruticosa - самостерильным, у C. fruticosaотмечены самофертильные формы (Симагин, 1978). У A. communisоплодотворение чаще обеспечивается перекрестным опылением (Рябов, 1930; Пахомова, 1962; Kester, 1965; Ядров, 1982).
Полученныеа результаты в общих чертах согласуются с литературными данными. Соотношение пыльцевых зерен и семязачатков (англ. pollen-оvuleratio - P/O; Cruden, 1977) у видов разное. Самый низкий показатель P/O (490-495) отмечен у C. fruticosaи M. tomentosa - система скрещивания проявляет тенденцию к автогамии, при которой происходит самоопыление, осуществляющееся при попадании пыльцы на рыльце пестика своего же цветка. У C. vulgaris, A. nana и C. avium значения P/O высокие, находятся в пределах от 1286 до 1502 - проявляют тенденцию к аллогамии, при которой возможны как гейтоногамия, так и ксеногамия. Принудительное опыление видов Cerasus, Microcerasus и Amygdalusпоказало, что для них характерны как ксеногамия, так и гейтоногамия (табл. 2).
У Amygdalusnanaмы авпервые отмечали возможность истинной клейстогамии - прорастание пыльцы прямо в пыльниках, еще до раскрытия бутонов, хотя случаев достижения пыльцевыми трубками зародышевого мешка не наблюдали.
ТАБЛИЦА 2.
Завязываемость плодов и семян у видов Cerasus, Microcerasus и Amygdalus
(III декада мая)
Вид |
Завязываемость семян (%) в условиях |
||
Гейтоногамии |
Ксеногамии |
свободного опыления |
|
Cerasusvulgaris (сорт Владимирская) |
67.41 |
46.61 |
21.85 |
Cerasus fruticosa |
22.23 |
23.73 |
5.67 |
Cerasusavium (сорт Итальянка) |
75.52 |
65.48 |
69.50 |
Microcerasustomentosa |
31.74 |
21.75 |
24.58 |
Amygdalusnana |
34.67 |
43.61 |
52.03 |
Данные по урожайности вишни степной, вишни обыкновенной (сорт Гремяченская), вишни войлочной, вишни японской, магалебки и черешни в Воронежской области приводятся в статье Назаровой с коллегами (1985). Авторы статьи отмечают, что самый низкий выход семян у M. tomentosa. В статьях прикладного характераа приводятся данные по урожайности сортов C. vulgaris, C. aviumи C. fruticosa. Авторы указывают на их невысокую реальную семенную продуктивность. Сиднин и Грушин (1996) выделили сорта-источники высокой урожайности C. vulgarisдля использования в селекции. Нами установлено, что потенциальная семенная продуктивность у C. vulgaris, C. fruticosa, C. avium, M. tomentosaи A. nanaвысокая (216-433 шт. - ачисло цветков на одном побеге). Реальная семенная продуктивность изученных растений гораздо ниже (2.3-24.5 шт. семян и плодов на 1 побеге в период созревания) (рис. 5).

Рис. 5. Потенциальная семенная продуктивность (ПСП) и реальная семенная продуктивность (РСП) видов Cerasus, Microcerasus иAmygdalus (% от числа цветков).
У C. vulgaris иC. avium (жизненная форма растений - дерево) обследовались побеги длиной 1 м; C. fruticosa, M. tomentosa и A. nana (жизненная форма - кустарник) - длиной 0.5 м. Объем выборки - 10 учетных побегов.
Биологическое значение невысокой реальной семенной продуктивности видов может быть следующим. С одной стороны, невысокие процентные показатели семенной продуктивности видов компенсируются за счет обилия общего количества семян, производимых одним растением. С другой стороны, невысокий процент сохранившихся завязей ко времени полного созревания семян является эволюционным приспособительным эффектом, способствующим самосохранению растения. Следует заметить, что даже при среднем коэффициенте продуктивности образуется достаточно большое количество полноценных семян, что дает возможность обеспечить процессы возобновления растений C. fruticosa, C. vulgaris, C. avium, M. tomentosaи A. nana семенным материалом. Коэффициент продуктивности выше в средних и верхних ярусах кроны растения. Достоверная разница между продуктивностью побегов верхних и средних ярусов кроны отмечена у A. nana и C. avium (33.0-51.4 и 24.6-57.9 %)
Наши исследования показали, что эффективность репродукции у C. fruticosa, C. vulgaris, C. avium, M. tomentosaи A. nana, определяемая проращиванием семян, достаточно высокая (25.2-65.9 %). Всхожесть семян из разных ярусов кроны неодинаковая, однако, разница между этими показателями небольшая. Некоторые семена не прорастают из-за аномалий в развитии зародыша и эндосперма.
Семена изученных растений характеризуются комбинированным покоем. Для Rosaceaeобычен физиологический механизм торможения (ФМТ) прорастания семян, у некоторых видов покой усугубляется дополнительным влиянием покровов. Косточка у видов подсемейства Prunoideaeтормозит прорастание семян; однако семена некоторых видов Amygdalusмогут находиться в экзогенном покое и прорастать после удаления косточки (Николаева, 1989). Семена C. avium, C. vulgaris, C. fruticosaхарактеризуются комбинированным покоем (А2-В3), нуждаются в стратификации при +3+50 С в течение 3-6 месяцев. Для семян в косточке рекомендуется 2-этапная стратификация: при +200 С (0.5 месяца), при +30 С (4-7 месяцев). Для прохождения стадии яровизации семенам C. vulgarisнеобходимы не только стратификация, но и влага, воздух, пища (Машкин, 1961). Семена M. tomentosaхарактеризуются покоем А2-В2, нуждаются в стратификации при +3+50 С в течение 2-3 месяцев (Потапенко, 1940, см. Руденко, 1972; Николаева, 1985). Условия стратификации семян C. aviumизучали и другие авторы (Suszka, 1964). Резкое изменение режима температуры семян C. fruticosaво время стратификации позволяет сократить стратификацию до 20 дней (Кочетов, 1951). Покой семян вишни характеризуется низкой интенсивностью дыхания и падением активности каталазных и пероксидазных систем, изменяется состав аминокислот (Федоров и др., 1966).
Нами установлено, что для успешного прорастания семян C. vulgaris, C. fruticosa, C. aviumи M. tomentosa важное значение имеют среда и продолжительность стратификации. Сроки стратификации в числе 30 и 90 дней недостаточны для активизации ростовых процессов в семенах изученных растений. Увеличение сроков стратификации до 120 дней повышает готовность семени к прорастанию. Однако аоптимальная продолжительность периода покоя для семян изученных нами растений C. fruticosa, C. vulgaris, C. avium, M. tomentosaи A. nana - 210 дней.
Стратификацию семян вишни и миндаля рекомендуется проводить в песке, торфе, смеси торфа с песком или сфагновом мхе (Николаева и др., 1985). Нами установлено, что наиболее оптимальной средой для стратификации являются земля и торфяная крошка. Семена, проходившие период покоя на таком субстрате, имеют самый высокий процент прорастания. Наряду с этим, хорошими субстратами для стратификации являются моховый и песчаный субстраты. Установлено, что среда стратификации влияет на сроки начала прорастания семян после периода покоя. Быстрее всего семена начинают прорастать после мохового и торфяного субстратов. Медленнее всего - после бумажного и песчаного субстратов.
Растения Amygdalus прорастают гипогеально; растения Cerasusпрорастают эпигеально, вынося семядоли над поверхностью почвы (Васильченко, 1950; Алексеев, 1960). Проращивание нами семян C. fruticosa, C. vulgaris, C. avium, M. tomentosaи A. nana подтверждает эти выводы. Следует добавить, что растения Microcerasustomentosaхарактеризуются надземным прорастанием.
ГЛАВА VII. ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ
Изученные растения подсемейства Prunoideaeимеют способность к естественному вегетативному размножению - сарментации. Прививка в искусственных условиях не всегда оказывается успешной. Особенно затруднительна она у косточковых растений. Привитые почки или черенки часто не прирастают на подвое из-за неблагоприятных погодных условий. Нами были предложены способы оптимизации этого процесса. Прививку проводили дважды в традиционные сроки: весной - до начала весеннего сокодвижения (апрель) и в конце лета - после завершения роста побегов и их листьев (первая декада августа). В обоих случаях использовали черенки. Максимальная приживаемость черенков разных сортов C. vulgaris летом была выше, чем после весенней прививки и составила 83.3 % (вишневые гибриды), 33.3 % (вишне-черешневые и вишне-черемуховые гибриды). Максимальная приживаемость черенков после весенней прививки составила 11.1-33.3 %. По-видимому, одной из причин разной приживаемости прививок, проводимых в разное время года, являются погодные условия. В Центральной Черноземной зоне России (Тамбовская область) весной ежегодно наблюдаются ночные заморозки, сменяющиеся относительно высокими положительными дневными температурами. Резкие перепады температур, скорее всего, тормозят функционирование меристем. В результате привитые черенки долго не приживаются или гибнут. Во время летней прививки разница между дневными и ночными температурами обычно невелика и благоприятна для интенсивных клеточных делений. Самую высокую приживаемость у C. vulgaris имеют черенки, взятые из верхнего и среднего ярусов кроны дерева (24-67 %). Полученные результаты (летняя прививка и взятие черенков для прививки из среднего яруса) могут быть успешно использованы в селекционной работе.
Клональное микроразмножение в культуре invitro является вариантом искусственного вегетативного размножения, позволяющим вырастить растение из одной клетки. Оптимизацией клонального микроразмножения C. vulgarisдетально занимались многие авторы. Нами был предложен принципиально новый способ повышения интенсивности каллусообразования из листьев растений C. vulgarisв культуре invitro. Этот способ состоит в том, что перед помещением на питательные среды экспланты растений, находящиеся в растворе питательной среды, обрабатывали ультразвуком. Результаты показали, что обработка ультразвуком определенной интенсивности растительных тканей invitro может улучшить действенность стандартных биотехнологических методик и существенно повысить их эффективность для C. vulgaris. Интенсивность каллусообразования возрастала с увеличением мощности УЗ-воздействия (3.0 - 14.0 Вт) в 2-2,5 раза по сравнению с вариантом без УЗ-обработки. Полученные результаты могут быть с успехом использованы в генетико-селекционной работе.
ЗАКЛЮЧЕНИЕ
Изучение взаимосвязанных этапов онтогенеза растений (органогенез цветка, цветение, опыление, оплодотворение, эмбриогенез, созревание семян) - одна из важных задач эмбриологии и репродуктивной биологии. Для познания сложных процессов развития зародыша и семени особенно актуальным является выявление различных аномалий при половой репродукции. Выявление закономерностей потенциальной и реальной семенной продуктивности, а, следовательно, и урожайности плодовых культур имеет практическое значение.
Изучение процессов формирования генеративных органов невозможно без оценки меняющихся в процессе онтогенеза взаимоотношений растения и среды. Эти исследования в последнее время приобретают все большую актуальность, так как репродуктивные структуры растений более всего подвержены влиянию неблагоприятных факторов среды. Репродуктивная биология растений Cerasus fruticosa, C. vulgaris, C. avium, Microcerasus tomentosa и Amygdalus nana характеризуется большими количественными резервами и экологической пластичностью разных ее этапов. Благодаря высокой потенциальной продуктивности растений образуется достаточное количество полноценных семян.
На эффективность репродукционных процессов растений Cerasus fruticosa, C. vulgaris, C. avium, M. tomentosa и A. nana влияют эндогенные (генетическое происхождение растений, местоположение цветка в кроне растения) и экзогенные (вода, температура, облучения, УНМ Таунит) факторы. Одним из важных факторов, влияющих на процессы формирования генеративных органов, является водообеспечение. Установлено, что оптимальное водообеспечение (70-75% ПВ) в сочетании с благоприятным для роста и развития температурным режимом нормализует процессы семя- и плодообразования, способствует их нормальноиу прохождению. Нарушения водного режима в сторону увеличения и особенно - уменьшения содержания воды в почве, сочетаясь с температурным фактором, изменяют морфологию и физиологию побегов, листьев, цветков и их частей, семян. Изучение действия недостатка воды или ее избытка на косточковые культуры наа разных эмбриональных этапах позволяет установить наиболее уязвимые (критические) этапы процесса формирования репродуктивных органов и выявить характер аномалий. Сравнение чувствительности разных генотипов к водному стрессу дало возможность выявить наиболее устойчивые, рекомендовать их к использованию в генетико-селекционной работе и сельскохозяйственном производстве.
Дестабилизация детерминированного состояния репродуктивного цикла мужского гаметофита, проявляющаяся в частоте его отклонений от нормы у гибридных растений и видовых форм в условиях стресса (водного и температурного, воздействия УФ- и электронных облучений, УНМ Таунит), таксоноспецифична. Генетически детерминированным у изученных видов является не только репродуктивный цикл, но и характер его нарушений, усиливающийся в условиях стресса. Различия между близкими в систематическом отношении видами имеют генетическую обусловленность, которая наиболее четко проявляется после воздействия на растения разных факторов.
Сходство по антэкологическим, цитогенетическим и эмбриологическим характеристикам подтверждает близкое филогенетическое родство видов Cerasusfruticosa, C.vulgaris, C. avium, Microcerasustomentosaи Amygdalusnana. Выявленные особенности, характеризующие процессы формирования и развития цветка, гинецея, андроцея, семязачатка, пыльника, пыльцевого зерна и семени, могут быть использованы в качестве диагностических признаков при характеристике видов.
Затрудненное прорастание семян хозяйственно важных косточковых растений создает большие трудности. В этой связи весьма важным является расширение исследований экологических аспектов прорастания семяна в зависимости не только от условий существования, но и жизненных форм растений. В связи с этим необходимо углубленное изучение физиолого-биохимической природы ФТМ, особенно пониженной активности зародышей покоящихся семян и роли температуры в ее усилении у мало изученных в этом отношении видов Cerasus, Microcerasus, Amygdalus. Дальнейшие исследования в этом направлении могут привести к созданию эффектитвных биотехнологий семенного размножения и расширения границ произрастания косточковых древесных растений.
ВЫВОДЫ
- У Cerasus fruticosa, C. vulgaris, C. avium, Microcerasus tomentosa и Amygdalus nana соблюдаются общая последовательность заложения частей цветка, единый план строения и одинаковые фазы его распускания. Наиболее вариабельными являются количественные признаки, характеризующие размеры чашелистиков, лепестков, диаметр и высоту завязи, общую длину плодолистика и тычиночных нитей.а
- У изученных видов развитие пыльника (формирование стенки микроспорангия с дистальной стороны по типу однодольных, или центростремительному типу; симультанный тип образования тетраэдральных тетрад микроспор; 3-клеточные зрелые пыльцевые зерна), формирование гинецея (псевдомономерный гинецей их двух плодолистиков, один из которых является фертильным), семязачатка (гемитропный, крассинуцеллятный, унитегмальный, мезохалазальный, с коротким фуникулусом, массивным рафе и гипостазой), мегаспорогенеза (археспорий потенциально многоклеточный, линейная тетрада мегаспор) и развития зародышевого мешка (Polygonum-тип) происходят сходно.
- Система скрещивания у Cerasusfruticosaи Microcerasustomentosaпроявляет тенденцию к автогамии, тогда как уа C. vulgaris, C. aviumи Amygdalusnana - к аллогамии. У изученных видов выявлена высокая потенциальная семенная продуктивность, благодаря чему даже при среднем коэффициенте продуктивности образуется значительное количество полноценных семян, всхожесть которых апосле оптимизации стратификации в течение 210 суток адостаточно высокая.
- Сходство поа антэкологическим, цитогенетическим и эмбриологическим характеристикам подтверждает близкое родство видов Cerasusfruticosa, C. vulgaris, C. avium, Microcerasustomentosaи Amygdalusnana в пределах подсемейства Amygdaloideae семейства Rosaceae. Выявленные различия могут быть использованы в качестве диагностических признаков при характеристике видов:
а) андроцей: число тычинок и длина тычиночных нитей, число рядов клеток сформированной стенки пыльника, сроки начала микроспорогенеза, характер и частота типичных и нетипичных нарушений в мейозе, продолжительность критических и стабилизационных стадий в микроспорогенезе, а также сроки созревания, форма,а размеры и фертильность пыльцевых зерен.
б) гинецей: размеры ножки и расположение фертильного плодолистика, соотношение высоты и ширины семязачатков, форма и размеры клеток постамента и подиума.
в) плод: форма и масса плодов, длина плодоножки, соотношение размеров частей перикарпия; семя: форма и масса семян, соотношение размеров семени,а длины зародыша и эндосперма; потенциальная и реальная семенная продуктивность: количество завязавшихся семян, характер аномалий в их развитии, всхожесть семян.
- На эффективность репродукционных процессов растений Cerasusfruticosa, C. vulgaris, C. avium, Microcerasustomentosaи Amygdalusnana влияют эндогенные (генетическое происхождение растений, местоположение цветка в кроне растения) и экзогенные (вода, температура, УФ-облучение, обработка ультразвуком, УНМ Таунит) факторы. Одним из важных экологических показателей является водообеспечение, которое сочетаясь с температурным фактором, изменяет строение побегов, листьев и органов цветка, особенно во время критических и стабилизационных стадий.
- аНа основе ряда эндогенных (использование черенкова из верхнего и среднего ярусов кроны дерева, особенно воа время летней прививки) и экзогенных (обработка ультразвуком) факторов разработан регламент микроклонального размножения Cerasusvulgaris. Разработанные подходы позволяют оптимизировать вегетативное размножение, расширяют границы стандартных биотехнологических методик и повышают процент выхода здоровых саженцев.
Автором опубликовано 75 работ, список наиболее значимых из них приводится.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Монография
1. Яндовка Л.Ф., Тарбаева В.М. Формирование генеративных органов Cerasusvulgaris и C. tomentosa (Rosaceae) в связи с водным режимом. - Изд-во ШиК. - СПб, 2005. - 120 с.
В изданиях, рекомендованных ВАК:
- Спицын И.П., Яндовка Л.Ф. Оценка качества пыльцы в связи с генетической природой рода Cerasus и экологией // Вестник Тамбовского университета. Серия: естественные и технические науки. - 2001. - Т.6. - Вып.1. - С. 44-45.
- Яндовка Л.Ф., Спицын И.П. К вопросу об опылении, оплодотворении и эмбриологии растений рода Cerasus в связи с режимом их водоснабжения // Вестник Тамбовского университета. Серия: естественные и технические науки. - 2001. - Т.6. - Вып.1. - С. 56-57.а
- Спицын И.П., Яндовка Л.Ф. Фенотипическая оценка некоторых эмбриональных структур растений рода Cerasus// Вестник Тамбовского университета. Серия: естественные и технические науки. - 2002. - Т.7. - Вып.1. - С. 182.
- Яндовка Л.Ф. Перспективы использования косточковых плодовых культур в качестве биоиндикаторов среды // Вестник Тамбовского университета.а Серия: естественные и технические науки. - 2003. - Т.8. - Вып.1. - С. 67-68.
- Яндовка Л.Ф., Деева Л.А. Биологические особенности пыльцы некоторых представителей родов Malus, Cerasus, Pyrus и Sorbus в связи с УФ-облучением // Вестник Тамбовского университета. Серия: естественные и технические науки. - 2004. - Т.9. - Вып.1. - С. 35.а
- Яндовка Л.Ф. Цитомиксис в процессе мейоза при микроспорогенезе у CerasusvulgarisMill. в связи с водным режимом // Бот. журн. - 2004. - Т.89. - № 7. - С. 1141-1145.
- Яндовка Л.Ф. Цитологический анализ процесса микроспорогенеза у CerasusvulgarisMill. в связи с водным режимом // Бот. журн. - 2004. - Т.89. - № 6. - С. 924-935.
- Яндовка Л.Ф., Лукашина Е. Н. Цветки вторичного цветения Cеrasusvulgaris //а Вестник Тамбовского университета. Серия: естественные и технические науки. - 2005. - Т.10. - Вып.1. - С. 21.аа
- Яндовка Л.Ф., Шамров И.И. Фертильность пыльцыа Cerasusvulgaris и C. tomentosa (Rosaceae) //а Бот. журн. - 2006. - Т. 91. - № 2. - С. 208-220.
- Шамров И.И., Яндовка Л.Ф. Развитие и строение гинецея и семязачатка у Cerаsusvulgaris (Rosaceae) // Бот. журн. - 2008. - Т. 93. - № 6. - С. 902-913.
- Яндовка Л.Ф. Микроспорогенез и развитие пыльцевого зерна у видов Cerasus, Microcerasus и Amygdalus // Вестник Тамбовского университета. Серия: естественные и технические науки. - 2009. - Т.14. - Вып. 2. - С. 375-383.
- Папихин Р.В., Яндовка Л.Ф. Особенности процесса микроспорогенеза отдаленных гибридов семечковых и косточковых плодовых растений // Вестник Тамбовского университета. Серия: естественные и технические науки. - 2009. - Т.14. - Вып.3. - С. 559-561.
- Яндовка Л.Ф. Фазы и ритм распускания цветков у Cerasus, Microcerasus и Amygdalus (Rosaceae) // Вестник Тамбовского университета. Серия: естественные и технические науки. - 2010. - Т.15. - Вып.5. - С. 1576-1580.
- Яндовка .Ф., Тарбаева В.М. Семенная продуктивность у видов Cerasus, Microcerasus и Amygdalus (Rosaceae) // Сибирский вестник сельскохозяйственной науки. - 2010. - № 8 (212). - С. 51-58.
- Яндовка Л.Ф. Фертильность пыльцы у видов Cerasus и Microcerasus (Rosaceae) // Аграрный вестник Урала. - 2010. - № 6 (72). - С.58-61.
- Яндовка Л.Ф., Шамров И.И. Развитие пыльника и пыльцевого зерна у видов Cerasus, Microcerasus и Amygdalus (Rosaceae) // Бот. журн. - 2011. - Т. 96. - № 1. - С. 62-75.
- Яндовка Л.Ф., Тарбаева В.М. К вопросу об антэкологии Cerasus, Microcerasus и Amygdalus (Rosaceae) // Вестник Балтийского федерального университетаа им. И. Канта. Серия: естественные науки. - 2011. - Вып. 7. - С. 148-156.
- Яндовка Л.Ф., Тарбаева В.М. Критические стадии микроспорогенеза у Cerasus, Microcerasus и Amygdalus (Rosaceae) // Вестник Удмуртского университета. Серия: Биология. Науки о земле. - 2011. - Вып. 1. - С. 111-117.
- Яндовка Л.Ф., Гусев А.А., Ткачев А.Г. Влияние углеродного наноструктурного материала на фертильность пыльцы высших цветковых растений // Вестник Тамбовского университета. Серия: естественные и технические науки. - 2011. - Т. 16. - Вып. 3. - С. 953-956
- Яндовка Л.Ф. К вопросу о морфологии цветков Cerasus, Microcerasusи Amygdalus(Rosaceae) // Вестник Тамбовского университета. Серия: естественные и технические науки. - 2011. - Т.16. - Вып.3. - С. 957-962.
- Яндовка Л.Ф., Папихин Р.В. Микроспорогенез у видов Pyrus, Malus, Cerasusи их гибридов а(Rosaceae) // Сельскохозяйственная биология. - 2012. - № 1. - С. 1-8.
- Яндовка Л.Ф., Шамров И.И. Строение гинецея и плацентация у представителей родов Cerasus, Microcerasus и Amygdalus (Rosaceae) // Вестник Тамбовского университета. Серия: естественные и технические науки. - 2011. - Т. 16. - Вып. 5. - С. 1316-1320.
В прочих изданиях
- Андросова Е.П., Жуков О.С., Яндовка Л.Ф. Изучение особенностей строения и развития пыльцы отдаленных гибридов вишни // Использование биотехнологических методов для решения генетико-селекционных проблем: Сборник докладов и сообщений XVIII Мичуринских чтений. - Мичуринск: Издательство ВНИИГиСПР, 1998. - С. 98-100.
- Спицын И.П., Яндовка Л.Ф. Цитогенетическая оценка растений рода Cerasus при различном режиме водоснабжения // Державинские чтения: Материалы научной конференции преподавателей и аспирантов. - Тамбов: Издательство ТГУ, 1999. - Выпуск IV. - С. 50-52.
- Спицын И.П., Яндовка Л.Ф. К вопросу об эмбриологии вишни, вишне-черешневых и вишне-черемуховых гибридов в связи с условиями их водообеспечения // Проблемы и перспективы отдаленной гибридизации плодовых и ягодных культур: Тезисы докладов и сообщений XX Мичуринских чтений. - Мичуринск: Издательство ВНИИГиСПР, 2000. - С. 63-64.
- Яндовка Л.Ф. Цитомиксис в процессе микроспорогенеза при различном режиме водоснабжения растений рода Cerasus // Интенсивное садоводство: Материалы Международной научно-практической конференции молодых ученых. - Мичуринск: Издательство ГАУ, 2000. - Часть I. - С. 83-85.
- Спицын И.П.. Яндовка Л.Ф., Спицын Д.И. Урожайность как реакция растений на регулируемый водный режим в период формирования репродуктивных органов растений рода Cerasus // Вопросы региональной экологии: Тезисы докладов IV региональной научно-технической конференции. - Тамбов: Издательство ТГУ, 2000. - С.78-80.
- Яндовка Л.Ф. Влияние водного режима на микроспорогенез некоторых растений рода Cerasus// Тезисы докладов II съезда Вавиловского общества генетиков и селекционеров. - СПб: РАН,а 2000. - Т.I. - С.228.
- Спицын И.П., Яндовка Л.Ф. К вопросу об аутоэкологии растений рода Cerasus// Фитофизиология: перспективные исследования, связь с другими науками. Сборник статей. - Тамбов: Издательство ТГУ, 2001. - С. 176 - 178.
- Тарбаева В.М., Яндовка Л.Ф. Изучение процесса микроспорогенеза растений рода Cerasus в связи с водным режимом // Объединенный научный журнал. - 2002. - Вып. 28 (51). -а С. 32-35.
- Яндовка Л.Ф. Формирование генеративных органов Cerasusvulgaris и C. tomentosa в связи с водным режимом (автореферат диссертации на соискание ученой степени к.б.н.). Сыктывкар, 2003. 24 с.
- Яндовка Л.Ф., Тарбаева В.М. Цитомиксис в процессе мейоза при микроспорогенезе в связи с различным водным режимом растений рода Cerasus // Экологическая ботаника: наука, образование, прикладные аспекты. Тезисы докладов Международной научной конференции, посвященной 25-летию кафедры ботаники Сыктывкарского университета. - Сыктывкар: Издательство Сыктывкарского ГУ, 2002. - С. 262-263.
- Яндовка Л.Ф. Изучение процесса мейоза при микроспорогенезе у растений рода Cerasus в связи с водным режимом // Отдаленная гибридизация. Современное состояние и перспективы развития: Труды Международной конференции по отдаленной гибридизации. - М.: Издательство СМХА, 2003. - С. 320-324.
- Яндовка Л.Ф. Явление цитомиксиса в процессе микроспорогенеза при различном режиме водоснабжения растений рода Cerasus // Флора и фауна Черноземья: Сборник научных статей. - Тамбов: Издательство ТГУ им. Державина, 2003. - Выпуск 6. - С. 32-39.
- Яндовка Л.Ф. Оценка качества и жизнеспособности семян растений рода Cerasusв связи с водообеспечением // Флора и фауна Черноземья: Сборник научных статей. - Тамбов: Издательство ТГУ им. Державина, 2003. - Выпуск 6. - С. 39-42.
- Яндовка Л.Ф. К вопросу о влиянии водного стресса на эмбриональные процессы косточковых плодовых культур // Инновационные технологии в экологическом образовании, пути, формы и методы их реализации. Материалы VII Всероссийской научно-практической конференции. - Тобольск: Издательство ТГПИ им. Менделеева, 2003. - С. 124-125.
- Яндовка Л. Ф., Деева Л. А.Биологические особенности пыльцы некоторых представителей рондов Malus, Cerasus, Pyrusи Sorbusв связи с УФ-облучением // Физиологические аспекты продуктивности растений. - Орел: Издательство Орловского регионального отделения о-ва физиологов растений России, 2004. - Ч. 2. - С. 232Ч235.
- аЯндовка Л.Ф. Оптимальный водный режим - один из способов повышения урожайности косточковых плодовых растений // Фундаментальные и прикладные исследования в системе образования. Материалы II-й Международной научно-практической конференции (заочной). - Тамбов: Издательство ТГУ им. Державина, 2004. - Часть 1. - С. 164-166.
- Яндовка Л.Ф., Туровцева Н.М. Аномалии цветков Cerasusvulgaris// Труды VII Международной конференции по морфологии растений, посвященной памяти Ивана Григорьевича и Татьяны Ивановны Серебряковых. - М.: Издательство МПГУ, 2004. - С. 274-275.
- Туровцева Н.М., Яндовка Л.Ф. Цитологический анализ процесса микроспорогенеза // Новации и эффективность производственных процессов в садоводстве: Тематический сборник материалов Международной научно-практической конференции. - Краснодар, 2005. - Т.I. - С. 103-107.
- Yandovka L.F., Shamrov I.I. Microsporogenesis and pollen grain in Cerasusvulgaris (Rosaceae) as related to temperature and water regimes // Эмбриология и биотехнология:а Тезисы докладов I Международной школы для молодых ученых. - СПб: Издательство РАН, 2005. - С. 59.
- Яндовка Л.Ф., Цаплина Л.В. Влияние температуры на биологические особенности пыльцы Cerasusvulgaris и C. tomentosa (Rosaceae) // Роль экологического пространства в обеспечении функционирования живых систем: Материалы I Международной научно-практической конференции. - Елец. 2005. - С. 109-111.
- Яндовка Л.Ф. Цито-морфологические особенности цветков вторичного цветения Cerasus vulgaris (Rosaceae) и перспективы их использования в селекции // Успехи современного естествознания. - 2005. - № 11. - С. 52.
- Яндовка Л.Ф., Никифорова Н.Н. Влияние УФ-облучения на биологические особенности пыльцы Cerasusvulgaris и C. tomentosa (Rosaceae) // Фундаментальные и прикладные исследования в системе образования: Материалы III Международной научно-практической конференции (заочной). - Тамбов: Издательство ТГУ им. Державина, 2005. - Ч. I. - С. 166-168.
- Яндовка Л.Ф.. Медведева Е.А. Морфогенез и аномалии цветков Cerasusvulgaris и C. tomentosa (Rosaceae) // Проблемы повышения качества и стабилизации продуктивности растений в естественных и антропогенных экосистемах: Материалы научно-производственной конференции. - Нальчик. 2006. - С. 51-53.
- Яндовка Л.Ф., Илларионова О.И. Критические стадиии мейоза при микроспорогенезе у разных по самоплодности растений Cerasusvulgaris и C. tomentosa (Rosaceae) // Материалы I (X) Международной конференции молодых ботаников в С.-Петербурге. - СПб: Издательство РАН, 2006. - С. 223.
- Яндовка Л.Ф., Окуджава Н.И.Влияние времени прививки и места сбора прививочного материала на жизнеспособность саженцев Cerasusvulgaris (Rosaceae) // Проблемы биологии, экологии и образования: история и современность. Материалы Международной научно-практической конференции. - СПб: Изд-во ЛГУ им. А.С. Пушкина, 2006. - С. 138-139.
- Яндовка Л.Ф., Никифорова Н.Н., Туровцева Н.М. Фертильность и жизнеспособность пыльцы Cerasusvulgaris и C. tomentosa в связи с УФ-облучением // Успехи современного естествознания. - 2006. - № 11. - С. 57-58.
- Яндовка Л.Ф., Полушкина А.А. Влияние УФ-облучения на динамику роста саженцев Rubusidaeus, Cerasusvulgaris, C. tomentosa, Loniceraxylosteum, Glossulariareclinata и Ribesnigrum, полученных зеленым черенкованием // Агропромышленный комплекс: состояние, проблемы, перспективы. - Сборник материалов IV Международнойа научно-практической конференции. - ПензаЦНейбранденбург: Издательство ПГСХА, 2007. - С. 53-54.
- Яндовка Л.Ф. Семенная продуктивность видов Cerasus fruticosa, C. vulgaris, C. avium, Microcerasus tomentosa и Amygdalus nana // Проблемы научной, обучающей и просветительской деятельности в биологических центрах вузов и хозяйствах зоопаркового типа. Материалы Всероссийской научно-практической конференции. - Тамбов: Издательство ТГУ им. Державина, 2007. - С. 118-122.
- Яндовка Л.Ф., Шамров И.И. Цитологический анализ микроспорогенеза у видов Cerasus (Rosaceae) // Фундаментальные и прикладные проблемы ботаники в начале XXI века: Тезисы докладов XII делегатского Съезда Русского ботанического общества. - Петрозаводск, 2008. - Ч. 1. -а С. 309-311.
- Яндовка Л.Ф., Шамров И.И. Семенная продуктивность у Cerasus, Microcerasus и Amygdalus (Rosaceae) // Труды Международной конференции, посвященной памяти Р.Е. Левиной. -а Ульяновск, 2008. - С. 133-138.аа
- Яндовка Л.Ф. Микроспорогенез у видов Cerasus (Rosaceae) // Сборник научных трудов Института естествознания ТГУ им. Державина. - Тамбов: Издательский дом ТГУ им. Державина, 2008. - С. 273-278.
- Яндовка Л.Ф. Влияние температуры на микроспорогенез и фертильность пыльцы Cerasusvulgaris и Microcerasustomentosa // II Ржавитинские чтения: Материалы Международной научной конференции Проблемы биоэкологии и пути их решения. -а Саранск: Издательство МордГУ им. Огарева, 2008. - С. 294-296.
- Яндовка Л.Ф., Шамров И.И., Папихин Р.В. Развитие пыльника и пыльцевого зерна у видов Cerasus, Microcerasus и Amygdalus (Rosaceae) // Труды VIII Международной конференции по морфологии растений, посвященной памяти Ивана Григорьевича и Татьяны Ивановны Серебряковых. - М.: Издательство МПГУ, 2009. - Т. 2. - С. 316-320.
- Яндовка Л.Ф. Влияние излучений УФ- и электронного диапазонов на фертильность пыльцы видов Cerasus, Microcerasus и Amygdalus // Вестник Тамбовского университета. Сер. Естественные и технические науки. Приложение к журналу. Кафедра биологии. Тамбов, 2009. - С. 104-118.
- Яндовка Л.Ф. Влияние излучений УФ- и электронного диапазонов на фертильность пыльцы видов Cerasus, Microcerasus и Amygdalus // Вестник Тамбовского университета. Серия: Естественные и технические науки. - Приложение к журналу. Кафедра биологии. - Тамбов: Издательский дом ТГУ им. Державина, 2009. - С. 104-118.
- Яндовка Л.Ф., Гусев А.А., Ткачев А.Г. Влияние углеродного наноматериала Таунит на фертильность пыльцы видов Cerasus, Microcerasusи Amygdalus// Современные проблемы контроля качества природной и техногенной сред. Материалы III Международной научно-практической конференции. - Тамбов: Издательский дом ТГУ им. Державина, 2010. Ца С. 101-106.
- Яндовка Л.Ф. Использование цито-эмбриологических показателей развития семян в систематике видов Cerasus, Microcerasus и Amygdalus (Rosaceae) // Материалы II Международной научной конференции Разнообразие почв и биоты Северной и Центральной Азии. - Улан-Удэ: Издательство Бурятского научного центра СО РАН, 2011. - Т.1. - С. 281-283.
 Все авторефераты докторских диссертаций
Все авторефераты докторских диссертаций
