Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Ферментные системы катаболизма органофосфонатов у почвенных бактерий Achromobacter sp. и Ochrobactrum anthropi GPK 3
Автореферат кандидатской диссертации
На правах рукописи
Свиридов Алексей Владимирович
ФЕРМЕНТНЫЕ СИСТЕМЫ КАТАБОЛИЗМА
ОРГАНОФОСФОНАТОВ У ПОЧВЕННЫХ БАКТЕРИЙ
Achromobacter sp. и Ochrobactrum anthropi GPK 3
03.01.04 Биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата биологических наук
Пущино -2012
Работа выполнена в лаборатории микробной энзимологии Федерального государственного бюджетного учреждения науки Института биохимии и физиологии микроорганизмов им. Г. К. Скрябина Российской академии наук, Пущино
Научный руководитель доктор биологических наук
еонтьевский Алексей Аркадьевич
Официальные оппонентыа Бурьянов Ярослав Иванович
доктор биологических наук, профессор,
Филиал Института биоорганической химии
им. М. М. Шемякина и Ю. А. Овчинникова РАН,
заведующий лабораторией
Кулаковская Татьяна Валентиновна
доктор биологических наук, Институт биохимии и физиологии микроорганизмов
им. Г. К. Скрябина РАН, заведующая лабораторией
Ведущая организацияаа Московский государственный университет
им. М. В. Ломоносова, Биологический факультет
Защита диссертации состоится л 29 июня 2012 г. в 10 часов 00 мин на заседании Диссертационного совета Д 002.121.01 при Институте биохимии и физиологии микроорганизмов им. Г. К. Скрябина РАН по адресу: 142290, г. Пущино Московской области, Проспект Науки, 5.
С диссертацией можно ознакомиться в библиотеке Института биохимии и
физиологии микроорганизмов им. Г. К. Скрябина РАН. Автореферат разме
щен на сайтах Ученый секретарь
Диссертационного совета,
доктор биологических наук Доронина Нина Васильевна
Актуальность проблемы
Неизбежным результатом технологического прогресса является поступление в окружающую среду различных типов ксенобиотиков. К их числу относятся фосфонаты, содержащие прямую ковалентную связь углерод-фосфор (С-Р). Такая связь чрезвычайно устойчива к химическим и физическим воздействиям, вследствие чего фосфонаты способны накапливаться в окружающей среде. Синтетические фосфонаты входят в состав многих пестицидов, могут поступать в среду как отходы химической индустрии и продукты де-токсикации фосфорорганических отравляющих веществ (ФОВ).
Глифосат (ГФ) является одним из наиболее распространенных синтетических фосфонатов и применяется как действующий компонент популярных гербицидов (Roundup, Ground-Bio и др.). К 2010 г. объемы поступления ГФ в среду превысили 800 тыс. тонн в год. По данным независимых исследований, ГФ способен сохраняться в почвах в течение многих лет, изменяя состав почвенной микрофлоры, проникая в культурные растения и просачиваясь в водоемы. У животных ГФ может вызывать поражения печени, иммунной системы и нарушения эмбрионального развития.
Метилфосфоновая кислота (МФК) Ч один из основных продуктов переработки ФОВ и побочный продукт ряда промышленных процессов, крайне стабильна в окружающей среде и может сохраняться в почве в течение десятков лет, проявляя фитотоксические свойства.
В связи с этим актуален поиск способов ремедиации почв и водоемов, загрязненных фосфонатами. Из-за высокой стойкости подобных соединений единственный рациональный подход к решению данной проблемы предполагает применение микроорганизмов-деструкторов. Однако разработка подобных технологий затрудняется недостатком сведений об организации путей метаболизма фосфонатов.
Считается, что С-Р связь большинства фосфонатов, в том числе МФК, неспецифически расщепляется ферментным комплексом С-Р лиаза, необратимо инактивирующимся при дезинтеграции клеток. Известно единствен-
1
ное сообщение о возможном существовании разновидности С-Р лиазы, специфически разлагающей ГФ (в настоящей работе обозначенной как С-Р лиа-за II). Существует предположение об альтернативном пути разложения ГФ, где начальную реакцию расщепления ГФ может катализировать фермент глифосат-оксидоредуктаза с образованием аминометилфосфоновой кислоты (АМФК). Однако ГФ-оксидоредуктаза не была очищена и охарактеризована. Путь дальнейшего метаболизма АМФК, связанный с разрывом С-Р связи, также неясен.
Дефицит знаний о метаболизме фосфонатов во многом объясняется отсутствием доступных и достоверных методов идентификации активности соответствующих ферментов, а также анализа их метаболитов. Разработка подобных методов и исследование метаболизма синтетических фосфонатов бактериями-деструкторами является одной из приоритетных задач современной биохимии.
Цель и задачи исследования
Целью настоящей работы было изучение путей катаболизма глифосата и метилфосфоновой кислоты у почвенных бактерий-деструкторов фосфонатов. Для достижения цели работы необходимо было решить следующие задачи:
- Разработка методов количественного и качественного анализа исследуемых фосфонатов и их метаболитов, а также методик измерения активности ферментов их деструкции.
- Подбор объектов исследования - штаммов, обладающих наибольшей эффективностью деструкции в отношении изучаемых фосфонатов.
- Изучение возможности адаптации штамма, выделенного под селективным давлением метилфосфоновой кислоты к утилизации глифосата.
- Выявление путей метаболизма фосфонатов у отобранных штаммов-деструкторов.
- Очистка нового фермента первичной атаки глифосата - глифосат-оксидоредуктазы.
- Характеристика глифосат-оксидоредуктазы.
2
Научная новизна
Разработаны новые методы идентификации и измерения активности ферментов метаболизма ГФ и МФК с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), тонкослойной хроматографии (ТСХ) и спек-трофотометрического определения, отличающиеся высокой достоверностью.
Впервые показана возможность адаптации штамма-деструктора МФК {Achromobactersp. MPS 12), первоначально не способного утилизировать ГФ, к использованию этого соединения как единственного источника фосфора. Адаптированный штамм Achromobactersp. MPS 12А по показателям деструкции ГФ был близок к О. anthropiGPK 3.
Доказано существование двух С-Р лиазных систем с различающейся субстратной специфичностью: С-Р лиаза I разлагала МФК, С-Р лиаза II - ГФ.
Впервые выявлено различие в путях метаболизма ГФ у штаммов, выделенных под селективным давлением двух разных фосфонатов: Achromobactersp. MPS 12А разлагал этот фосфонат с помощью ГФ-специфичной С-Р лиазы II с образованием саркозина. Ферментом первичной атаки ГФ у О. anthropiGPK 3 была ГФ-оксидоредуктаза; продуктами этой реакции были АМФК и глиоксилат.
У О. anthropiGPK 3 был идентифицирован ранее не описанный путь метаболизма АМФК, который включал стадии переаминирования и разрыва С-Р связи при вероятном участии фермента фосфоноацетальдегидгидролазы (фосфонатазы).
ГФ-оксидоредуктаза О. anthropiGPK 3 была впервые очищена до элек-трофоретически гомогенного состояния. Изучены ее основные характеристики, определен кофактор, выявлены параметры, способствующие повышению выхода фермента.
Практическая значимость
Разработанные высокоточные методы анализа фосфонатов и продуктов их метаболизма отличаются универсальностью и могут применяться для обнаружения фосфонатов в природных образцах почвы и грунтовых вод, сточ-
3
ных водах, а также в лабораторных исследованиях при анализе гомогенатов клеток и культуральной жидкости.
Изученные физиологические и биохимические особенности отобранных штаммов-деструктров ГФ и МФК позволяют давать точную оценку деструктивного потенциала таких микроорганизмов. Обнаруженный эффект адаптации изучаемых бактерий к утилизации фосфонатов разных типов открывает новые возможности селекции универсальных и высокоэффективных деструкторов, активных в отношении широкого диапазона этих соединений.
Данные о различиях в путях деструкции ГФ у штаммов, выделенных под селективным давлением разных фосфонатов, позволяют осуществлять более эффективный скрининг и отбор микроорганизмов, пригодных для последующего дальнейшего применения их в технологиях очистки природных сред от загрязнения фосфонатами. Сведения о факторах, способствующих индукции ГФ-оксидоредуктазы у О. anthropiGPK 3, дают возможность подобрать условия, способствующие наибольшей экспрессии данного фермента.
Впервые полученные сведения об организации и распределении ферментных систем катаболизма фосфонатов у бактерий являются основой для разработки биотехнологий очистки и восстановления природных сред, загрязненных фосфонатами.
Структура и объем диссертации
Диссертация состоит из 7 разделов: введение, обзор литературы, материалы и методы, результаты, обсуждение результатов, выводы, список литературы. Работа изложена на 152 страницах, содержит 10 таблиц и 42 рисунка. Библиографический указатель содержит 294 источника литературы.
Апробация работы и публикации
Материалы диссертации были представлены на российских и международных конференциях: 10th International UFZ-Deltares/TNO conference on soil-water systems ConSoil 2008 (Milan, Italy, 2008), 12-я международная школа-конференция молодых ученых Биология - наука XXI века (Пущино, 2008),
4
5-я международная конференция Наука и образование для целей биобезопасности (Пущино, 2008), Международная школа-конференция Генетика микроорганизмов и биотехнология (Пущино, 2008), Всероссийская конференция с элементами научной школы для молодежи Экотоксикология-2009. Современные биоаналитические системы, методы и технологии (Пущино-Тула, 2009), 3rd International conference on Environmental, Industrial and Applied Microbiology BioMicroWorld 2009 (Lisbon, Portugal, 2009), Пущинская научно-практическая конференция Системная биология (Пущино, 2009), Международный молодежный научный форум Ломоносов-2010 (Москва, 2010), 14-я международная школа-конференция молодых ученых Биология - наука XXI века (Пущино, 2010), 2-й международный конкресс-партнеринг и выставка по биотехнологии и биоэнергетике EurasiaBio (Москва, 2010), VI Московский международный конгресс Биотехнология: состояние и перспективы развития (Москва, 2011). По материалам диссертации опубликовано 3 статьи в изданиях из списка, рекомендованного ВАК и 10 тезисов в сборниках отечественных и зарубежных конференций.
Исследования поддерживались грантом Российского фонда фундаментальных исследований 09-04-00320 Глифосат-оксидоредуктаза бактерии OchrobactrumanthropiGPK 3 и в рамках проекта РНП 2.1.1.9227 Создание ассоциаций грибов и бактерий для биодеструкции устойчивых гетероциклических соединений.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Среды для культивирования бактерий. Для культивирования бактерий использовали минеральную среду MS1 (Ермакова с сотр., 2008). Источниками фосфора служили МФК в концентрации 0,3 г/л, ГФ в концентрации 0,05-20 г/л в составе гербицида Roundup, 2-аминоэтилфосфоновая кислота (2-АЭФ) и АМФК в концентрации 0,2 г/л, неорганический фосфат (Pi) в концентрации 0,3 г/л. Источниками углерода служили глутамат натрия, сукцинат натрия, глицерин и глюкоза в концентрации 10 г/л.
5
Микроорганизмы. Использовали два штамма бактерий-деструкторов фосфонатов: OchrobactrumanthropiGPK 3 (ВКМ B-2554D), выделенный из почв, загрязненных ГФ, и Achromobactersp. MPS 12 (ВКМ В-2694), выделенный из сайтов загрязнения метилфосфоновой кислотой (МФК). При адаптации последнего к росту на средах с ГФ был получен деструктор МФК и ГФ Achromobactersp. MPS 12А.
Условия культивирования. Выращивание культур проводили 1) в колбах объемом 750 мл со 100 мл среды на качалке при температуре 28 С; 2) в ферментерах АНКУМ-2 (ИБП РАН, Россия) объемом 10 л при температуре 28 С и интенсивности аэрации 50 % от насыщения; 3) в герметически закрытых 15-мл пробирках с 5 мл среды.
Субклеточное фракционирование. Клетки фракционировали по методе Nossal и Heppel (1966) с модификациями: биомассу ресуспендировали в 40 мл 33 мМ Трис-HCl рН 7,65, добавляли 40 мл 33 мМ Трис-HCl рН 7,65, содержавшего 40% сахарозу и 100 мМ ЭДТА. После 10 мин инкубации при 22 С клетки осаждали (18000 g х 5 мин) и отбирали фракцию периплазмы. Сферопласты разрушали с помощью ИБФМ-пресса при рабочем давлении 0,9 МПа. Гомогенат помещали в ледяную баню, вносили 100 Ед ДНКазы I, осаждали центрифугированием (120000 g х 1 ч, 4 С). Отделяли супернатант с водорастворимыми белками цитоплазмы. Осадок ресуспендировали в 10 мл буфера 100 мМ Трис-HCl рН 7,65, 100 мМ NaCl, 0,1 мМ ЭДТА, 20% глицерин, 0,001 мМ фенилметилсульфонилфторид с 2% Тритон Х-100 и инкубировали 30 мин при 22 С. Суспензию осаждали (120000 g х 1 ч, 22С), отбирали надосадочную жидкость.
Аналитические методы. Хроматографический анализ ГФ и его метаболитов в культуральных жидкостях, бесклеточных экстрактах и реакционных смесях проводили методами тонкослойной хроматографии (ТСХ) и высокоэффективной жидкостной хроматографии (ВЭЖХ), получая ацильные, бен-зоильные и дансильные производные (Свиридов с сотр., 2011). Концентрацию фосфонатов и Pi измеряли спектрофотометрическим методом с малахи-
6
товым зеленым (Hess and Derr, 1975) после гидролиза С-Р связи персульфатом аммония (Schowanek and Verstraete, 1990а).
Определение активности ферментов. Активность С-Р лиазы в интакт-ных клетках I определяли: 1) по выделению метана при культивировании бактерий на среде с МФК в герметичных пробирках (концентрацию метана измеряли методом газовой хроматографии с помощью калибровочной кривой); 2) по убыли МФК и накоплению Pi (определяли спектрофотометриче-ски по цветной реакции Pi с молибдатом аммония в присутствии малахитового зеленого) (Sviridov etal., 2012).
Активность С-Р лиазы II в интактных клетках идентифицировали по присутствию в бесклеточных экстрактах саркозина, который обнаруживали методом ВЭЖХ в виде ацильных, дансильных и бензоильных производных (Свиридов с сотр., 2011).
Определение активности ГФ-оксидоредуктазы в субклеточных фракциях О. anthropiGPK 3 проводили 1) спектрофотометрическим методом по образованию окрашенного комплекса продукта реакции (глиоксилата) с фенил-гидразином (Свиридов с сотр., 2011); 2) методом ВЭЖХ, определяя концентрацию глиоксилата и АМФК (в виде производных) в реакционных смесях (Sviridov etal., 2012).
Убыль АМФК, образующейся при расщеплении ГФ глифосат-оксидоредуктазой, обнаруживали методом ВЭЖХ в реакционной смеси, содержавшей ГФ, бесклеточный экстракт, пиридоксаль-5'-фосфат и пируват натрия.
Активность фосфонатазы определяли по окислению НАДН в сопряженной реакции с алкогольдегидрогеназой, восстанавливавшей один из продуктов фосфонатазной реакции - ацетальдегид.
Очистка ГФ-оксидоредуктазы. Белки бесклеточного экстракта осаждали сульфатом аммония до 80% насыщения, осадок отделяли центрифугированием, растворяли в буфере 50 мМ Трис-HCl рН 7,65, 100 мМ NaCl, 10 мМ MgCl2, 0,05 мМ ЭДТА и подвергали гель-фильтрации на колонке
7
Superdex 200 (2,6 x 60 см). Активные фракции наносили на колонку Octyl-Sepharose (1x6 см), элюировали буфером, содержавшим 1 М сульфата аммония. Препарат затем подвергали гель-фильтрации на колонке Toyopearl HW-60 (1,6 х 100 см).
Характеристика ГФ-оксидоредуктазы. Денатурирующий электрофорез проводили по Laemmli (1970), белковые полосы проявляли по Fairbanks (1971). Нативный электрофорез проводили в полиакриламидном геле (ПААГ) с градиентом концентрации 4-10% в системе для кислых белков. Окрашивание белков проводили 0,2% раствором нитратом серебра в 0,4% растворе формальдегида.
Молекулярную массу (ММ) фермента определяли по электрофоретиче-ской подвижности и с помощью гель-фильтрации на колонке Superdex 200, предварительно калиброванной с помощью набора Gel Filtration Molecular Weight Markers (Sigma, США).
Изоэлектрофокусировку проводили в 5% ПААГ в градиенте рН 3,0-10,0 с амфолинами фирмы Pharmacia (pharmalytes). Белковые полосы проявляли последовательной инкубацией геля в смеси уксусной кислоты, этанола и воды (19 : 25 : 65), содержащей 0,1% CuS04 и 0,05% кумасси R-250. Изоэлектриче-скую точку определяли с помощью набора Calibration Kit for pi Determinations using Isoelectric Focusing Broad Range pi (pH 3-10) (GE Healthcare, США).
Определение зависимости активности ГФ-оксидоредуктазы от рН среды проводили спектрофотометрически в буфере Britton и Robinson (1931) в интервале рН 6,8-9,6.
Температурный оптимум фермента определяли спектрофотометрически в диапазоне 20-60 С при термостатировании измерительной кюветы.
Термостабильность определяли путем инкубирования ферментного препарата при температурах 22, 25, 30, 40, 45, и 50 С в течение часа; измерения остаточной активности проводили через 5, 10, 15, 30 и 60 мин после начала инкубации.
8
Спектры поглощения препаратов ГФ-оксидоредуктазы и реакционных смесей в диапазоне 300-560 нм записывали на спектрофотометре Shimadzu UV-1650PC (Япония). Апофермент отделяли от кофактора после инкубации в буфере 33 мМ Трис-HCl рН 8,05 с помощью ультрафильтрации.
Свободный кофактор получали кипячением препарата ГФ-оксидоредуктазы и анализировали методом ВЭЖХ на колонке Lichrospher 100 RP18 250 х 4 мм (Dr. Maisch, Германия) в подвижной фазе метанол : 5 мМ ацетат аммония рН 6,0 (20 : 80 ) с детектором оптического поглощения при 450 нм.
Значения Кт и Vmax определяли с линеаризацией данных в координатах Хейнса-Вольф. Влияние ионов металлов изучали в реакционных смесях, содержавших очищенный ферментный препарат, 2 мМ ГФ и соли: MgCl2 в концентрации 1-20 мМ; NiCl2, CuS04, MnCl2, ZnCl2, FeS04, СоС12 в концентрации 10 мМ.
Ингибиторный анализ ГФ-оксидоредуктазы проводили в реакционных смесях, содержавших очищенный фермент, 2 мМ ГФ и глицин, саркозин, AgN03, ФМСФ, /?-хлормеркурийбензойную кислоту (рХМБ), MnCl2, CuS04 в концентрации 0,1-4 мМ.
Определение концентрации белка. Концентрацию белка определяли с помощью реактива Брэдфорд (Sigma) в соответствии с рекомендациями производителя.
Статистическая обработка результатов. Все эксперименты проводили в трех повторностях. На основании полученных выборок определяли стандартное отклонение и доверительный интервал при уровне значимости 0,95.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Разработка методов анализа ГФ и его метаболитов. Были предложены новые методы обнаружения и количественного определения ГФ и соединений, образующихся при его деструкции с помощью ВЭЖХ (табл. 1) и ТСХ (табл. 2). Получение ацильных, бензоильных и дансильных дериватов проб позволяло значительно снизить предел обнаружения, и достичь высокой дос-
9
товерности анализа. В рутинных экспериментах использовалось ацилирова-ние проб, требовавшее наименьших временных затрат. Бензилирование и дансилирование применялось для верификации полученных данных.
Отбор и характеристика штаммов-деструкторов фосфонатов. По результатам скринига лабораторной коллекции микроорганизмов были отобраны: 1) штамм Achromobactersp. MPS 12, отличавшийся наибольшей эффективностью утилизации МФК (табл. 3); 2) штамм OchrobactrumanthropiGPK 3 -лучший деструктор ГФ (табл. 3).
Таблица 1.
Анализ производных ГФ и его метаболитов методом ВЭЖХ
Ацилпроизводные |
Бензоилпроизводные |
Дансилпроизводные |
||||
Соединение |
Время удержания, мин |
Предел обнаружения, нг/мкл |
Время удержания, мин |
Предел обнаружения, нг/мкл |
Время удержания, мин |
Предел обнаружения, нг/мкл" |
ГФ |
19,97 |
0,60 |
43,16 |
0,36 |
4,73 |
0,16 |
АМФК |
4,98 |
0,90 |
6,52 |
0,44 |
13,31 |
0,48 |
Саркозин |
11,00 |
0,86 |
21,44 |
0,74 |
26,16 |
0,33 |
Глицин |
9,20 |
0,40 |
19,73 |
0,36 |
14,67 |
0,29 |
Глиоксилат |
5,40 |
0,76 |
5,40 |
0,76 |
н/о |
н/о |
* н/о - не определяли
Таблица 2.
Хроматографическая подвижность и пределы обнаружения ГФ и его мета-
болитов методом ТСХ в немодифицированном виде и в виде дансилпроизводных
Без модификации |
Дансилпроизводные |
|||
Соединение |
Rf(%) |
Предел обнаружения, нг |
Rf(%) |
Предел обнаружения, нг |
ГФ |
33 1 |
600 |
32 1 |
30 |
АМФК |
25 1 |
500 |
49 1 |
35 |
Саркозин |
54 2 |
250 |
.* |
1 |
Глицин |
64 2 |
200 |
23 1 |
1 |
* Определение саркозина проводили методом двумерной ТСХ
Адаптация штамма Achromobacter sp. MPS 12 к утилизации ГФ. В отличие от прочих изученных деструкторов МФК, не способных расти на средах с ГФ, у Achromobactersp. MPS 12 был обнаружен крайне слабый рост на среде с этим фосфонатом (табл. 3), в связи с чем данный штамм был подвергнут адап-
10
Таблица 6.
Таблица очистки ГФ-оксидоредуктазы
Стадия очистки |
Общий белок, мг |
Общая активность, ФЕ |
Удельная активность, Ед/мг белка |
Выход, % |
Степень очистки |
Бесклеточный экстракт |
510,000 |
0,43 |
0,0008 |
100,00 |
1,00 |
Высаливание |
384,000 |
0,40 |
0,0010 |
93,28 |
1,24 |
Superdex 200 |
2,970 |
0,36 |
0,1227 |
85,08 |
146,10 |
Octyl-Sepharose |
0,214 |
0,29 |
1,3765 |
68,82 |
1638,66 |
Toyopearl HW-60 |
0,082 |
0,13 |
1,5833 |
33,26 |
1884,92 |
Очищенный препарат ГФ-оксидоредуктазы имел максимумы оптического поглощения, характерные для флавоферментов (рис. 7, 1). Кофермент реакции (рис. 7, 2) был идентифицирован как ФАД методом ВЭЖХ. Связывание ФАД с молекулой фермента имело нековалентный характер: кофермент десорбировался в относительно мягких условиях (кипячение, денатурация мочевиной, инкубирование в буферах с низкой ионной силой) без проведения реакций пептидолиза, необходимых для выделения ковалентно связанного ФАД (Mewies, 1998). Восстановления активности после инкубации апофер-мента в буферах, содержавших различные концентрации ФАД, не происходило. Причиной этого, по-видимому, была характерная для многих флаво-ферментов крайне низкая стабильность апофермента, лишенного кофактора, приводящая к необратимому изменению структуры активного центра (Hefti еа/.,2003).
16
|
|
кДа М1аа 1
97 66
45 30
20,1 14,4
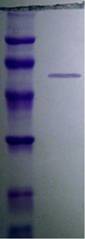
Рисунок 5. ПААГ-электрофорез очищенного препарата ГФ-оксидоредуктазы. А -Денатурирующий электрофорез в 10% ПААГ; Ml - белки-маркеры: фосфорилаза В (97 кДа), БСА (66 кДа), овальбумин (45 кДа), карбоангидраза (30 кДа), ингибитор трипсина (20 кДа), а-лактоальбумин (14,4 кДа); окрашивание кумасси. Б - Нативный электрофорез в ПААГ с градиентом концентрации 4-10%; М2 - белки-маркеры: тироглобулин (669 кДа), ферритин (440 кДа), каталаза (232 кДа), лактатдегидрогеназа (140 кДа); Окрашивание нитратом серебра. 1, 2 - Очищенный препарат ГФ-оксидоредуктазы.
pi М
|
Рисунок 6. Изоэлектрофокусировка ГФ-оксидоредуктазы. М - белковые маркеры (pi): амилогликозидаза (3,50), соевый ингибитор трипсина (4,55), Р-лактоголобулин А (5,20), бычья карбоангидраза В (5,85), карбоангидраза В человека (6,55), кислая цепь миоглобина лошади (6,85), щелочная цепь миоглобина лошади (7,35), кислая цепь лектина чечевицы (8,15), средняя цепь лектина чечевицы (8,45), щелочная цепь лектина чечевицы (8,65), трипсиноген (9,30); 1 - ферментный препарат
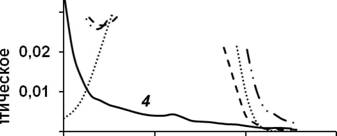
Участие ФАД в реакции расщепления ГФ было продемонстрировано при инкубации фермента в присутствии субстрата без доступа кислорода. При этом наблюдали изменение максимумов поглощения, что указывало на восстановление ФАД (рис. 7, 4) (Pedotti etal., 2009). Данный эффект нивелировался в присутствии убихинона Q-10.
17
V |
/ |
2\\ |
4 .--. s 1а /аа ?' Vаа -Х /аа ч- /_ |
300 |
400 500 Длина волны, нм |
600 |
 0,06
0,06
ф 0,05 4
0,04
О о,оо |
Е 0,03 о
Рисунок 7. Спектры оптического поглощения ГФ-оксидоредуктазы и ее кофактора: 1 - холофермент; 2 - кофактор (ФАД); 3 - после инкубации холофер-мента в анаэробных условиях в присутствии субстрата; 4 - апофермент
ГФ-оксидоредуктаза обладала относительно узким диапазоном оптимальных значений рН (рис. 8); максимальная активность наблюдалась при значении рН 8,05
120 |
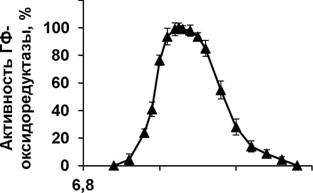 Рисунок 8. Зависимость активности ГФ-оксидоредуктазы от рН среды в буфере Britton-Robinson
Рисунок 8. Зависимость активности ГФ-оксидоредуктазы от рН среды в буфере Britton-Robinson
9,8 |
7,8а 8,8
РН
Помимо ГФ, фермент проявлял активность в отношении иминодиацета-та (ИДА) и фосфонометилиминодиацетата (ФИА). Для ГФ, ИДА и ФИА были определены основные кинетические константы (табл. 7). ИДА был лучшим субстратом и обладал наибольшим сродством к ферменту. Высокое значение Кт для ФИА могло объясняться наличием у этого соединения третичного азота и дополнительной фосфонометильной цепью, в отличие от ИДА, что могло затруднять узнавание ФИА активным центром ГФ-оксидоредуктазы.
18
Таблица 7.
Кинетические характеристики ГФ-оксидоредуктазы
Субстрат |
Кщ, МКМ |
Vmax, Ед/мГ беЛКа |
* max' ^m |
ГФ |
211 |
3,68 |
0,17* 10 |
ИДА |
107 |
4,64 |
0,43 Х 10 |
ФИА |
2450 |
1,67 |
0,68 Х 10_3 |
Температурный оптимум активности ГФ-оксидоредуктазы был равен 40 С (рис. 9, А); время полуинактивации в этих условиях составляло около 60 мин (рис. 9, Б).
|
 о о
о о
X
ш
<
30 50
Температура, С
70
о о
X
ш
к:
Рисунок 9. А. Температурный оптимум глифосат-оксидоредуктазы. Б. Термостабильность фермента: ж - 30 С; ж - 40 С; ^ - 45 С; Х - 50 С; х- 60 С.
Ингибиторами ГФ-оксидоредуктазы были ионы Ag+, Cu2+, Mn2+, а также /?-хлормеркурийбензоат (рХМБ), атакующий прежде всего тиоловые группы белков. Весьма слабыми конкурентными ингибиторами являлись глицин и саркозин. Впервые описано субстратное ингибирование фермента при больших концентрациях ГФ (табл. 8).
Ионы металлов (Mg2+, Zn2+, Ni2+) могли оказывать не только ингиби-рующее, но и активирующее действие на ГФ-оксидоредуктазу (рис. 10). Процесс расщепления ГФ шел быстрее всего в присутствии MgCl2, оптимальное значение концентрации которого составляло 10-15 мМ. Реакция ускорялась в меньшей степени в присутствии МС12 и ZnCl2 (рис. 10). Ионы Fe2+ и Со2+ заметного влияния на скорость реакции не оказывали (данные не приведены).
19
Таблица 8.
Значения 1С5о для различных ингибиторов ГФ-оксидоредуктазы
Соединение |
Глифосат |
Глицин |
Саркозин |
рХМБ |
Ag+ |
Cu2+ |
Mn2+ |
1С50, мМ |
14,8 |
22,9 |
11,3 |
0,7 |
0,6 |
1,4 |
0,8 |
Учитывая данные о способности ГФ связываться с активным центром алкогольдегидрогеназы через атом цинка (Жемчужин и Горобец, 1989), можно предположить, что различия во влиянии металлов на активность ГФ-оксидоредуктазы зависят от константы устойчивости возникающих комплексов ГФ-металл-фермент, которые могут как облегчать связывание субстрата в активном центре, так и препятствовать катализу. Так, в присутствии ионов
94-аа 94-
120 100 80 60 40 20 0 |
Си и Мл , ингибирующих ГФ-оксидоредуктазу, ГФ образует устойчивые комплексы с рядом органических функциональных групп (Barrett and McBride, 2005).
i |
1а 23456789 10 |
Рисунок 10. Активирующее действие ионов некоторых металлов на процесс расщепления глифосата ГФ-оксидоредуктазой. 1 - контроль; 2 - 10 мМ ZnCl2; 3 - 10 мМ NiCl2; 4 - 1 мМ MgCl2; 5 - 5 мМ MgCl2; 6 -10 мМ MgCl2; 7 - 15 мМ MgCl2; 8 -30 мМ MgCl2; 9 - 10 мМ MgCl2 + 10 мМ NiCl2; 10 - 10 мМ MgCl2 + 10 мМ ZnCl2.
20
выводы
- Разработаны качественные и количественные методики ВЭЖХ- и ТСХ-анализа глифосата и его метаболитов, включая их ацил-, бензоил-, дан-силпроизводные. Предложен новый спектрофотометрический экспресс-метод измерения активности глифосат-оксидоредуктазы, основанный на образовании фенилгидразона глиоксилата как продукта реакции.
- Деструктор метилфосфоновой кислоты Achromobactersp. MPS 12 был впервые адаптирован к потреблению глифосата как источника фосфора; биодеструктивные характеристики адаптированного штамма MPS 12А были близки к таковым у О. anthropiGPK 3.
- Доказано существование у бактерий двух С-Р лиазных систем, специфичных для разных субстратов: С-Р лиаза I (расщепление метилфосфоновой кислоты) и С-Р лиаза II (расщепление глифосата).
- Изучение путей катаболизма фосфонатов у бактерий показало, что метил фосфоновая кислота и глифосат у Achromobactersp. MPS 12А расщеплялись, соответственно, С-Р лиазой I и С-Р лиазой II, а у О. anthropiGPK 3 - С-Р лиазой I и глифосат-оксидоредуктазой.
- Впервые идентифицирован путь катаболизма глифосата с участием глифосат-оксидоредуктазы, продукт которой - аминометилфосфоновая кислота, минерализовался по ранее не описанному метаболическому пути с участием аминометилфосфонат-специфичной аминотрансферазы и фосфонатазы.
- Впервые очищен до гомогенного состояния и охарактеризован фермент первичной атаки глифосата - глифосат-оксидоредуктаза. В нативной форме фермент являлся гомодекамером (ММ 620 кДа); ММ субъединицы 61,4 кДа; кофактор ФАД; оптимум рН 8,05, температуры - 40 С; pi 6,85; ингибиторы/?ХМБ, Ag+, Cu2+, Mn2+.
21
БЛАГОДАРНОСТИ
Автор выражает благодарность сотрудникам ИБФМ РАН Винокуровой Н. Г. и к.х.н. Зеленковой Н. Ф. за помощь в создании методов анализа орга-нофосфонатов и синтез фосфоноацетальдегида, а также д.б.н. Моргунова И. Г. за помощь в разработке метода измерения активности фосфонатазы. Автор глубоко признателен к.б.н. Ермаковой И. Т. и д.б.н. Леонтьевскому А. А. за помощь в подготовке настоящей работы и плодотворное обсуждение ее этапов.
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи
- Свиридов А. В., Зеленкова Н. Ф., Винокурова Н. Г., Ермакова И. Т., Леонтьевский А. А. Новые подходы к идентификации и определению активности ферментов деградации глифосата. Биохимия. 2011. № 6. С. 880-887.
- Шушкова Т. В., Ермакова И. Т., Свиридов А. В., Леонтьевский А. А. Биодеструкция глифосата почвенными бактериями: оптимизация процесса культивирования и способ сохранения активной биомассы. Микробиология. 2012. № 1. С. 48-55.
- Sviridov, А. V., Shushkova, Т. V., Zelenkova, N. F., Vinokurova, N. G., Morgunov, I. G., Ermakova, I. Т., Leontievsky, A. A. Distribution of Glyphosate and Methylphosphonate Ca-tabolism Systems in Soil Bacteria Ochrobactrum anthropi and Achromobacter sp. Appl. Microbiol. Biotechnol. 2012. V. 97. P. 787-796.
Тезисы
- Свиридов А. В., Ермакова И. Т., Шушкова Т. В., Леонтьевский А. А. Обнаружение и очистка нового фермента первичной атаки органофосфонатов - глифосат-оксидоредуктазы. Сб. тез. 12-й международной школа-конференции молодых ученых Биология - наука XXI века. 2008. Пущино. С. 104-105.
- Свиридов А. В., Ермакова И. Т., Шушкова Т. В., Леонтьевский А. А. Ремедиация загрязненных органофосфонатами почв с помощью микробных биопрепаратов. Материалы 5-й международной конференции Наука и образование для целей биобезопасности. 2008. Пущино. С. 108-109.
- Свиридов А. В., Шушкова, Т. В., Ермакова, И. Т., Леотьевский, А. А. Разработка научных основ для создания методов ремедиации загрязненных органофосфонатами почв с помощью микробных препаратов. Сб. тез. международной школы-конференции Генетика микроорганизмов и биотехнология. 2008. Пущино. С. 78.
22
- Свиридов А. В., Шушкова Т. В., Ермакова И. Т., Леонтьевский А. А. Метаболические пути деструкции глифосата у почвенных бактерий. Сб. статей всероссийской конференции с элементами научной школы для молодежи Экотоксикология-2009. Современные биоаналитические системы, методы и технологии. 2009. Пущино-Тула. С. 84-85.
- Sviridov А. V., Leontievsky A. A. Enzymes of phosphonates metabolism in soil bacteria. Abstr. 3 International conference on Environmental, Industrial and Applied Microbiology BioMicroWorld 2009.а 2009.аа Lisbon.
- Свиридов А. В., Шушкова Т. В., Ермакова И. Т., Леонтьевский А. А. Биохимические основы разработки микробных препаратов для ремедиации загрязненных органо-фосфонатами почв. Сб. тез. Пущинской научно-практической конференции Системная биология. 2009. Пущино. С. 34-35.
- Свиридов А. В., Леонтьевский А. А. Характеристика нового фермента первичной атаки органофосфонатов - глифосат-оксидоредуктазы. Сб. тез. 14-й международной школы-конференции молодых ученых Биология - наука XXI века. 2010. Пущино. Т. 1. С. 59-60.
- Свиридов А. В. Глифосат-оксидоредуктаза Ч новый фермент первичной атаки органофосфонатов. Материалы международного молодежного научного форума Ломоно-сов-2010. 2010. Москва. С. 62-63.
- Свиридов А. В., Леонтьевский А. А. Глифосат-оксидоредуктаза: новый фермент деструкции органофосфонатов у бактерий. Сб. тез. 2-го международного конгресс-партнеринга и выставки по биотехнологии и биоэнергетике EurasiaBio. 2010. Москва. С. 161-162.
- Свиридов А. В., Леонтьевский А. А. Пути утилизации глифосата почвенными штаммами-деструкторами OchrobactrumanthropiGPK 3 и Achromobactersp. MPS 12A. Материалы VI Московского международного конгресса Биотехнология: состояние и перспективы развития. 2011. Москва. С. 59-60.
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]