Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Влияние искусственного гипобиоза на липиды неокортекса и тимоцитов крыс
Автореферат кандидатской диссертации
На правах рукописи
БЫКОВА ОЛЬГА ВЛАДИМИРОВНА
ВЛИЯНИЕ ИСКУССТВЕННОГО ГИПОБИОЗА НА ЛИПИДЫ НЕОКОРТЕКСА И ТИМОЦИТОВ КРЫС
Биохимия- 03.01.04
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
кандидата биологических наук
ПУЩИНО-2012
Работа выполнена в Федеральном государственном бюджетном учреждении науки Институте биофизики клетки Российской академии наук.
Научный руководитель:а доктор биологических наук, профессор
Коломийцева Искра Константиновна
Официальные оппоненты:а Новоселова Елена Григорьевна
доктор биологических наук, профессор
Федеральное государственное бюджетное учреждение науки Институт биофизики клетки Российской академии наук, главный научный сотрудник лаборатории механизмов рецепции.
Шишкина Людмила Николаевна
доктор химических наук, профессор
Федеральное государственное бюджетное учреждение науки Институт биофизической химии им. Н.М.Эмануэля Российской академии наук, заведующая лабораторией физико-химических проблем радиобиологии и экологии
Ведущая организация: |
Федеральное государственное бюджетное учреждение науки Институт теоретической и экспериментальной биофизики Российской академии наук
Защита диссертации состоится 27 сентября 2012 года в 14 -00 часов
на заседании совета по защите докторских и кандидатских диссертаций Д 002.038.01
Федерального государственного бюджетного учреждения науки Института биофизики
клетки Российской академии наук по адресу: 142290 Московская область, г. Пущино, ул.
Институтская, 3.
С диссертацией можно ознакомиться в Центральной библиотеке Пущинского научного
центра РАН.
Автореферат разослан л____________________ 2012 года
Ученый секретарь диссертационного совета
кандидат биологических наука Смолихина Татьяна Ивановна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Потенциальная возможность человека и животных адаптироваться к условиям низких температур актуальная проблема современной биологии и медицины. Особый интерес исследователей привлекает удивительная способность ряда видов млекопитающих в течение многих месяцев переживать неблагоприятные условия среды за счет перестройки организма на пониженный уровень жизнедеятельности. Так, у сусликов в состоянии зимней спячки в десятки-сотни раз снижается уровень метаболизма, а температура тела падает почти до 0С [Lyman et al., 1982; Калабухов, 1985; Ануфриев, Васильев, 1990]. Низкотемпературное состояние может быть достигнуто и у незимоспящих животных в условиях гипоксии, гиперкапнии и пониженной температуры окружающей среды. В этих условиях крысы или мыши впадают в состояние так называемого холодового наркоза со снижением температуры тела до 14С и понижением в 6-7 раз уровня метаболизма со способностью этих животных без патологических последствий самостоятельно возвращаться к норме в обычных условиях [Майстрах, 1964; Игнатьев и др., 1995, 1998]. Искусственная гипотермия находит широкое применение в медицинской практике в связи с необходимостью временного значительного снижения обмена веществ и уровня потребления кислорода при пониженной температуре. Различают общую и локальную гипотермию. Общая подразделяется на мягкую (35-32С) и лумеренную (32-27С). При мягкой гипотермии обычно используется легкая нейровегетативная фармакологическая блокада. При умеренной гипотермии, с современным многокомпонентным интубационным наркозом, применяется искусственная аппаратная вентиляция легких, релаксация и нейровегетативная блокада [Edwards, 1999; Liu, Yenari, 2009; Marion, Bullock, 2009; Turk, 2010]. Для адаптационной медицины, космической биологии и физиологии стресса особый интерес представляет изучение влияния более глубокой гипотермии (ниже 27С). В этом отношении перспективны исследования искусственного гипометаболического состояния млекопитающих.
При переходе функций организма млекопитающих на пониженный уровень активности в условиях низкой температуры окружающей среды существенная роль отводится липидам [Турин, 1986; Aloia, Raison, 1989; Dark, 2004;], в частности, липидам ядер [Brown, London, 1998; Alessenko, Burlakova, 2002; Albi et al., 2008]. Роль липидов при гипотермии, влияние низких температур при искусственном гипобиозе на синтез липидов в тканях животных практически не исследовано. Изучение влияния искусственного гипобиоза на метаболизм мембранных липидов у млекопитающих представляет фундаментальный и практический интерес.
Цель работы:
Целью является выяснение участия липидов ядер нейронов и глии неокортекса (органа, регулирующего процессы гипобиоза) и роль метаболизма липидов клеток тимуса (органа иммунной системы) в адаптации млекопитающих к искусственному гипобиозу.
Задачи исследования:
Изучить:
1. Влияние искусственного гипобиоза на количество фосфолипидов (сфингомиелина, фосфатидилхолина, фосфатидилсерина, фосфатидилинозитола, кардиолипина и фосфатидилэтаноламина) и нейтральных липидов (холестерина, моно- и диглицеридов, свободных жирных кислот) в гомогенате и ядерных фракциях нейронов и глии коры головного мозга крыс линии Wistar;
2.а Количество и метаболизм липидов тимоцитов (по включению 2-[ С]-ацетата in
vitro) у крыс линии Wistar в состоянии искусственного гипобиоза и через 24 часа после
окончания охлаждения.
3.а Сопоставить изменения липидного обмена тимоцитов с эффектами
искусственного гипобиоза на клеточный цикл;
4.а Оценить биологическую активность состояния искусственного гипобиоза у крыс
по критериям изменения структуры ДНК тимоцитов и индукции синтеза холестерина.
Научная новизна работы
Впервые показано, что ядра нейронов и глии неокортекса крыс содержат в 4 раза меньше фосфолипидов и холестерина, и в 4-5 раз больше свободных жирных кислот, моно- и диглицеридов, чем гомогенат неокортекса.
Впервые показано, что адаптация млекопитающих к искусственному гипобиозу сопровождается специфическими изменениями липидного состава ядер нейронов и глии неокортекса: в состоянии искусственного гипобиоза у крыс отношения холестерин/фосфолипиды (М/М) в ядрах нейронов и глии увеличено; в глиальных ядрах увеличено количество холестерина и сфингомиелина. Таким образом, впервые обнаружена функциональная роль липидов ядер в ответе нервных клеток на состоянии искусственного гипобиоза млекопитающих. Обнаружена специфичность изменений липидного состава неокортекса и тимуса крыс в состоянии искусственного гипобиоза: в тимусе растет количество свободных жирных кислот и фосфолипидов при отсутствии изменений в ткани неокортекса. Таким образом, выявлены отличия функциональной роли липидов в разных тканях. Впервые обнаружена высокая интенсивность ацилирования моноглицеридов в тимоцитах крыс. Впервые исследован липидный состав и синтез липидов в тимоцитах у крыс в состоянии искусственного гипобиоза и через 24 часа после окончания охлаждения. Впервые обнаружен эффект последействия искусственного гипобиоза по критерию липидного обмена в тимоцитах. Установлено, что состояние искусственного гипобиоза не повреждает структуру ДНК и не индуцирует синтез холестерина. Показана функциональная роль липидов в адаптивных реакциях млекопитающих на состояние искусственного гипобиоза.
Научная и практическая значимость работы
Исследования посвящены кардинальному вопросу о роли липидов в формировании состояния искусственного гипобиоза у млекопитающих.
Результаты диссертационной работы важны для адаптационной медицины и функциональной биохимии липидов, необходимы для понимания путей адаптации млекопитающих к низким температурам окружающей среды и для поиска способов поддержания длительного, глубокого и безопасного гипобиоза, возможно, с помощью модуляции липидного обмена.
Результаты представляют практический интерес, направляя внимание исследователей к поиску способов увеличения устойчивости млекопитающих к экстремальным условиям посредством регуляции липидного обмена. Данные диссертации важны для адаптационной медицины, космической биологии и радиобиологии.
Апробация работы
Результаты исследований и основные положения диссертации были представлены и обсуждены на следующих конференция: на 12-й, 13-й, 14-й, 15-й и 16-й школах-конференциях молодых ученых Биология - наука XXI века (Пущино, 2008 г., 2009 г., 2010 г., 2011 г., 2012 г.); на 21-й зимней международной молодежной научной школе Перспективные направления физико-химической биологии и биотехнологии (Москва, 2009 г.); на 16-й международной конференции Ломоносов-2009 (Москва, 2009 г.); на II и III всероссийском с международным участием конгрессе биологов Симбиоз России
(Пермь,аа 2009аа г.;аа Нижнийа Новгород,аа 2010аа г.);аа наа XVIа Всероссийскомаа симпозиуме Структура и функции клеточного ядра (Санкт-Петербург, 2010 г.).
Публикации
По материалам диссертации опубликовано 17 печатных работ, в том числе 3 статьи в отечественных журналах.
Структура и объем диссертации
Диссертация состоит из введения, обзора литературы, описания материалов и методов исследования, результатов исследования и их обсуждения, заключения, выводов и списка литературы. Работа изложена на 99 страницах машинописного текста, содержит 9 рисунка, 3 таблицы. Список цитируемой литературы включает 220 источников.
СОДЕРЖАНИЕ РАБОТЫ Материалы и методы исследования Объекты исследования
В качестве объектов исследования использовали крыс линии Wistar. Все процедуры с животными проводились в соответствии с требованиями институтской комиссии по этике и Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей (European Communities Council Directive (86/609/EEC)).
Крысы Wistar. Опыты проводили на крысах-самцах массой 180-220г. Состояние крыс в опытах оценивали по температуре тела и ЧС. Для исследований крыс декапитировали в состоянии искусственного гипобиоза (температура тела 14,4-17,8С) сразу и через 24 часа после окончания воздействия гипотермии-гипоксии-гиперкапнии (извлечения из холодовой камеры) (температура тела 37С).
Методы исследования
Охлаждение крыс методом закрытого сосуда. Для охлаждения животных использовали метод закрытого сосуда в условиях гипоксии-гиперкапнии [Игнатьев и др., 2006]. Крыс выдерживали в герметичной камере объемом 5 л при температуре среды 1-2С в течение 3,0-3,5 ч. После охлаждения и извлечения из камеры у крыс измеряли ректальную температуру тела и частоту сердцебиений.
Получение материала.
- Выделение ядер клеток неокортекса. Извлекали головной мозг, выделяли неокортекс, гомогенизировали. Фракции нейрональных и глиальных ядер получали методом дифференциального центрифугирования в градиенте сахарозы [Thompson, 1973; модификация Baker, Chang, 1980]. Для каждого определения объединяли неокортекс пяти крыс. Чистоту получаемых фракций контролировали микроскопически. Аликвоты гомогената неокортекса, ядер глии и ядер нейронов использовали для определения количества липидов и белка (см. ниже).
- Выделение тимоцитов. Ткань тимуса протирали через капроновую ткань, тимоциты выделяли центрифугированием. Для каждого определения объединяли тимусы от трех крыс. Материал использовали для определения количества липидов, уровня включения 2-[ С]-ацетата в липиды, анализа состояния ДНК методом комета-тест и количества белка.
Количественное определение липидов. Выделяли и очищали общую фракцию липидов методом Фолча [Folch et al., 1957]. Разделяли липиды методом тонкослойной хроматографии. Для хроматографии нейтральных липидов использовали силикагель L 5-40 цк с добавлением 1%-ного гипса. На стеклянные пластинки размером 13x18 см наносили смесь силикагель/гипс/вода (6г:0,6г:18мл), растертую в агатовой ступке. Пластинки сушили при комнатной температуре, перед использованием активировали в течение 1 часа при 105С. Хроматографию проводили в системе гексан/диэтиловый эфир/уксусная кислота (73:25:2 по объему) [Прохорова, Туликова, 1965]. Для хроматографии фосфолипидов использовали пластины с силикагелем 60 F254 на алюминии (Merck, Germany). Хроматографию проводили в системе метилацетат/н-пропонол/хлороформ/метанол/0,25% КС1 (25:25:25:10:9 по объему) [Vitiello, Zanetta, 1978]. Липиды идентифицировали с использованием соответствующих липидных маркеров. Хроматограммы проявляли в парах йода. Для определения количества нейтральных липидов пятна с хроматограмм элюировали и определяли методом озоления [Marsh, Weinstein, 1966]. Концентрацию фосфолипидов определяли по липидному фосфору, умножая его количество на коэффициент 25. Липидный фосфор определяли по методу Герлаха-Дойтике [Gerlach, Deutike 1963], который состоит в озолении липидов смесью 60% хлорной и 95-97% серной кислот (1:1 по объему).
Исследование включения 2-[ С]-ацетата в суммарную фракцию белков и липидов при инкубации тимоцитов in vitro. Тимоциты, инкубировали при 37С в круглодонных колбах в Кребс - Рингер - фосфатном буфере (рН 7.2) с добавлением 0,44 МБк/мл 2-[ С]-ацетата Na в водяном термостате при осторожном периодическом встряхивании. Конечная концентрация клеток составляла 10 клеток/мл. В процессе инкубации суспензии тимоцитов с 2-[ С]-ацетатом отбирали аликвоты суспензии клеток. Аликвоты для определения белка сразу лизировали в 0,2N NaOH, добавляли немеченый ацетат Na до конечной концентрации 1мМ, помещали в ледяную баню и добавляли холодную трихлоруксусную кислоту до конечной концентрации 5% и оставляли во льду до формирования осадков. Осадки дважды отмывали от 2-[ С]-ацетата и вновь перерастворяли в 0,2N NaOH. Часть лизата использовали для определения белка, вторую часть для счета радиоактивности. Радиоактивность рассчитывали в имп/мин на 1 мг белка. Аликвоты для определения липидов помещали в ледяную баню, добавляли немеченый ацетат Na до конечной концентрации 1мМ и равный объем холодного буфера. Клетки осаждали центрифугированием. Клетки дважды отмывали от 2-[ С]-ацетата и вновь ресуспендировали в Кребс - Рингер - фосфатном буфере (рН 7.2). Выделяли общую фракцию липидов (см. выше). Часть фракции использовали для определения нейтральных и фосфолипидов, вторую часть для счета радиоактивности. Радиоактивность рассчитывали в имп/мин на 1 мг белка. Радиоактивность определяли на жидкостном сцинтилляционном счетчике SL-30 (Intertechnique, Франция). Результаты представляли в имп/мин на 1 мг белка.
Метод комета тест. Уровень поврежденности ДНК в изолированных тимоцитах определяли методом щелочного гель-электрофореза. Для приготовления препаратов использовали суспензию тимоцитов в фосфатном буфере (рН 7,2) с концентрацией 10 клеток/мл и 1% раствор агарозы. Готовые препараты помещали в лизирующий раствор (1% саркозинат натрия, 2,5 М NaCl, 0,1 М ЭДТА, 0,01 М трис-HCl рН=10 и 1% Тритон X-100) на 1 - 24 часа при 4С. Сразу после лизиса препараты перемещали в щелочной раствор А: 0,3 М NaOH, 0,001 М ЭДТА, рН>13, на 20 минут. После щелочной обработки препараты переносили в камеру для горизонтального электрофореза. Проводили электрофорез в свежей порции раствора А в течение 20 минут при 4С (объем буфера - 250 мл, напряжение - 27 В, сила тока - 260-270 мА, напряженность электрического поля 2 В/см). После электрофореза препараты промывали дистиллированной водой и окрашивали ва фосфатном буфере,а содержащем 2а мкг/мл
бромистого этидия, не менее 1 часа. Препараты анализировали под флюоресцентным микроскопом ЛЮМАМ И-3 (ЛОМО). Изображения регистрировали цифровым фотоаппаратом Nikon CoolPix 995, обрабатывали с помощью специализированного программного обеспечения для расчета стандартных параметров комет. Измеряли процент ДНК в хвосте кометы - ТДНК. Для каждого образца готовили по 3 препарата, фотографировали по 30-40 клеток на препарат.
Определение белка проводили по стандартной методике Лоури. В качестве стандарта использовали бычий сывороточный альбумин.
Статистическая обработка результатов исследования. Результаты экспериментальных исследований представлены как среднее стандартная ошибка. Достоверность различий устанавливали по t-критерию Стьюдента. Значение при р<0,05 принималось статистически достоверным.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для исследования функциональной роли липидов в процессах адаптации незимоспящих млекопитающих к искусственному гипобиозу был проведен анализ липидного состава коры головного мозга и тимуса крыс - органов, резко различающихся по функциям и липидному составу. Мозг рассматривается как основной регулирующий орган при гибернации млекопитающих [Beckman, 1982], принимающий участие в изменениях липидного обмена при гипотермии [Гурин, 1986]. Тимус был выбран как основной орган иммунитета молодых крыс [Ярилин, 2010]. Следует отметить, что выбор органов был связан также с тем, что реализация эффектов внешних воздействий на уровне организма происходит при непосредственном участии регуляторных систем, ответственных за поддержание гомеостаза, каковыми являются нервная и иммунная системы.
Влияние искусственного гипобиоза на липидный состав неокортекса крыс
Электрическая активность головного мозга в состоянии искусственного гипобиоза крыс резко снижается, повторяя с некоторыми модификациями снижение электрической активности при спячке естественных гибернантов [Bekman, 1982; Игнатьев и др., 2006, 2012]. Несмотря на интерес к исследованию роли липидов в нормальных и патологических состояниях мозга, данные о липидном составе клеток нейронов и глии [Hamberger, Svennerholm, 1971] и субклеточных компонентов нервных клеток неокортекса малочисленны [Baker, Chang, 1980; Kolomiytseva et al., 2008].
Полученные нами данные о липидном составе ткани неокортекса соответствуют литературным данным [Woelk et al., 1974; Baker, Chang, 1980; Кулагина и др., 2004]. Следует отметить, что количество фосфолипидов и холестерина на мг белка в ткани мозга больше, чем в ткани печени, в 3-4 раза. Известно, что фосфолипидный состав мозга устойчив даже при таких воздействиях, как высокие дозы ионизирующих излучений [Давыдов, Ушаков, 1987]. Изменений количества фосфолипидов и нейтральных липидов в гомогенате ткани неокортекса в состоянии искусственного гипобиоза у крыс обнаружено не было (табл.1). Ранее отмечалось, что в состоянии искусственного гипобиоза у крыс происходит некоторое недостоверное снижение количества холестерина в неокортексе [Игнатьев и др., 2006]. Состояние гипотермии у крыс, кроликов и собак сопровождалось снижением количества холестерина в мозге примерно на 12% [Гурин, 1986]. Возможно, что в коре головного мозга уменьшение количества холестерина не так ярко выражено, как в других отделах головного мозга.
Таблиц 1.аа Содержаниеа липидова ва ткани,аа нейрональныха иа глиальныха ядрах
неокортекса крыс в состоянии искусственного гипобиоза (мкг липида/мг белка).________
Ткань неокортекса |
Ядра глии |
Ядра нейронов |
|
Холестерин |
90,8 8,3 (8) 74,3 14,7 (5) |
21,4 2,9 (7) 32,0 3,4* (5) |
14,5 2,8 (7) 27,8 8,3 (5) |
Моноглицериды |
11,8 3,4 (7) 7,8 1,8 (5) |
33,0 4,7 (8) 36,9 9,3 (7) |
23,9 5,0 (7) 28,7 5,4 (5) |
Диглицериды |
5,6 0,6 (7) 7,1 0,5 (4) |
36,6 6,0 (8) 30,0 4,8 (5) |
21,4 5,3 (7) 24,1 7,3 (6) |
Жирные кислоты |
22,6 2,4 (7) 18,3 1,3 (5) |
105,1 19,2 (6) 69,6 16,0 (6) |
82,9 21,0 (8) 94,4 21,3 (5) |
Холестерин/фосфолипиды, моль/моль |
0,40 0,08 (4) 0,36 0,07 (4) |
0,69 0,12 (7) 1,07 0,06* (5) |
0,48 0,11 (6) 1,0 0,15* (5) |
Общая фракция фосфолипидов |
381 31 (5) 392 33 (4) |
77,1 7,5 (8) 59,0 4,6 (6) |
64,4 2,8 (8) 80,1 12,0 (4) |
Фосфатидилхолин |
113 16(7) 119 13 (5) |
41,2 6,1 (7) 41,0 4,3 (5) |
29,0 1,9 (7) 26,2 1,6 (5) |
Фосфатидилэтаноламин |
95,6 4,6 (6) 101,1 17,6 (5) |
13,8 0,7 (6) 13,0 2,6 (4) |
15,8 2,0 (7) 14,5 2,7 (5) |
Фосфатидилсерин |
42,3 4,7 (7) 52,0 9,1 (4) |
4.7аа 0,2 (5) 5.8аа 1,0 (4) |
4,2 1,2 (6) 4,5 1,2 (5) |
Фосфатидилинозитол |
35,9 5,4 (5) 38,1 3,2 (5) |
9,1 0,8 (5) 9,0 2,1(5) |
7,5 0,8 (6) 7,2 1,2 (4) |
Сфингомиелин |
19,5 1,2 (7) 26,0 4,1 (4) |
3,4 0,3 (5) 6,0 1,0* (5) |
4,1 0,2 (6) 3,7 0,9 (4) |
Кардиолипин |
14.4аа 1,7 (6) 14.5аа 2,3 (5) |
4,2 0,7 (4) 4,7 0,8 (4) |
2,4 0,6# (5) 1,8 0,5# (4) |
Белок, мг/г ткани |
85,7 4,6 (9) 73,3 4,8 (6) |
0,74 0,15 (8) 0,77 0,12 (6) |
0,90 0,12 (8) 0,95 0,14 (6) |
Верхняя строка - нормотермия, нижняя строка - искусственный гипобиоз, в скобках указано количество экспериментов, количества даны в мкг липида / мг белка.
* Различие достоверно по отношению к количеству в норме при р < 0,05.
# Различие достоверно по отношению к количеству в ядрах глии при р < 0,05.Влияние искусственного гипобиоза на липидный состав ядер нейронов и глии неокортекса крыс
Липиды, являясь структурными компонентами мембран, входят в состав сигнальных систем клетки. В связи с этим представляло интерес исследовать липидный состав ядер нервных клеток с разными физиологическими функциями - нейронов и глии. В ядрах нейронов и глии из неокортекса крыс в состоянии искусственного гипобиоза методом электронной микроскопии не было обнаружено морфологических отличий от нормы.
Клетки глии содержат на 50% больше общих липидов, чем нейроны (липиды на 1 мг белка), однако количество холестерина и фосфолипидов в клетках глии лишь незначительно превышает их концентрации в нейронах [Hamberger, Svennerholm, 1971]. Количество фосфолипидов в ядрах нейронов неокортекса кроликов [Baker, Chang, 1981], холестерина и фосфолипидов в ядрах нейронов и глии неокортекса крыс [Кулагина и др., 2004]аа значительноаа меньшеаа таковыхаа ваа микросомахаа иаа тканиаа неокортекса.аа Состав
нейтральных липидов ядер нервных клеток резко отличается от состава нейтральных липидов ткани неокортекса малым количеством холестерина (табл. 1). Еще большее отличие концентрации холестерина обнаруживается при сравнении холестерина ядер и микросомальной фракции (эндоплазматический ретикулум и диктиосомы): количество холестерина в микросомах неокортекса крыс превышает содержание в ядрах в 7-10 раз, составляя 148 24 мкг холестерина на 1 мг белка [Kolomiytseva et al., 2008]. Хотя неокортекс обогащен холестерином в 10-20 раз по сравнению с другими тканями крыс, различия в количестве холестерина между ядрами печени, тимуса и ядрами нейронов и глии невелики. В ядрах печени и тимуса обнаруживается соответственно 3,5 0,3 и 9,1 0,9 мкг холестерина на 1 мг белка [Kolomiytseva et al., 2002], причем холестерина в ядрах нейронов содержится 14,5 2,8 и в ядрах глии - 21,4 2,9 (мкг на 1 мг белка) (табл. 1). Среди нейтральных липидов в микросомальной фракции и синаптосомальных мембранах неокортекса холестерин присутствует в наибольшей концентрации [Kolomiytseva et al., 2008, Коломийцева и др., 2003]. В липидах ядер нейронов и глии это место занимают жирные кислоты (табл. 1), являясь мажорными нейтральными липидами ядер.
Холестерин как сигнальная молекула играет важную роль в метаболизме нервных клеток, механизмах памяти, пластичности и нейродегенеративных процессах [Nelson, Alkon, 2005]. Холестерин и сфинголипиды являются необходимой частью рафтов, влияя на активность, латеральную диффузию рецепторов и их взаимодействие с агонистами (лигандами) [Brown, London, 1998; Ikonen, 2008]. Поэтому представляет интерес увеличение количества холестерина в ядрах глии и отношения холестерин/фосфолипиды за счет роста количества холестерина в ядрах глии и нейронов неокортекса крыс в состоянии искусственного гипобиоза в условиях гипотермии-гипоксии-гиперкапнии (табл. 1). Цепь синтеза холестерина локализована в цитозоле и мембранах эндоплазматического ретикулума. Возможно, увеличение количества холестерина при гипобиозе затрагивает механизмы синтеза холестерина и его транспорта в ядра.
Из анализа литературных данных следует, что рост отношения холестерин/фосфолипиды в мембранах обнаруживали при активации специфических функций органелл. Активация дыхания в митохондриях печени при воздействии сверхвысоких доз ионизирующей радиации на крыс проходила на фоне роста количества холестерина в этих структурах [Маркевич, Коломийцева, 1994]. Увеличение количества холестерина в микросомах неокортекса сусликов [Коломийцева и др., 2003] обнаружено при активации синтеза белков [Гордон и др., 2006] в течение интербаута (активное состояние) в ходе гибернации. Активация синтеза белка в микросомах печени при остром воздействии ионизирующей радиации на крыс сопровождалась увеличением количества холестерина в микросомах и ростом скорости межмембранного переноса холестерина [Коломийцева и др., 1985; Коломийцева, 1989]. Апоптозный агент - фактор некроза опухоли а - вызывал в неокортексе в ранние сроки после введения крысам (30-60 мин) некоторое увеличение количества холестерина [Рожнова и др., 1999]. Увеличение отношения холестерин/фосфолипиды в ядрах клеток неокортекса может трактоваться как свидетельство функциональной роли холестерина в ответе на гипобиоз, не связанной напрямую с гомеовязкостной адаптацией мембран [Hazel, 1995]. Можно полагать, что увеличение количества холестерина и рост отношения холестерин/фосфолипиды в ядрах связаны с определенным этапом активации клеток неокортекса в ответ на состояние гипобиоза в условиях гипотермии-гипоксии-гиперкапнии.
Показано обогащение ядерных фракций неокортекса моноглицеридами и диглицеридами (табл. 1) по сравнению с тканью. Моноглицерид 2-арахидоноилглицерид составляет основную часть (до 47%) всех моноглицеридов в мозге крыс [Sugiura et al., 1995] и является эндогенным каннабиноидом. Эндогенные каннабиноиды и их рецепторы играют роль в обучении, памяти, локомоции и в нейродегенеративных процессах [Dinh et al., 2002].
Концентрация диглицеридов в ядрах нервных клеток также существенно превышает их количество в ткани неокортекса (табл. 1). Диглицериды рассматриваются как ключевой элемент в системе клеточной сигнализации и являются интермедиатами синтеза фосфатидилхолина и фосфатидилэтаноламина [Carrasco, Merida, 2007]. Диглицериды служат также промежуточными продуктами действия на фосфолипиды фосфолипазы С и (в присутствии фосфатаз) фосфолипазы D [Kanfer et al., 1996]. Источником диглицеридов ядер в процессе клеточной сигнализации служит фосфатидилинозитол [Carrasco, Merida, 2007]. Обнаружение высоких концентраций жирных кислот, моно- и диглицеридов в ядрах нейронов и глии открывает новые перспективы изучения их структурной организации.
В ядрах нейронов и глии неокортекса третьим по количеству фосфолипидом является фосфатидилинозитол, в отличие от ткани и микросом, где это положение занимает фосфатидилсерин. Фосфатидилинозитол в качестве третьего мажорного фосфолипида определен ранее в ядрах нейронов и глии [Baker, Chang, 1981; Кулагина и др., 2004], ядрах тимуса и ядрах печени крыс [Kolomiytseva et al., 2002]. Таким образом, общность липидного состава ядер различных органов и тканей проявляется в превышении количества фосфатидилинозитола над количеством фосфатидилсерина.
Судя по нашим и литературным данным, соотношения липид/белок для нейтральных липидов и фосфолипидов в ядрах нервных клеток принципиально отличаются от таковых в липидах ткани и микросомальных мембран неокортекса (в ядрах резко увеличено количество жирных кислот, моно- и диглицеридов). Была выделена ядерная мембрана нейрональных клеток неокортекса кроликов и показано, что по активности маркерных ферментов, количеству РНК и фосфолипидов она не отличается от микросомальной фракции неокортекса [Baker, Chang, 1981]. Из анализа результатов следует, что ядра нервных клеток представляют собой обогащенные белками, моно- и диглицеридами и жирными кислотами гидрофильные островки, обернутые в гидрофобную ядерную мембрану.
Состояние искусственного гипобиоза у крыс в условиях гипотермии-гипоксии-гиперкапнии вызывает в ядрах глии увеличение количества сфингомиелина (табл. 1). Конечным этапом синтеза сфингомиелина служит перенос фосфорилхолина сфингомиелин-синтазой от фосфатидилхолина на церамид с образованием диглицерида и сфингомиелина. Сфингомиелин-синтаза обнаружена в различных частях клеток, в том числе и в ядерной мембране [Albi et al., 1999]. Деградацию сфингомиелина - отщепление фосфорилхолина с образованием церамида - осуществляют ферменты семейства сфингомиелиназ, имеющие различную локализацию. Во многих работах показано, что под воздействием факторов, вызывающих апоптоз, происходит увеличение количества церамидов [Dbaibo et al., 1997]. Источником роста сфингомиелина ядер глии в условиях гипобиоза может быть активация сфингомиелинсинтаз, угнетение сфингомиелиназ или изменение скорости транспорта сфингомиелина из мембран эндоплазматического ретикулума в ядра. Скорость межмембранного переноса липидов высока и может быть фактором увеличения количества липидов в мембране [Коломийцева, 1989]. Следует отметить отсутствие увеличения количества диглицеридов и уменьшения количества фосфатидилхолина в ядрах глии, т.е. не обнаружены признаки активации сфингомиелинсинтаз. Более вероятны угнетение активности сфингомиелиназ или изменение скорости транспорта сфингомиелина.
Апоптозный агент - фактор некроза опухоли а - вызывал в неокортексе в ранние сроки после введении крысам (30-60 мин) снижение активности сфингомиелиназы и некоторое увеличение количества сфингомиелина [Рожнова и др., 1999]. Показано, что подавление активности сфингомиелиназы, уменьшение продукции церамидов защищают нейрональные клетки от апоптоза и совпадают с ростом количества сфингомиелина [Soeda et al., 2004]. Накопление сфингомиелина в ядрах связывают с активацией восстановительных реакций и деления клеток [Алесенко и др., 1989]. Однако имеются и
противоположные данные, полученные на Т-лимфоцитах крови, где показано, что накопление сфингомиелина и уменьшение отношения фосфатидилхолин/сфингомиелин происходит на стадии подготовки к апоптозу за счет активации сфингомиелин-синтаз при уменьшении количества фосфатидилхолина [Flores et al., 2000]. Мы не обнаружили уменьшения количества фосфатидилхолина, а уменьшение отношения фосфатидилхолин/сфингомиелин в ядрах глии при гипобиозе происходит за счет роста количества сфингомиелина (табл. 1).
Известно также, что сфингомиелин вместе с холестерином являются основными образующими рафтов или микродоменов на мембране. Рафты принимают активное участие в сортировке молекул (липидов и белков), в их транспорте внутрь клетки и, следовательно, в сигналинге [Brown, London, 1998]. Хотя о наличии этих специфических лостровков на ядерной мембране не сообщается, можно предположить, что увеличение количества холестерина и сфингомиелина связано с их функционированием.
Таким образом, учитывая сигнальную роль холестерина и сфингомиелина, а также их участие в образовании рафтов, рост их количества в ядрах глии можно рассматривать как свидетельство участия сигнальных систем глиальных клеток неокортекса в ответе организма млекопитающего на гипобиоз в условиях гипотермии-гипоксии- гиперкапнии.
Рост количества сфингомиелина и увеличение количества холестерина в ядрах глии, а также отношения холестерин/фосфолипиды в ядрах нейронов неокортекса крыс при гипобиозе, возможно, свидетельствует об увеличении устойчивости к повреждающему воздействию. Показано, что через 48 ч после искусственного гипобиоза увеличивается количество мембран эндоплазматического ретикулума в неокортексе крыс [Перепелкина и др., 2008]. Эти же эффекты могут играть роль и в известном радиозащитном действии искусственного гипобиоза [Игнатьев и др., 2006].
Уже в ранних работах по исследованию роли фосфатидилинозитидов в генерации кальциевых волн ставился вопрос о локализации в клетке систем внутриклеточной сигнализации [Berridge et al., 1988]. Результаты исследований позволяют предположить, что изменения липидного состава ядер неокортекса крыс в состоянии искусственного гипобиоза определяются сигнальной ролью липидов. Намечаются перспективы использования гипобиоза в условиях гипотермии-гипоксии-гиперкапнии как способа модификации состояния клеток неокортекса для воздействия на патологические процессы в головном мозге.
Влияние искусственного гипобиоза на липидный обмен, клеточный цикл и структуру ДНК тимоцитов крыс
Тимус состоит на 95-98% из лимфоцитов и является активно пролиферирующим органом иммунной системы. Тимус очень чувствителен к действию различных факторов, вызывающих апоптоз клеток [Ярилин, 2010]. В тимусе мышей 20% всех тимоцитов являются делящимися клетками, время жизни которых составляет примерно 1 сутки, а 80% - неделящимися [Egerton et al., 1990]. Основную часть объема тимоцита занимает ядро. Липидный состав тимоцитов близок к липидному составу ядер тимоцитов [Kolomiytseva et al., 2002]. Тимоциты - удобный объект для исследования синтеза липидов in vitro. Исследовали липидный обмен тимоцитов крыс, находящихся в состоянии искусственного гипобиоза для сравнения с липидным обменом в тимоцитах крыс через 24 часа после процедуры охлаждения. Результаты представляют большой интерес для оценки роли липидного обмена в функциональной активности тимоцитов.
Влияние искусственного гипобиоза на липидный состав тимоцитов крыс. Известно, что фосфолипидный состав мембран различных клеток изменяется под действием различных физических и химических повреждающих факторов даже в малых дозах [Кулагина и др., 2000; Урнышева и Шишкина, 2004; Козлов и Шишкина, 2008].
Фосфолипидный состав тимоцитов соответствовал литературным данным [Кулагина и др., 1993; Kulagina et al., 2003]. Характерной особенностью фосфолипидного
состава тимоцитов является высокий вклад фосфолипидов ядер. Известно, что в некоторых тканях (печень, неокортекс) количество фосфатидилсерина (ФС) превышает количество фосфатидилинозитола (ФИ), в ядрах этих тканей, напротив, содержание ФИ выше, чем содержание ФС [Kolomiytseva et al., 2002]. Нами показано, что количество ФС в тимоцитах примерно равняется количеству ФИ (табл. 2). Таким образом, высокое содержание ФИ в тимоцитах свидетельствует о значительном вкладе липидов ядра. В пользу этого свидетельствует также отношение количества моноглицеридов к количеству диглицеридов, которое в ткани неокортекса равно 2, в ядрах нейронов и глии 0,9-1,1, а в тимоцитах - 1,2 (табл. 1,2).
В состоянии искусственного гипобиоза крыс в тимоцитах: увеличивалось содержание фосфатидилхолина (ФХ) на 28%, фосфатидилинозитола (ФИ) в 2 раза, фосфатидилэтаноламина (ФЭА) на 23% и свободных жирных кислот почти в 2 раза, количество кардиолипина уменьшалось на 59% (табл. 2); через 24 часа после окончания процедуры охлаждения содержание фосфатидилхолина, фосфатидилэтаноламина и свободных жирных кислот приходило в норму, оставалось повышенным количество фосфатидилинозитола в 2,3 раза, увеличивалось содержание фосфатидилсерина в 2,4 раза и диглицеридов в 1,7 раз, количество кардиолипина уменьшалось в 2,3 раза (табл. 2). Количество остальных липидов, а именно холестерина, моноглицеридов, сфингомиелина, не изменялось.
Таблица. 2. Количество индивидуальных липидов в тимоцитах при искусственном
гипобиозе крыс (мкг липида / мг белка).___________________________________________
Нормотермия |
Искусственный гипобиоз |
Через 24 часа после гипобиоза |
|
Сфингомиелин |
2,80,8 (9) |
1,70,5 (4) |
2,70,4 (5) |
Фосфатидилхолин |
42,71,9 (7) |
55,05,2* (5) |
49,05,1 (4) |
Фосфатидилсерин |
5,50,9 (8) |
8,71,4(6) |
13,10,9** (4) |
Фосфатидилинозитол |
5,00,7 (7) |
10,52,3* (5) |
11,30,5** (4) |
Кардиолипин |
3,90,4 (7) |
2,30,3* (3) |
1,50,1** (3) |
Фосфатидилэтаноламин |
17,80,6 (7) |
21,91,4* (5) |
18,23,2(5) |
Холестерин |
11,50,8(5) |
12,51,4(4) |
12,71,4 (3) |
Свободные жирные кислоты |
18,91,8(5) |
34,44,2* (4) |
14,62,1 (3) |
Моноглицериды |
6,90,8 (6) |
7,72,8 (4) |
9,32,1(6) |
Диглицериды |
5,60,7 (7) |
5,82,2 (4) |
9,61,5 (5)* |
Белок, мкг / мг ткани |
54,79,0 (6) |
41,65,9 (4) |
57,55,8 (5) |
* - различие достоверно по отношению к контролю при р<0,05; ** - различие достоверно по отношению к контролю при р<0,001; в скобках указано количество экспериментов.
ФХ, как и другие липиды, является участником сигнальных систем, его метаболизм тесно связан с метаболизмом СМ, ФЭА, ФС и ФИ [Nohturfft, Zhang, 2009]. На Т-лимфоцитах крови показано, что синтез de novo и накопление ФХ и рост отношения фосфатидилхолин/сфингомиелин происходит при активации пролиферации тимоцитов в культуре, стимулированных IL-II [Flores et al., 2000]. Искусственный гипобиоз вызывает увеличение отношения ФХ/СМ, за счет увеличения количества ФХ. Показано, что активность орнитиндекарбоксилазы, фермента, являющегося маркером активации клеток,
снижается до 20% от контроля [Аксенова и др., 2010]. Можно полагать, что увеличение количества ФХ, ФЭА и стойкое увеличение ФИ (табл. 2) имеют адаптивный характер и направлены на поддержание жизнеспособности клеток.
Концентрация кардиолипина в ядрах тимоцитах равна его концентрации в клетке [Kolomiytseva et al., 2002]. Таким образом, кардиолипин тимоцитов практически полностью локализован в ядрах. Поэтому полагаем, что обнаруженное достоверное снижение его количества в состоянии искусственного гипобиоза крыс касается, прежде всего, ядерных структур тимоцитов. Известно, что среди ДНК-связанных липидов кардиолипин занимает особое место, весь кардиолипин хроматина локализован в ДНК и ядерном матриксе. Он регулирует, например, активность ДНК- и РНК-полимераз, протеинкиназы С, показано его участие в регуляции клеточной пролиферации [Стручков, Стражевская, 1993]. В тоже время, стойкое снижение содержания кардиолипина, максимальное через 24 часа после окончания охлаждения, на фоне снижения активности ОДК [Аксенова и др., 2010] и снижения числа клеток в фазе S на 18% (табл.3), может свидетельствовать об участии кардиолипина в клеточной пролиферации. Имеются данные о том, что на ядерной мембране тимоцитов обнаружены участки электрон-транспортной цепи, в ядрах показан синтез АТФ, количество которого сравнимо с количеством АТФ в целой клетке [Allfrey, 1970]. Известно также, что кардиолипин обеспечивает связь цитохром с-оксидазы (IV комплекса дыхательной цепи митохондрий) с внутренней мембраной митохондрий. Его присутствие абсолютно необходимо для нормальной работы этого фермента [Gohil et al., 2004; Милейковская и др., 2005]. Таким образом, уменьшение кардиолипина в тимоцитах при искусственном гипобиозе крыс может свидетельствовать о нарушении функционирования дыхательной цепи.
Таблица 3. Распределение тимоцитов по фазам клеточного цикла в состоянии искусственного гипобиоза и через 24 часа после окончания охлаждения (% от общего числа клеток).
Состояние животного |
Фазы клеточного цикла |
||
Go+d |
S |
G2+M |
|
Нормотермия (контроль) |
88,50,8 (6) |
5,70,2 (4) |
6,20,6 (6) |
Искусственный гипобиоз |
86,11,4(5) |
6,60,4 (3) |
7,01,1 (5) |
Через 24 ч после окончания охлаждения |
91,70,5** (5) |
4,00,4** (5) |
4,30,3** (5) |
Обозначения те же, что и в табл.2.
В неокортексе крыс в состоянии искусственного гипобиоза количество жирных кислот не изменялось (табл.1). Напротив, в тимоцитах крыс в состоянии искусственного гипобиоза наблюдался рост количества свободных жирных кислот (табл.2). Известно, что в состоянии искусственного гипобиоза увеличивается количество насыщенных жирных кислот в крови и сердечной мышце крыс [Тимофеев, 2005]. Увеличение количества жирных кислот отмечено в крови при разной степени гипотермии и других видах стресса и рассматривается как следствие общей реакции организма млекопитающих, направленной на активацию энергетического метаболизма [Гурин, 1986].
Через 24 часа после окончания процедуры охлаждения количество основных фосфолипидов не отличалось от контроля. Было отмечено увеличение количества минорных фосфолипидов, таких как фосфатидилинозитол и фосфатидилсерин более чем в
2 раза (табл. 2). Таким образом, по сравнению с состоянием гипобиоза происходит уменьшение количества ФХ и ФЭА, соответственно растет количество диглицеридов, что свидетельствует об активации сигнальных путей и функциональной роли фосфолипидов. Из анализа результатов следует, что липиды играют важную роль в адаптивном ответе и регуляции клеточной пролиферации тимоцитов в состоянии искусственного гипобиоза крыс.
Таким образом, после окончания охлаждения через 24 часа содержание ФХ, ФЭА и жирных кислот возвратилось к норме. Однако количество ФИ осталось повышенным, увеличилось количество ФС, ещё больше снизилось содержание кардиолопина и возросло количество ДГ. Следовательно, гомеостатические системы индуцировали изменения липидного состава тимоцитов через 24 ч после искусственного гипобиоза. Это явление может рассматриваться как эффект последействия, обусловленный немонотонным метаболическим ответом. Немонотонный метаболический и функциональный ответ является основополагающим свойством живых систем [Степанова, 1986]. Его проявление свидетельствует о включении прямых и обратных связей систем клеточного гомеостаза при различных видах стресса и повреждающих воздействиях [Кузин, 1986; Коломийцева, 2009]. Следует отметить, что подобный эффект последействия выявляется при исследовании клеточного цикла тимоцитов.
Влияние искусственного гипобиоза на включение 2-[14С]-ацетата в липиды тимоцитов крыс in vitro. Для анализа влияния искусственного гипобиоза на метаболизм липидов исследовали синтез липидов по включению 2-[ С]-ацетата. 2-[ С]-ацетат является прямым предшественником синтеза жирных кислот и холестерина и включается в фосфолипиды и глицериды в реакциях ацилирования. Для инкубации клеток был использован фосфатный буфер Кребса-Рингера без добавления сыворотки, ингибирующей синтез липидов [Кулагина, Коломийцева, 1989]. Инкубация клеток в течении 120 минут не приводила к значительной гибели клеток - снижение живых клеток составляло 20%. Таким образом, данная среда является вполне удовлетворительной для исследования синтеза липидов в тимоцитах.
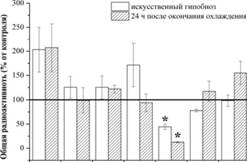
При инкубации тимоцитов, выделенных из крыс в состоянии искусственного гипобиоза наблюдали уменьшение включения 2-[ С]-ацетата в кардиолипин. Изменений включения метки в другие фосфолипиды не обнаружено (рис. 1). Таким образом, состояние искусственного гипобиоза затрагивает метаболизм кардиолипина, который является важным структурным компонентом дыхательной цепи митохондрий [Милейковская и др., 2005], связан со структурой и функционированием ДНК [Стручков, Стражевская, 1993]. Концентрация кардиолипина уменьшается при стрессе и гипоксии [Fariss et al., 2005].
|
Рис. 1. Общая радиоактивность фосфолипидов (ими / мин / мг белка) тимоцитов в состоянии искусственного гипобиоза крыс и через 24 часа после окончания охлаждения (в % от контроля); количество экспериментов 3-6; * -различие достоверно по отношению к контролю при попарном сравнении, р < 0,05.
Ф'Ма ОФФЛ
Состояние искусственного гипобиоза крыс не влияло на синтез холестерина в тимоцитах (рис. 2). Известно, что воздействие на организм млекопитающих самых разнообразных повреждающих агентов стимулирует новообразование холестерина в связи с активацией пролиферации клеток и восстановления мембран [Коломийцева, 1989]. Воздействие на крыс повреждающего агента - ионизирующего излучения в сублетальных и даже в малых дозах - активировало синтез холестерина в лимфоцитах [Новоселова и др., 1985; Kolomiytseva et al., 1999]. Следовательно, по критерию синтеза холестерина состояние гипобиоза не воспринимается организмом крысы как повреждающий фактор.
искусственный гнпобноз |
? :ж< |
ч после окончания охлавдення |
?аа 2S0 |
Рис. 2. Общая радиоактивность
нейтральных липидов (имп / мин / мг
белка)аа тимоцитоваа ва состоянии
г*А |
-, Iа к) |
\ |
J |
_ |
.и |
искусственного гипобиоза крыс и через 24 часа после окончания охлаждения (в % от контроля), количество экспериментов 4Ч 7; * - различие достоверно по отношению к контролю при попарном сравнении, р < 0,05.
Интенсивность включения метки в свободные жирные кислоты (СЖК) также не изменялась (рис. 2). Следовательно, рост количества СЖК происходил в результате их поступления из крови, где они увеличены вследствие липолиза жировой ткани [Гурин, 1986]. Следует отметить, что в ткани, ядрах нейронов и глии коры головного мозга крыс в состоянии искусственного гипобиоза не было обнаружено увеличения количества жирных кислот, что свидетельствует о тканеспецифичности влияния искусственного гипобиоза на метаболизм жирных кислот (табл. 1).
Включение 2-[ С]-ацетата в моноглицериды тимоцитов уменьшалось в 2 раза в состоянии искусственного гипобиоза, а через 24 часа после окончания охлаждения крыс более чем в 2 раза превышало норму (рис. 2). Метаболизм моноглицеридов тесно связан с метаболизмом глюкозы, через триозофосфаты. Известно, что состояние естественного гипобиоза у млекопитающих сопровождается резким угнетением углеводного обмена в клетках [Galster and Morrison]. Подавление окислительного метаболизма при искусственном гипобиозе уменьшает интенсивность образования моноглицеридов, возможно за счет уменьшения пула предшественников. При возвращении к нормотермии компенсаторно увеличивается интенсивность синтеза моноглицеридов. Известно, что при естественном гипобиозе происходит модуляция активности некоторых ферментов и дифференциальная экспрессия генов [Srere et al., 1992; Epperson et al., 2010]. Следует отметить, что эффект увеличения синтеза моноглицеридов совпадал с нормализацией количества СЖК через 24 ч после окончания охлаждения (рис. 2). Из анализа результатов
следует, что метаболизм моноглицеридов участвует в функциональном ответе тимоцитов на воздействие искусственного гипобиоза и в реализации эффекта последействия.
Таким образом, через 24 часа после окончания охлаждения, когда уровень метаболизма и пролиферация клеток еще снижены, для процессов синтеза липидов показана тенденция к нормализации. В тоже время, через 24 часа после окончания охлаждения последствия гипотермии ещё не преодолены, что подтверждается активацией синтеза моноглицеридов и угнетением синтеза кардиолипина.
Возможно, что в изменениях липидного состава в тимоцитах играет роль смена пула пролиферирующих клеток за счет клеток-предшествеников из костного мозга [Egerton et al., 1990; Ярилин, 2005].
Влияние искусственного гипобиоза на структуру ДНК.
В состоянии искусственного гипобиоза млекопитающие подвергаются действию гипотермии и гипоксии. Гипоксия вызывает различные повреждающие эффекты: иммунодепрессию [Реджебова, 1992], изменение активности оксигеназ, системы кальпаина, снижение уровня и соотношения креатинфосфат/АТФ, изменение в составе фосфолипидов клеточных мембран [Ляпкова и Ткачук, 1995], а также повреждения ДНК [Bouquet et al., 2011]. Гипотермия, например содержание крыс в холодной комнате (-7С) вызывает различную реакцию органов животного. Показано, что печень более устойчива, чем легкие к холодовому повреждению по показателям перекисного окисления липидов [Тминовидр., 1984; 1985].
Тимоциты очень чувствительны к различным внешним воздействиям на организм. Представляло интерес выяснить, влияет ли искусственный гипобиоз на структуру ДНК тимоцитов.
Метод комета-тест позволяет проанализировать наличие двойных и одиночных разрывов ДНК, а также уровень апоптоза в клеточной популяции. Различные генотоксические агенты - химические факторы и ионизирующая радиация - вызывают увеличение доли ТДНК [Сирота, Кузнецова, 2010].
При сравнении значений ТДНК (доля ДНК в хвосте кометы") тимоцитов, изолированных в состоянии нормотермии и в состоянии гипотермии крыс различий не выявлено: 5,80,6%; 5,11,0%; п=6, соответственно. Таким образом, состояние искусственного гипобиоза млекопитающих не вызывает повреждений ДНК и не является генотоксическим фактором.
ЗАКЛЮЧЕНИЕ
В настоящем исследовании показана функциональная роль липидов в механизмах
адаптации незимоспящих млекопитающих к искусственному гипобиозу. Искусственный
гипобиоз вызывает специфические изменения липидного состава неокортекса, тимоцитов
и ядер нейронов и глии неокортекса крыс, свидетельствующие о модуляции клеточных
функций. Выявлено участиеа фосфатидилхолина,а фосфатидилсерина,
фосфатидилинозитола, фосфатидилэтаноламина, кардиолипина, свободных жирных кислот, моно- и диглицеридов в адаптации крыс к искусственному гипобиозу. Показано, что состояние искусственного гипобиоза у крыс не вызывает повреждений ДНК и не индуцирует новообразования холестерина и жирных кислот в тимоцитах. Установлено, что искусственный гипобиоз, как стрессовый фактор, вызывает эффект последействия в тимоцитах крыс.
В настоящем исследовании искусственный гипобиоз рассматривается как один из видов стрессовых состояний млекопитающих. Такой подход представляет интерес для адаптационной медицины и космической биологии. Состояние искусственного гипобиоза при температуре тела 15-18С в условиях гипоксии-гиперкапнии вызывает эффект последействия, выраженный в адаптивных изменениях метаболизма липидов и клеточного цикла, имеющих отношение к адаптации млекопитающих к экстремальным условиям.
выводы
- Показано участие липидов неокортекса и тимоцитов в адаптации крыс к искусственному гипобиозу.
- ипиды ядер нейронов и глии играют функциональную роль при искусственном гипобиозе млекопитающих. Увеличение отношения холестерин/фосфолипиды в ядрах нейронов и глии, а также рост количества сфингомиелина и холестерина в ядрах глии свидетельствуют об активации нервных клеток при искусственном гипобиозе.
- Искусственный гипобиоз крыс модифицирует липидный состав тимоцитов как в состоянии гипометаболизма (увеличено количество фосфатидилхолина, фосфатидилэтаноламина, свободных жирных кислот и фосфатидилинозитола, снижено количество кардиолипина), так и спустя 24 часа после окончания охлаждения (увеличено количество фосфатидилсерина и фосфатидилинозитола, остается сниженным содержание кардиолипина), обнаруживая эффект последействия.
- Состояние искусственного гипобиоза не влияет на синтез холестерина и жирных кислот, но модифицирует ацилирование моноглицеридов, при резком угнетении синтеза кардиолипина в тимоцитах крыс.
- Состояние искусственного гипобиоза крыс не вызывает повреждений структуры ДНК тимоцитов.
- Выявлены особенности липидного состава ядер нейронов и глии неокортекса крыс. Нейрональные ядра обеднены холестерином и фосфолипидами и обогащены моно- и диглицеридами по сравнению с эндоплазматическим ретикулумом; количество кардиолипина в ядрах глии превышает количество кардиолипина в ядрах нейронов.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи в журналах:
- Коломийцева И.К., Маркевич Л.Н., Перепелкина Н.И., Быкова О.В., Игнатьев Д.А., Фесенко Е.Е. Влияние состояния гипотермии у крыс на липиды мембранных структур неокортекса//ДАН. 2009. Т.427. №6. С.844-848.
- Коломийцева И.К., Маркевич Л.Н., Игнатьев Д.А., Быкова О.В. Липиды ядерных фракций нейронов и глии неокортекса при искусственном гипобиозе крыс // Биохимия. 2010. Т.75. №9. С. 1265-1272.
- Быкова О.В., Маркевич Л.Н., Коломийцева И.К. Влияние искусственного гипобиоза на количество липидов в тимоцитах крыс // Вестник ННГУ. Сер. Биология. 2012. №1 (1). С. 100-103.
Глава в книге
Kolomiytseva I.K., Markevich L.N., PerepelkinaN.L, Bykova O.V., Aksyonova G.E., Fialkovskaya L.A., Logvinovich O.S., Afanasyev V.N., Ignat'ev D.A. Ch. 1. Artificial hypobiosis in rats: influence on physiology, lipid metabolism and ornithin decarboxylase activity (pp. 1-42). In book: Hypothermia: prevention, recognition and treatment. Ed. J.I.V. Delgado and V.G.F. Garza. N.Y.: Nova Sci. Publ. 2012. ISBN 978-1-61942-551-4.
Статьи в сборниках:
- Маркевич Л.Н., Перепелкина Н.И., Быкова О.В., Игнатьев Д.А., Коломийцева И.К. Влияние состояния гипотермии у крыс на липиды органелл клеток неокортекса // сб. статей Рецепция и внутриклеточная сигнализация. Пущино. 2009. Т.1. С. 130-135.
- Фиалковская Л.А., Быкова О.В., Аксенова Г.Е., Логвинович О.С, Маркевич Л.Н., Игнатьев Д. А., Коломийцева И.К. Воздействие малых доз ионизирующей радиации
и гипотермии на активность орнитиндекарбоксилазы и липидный обмен в тимусе крыс // Материалы Международной конференции Биологические эффекты малых доз ионизирующей радиации и радиоактивное загрязнение среды, Сыктывкар, 2009. С. 377-379.
Тезисы докладов:
- Маркевич Л.Н., Быкова О.В., Коломийцева И.К. Содержание липидов в ядрах нейронов и глии неокортекса крыс при действии сверхвысоких доз рентгеновского излучения // сб. тезисов конференции Медико-биологические проблемы токсикологии и радиологии. Санкт-Петербург. 2008. С. 133.
- Быкова О.В., Маркевич Л.Н., Игнатьев Д.А., Перепелкина Н.И., Коломийцева И.К. Изменение липидного состава неокортекса крыс при гипотермии // сб. тезисов конференции Биология - наука XXI века. Пущино. 2008. С.75.
- Быкова О.В., Маркевич Л.Н., Игнатьев Д.А., Коломийцева И.К. Влияние гипотермии на метаболизм фосфолипидов в тимоцитах крыс // сб. тезисов конференции Перспективные направления физико-химической биологии и биотехнологии. Москва. 2009. С.48.
- Быкова О.В. Влияние состояния гипотермии на липидный состав ядер неокортекса крыс // сб. тезисов конференции Ломоносов-2009, Москва, 2009. С. 41-42.
- Быкова О.В., Логвинович О.С. Липиды и активность орнитиндекарбоксилазы неокортекса крыс в условиях гипотермии // сб. тезисов конгресса Симбиоз России. Пермь. 2009. С. 195-196.
- Быкова О.В., Маркевич Л.Н., Игнатьев Д.А., Коломийцева И.К. Метаболизм фосфолипидов в тимоцитах крыс в условиях гипотермии // сб. тезисов конференции Биология - наука XXI века. Пущино. 2009. С.63-64.
- Быкова О.В., Маркевич Л.Н., Игнатьев Д.А., Коломийцева И.К. Метаболизм нейтральных липидов в тимоцитах при искусственном гипобиозе крыс // сб. тезисов конференции Биология - наука XXI века. Пущино. 2010. С. 13-14.
- Быкова О.В., Маркевич Л.Н., Игнатьев Д.А., Коломийцева И.К. Влияние гипотермии на метаболизм нейтральных липидов в тимоцитах крыс // сб. тезисов конгресса Симбиоз России. Н.Новгород. 2010. С. 121.
- Маркевич Л.Н., Быкова О.В., Коломийцева И.К. Липиды ядерных фракций нейронов и глии в норме и при воздействии на крыс ионизирующей радиации и искусственного гипобиоза // Цитология. 2010. Т.52. №8. С.671-672. (тезисы докладов XVI Всероссийского симпозиума Структура и функции клеточного ядра Санкт-Петербург, 5-7 октября 2010 г.)
- Быкова О.В., Маркевич Л.Н., Коломийцева И.К. Липидный обмен тимоцитов при искусственном гипобиозе крыс // сб. тезисов конференции Биология - наука XXI века. Пущино. 2011. С.91-92.
П.Быкова О.В., Афанасьев В.Н., Сирота Н.П., Коломийцева И.К. Метаболизм фофолипидов и клеточный цикл тимоцитов у крыс в состоянии искусственного гипобиоза // сб. тезисов конференции Биология - наука XXI века. Пущино. 2012. С.168.
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]