Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Питание и трофические связи демерсальных рыб зал. Петра Великого (Японское море) в летний период
Автореферат кандидатской диссертации
На правах рукописи |
Пущина Ольга Игоревна
![]()
ПИТАНИЕ И ТРОФИЧЕСКИЕ СВЯЗИ ДЕМЕРСАЛЬНЫХ РЫБ ЗАЛ. ПЕТРА ВЕЛИКОГО (ЯПОНСКОЕ МОРЕ) В ЛЕТНИЙ ПЕРИОД
03.02.06 - ихтиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата биологических наук
Владивосток - 2012
Работа выполнена в федеральном государственном унитарном предприятии Тихоокеанский научно-исследовательский рыбохозяйственный центр (ФГУП ТИНРО-Центр)
Научный руководитель:аа доктор биологических наук, старший научный сотрудник
Чучукало Валерий Иванович
Официальные оппоненты: Дулепова Елена Петровна,
доктор биологических наук, старший научный сотрудник,
ведущий научный сотрудник лаборатории прикладной
биоценологии ФГУП ТИНРО-Центр
Иванков Вячеслав Николаевич,
доктор биологических наук, профессор,
профессор кафедры Биоразнообразие и морские
биоресурсы Дальневосточного федерального университета
Ведущая организация: ФГБУН Институт биологии моря
им. А.В. Жирмунского ДВО РАН, г. Владивосток
Защита состоится л28 июня 2012 г. в 10-00 часов на заседании диссертационного совета Д 307.012.01 при ФГУП ТИНРО-Центр по адресу: 690091, г. Владивосток, переулок Шевченко, 4. Факс (423)2300-751. E-mail:
С диссертацией можно ознакомиться в библиотеке ФГУП ТИНРО-Центр.
Автореферат разослан л25 мая 2012 г.
/
Ученый секретарьа J
диссертационного совет (у/ТЛО.Н. Лукьянова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Трофологические исследования являются важнейшим инструментом в познании закономерностей функционирования водных сообществ и экосистем. Изучение питания и пищевых отношений рыб, определение степени использования ими кормовой базы и обеспеченности пищей, наряду с другими специальными работами, позволяют решать вопросы, связанные с динамикой популяций, емкостью среды и рациональным использованием продукции гидробионтов (Чучукало, 2006). С середины 1980-х гг. крупномасштабные трофологические работы стали неотъемлемой частью экосистемных исследований, проводимых ТИНРО-Центром в дальневосточных морях и направленных на разработку мер по управлению биоресурсами и многовидовому рыболовству (Шунтов и др., 2010).
В северо-западной части Японского моря одной из самых высокопродуктивных акваторий является зал. Петра Великого, освоение ресурсов которого непрерывно ведется с конца XIX столетия (Гаврилов, 1998; Вдовин и др., 2004). Однако на сегодняшний день в плане изученности питания нектона этот водоем, как и все российские воды Японского моря, значительно уступает многим другим районам дальневосточного бассейна. Несмотря на почти столетнюю историю исследований биоты залива, имеется весьма ограниченное число публикаций, в которых с разной степенью подробности описан качественный состав пищи массовых и некоторых обычных рыб, его сезонная изменчивость и отдельные аспекты пищевых отношений видов. Особенности питания многих представителей ихтиофауны, количественные оценки рационов и в целом трофические связи нектона на шельфе и материковом склоне залива ранее не рассматривались.
Цель и задачи исследования. Настоящая работа ставит своей целью определение качественных и количественных характеристик питания и анализ трофических связей де-мерсальных рыб зал. Петра Великого (Японское море) в летний период.
Для достижения этой цели решались следующие задачи:
- Изучить состав и величину суточных рационов рыб с учетом их размерной и батиметрической изменчивости.
- Рассчитать объемы сезонного потребления рыбами различных гидробионтов.
- Изучить трофическую структуру демерсальных ихтиоценов.
- Оценить степень внутри- и межвидовой пищевой конкуренции рыб.
Научная новизна. Впервые для зал. Петра Великого с помощью весового метода получены данные по питанию щитоносного ската Bathyrajaparmifera, красного Alcichthyselongatusи двурогого Enophrysdicerausбычков, нитчатого Gymnocanthuspistilliger, дальневосточного G. herzensteiniи широколобого G. detrisusшлемоносцев, колючего ицела Ice-luscataphractus, снежного Myoxocephalusbrandti, многоиглого M. polyacanthocephalusи керчака-яока М. jaok, бычка-ворона Hemitripterusvillosus, охотского липариса Liparisocho-tensis, чешуйчатого аллолеписа Bothrocarahollandi, полосатой Liopsettapinnifasciata. звездчатой Platichthysstellatus, длиннорылой Limandapunctatissima, японской Pseudopleu-ronectesyokohamaeи колючей Acanthopsettanadeshnyiкамбал, а также стихея Григорьева Stichaeusgrigorjewi.
3
Значительно дополнены и уточнены сведения о питании в заливе тихоокеанской сельди Clupeapallasii, мелкочешуйной красноперки Tribolodonbrandti, дальневосточной наваги Eleginusgracilis, тихоокеанской трески Gadusmacrocephalus, минтая Theragrachal-cogramma, пятнистого Hexagrammosstelleriи южного одноперого Pleurogrammusazonusтерпугов, стреловидного люмпена Lumpenussagitta, желтополосой Ps. herzensteini, желтоперой L. aspera, малоротой Glyptocephalusstelleri, остроголовой Cleisthenesherzensteiniи южной палтусовидной Hippoglossoidesdubiusкамбал.
Впервые для российских вод Японского моря определены количественные характеристики пищевых рационов вышеуказанных рыб, на основе которых рассчитаны объемы сезонного потребления ими других гидробионтов (в том числе промысловых) в зал. Петра Великого. Исследована трофическая структура демерсальных ихтиоценов и количественно оценена степень внутри- и межвидовой пищевой конкуренции в них, что позволило получить целостную картину трофических связей в рыбных сообществах шельфа и верхней части материкового склона залива.
Практическая значимость. Диссертация является первой обобщающей сводкой по трофологии демерсальных рыб зал. Петра Великого. Представленные в ней данные существенно расширяют представления о биологии промысловых и перспективных для промысла видов рыб зал. Петра Великого, о структуре и масштабах выедания ими гидробионтов. Результаты работы могут применяться для мониторинга состояния биологических ресурсов, исследования функционирования рыбных сообществ и в целом экосистемы зал. Петра Великого, а также для оценки экологической емкости этого водоема. Количественные характеристики рационов рыб, полученные автором, используются специалистами ТИНРО-Центра для расчета кормовых коэффициентов при определении экологического ущерба от хозяйственной деятельности на побережье. Материалы диссертации могут быть полезны в качестве справочных в лекционных курсах для студентов-биологов.
Защищаемые положения. 1. По характеру питания в летний период из 32 исследованных видов рыб 11 относятся к бентофагам, 9 - к эврифагам и 12 - к хищникам. Как по числу видов (34.4%), так и по биомассе (58.5%) среди потребителей преобладают консу-менты П-Ш порядка. Батиметрические изменения в трофической структуре ихтиоценов вполне закономерны и находятся в соответствии с кормовой базой.
- Главную роль в формировании общего летнего рациона рыб на шельфе и верхней части материкового склона зал. Петра Великого играют бентосные и нектобентосные беспозвоночные (по 32%), второстепенную, но весьма существенную, - рыбы (18.3%) и зоопланктон (17%). Большая часть органического вещества поступает в демерсальные ихтио-цены со второго и третьего трофических уровней.
- Внутри- и межвидовая пищевая конкуренция среди рассматриваемых рыб в подавляющем большинстве случаев отсутствует или находится на низком уровне. Средняя и высокая степень конкуренции отмечаются очень редко и связаны, главным образом, с фактором плотности потребителей.
Вклад автора.Автором обработаны материалы, собранные сотрудниками лаборатории ресурсов рыб прибрежных вод (ныне лаборатории комплексных исследований ре-
4
сурсов рыб Японского моря) ТИНРО-Центра в 2002-2009 гг., проанализированы результаты и сформулированы научные выводы. В работе использованы также опубликованные данные автора, полученные на основе материалов, собранных с его участием в 1994-1999 гг.
Апробаиия работы. Материалы диссертации представлялись на юбилейной научной конференции Дальрыбвтуза Рыбохозяйственные исследования океана (Владивосток, 1996); на Международной конференции PICES (Хакодате, Япония, 2000); на Международной конференции Биологические основы устойчивого развития прибрежных морских экосистем (Мурманск, 2001); на Международных научно-практических коференциях Морские прибрежные экосистемы. Водоросли, беспозвоночные и продукты их переработки (Владивосток, 2008; Южно-Сахалинск, 2011); на Международной научно-технической конференции Актуальные проблемы освоения биологических ресурсов Мирового океана (Владивосток, 2010); на отчетных сессиях ТИНРО-Центра (2009, 2010, 2011).
Публикаиии. По теме диссертации опубликовано 19 работ, из них 13 - в изданиях, рекомендованных ВАК. Одна работа находится в печати.
Структура работы. Диссертация состоит из введения, четырех глав, выводов и списка литературы (274 наименования, из них 41 на иностранных языках). Общий объем работы 200 страниц, включая 44 таблицы и 31 рисунок.
Благодарности. Автор глубоко признателен к.б.н. С.Ф. Соломатову, к.б.н. А.Н. Вдовину, П.В. Калчугину, к.б.н В.В. Панченко, к.б.н Д.В. Антоненко, к.б.н В.А. Нуждину, Л.А. Черноивановой, к.б.н З.Г. Иванковой и к.б.н. Д.В. Измятинскому за активное участие в сборе материала и постоянную поддержку при подготовке этой работы. Автор также искренне благодарен к.б.н Л.Л. Будниковой, к.б.н. В.А. Надточему, Б.М. Борисову, к.б.н Н.М. Мокрину и к.б.н Г.А. Шевцову, определившим видовую принадлежность гаммарид, мизид и моллюсков, д.г.н. Ю.И. Зуенко, любезно предоставившему необходимые для расчетов данные по температуре воды в районе исследований, и к.б.н. Е.Э. Борисовцу за помощь в компьютерной обработке данных. Особую признательность выражаю своему учителю и научному руководителю д.б.н. В.И. Чучукало, а также к.б.н. В.В. Напазакову и к.б.н. В.А. Дудареву за критический просмотр рукописи и ценные замечания.
СОДЕРЖАНИЕ РАБОТЫ
Глава 1. Материал и методика
В основу работы легли материалы, собранные в ходе проведения учетных траловых съемок гидробионтов на шельфе и верхнем отделе материкового склона зал. Петра Великого (5 - 600 м) в летний период (вторая половина июня - первая половина сентября) на МРС-5005 (2002-2007 гг.), РКМРТ Бухоро (2007 г.) и МРТК Янтарь (2009 г.) (рис. 1). Съемки выполнялись в светлое время суток по стандартной сетке станций с помощью 23.2 и 27.1-метровых донных тралов типа ДТ/ТВ с мягким грунтропом и ячеей в кутце 10 мм.
5
|
Рис. 1. Карта-схема района работ: 1 - зал. Посьета, 2 -Амурский залив, 3 - Уссурийский залив, 4 - зал. Восток. Точками обозначены траловые станции
Сбор и обработку проб по питанию вели групповым
;гшаа МкТОДОМ (МкТОДИЧкСКОк ПО-
Японское море |
собие ..., 1974; Руководство..., 1986). Измерение длины рыб (АС) проводили с точностью до 1 см, при взвешивании оценивали общую массу рыб в пробе. Крупные и единично встречающиеся экземпляры взвешивали и обрабатывали индивидуально. Желудочно-кишечные тракты отбирали на борту судна с учетом размеров и глубины обитания рыб и фиксировали 10% формалином. Дальнейшую обработку осуществляли в береговой лаборатории. Компоненты корма по возможности определяли до вида и взвешивали с точностью до 0.01 г. Значение их в рационах рыб оценивали по массе (в % от общей массы пищи). Общее количество обработанного в 2002-2009 гг. материала составило 6481 желудок от 32 видов рыб (табл. 1). Дополнительно в работе использованы опубликованные данные автора по питанию рыб, полученные в 1994-1999 гг. в зал. Петра Великого и в 1996-2005 гг. в водах северного Приморья.
Таблица 1
Объем материала по питанию рыб, собранного в зал. Петра Великого в 2002-2009 гг.
Вид |
Число |
Вид |
Число |
желудков |
желудков |
||
Щитоносный скат |
32 |
Бычок ворон |
112 |
Тихоокеанская сельдь |
180 |
Охотский липарис |
89 |
Мелкочешуйная красноперка |
79 |
Чешуйчатый аллолепис |
98 |
Дальневосточная навага |
327 |
Стреловидный люмпен |
139 |
Тихоокеанская треска |
382 |
Стихей Григорьева |
107 |
Минтай |
552 |
Полосатая камбала |
136 |
Пятнистый терпуг |
156 |
Звездчатая камбала |
56 |
Южный одноперый терпуг |
426 |
Длиннорылая камбала |
136 |
Красный бычок |
120 |
Японская камбала |
268 |
Двурогий бычок |
ПО |
Желтополосая камбала |
318 |
Нитчатый шлемоносец |
ПО |
Остроголовая камбала |
129 |
Дальневосточный шлемоносец |
163 |
Желтоперая камбала |
285 |
Широколобый шлемоносец |
266 |
Малоротая камбала |
385 |
Колючий ицел |
145 |
Южная палтусовидная камбала |
223 |
Снежный керчак |
200 |
Колючая камбала |
315 |
Керчак-яок Многоиглый керчак |
281 156 |
||
Всего |
6481 |
6
Величины суточных пищевых рационов рыб (СПР) рассчитывали по методу Н.С. Новиковой (1949), модифицированному В.И. Чучукало и В.В. Напазаковым (1999): с помощью дробной шкалы переваренности реконструировали исходную массу кормовых объектов, а затем определяли продолжительность их переваривания в зависимости от придонной температуры воды по формуле В.Б. Цейтлина (1986):
Dx=16*W0,18*ym0,6*T,аа (1)
где Dx - время переваривания 90% исходной пищи (час), W - масса рыбы (г), ут -отношение исходной массы пищи (г) к массе рыбы (г), т - температурная поправка по Р. Джонсу (Jones, 1974):
х = ехр [0,0806*(20 - Q)],а (2)
где Q - температура воды при наблюдениях, С.
Средняя для вида величина рациона и соотношение в нем компонентов корма вычислены с учетом биомасс отдельных размерных групп рыб и их вклада в общее потребление пищи в трех батиметрических зонах: сублиторали (менее 50 м), элиторали (50-200 м) и мезобентали (более 200 м).
Индексы пищевого сходства (или объем конкуренции) рассчитывали по А.А. Шоры-гину (1952) путем суммирования меньших процентов (долей по массе) общих для сравниваемых рыб видов кормовых организмов. При значениях индекса до 33% объем конкуренции считается слабым, от 34 до 66% - средним, более 66% - высоким.
Степень пищевой конкуренции оценивали с помощью уравнения К.В. Мартино -М.С. Карапетковой (1957) в модификации В.И. Чучукало (2002):
а
СПК = -^- *0*СПР*СПР2,аа (3)
а т
а
где СПК - степень пищевой конкуренции, -------- а- отношение биомассы двух конку-
а т
рирующих видов (т), D - сходство пищи по А.А.Шорыгину (1952) (в долях от 1), СИР] и
СПР2 - величины суточных пищевых рационов (в % от массы тела). При величине СПК
менее 1000 единиц степень пищевой конкуренции считается слабой, от 1000 до 5000 -
средней, более 5000 - высокой.
Трофический уровень исследованных видов рыб рассчитан по формуле (Cortes,
1999):
TLk=l +(IPj*TLj),а (4)
Н
7
где TLk - трофический уровень вида k, Pj - доля пищевого компонента j в рационе вида k, п - общее количество пищевых компонентов, TLj - трофический уровень пищевого компонента j.
К первому трофическому уровню отнесены детрит и водная растительность, ко второму уровню (консументам I порядка) - преимущественные детритофаги и фитофаги, ко второму-третьему уровню (консументам I-II порядка) - эврифаги, к третьему (консументам II порядка, хищникам I порядка) - хищные беспозвоночные (Кузнецов, 1980; Дулепова, 2002; Колпаков, 2006 и др.). Трофические уровни встреченных в желудках десятиногих ракообразных, щетинкочелюстных, головоногих моллюсков и рыб вычислены по вышеприведенной формуле (4) на основе литературных и собственных (по рыбам-жертвам) данных о составе их пищи.
Глава 2. Литературный обзор
2.1. Краткая характеристика ихтиофауны зал. Петра Великого
Расположение зал. Петра Великого на стыке умеренной и субтропической климатических зон обусловливает чрезвычайное разнообразие его биоты. Ихтиофауна этого водоема представлена рыбами как северного (арктическо-, субарктическо-, умеренно- и низко-бореальный комплексы), так и южного происхождения (субтропическо-низкобореальный, субтропический и тропическо-субтропический комплексы) (Шейко, 1983). В первую группу входят в основном постоянно обитающие здесь донные, придонные и придонно-пелагические виды (тресковые, терпуговые, рогатковые, камбаловые и др.), во вторую -пелагические мигранты. За всю историю наблюдений (с 1860 г.) в зал. Петра Великого зарегистрировано 312 видов рыб. Максимальное их число отмечалось в 20-40-х гг. прошлого века (233) и в первом десятилетии нынешнего (236) (Соколовский и др., 2009).
В донных съемках залива таксономический состав ихтиофауны беднее, поскольку в зону учета не попадают рыбы, обитающие в узкой прибрежной полосе и в толще воды выше облова тралом. Вместе с тем, в значительном количестве в этих съемках учитываются массовые полупроходные (мелкочешуйная красноперка), нерито- и придонно-пелагические виды (сельдь, минтай, южный одноперый терпуг и др.), а в годы высокой численности - и некоторые южные пелагические мигранты (дальневосточная сардина Sar-dinopsmelanostictus), придерживающиеся (особенно на небольших глубинах) придонных слоев воды (Гаврилов, 1998; Вдовин и др., 2004).
В теплый период года основная масса демерсальных рыб зал. Петра Великого сосредоточена на шельфе, при этом наибольшая плотность их концентраций и видовое разнообразие наблюдаются в сублиторальной зоне с глубинами 5-50 м. На внешнем шельфе эти показатели снижаются и достигают минимальных значений в верхней части материкового склона (в диапазоне 200-600 м) (Измятинский, 2004, 2005, 2006).
В 2001-2009 гг. в летних донных траловых съемках залива было зарегистрировано 147 видов рыб, относящихся к 36 семействам. Основу ихтиомассы, оцененной в среднем в 78.5 тыс. т, формировали семейства тресковых (28.5%), рогатковых (22.8%), камбаловых
8
(18.7%) и терпуговых (14.8%), а доминирующими видами являлись навага (17.1%), южный одноперый терпуг (14.4%), минтай (8.3%) и керчак-яок (8.3%). Средняя плотность рыб в сублиторали составила 10.3 т/км , в элиторали - 5.7 т/км , в мезобентали - 3.5 т/км . В отличие от шельфа, где в разных соотношениях преобладали указанные выше виды, на материковом склоне большая часть биомассы рыб была представлена колючей камбалой (23.4%), минтаем (19%), щитоносным скатом (9.6%), колючим ицелом (8.8%) и чешуйчатым аллолеписом (8.4%) (Соломатов, Калчугин, 2012).
2.2. Краткая характеристика кормовой базы рыб зал. Петра Великого
Имеющиеся в литературе данные характеризуют зал. Петра Великого как район с довольно благоприятными условиями для нагула планктоноядных рыб и бентофагов. По последним сведениям (Долганова, 2010), в летний период максимальные концентрации зоопланктона (в среднем 2008 мг/м ), сформированные личинками донных беспозвоночных (40.2%), мелкими видами копепод (32.8%) и щетинкочелюстными (19%), образуются на внутреннем шельфе, особенно в Амурском и Уссурийском заливах. По мере удаления от берега удельная биомасса планктона снижается (до 849 мг/м в водах материкового склона), однако в нем возрастает количество крупных интерзональных и океанических видов копепод (51.6%), гипериид (8.7%), эвфаузиид (11.4%), щетинкочелюстных (24.2%) и в целом доля крупной фракции (до 75%), являющейся основой кормовой базы планктоноядных рыб. В истекшем десятилетии ресурсы зоопланктона в заливе оценивались в 1 млн. т.
Средняя биомасса дночерпательного зообентоса на шельфе залива в настоящее время составляет 265.4 г/м . Максимальным обилием отличаются донные сообщества Амурского и Уссурийского заливов, на отдельных участках которых концентрации животных превышают 1000 г/м . Общий ресурс бентоса на глубинах 7-280 м оценивается в 1.8 млн. т, кормового - в 1.6 млн. т, при этом доминирующими группами являются двустворчатые моллюски (30.7%), голотурии (24.4%), многощетинковые черви (16.9%) и эхиуриды (8.3%) (Надточий и др., 2005). Сведения о бентосе глубоководной части зал. Петра Великого ограничиваются данными 1930-х гг. (Дерюгин, Сомова, 1941), согласно которым в верхнем отделе материкового склона (200-600 м) средняя биомасса донных беспозвоночных составляет всего 87 г/м , а кормовая ее часть (полихеты и моллюски) - 34.5 г/м .
При меньших величинах биомасс, темпы продуцирования органического вещества зоопланктоном и зообентосом в зал. Петра Великого выше, чем в северных морях, что обусловлено более теплым температурным режимом этого водоема, а также обилием мелких короткоцикловых видов копепод (в том числе субтропических) в первом случае и полихет, имеющих сравнительно высокую скорость роста, - во втором (Шунтов, 2001; Дулепова, 2002). По годовой удельной продукции донные сообщества Амурского и Уссурийского заливов (соответственно 699.4 и 501 г/м ) не уступают наиболее продуктивным районам шельфа Охотского и Берингова морей (Дулепова и др., 2008).
Что касается крабов, креветок, шримсов, головоногих моллюсков и некоторых других важных в кормовом отношении групп животных, то опубликованных данных по их ресурсам в зал. Петра Великого нет. Известно, что самый массовый здесь промысловый вид крабов - обыкновенный краб-стригун Chionoecetesopilio- в летний период встречается на
9
глубинах от 12 до более 600 м, преимущественно в диапазоне 100-350 м (Мирошников, 2008; Кобликов, 2011). Другой промысловый вид декапод - шримс-медвежонок Sclerocran-gonsalebrosa- обитает на глубинах от 30 до 110 м, концентрируясь в основном в центральной части залива (Цробязин, 2008). На материковом склоне массовые скопления создают северная Pandalusborealisи гребенчатая P. hypsinotusкреветки, однако в настоящее время их запасы находятся в депрессивном состоянии (Кобликов, Корнейчук, 2010). Из головоногих моллюсков наиболее массовым видом в летне-осенний период является тихоокеанский кальмар Todarodespacificus(Мокрин, 2006).
Глава 3. Питание демерсальных рыб зал. Петра Великого
В настоящем разделе диссертации подробно рассматриваются качественные и количественные аспекты питания 32 массовых и обычных видов рыб залива в летний период, проводится сравнение полученных данных с литературными сведениями. Ниже по результатам исследования приводится краткая трофологическая характеристика этих рыб.
Главным кормом щитоносного ската являются десятиногие ракообразные (57.4%) и головоногие моллюски (28.9%), второстепенным - рыбы (10.7%). Молодь длиной 21-40 см питается макропланктоном (в основном эвфаузиидами), более крупная (41-80 см) - креветками, шримсами и крабом-стригуном. Основная пища половозрелых скатов длиной 81-100 см представлена кальмарами и декаподами (в основном крабами), а особей длиной 101-120 см - рыбами (главным образом камбалами) и северной креветкой. По мере роста ската величина его СПР снижается с 2 до 0.3% и в среднем составляет 0.9 % от массы тела.
В питании придонной сельди ведущую роль играют мизиды (32.1%), щетинкочелю-стные (24.3%) и копеподы (19.9%), второстепенную - личинки крабов (16.6%) и эвфаузии-ды (5.3%). Сельдь размером 11-15 см поедает в основном личинок крабов и щетинкочелю-стных. В рационе рыб длиной 16-25 см увеличивается доля копепод и мизид, а более крупные (26-30 см) откармливаются главным образом мизидами и эвфаузиидами. Величина СПР сельди в среднем составляет 4.5% и по мере роста снижается с 7.9 до 2.8%.
Мелкочешуйная красноперка потребляет преимущественно мелких брюхоногих и двустворчатых моллюсков (соответственно 27.3 и 27.2%), отчасти - детрит (17%), полихет (16.7%) и декапод (11.8%). Особи размером 16-20 см питаются в основном детритом, более крупные (21-30 см) предпочитают моллюсков и червей, а рыбы длиной свыше 30 см - декапод. Величина СПР по мере роста значительно снижается (с 6.8 до 0.7%) и в среднем составляет 2.9% от массы тела.
Основу пищевого спектра наваги размером 8-35 см формируют декаподы (33.3%), молодь различных рыб (25.2%) и мизиды (21.2%). Второстепенное значение имеют поли-хеты, изоподы, гаммариды и щетинкочелюстные. Сеголетки и молодь длиной 8-15 см потребляют главным образом мизид и мальков стреловидного люмпена, но с увеличением размеров наваги в ее пище постепенно возрастает роль полихет, креветок, шримсов и молоди рыб (в основном рогатковых и стихеевых). СПР наваги составляет в среднем 5.3% от массы тела, снижаясь по мере роста с 6.4 до 2.6%.
10
Треска откармливается преимущественно рыбами (60.5%), среди которых несколько большее значение, чем другие виды, имеют южный одноперый терпуг, стреловидный люмпен и мелкие виды рогатковых. Значительную часть рациона составляют декаподы (20.6%), в основном краб-стригун, и головоногие моллюски (11.9%), главным образом тихоокеанский кальмар. Молодь размером 21-30 см поедает мизид, креветок, гаммарид и, в меньшей степени, рыб и других животных. Рацион среднеразмерной трески (31-70 см) состоит преимущественно из рыб, но со значительной долей декапод и головоногих. В пище крупных особей длиной свыше 70 см абсолютно доминируют рыбы. Величина СПР исследованных размерных групп трески варьирует в пределах 1.5-3.2% от массы тела (в среднем 2.7%).
Основным кормом придонного минтая являются мизиды (40.1%) и копеподы (20.1%), второстепенным - эвфаузииды (11.3%), гиперииды (7.8%), щетинкочелюстные (5.6%), декаподы (6.8%) и рыбы (4.6%). Молодь длиной 11-20 см питается преимущественно копеподами, отчасти - мизидами, щетинкочелюстными и эвфаузиидами. С увеличением размеров минтая в его желудках возрастает количество гипериид, эвфаузиид, мизид, креветок и рыб. Особи длиной свыше 60 см отдают предпочтение нектобентосным ракообразным и рыбам. Величина СПР минтая составляет в среднем 3% от массы тела и по мере роста снижается с 4.1 до 2.1 %.
В рационе пятнистого терпуга доминируют декаподы (46.4%) и рыбы (29.4%). Молодь размером 11-20 см поедает в основном креветок, мизид, полихет и стреловидного люмпена, а взрослые особи (21-40 см) - рыб (с преобладанием мелких бычков и молоди наваги), раков-отшельников, эхиурид, мягкие ткани двустворчатых моллюсков и икру рыб. В процессе онтогенеза средняя величина СПР пятнистого терпуга снижается с 11.2 до 5.7% от массы тела (в среднем 7.2%).
Ведущую роль в питании южного одноперого терпуга играют мизиды (23.1%), гиперииды (22.9%) и эхиуриды (20.4%), второстепенную - рыбы (11.6%), преимущественно молодь наваги, декаподы (10.1%) и эвфаузииды (5.7%). Большая часть пищи особей длиной 21-30 см представлена зоопланктоном, но с увеличением размеров терпуга его доля в рационе сокращается, уступая место бентосу и нектобентосу (эхиуридам, мизидам, мелким креветкам, молоди краба-стригуна, а также откушенной вместе с плеоподами самок наружной икре этого вида). Крупные особи длиной 41-50 см откармливаются в основном эхиуридами и рыбами. Величина СПР разноразмерных групп южного одноперого терпуга находится в пределах 4.1-5.6% (в среднем 4.3%).
Основными компонентами корма красного бычка являются декаподы (главным образом молодь краба-стригуна) - 69.2% и рыбы (преимущественно мелкие виды рогатковых) - 20.5%. В питании его молоди длиной 11-20 см существенное значение имеют также мизиды, креветки и шримсы. Доля краба-стригуна максимальна в пище бычков размером 31-40 см, а рыб и рыбной икры - у самых крупных особей (свыше 40 см). По мере роста красного бычка величина его СПР снижается с 4.1 до 2.8% и в среднем составляет 3% от массы тела.
11
Двурогий бычок отдает предпочтение полихетам (43.7%) и декаподам (34%). Второстепенная его пища включает эхиурид (6.7%), асцидий (4.9%), офиур (4.1%) и гаммарид (3.3%). В желудках рыб длиной 16-20 см преобладают полихеты, молодь краба-стригуна и офиуры. Особи длиной 21-25 см поедают в основном червей, а более крупные (26-30 см) -раков-отшельников и эхиурид. СПР бычка составляет в среднем 1%, варьируя в пределах 0.7-1.4% от массы тела.
Нитчатый ишемоносец питается главным образом полихетами (54.4%), в меньшей степени - эхиуридами (17.1%), гаммаридами (8.2%), двустворчатыми (11.5%) и брюхоногими моллюсками (5.3%). Молодь длиной 11-15 см потребляет в основном полихет и гаммарид, но по мере роста бычка в пище возрастает доля более крупных беспозвоночных (преимущественно эхиурид и двустворчатых). В желудках взрослых особей (21-25 см) примерно в равном соотношении доминируют полихеты и эхиуриды. Величина СПР исследованных размерных групп рыб меняется незначительно (3.5-3.3%).
Основу рациона дальневосточного шлемоносца формируют рыбы (37.2%), среди которых преобладают японский анчоус Engraulisjaponicusи мелкие виды рогатковых, и де-каподы (27.2%). Бычки длиной 11-15 см откармливаются преимущественно мизидами, полихетами и мальками рыб. С увеличением размеров тела в пище шлемоносца возрастает доля эхиурид, гаммарид, креветок, шримсов, головоногих и рыб. Взрослые особи длиной 21-30 см поедают главным образом шримсов, рыб и гаммарид, а самые крупные (свыше 30 см) - краба-стригуна, рыб и мягкие ткани двустворчатых моллюсков. Величина СПР шлемоносца снижается по мере его роста с 4.6 до 2.3% от массы тела (в среднем 3.3%).
В питании широколобого шлемоносца ведущую роль играют гиперииды (53.8%). Второстепенный корм также представлен зоопланктоном - сальпами (13.6%), гидроидными медузами (8.2%), щетинкочелюстными (6.8%), эвфаузиидами (6.3%). На долю бентоса и нектобентоса (полихет, мизид, головоногих) приходится менее 9% рациона. Молодь бычка длиной 11-15 см поедает в основном сальп и мизид, более крупная - гипериид, сальп и щетинкочелюстных. В желудках взрослых особей длиной 21-35 см доминируют гиперииды. Средняя величина СПР рыб составляет 2.8%, варьируя в пределах 2.4-3.5%.
Колючий щел откармливается преимущественно ракообразными - декаподами с преобладанием креветок (40%), мизидами (34.8%) и эвфаузиидами (15.9%). В процессе онтогенеза ицела мелкие рачки (гаммариды, мизиды, эвфаузииды) в его желудках постепенно замещаются креветками, шримсами, молодью краба-стригуна, а величина СПР снижается с 7.1% у молоди длиной 6-10 см до 3.8% у взрослых рыб размером 26-30 см (в среднем 3.1% от массы тела).
Основным кормом снежного керчака являются эхиуриды (42.6%), различные дека-поды (25.9%) и рыбы (23.3%), главным образом стреловидный люмпен, молодь наваги и желтоперой камбалы. Второстепенное значение имеют полихеты и тихоокеанский кальмар. В рационе бычков длиной 21-30 см доминируют креветки, мелкие крабы и молодь рыб, у более крупных (31-40 см) - эхиуриды, а особи размером свыше 40 см предпочитают рыб. Величина СПР снежного керчака составляет в среднем 2.4%, снижаясь по мере его роста с 2.7 до 1.1 %.
12
Пищевой спектр керчака-яока слагают в основном рыбы (47.7%), декаподы (23.5%) и эхиуриды (26.4%). Самые мелкие из проанализированных особей (11-20 см) питаются преимущественно шримсами и молодью люмпена. Бычки длиной 21-40 см переходят в основном на потребление эхиурид, краба-стригуна, анчоуса, молоди наваги и южного одно-перого терпуга. Керчаки размером 41-50 см поедают рыб (навагу, пятнистого терпуга, молодь камбал), в меньшем количестве - крабов и других беспозвоночных, а самые крупные особи (более 50 см) - крабов и рыб. По мере роста керчака-яока величина его СПР снижается с 6.8 до 2.2% от массы тела (в среднем 3.6%).
Многоиглый керчак потребляет в основном декапод (62.2%), преимущественно краба-стригуна, и рыб (32.2%). Молодь бычка длиной 11-20 см предпочитает мелкие виды ро-гатковых и молодь камбал. В питании особей размером 21-30 см крабы и рыбы имеют почти равное значение, а в рационе половозрелых (31-50 см) возрастает доля крабов, шримса-медвежонка и осьминогов. Керчаки длиной свыше 50 см поедают главным образом краба-стригуна, в меньшей степени других беспозвоночных и рыб (молодь минтая, южного од-ноперого терпуга, рогатковых). Величина СПР керчака составляет в среднем 2.5%, снижается по мере роста с 4.4 до 2.3%.
В рационе бычка-ворона доминируют рыбы (92.5%), второстепенным кормом является тихоокеанский кальмар (7.2%). Особи длиной 11-20 см питаются в основном молодью стихеевых, которые по мере роста бычка постепенно замещаются более крупными рыбами (рогатковыми, камбалами и др.). При длине свыше 30 см бычок-ворон начинает потреблять кальмара и взрослого южного одноперого терпуга, достигающих максимального значения в пище особей длиной 41-50 см. Величина СПР этого вида варьирует от 1.6 до 3.2% от массы тела (среднем 2.5%).
Главным кормом охотского липариса являются рыбы (48.7%), преимущественно мелкие виды рогатковых, и декаподы (35.8%), в основном краб-стригун, шримс-медвежонок и северная креветка. Существенную часть пищи особей длиной 11-30 см составляют также мизиды и гаммариды. С увеличением размеров липариса доля рыб в его рационе сокращается, но возрастает количество шримсов и креветок, преобладающих в рационе самых крупных особей (51-60 см). По мере роста липариса величина СПР снижается от 3.6 до 1.3%, составляя в среднем 2.5% от массы тела.
Основу рациона чешуйчатого аллолеписа размером 16-40 см формируют нектобен-тосные и планктонные ракообразные - креветки (47.4%), эвфаузииды (18.2%), гиперииды (14.8%) и мизиды (13.1%). По мере роста рыбы переходят с потребления макропланктона и мизид на креветок. Пищевой спектр особей длиной свыше 30 см включает также значительную долю головоногих моллюсков (предположительно кальмаров). С увеличением размеров тела величина СПР аллолеписа снижается с 1 до 0.4% (в среднем 0.4%).
Стреловидный люмпен питается в основном полихетами (80.9%). Второстепенные компоненты его корма представлены гаммаридами (10%) и двустворчатыми моллюсками (4.8%), преимущественно их мягкими тканями. Кроме того, особи длиной 11-15 см в значительном количестве поедают мелких брюхоногих моллюсков, а наиболее крупные рыбы
13
(36-40 см) - кумовых раков. Величина СПР люмпена варьирует от 1.8 до 5% от массы тела, составляя в среднем 2.8%.
В рационе стихея Григорьева размером 21-50 см абсолютно доминируют рыбы (98.3%), главным образом молодь южного одноперого терпуга и стреловидный люмпен. Онтогенетические изменения в питании проявляются в снижении потребления мелких стихеевых и росте потребления терпуга, наваги, рогатковых и других рыб. Величина СПР стихея меняется незначительно (1.7-2%) и в среднем составляет 1.9%.
Полосатая камбала длиной 11-35 см откармливается мелкими бентосными беспозвоночными, в основном двустворчатыми моллюсками (47.8%) и полихетами (33%). Молодь размером 11-15 см предпочитает моллюсков, но по мере роста рыб в рационе возрастает значение червей (полихет и приапулид). Величина СПР полосатой камбалы варьирует от 1.9 до 4.1 % от массы тела, составляя в среднем 2.8%.
Ведущую роль в питании звездчатой камбалы играют эхиуриды (33.7%) и офиуры (19.6%), второстепенную - полихеты (14%), двустворчатые моллюски (11.5%), приапули-ды (7.1%), рыбы (7%) и асцидии (6.5%). Рыбы длиной 21-30 см поедают в основном полихет и мягкие ткани моллюсков, более крупные (31-50 см) переходят на преимущественное потребление эхиурид и офиур. В желудках особей размером свыше 50 см доминируют эхиуриды и моллюски, а также существенно возрастает доля рыб. Величина СПР камбалы находится в пределах 1-2.1% от массы тела (в среднем 1.7%).
Длиннорылая камбала отдает предпочтение полихетам (75.1%). Второстепенное значение имеют амфиподы (17.2%) и мелкие двустворчатые моллюски (5.9%). В рационе молоди размером 11-15 см преобладают амфиподы, более крупные рыбы (16-35 см) питаются в основном червями. Величина СПР длиннорылой камбалы составляет в среднем 1.7% от массы тела, снижаясь по мере ее роста с 3.3 до 1.3%.
Главными компонентами корма японской камбалы являются полихеты (55.8%) и эхиуриды (26.1%), второстепенными - двустворчатые моллюски (8.3%), мелкие декаподы (4.4%) и офиуры (3.7%). Молодь длиной 16-20 см поедает преимущественно полихет и амфипод. В желудках взрослых рыб размером 21-25 см, кроме полихет, значительно возрастает количество двустворок. В рационе особей длиной 26-40 см полихеты постепенно замещаются эхиуридами, а мелкие виды Bivalvia - мягкими тканями крупных форм. Величина СПР японской камбалы варьирует от 1.4 до 4.2% от массы тела (в среднем 3.4%).
В рационе желтополосой камбалы длиной 16-35 см доминируют полихеты (72.5%). Второстепенный корм включает эхиурид (11.9%), декапод (3.4%), двустворчатых моллюсков (4.5%) и офиур (3%). Онтогенетические изменения пищевого спектра желтополосой камбалы, как и японской, проявляются в постепенном сокращении доли полихет вследствие роста потребления более крупных животных - эхиурид, мягких тканей Bivalvia, декапод. Величина СПР рыб меняется незначительно (3.4-4.2%) и в среднем составляет 3.9%.
Остроголовая камбала длиной 16-35 см откармливается в основном эхиуридами (46.1%) и гипериидами (38%), отчасти - двустворчатыми моллюсками (7.5%) и мелкими рыбами (5.2%), преимущественно рогатковыми. При длине около 20 см камбала переходит с потребления макропланктона на эхиурид, моллюсков и рыб. В пище особей крупнее 30
14
см доминирует эхиуриды. Средняя величина СПР остроголовой камбалы составляет 3.3% от массы тела, варьируя в пределах 1.9-6.1%.
Основу питания желтоперой камбалы составляют черви - эхиуриды (40.1%) и полихеты (38.2%). Из других животных наиболее значительна доля декапод (5.8%), офиур (4.3%) и асцидий (4.4%), а у отдельных размерных групп - двустворчатых моллюсков и молоди рыб. Молодь камбалы длиной 16-20 см поедает преимущественно полихет, в желудках взрослых рыб размером 21-30 см полихеты и эхиуриды имеют практически равное значение, а особи длиной свыше 30 см предпочитают эхиурид. По мере роста камбалы в составе ее второстепенного корма также происходит замещение мелких животных на более крупных: офиуры и мальки рыб постепенно вытесняются раками-отшельниками, асци-диями и мягкими тканями моллюсков. Величина СПР желтоперой камбалы варьирует от 1.8 до 5.4% от массы тела (в среднем 2.6%).
Малоротая камбала формирует свой рацион за счет полихет (64.5%) и гаммарид (31.4%), доминирование которых наблюдается в пище всех исследованных размерных групп рыб. Величина СПР малоротой камбалы снижается с 5.3% у молоди длиной 11-15 см до 1.6% у взрослых особей свыше 35 см и в среднем составляет 2.5% от массы тела.
Главными компонентами корма южной палтусовидной камбалы являются мизиды (28.4%) и рыбы (28.9%), второстепенными - эхиуриды (16.3%), эвфаузииды (14.5%) и полихеты (6.9%). Особи длиной 11-25 см питаются мизидами и отчасти молодью рыб (в основном стихеевых). В рационе камбал размером 26-30 см возрастает значение полихет, эхиурид и рыб (главным образом анчоуса). Особи крупнее 30 см откармливается преимущественно рыбами (стреловидным люмпеном, японским волосозубом Arctoscopusjaponi-cusи др.), а также эвфаузиидами и эхиуридами. Величина СПР камбалы варьирует в пределах 1.4-3.2% от массы тела (в среднем 2.2%).
Ведущая роль в питании колючей камбалы принадлежит полихетам (29.9%) и эвфау-зиидам (26.8%), второстепенная - гипериидам (16%), гаммаридам (3,9%), мизидам (7.6%) и молоди рыб (6.2%). Мелкоразмерные особи (11-15 см) поедают преимущественно полихет, мизид и гаммарид. С ростом камбалы потребление ею бентоса и нектобентоса сокращается и при длине тела свыше 20 см в желудках рыб начинает доминировать макропланктон. В рационе особей размером 21-30 см доля эвфаузиид несколько превышает таковую гипери-ид, но самые крупные камбалы (31-35 см) поедают в основном последних. СПР рыб составляет в среднем 1.5% от массы тела, варьируя в пределах 0.9-1.8 %.
Глава 4. Трофические связи демерсальных рыб зал. Петра Великого
4.1. Трофическая структура ихтиоценов и количественная оценка выедания рыбами
различных гидробионтов
Одним из подходов при изучении структурных особенностей многовидовых сообществ является концепция гильдий - групп видов, использующих однотипные ресурсы функционально сходным образом и характеризующихся наиболее интенсивными межвидовыми взаимодействиями (Цжиллер, 1988). Результаты наших исследований показали,
15
что рассматриваемые виды рыб зал. Петра Великого образуют 3 основные трофические гильдии - бентофагов, эврифагов и хищников (рис. 2).
Гильдия бентофагов представлена типично донными рыбами и включает 2 группы: червеедов (нитчатый шлемоносец, стреловидный люмпен, длиннорылая, японская, желто-полосая, желтоперая и малоротая камбалы) и бентофагов-полифагов (двурогий бычок, полосатая и зведчатая камбалы). К этой же гильдии на меньшем уровне сходства примыкает мелкочешуйная красноперка, питающаяся различными донными беспозвоночными и отчасти детритом. По своему трофическому статусу подавляющее большинство бентофагов являются консументами II порядка, а двурогий бычок - консументом П-Ш порядка (табл. 2).
Рис. 2. Дендрограмма сходства группового состава пищи демерсальных рыб зал. Петра Великого в летний период: 1 - бентофаги, 2 - эврифаги, 3 - хищники
В гильдию с условным названием лэврифаги входят 9 донных и придонно-пелагических видов (сельдь, минтай, южный одноперый терпуг, широколобый шлемоносец, колючий ицел, аллолепис, остроголовая, южная палтусовидная и колючая камбалы) с самыми разнообразными пищевыми спектрами, но объединяет их присутствие в значительном количестве в рационе зоопланктона. Среди эврифагов к консументам III порядка относится только аллолепис, остальные виды - консументы П-Ш порядка.
Гильдию хищников образуют 12 донных и придонных видов, которые подразделяется на облигатных (бычок-ворон и стихей Григорьева) и факультативных ихтиофагов (щитоносный скат, треска, навага, пятнистый терпуг, красный бычок, дальневосточный шлемоносец, снежный и многоиглый керчаки, керчак-яок и охотский липарис). Навага и снежный керчак являются консументами П-Ш порядка, треска, многоиглый керчак и облигат-
16
ные ихтиофаги - консументами III-IV порядка, остальные виды - консументами III порядка.
Таблица 2
Трофический уровень (ТУ) исследованных видов рыб зал. Петра Великого
Вид |
ТУ |
Вид |
ТУ |
Щитоносный скат |
4.37 |
Многоиглый керчак |
4.58 |
Тихоокеанская сельдь |
3.56 |
Бычок-ворон |
4.52 |
Мелкочешуйная красноперка |
3.35 |
Охотский липарис |
4.32 |
Дальневосточная навага |
3.94 |
Чешуйчатый аллолепис |
4.0 |
Тихоокеанская треска |
4.51 |
Стреловидный люмпен |
3.43 |
Минтай |
3.58 |
Стихей Григорьева |
4.54 |
Пятнистый терпуг |
4.12 |
Полосатая камбала |
3.14 |
Южный одноперый терпуг |
3.69 |
Звездчатая камбала |
3.21 |
Красный бычок |
4.37 |
Длиннорылая камбала |
3.34 |
Двурогий бычок |
3.61 |
Японская камбала |
3.32 |
Нитчатый шлемоносец |
3.37 |
Желтополосая камбала |
3.34 |
Дальневосточный шлемоносец |
4.03 |
Остроголовая камбала |
3.59 |
Широколобый шлемоносец |
3.88 |
Желтоперая камбала |
3.41 |
Колючий ицел |
3.84 |
Малоротая камбала |
3.38 |
Снежный керчак |
3.86 |
Южная палтусовидная камбала |
3.7 |
Керчак-яок |
4.25 |
Колючая камбала |
3.58 |
В целом трофический уровень исследованных рыб варьирует от 3.14 до 4.58. По числу видов среди потребителей преобладают консументы П-Ш порядка (34.4%).
Максимальные средние величины СПР наблюдаются у пятнистого терпуга (7.2%), наваги (5.3%), сельди (4.5%) и южного одноперого терпуга (4.3%). Минимальные СПР характерны для глубоководных рыб - ската (0.9%) и аллолеписа (0.4%). Пониженная интенсивность питания наблюдается у колючей (1.5%) и длиннорылой камбал (1.7%) в связи с нерестом, а также у звездчатой камбалы (1.7%) и двурогого бычка (1%). Средние величины рационов остальных видов варьируют в пределах 2-4%.
На внутреннем шельфе залива биомасса исследованных рыб, по среднемноголетним оценкам, составляет 35.9 тыс. т и почти половина ее (45%) приходится на хищников. Наибольшая интенсивность питания в этом биотопе наблюдается у эврифагов (общий СПР 5.1%), далее в порядке убывания рациона следуют хищники (4.6%) и бентофаги (3.1%). Основные трофические связи бентофагов замыкаются на полихет, второстепенные - на эхиурид, двустворчатых моллюсков и некоторых других беспозвоночных. В рационе эврифагов наиболее значительную роль играют эхиуриды, гиперииды, рыбы и мизиды. Пищевые потребности хищников удовлетворяются в основном за счет рыб и декапод (преимущественно креветок и шримсов).
На внешнем шельфе биомасса хищников и бентофагов сокращается в 2-2.2 раза, а эврифагов возрастает в 1.9 раза, в результате чего общая ихтиомасса несколько уменьшается (до 30.3 тыс. т). Суммарные суточные рационы всех трофических гильдий также снижаются до уровня 2.2-2.9%. Общей закономерностью в элиторали является ослабление трофических связей рыб с эхиуридами, особенно заметное у эврифагов и бентофагов, и усиление связей с декаподами (в основном с крабом-стригуном), наиболее значительное у
17
хищников. Одновременно с этим, в питании бентофагов возрастает роль полихет и гамма-рид, а у эврифагов - мизид и макропланктона (в основном гипериид и эвфаузиид). Потребление рыб хищниками существенно не меняется, но у эврифагов доля этого корма сокращается на порядок.
В верхнем отделе материкового склона залива среди 7 исследованных нами видов бентофагов не обнаружено. Биомасса рыб здесь очень незначительна (1.9 тыс. т), при этом большую ее часть (76.6%) формируют эврифаги. Кормовая активность рыб в мезобентали минимальна: величина СПР эврифагов составляет 2%, хищников - 1.4%. В рационе эврифагов значение макропланктона и декапод (креветок) по сравнению с шельфом еще больше возрастает, а мизид и рыб снижается. В пище хищников доля декапод остается на прежнем уровне, но почти в 2 раза сокращается доля рыб и на порядок увеличивается доля головоногих моллюсков.
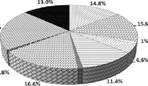
Наиболее интенсивный нагул рыб в летний период происходит в сублиторальной зоне зал. Петра Великого. По нашим оценкам, за 3 месяца здесь выедается около 140.8 тыс. т различных гидробионтов, из которых 40.4% приходится на бентос, 27% - на нектобентос, 21.3% - на рыб и 10.5% - на планктон (рис. 3).
Рис.а 3.а Соотношение компо-
140 8 ты с таа нентова ва общема объемеа сезонного
|
потребления корма демерсальными рыбами в сублиторали (а), элиторали (б) и мезобентали (в) в зал. Петра Великого в летний период
(а)
76,9 тыс. т |
СЗПолихеты ЕЗЭхиуриды ? Копегюды г.а% ПГм пери ИДЫ ПМизиды ОЭефаузииды НДекаподы Я Головоногие моллюски 0 Рыбы ж Прочие |
9,0% 1D.Z&, |
(б) |
.9-; |
3,2 тыс. т |
|
(в) |
![]() На внешнем шельфе объем сезонного потребления корма почти в 2 раза ниже - 76.9 тыс. т. В питании рыб этого биотопа ведущую роль приобретают нектобен-тосные беспозвоночные (40.5%) и планктон (27.8%), а бентос (18.4%) и рыбы (13.3%) отходят на второй план. В верхней части материкового склона выедание невелико - 3.2 тыс. т. В суммарном рационе рыб мезобентали примерно в равных пропорциях доминируют нектобентосные и планктонные животные (соответственно 43.2 и 47.9%); донные формы и рыбы составляют всего 3.9% и 5% соответственно.
На внешнем шельфе объем сезонного потребления корма почти в 2 раза ниже - 76.9 тыс. т. В питании рыб этого биотопа ведущую роль приобретают нектобен-тосные беспозвоночные (40.5%) и планктон (27.8%), а бентос (18.4%) и рыбы (13.3%) отходят на второй план. В верхней части материкового склона выедание невелико - 3.2 тыс. т. В суммарном рационе рыб мезобентали примерно в равных пропорциях доминируют нектобентосные и планктонные животные (соответственно 43.2 и 47.9%); донные формы и рыбы составляют всего 3.9% и 5% соответственно.
18
Выявленные особенности батиметрического распределения биомассы трофических гильдий рыб и структуры потребления ими различных экологических групп организмов вполне закономерны и находятся в соответствии с кормовой базой. Наиболее продуктивным и богатым кормовым бентосом районом залива является внутренний шельф (Надто-чий и др., 2005; Дулепова и др., 2008). В число доминирующих групп донных беспозвоночных входят полихеты и эхиуриды, что способствует широкому распространению чер-веедения среди бентофагов и ряда представителей других трофических гильдий нектона. Здесь же в летний период происходит нагул основной массы рыб, в том числе их молоди (Вдовин, Зуенко, 1997; Измятинский, 2001) - одной из главных составляющих рациона хищников. С глубиной плотность концентраций кормового бентоса в заливе снижается на порядок (Дерюгин, Сомова, 1941), а рыб - в 3 раза (Соломатов, Калчугин, 2012), поэтому в элиторали и мезобентали основные пищевые потребности рыб удовлетворяются за счет нектобентоса и макропланктона, доля которого максимальна в открытых водах над материковым склоном (Долганова, 2010).
Несмотря на значительное снижение с глубиной количества рыб в суммарном рационе потребителей, уровень хищничества в сообществе возрастает (табл. 3). Во всех батиметрических зонах доминируют консументы П-Ш порядка (хищники I-II порядка), однако по мере перехода от сублиторального биотопа к мезобентальному их доля в общей биомассе исследованных видов, как и доля консументов III и III-IV порядков (хищников II и П-Ш порядков), постепенно увеличивается. С одной стороны, это обусловлено сокращением биомассы потребителей более низкого уровня (бентофагов), с другой - замещением рыбной части рациона хищников и эврифагов жертвами не меньшего трофического статуса (крабами, креветками, головоногими моллюсками, хищными планктерами).
Таблица 3
Соотношение (%) биомассы рыб разного трофического статуса и средний трофический уровень (ТУ) их пищи в различных батиметрических зонах зал. Петра Великого в летний период
Порядок консумента |
Сублитораль |
Элитораль |
Мезобенталь |
В среднем |
II П-Ш III III-IV |
29.9 53.9 15.8 0.4 |
13.6 63.3 2.7 20.4 |
65.8 27.4 6.8 |
20.4 58.5 14.2 7.0 |
ТУ пищи |
2.75 |
2.85 |
2.91 |
2.79 |
За три летних месяца исследованные рыбы зал. Петра Великого выедают 220.9 тыс. т кормовых организмов, большая часть которых представлена бентосными и нектобентос-ными беспозвоночными (по 32%), меньшая - рыбами (18.3%) и зоопланктоном (17%). Основной вклад в летний рацион рыб залива вносят животные второго и третьего трофических уровней (соответственно 46.3 и 31.6%).
К самым потребляемым группам бентоса относятся полихеты (13%) и эхиуриды (10.9%), нектобентоса - декаподы (17.5%) и мизиды (14.4%), планктона - гиперииды (7.7%). Промысловые виды составляют 12.3% от общего количества корма, из них краб-
19
стригун - 5.3%, навага - 2.1% и камбалы - 2%. Главными и почти равнозначными потребителями гидробионтов в заливе являются два наиболее массовых вида - южный одноперый терпуг и навага, на долю которых приходится 42.5% суммарного рациона демерсальных рыб. Из других видов рыб наиболее существенную роль в выедании беспозвоночных и рыб играют керчак-яок (9.6%) и минтай (8.2%).
4.2. Конкурентные отношения
Сложность трофических отношений в морских экосистемах и их слабая изученность не позволяют в настоящее время достаточно объективно оценивать реальную степень конкуренции между различными видами нектона (Чучукало, 2006). Эта задача затрудняется и несовершенством количественного учета кормовой базы гидробионтов, данные о которой часто недостоверны или вообще отсутствуют. Поэтому для исследования пищевых противоречий рыб в естественных условиях широко применяются косвенные методы, к которым относится и выбранный нами модифицированный метод К.В. Мартино - М.С. Карапетковой (Чучукало, 2002). Данный способ, как и любой другой, не лишен недостатков, однако с его помощью можно установить степень конкурентного взаимовлияния видов, которая из-за разности их биомасс проявляется неравнозначно.
В настоящей работе анализ конкурентных отношений рыб выполнен с учетом онтогенетической изменчивости их питания. Предварительно были вычислены значения одного из параметров уравнения К.В. Мартино - М.С. Карапетковой - индекса сходства пищи (или объема конкуренции) А.А. Шорыгина (1952), позволяющего вьгавить круг потенциальных конкурентов. Как видно из данных табл. 4, во всех батиметрических зонах зал. Петра Великого соотношение различных уровней этого показателя примерно одинаково. В большинстве случаев пищевые спектры потребителей полностью расходятся (46%) или незначительно перекрываются (47.6%). Средний и высокий уровни сходства отмечаются редко (соответственно в 5.8% и в 0.6% случаев).
Таблица 4 Соотношение (%) различных уровней сходства пищи (объема конкуренции) между демер-сальными рыбами зал. Петра Великого в летний период
Уровень сходства |
Сублитораль |
Элитораль |
Мезобенталь |
Сходство отсутствует Низкий (до 33%) Средний (34-66%) Высокий (более 66%) |
50.1 43 6.4 0.5 |
40.7 54.1 4.7 0.5 |
43.9 46.2 7.1 2.8 |
Число сравниваемых пар |
4656 |
3403 |
465 |
В сублиторали залива высокий уровень внутри- и межвидового перекрывания пищевых спектров чаще всего наблюдается среди рыб, в рационе которых доминируют эхиури-ды (остроголовой и желтоперой камбал крупнее 25 см, палтусовидной размером 31-35 см, японской более 30 и звездчатой более 50 см, керчака-яока длиной 21-40 см), реже - среди потребителей полихет (длиннорылой камбалы размером 21-30 см и желтополосой 21-30 см), двустворчатых моллюсков (полосатой камбалы длиной 11-25 см) и молоди рыб (бычка-ворона размером 11-20 см и стихея 21-30 см).
20
В элиторальной зоне наиболее вероятными конкурентами могут быть эврифаги, предпочитающие мизид и макропланктон (сельдь длиной 26-30 см, минтай 21-60 см и пал-тусовидная камбала 11-15 см, широколобый шлемоносец длиной 26-35 см и южный одноперый терпуг 21-30 см, ицел 6-15 см, палтусовидная камбала 16-25 см), а также хищники -потребители краба-стригуна (красный бычок размером 31-40 см, керчак-яок крупнее 30 см и многоиглый керчак длиной 31-40 и более 60 см) и мелких рыб (липарис размером 11-30 см и стихей 21-30 и 41-50 см). Среди бентофагов высокая степень сходства пищи в этом биотопе наблюдается у малоротой камбалы смежных размерных групп (26-30 и 31-35 см).
В мезобентали высокий уровень объема конкуренции характерен для рыб, поедающих в основном макропланктон (аллолеписа длиной 16-25 см и колючей камбалы 21-30 см), макропланктон и мизид (минтая размером 11-30 см и ицела 11-20 см), северную креветку (трески длиной 41-50 см, минтая 51-60 см, ицела 26-30 см и липариса 51-60 см) и ко-зырькового шримса Argislarlar(ската размером 41-60 см и трески 31-40 см).
Расчет степени пищевой конкуренции между всеми исследованными размерными группами рыб показал, что в подавляющем большинстве случаев она отсутствует (72%) или находится на низком уровне (27.9%) (табл. 5). Средняя и высокая степень конкуренции отмечаются очень редко (соответственно в 0.09 и 0.01% случаев) и только на шельфе.
В сублиторальной зоне конкурентное давление средней силы навага длиной 16-30 см оказывает на молодь пятнистого терпуга и красного бычка размером 11-20 см. С такой же силой навага длиной 21-25 см влияет на минтая длиной свыше 60 см и пятнистого терпуга размером 31-40 см, а южный одноперый терпуг и керчак-яок длиной 31-40 см - на желтоперую камбалу сходных размеров.
Таблица 5 Соотношение (%) различных уровней пищевой конкуренции между демерсальными рыбами зал. Петра Великого в летний период
Уровень конкуренции |
Сублитораль |
Элитораль |
Мезобенталь |
Конкуренция отсутствует Низкий (менее 1000 ед.) Средний (1000-5000 ед.) Высокий (более 5000 ед.) |
72.2 27.7 0.1 |
71.2 28.7 0.09 0.01 |
76.1 23.9 |
Число сравниваемых пар |
9312 |
6806 |
930 |
В элиторали залива только самый малочисленный колючий ицел длиной 6-10 см испытывает значительное конкурентное давление со стороны других рыб, в том числе и более крупных особей своего вида. Со средней силой на него воздействуют минтай размером 11-30 и 41-50 м, южный одноперый терпуг длиной 31-40 см, палтусовидная камбала длиной более 35 см и ицел длиной 16-20 см, с высокой силой - минтай длиной 31-40 см. Обращает на себя внимание тот факт, что высокой степени сходства пищи между указанными выше конкурентами не обнаружено. Главными причинами, определяющими их напряженные пищевые отношения, являются соотношение биомасс и величина рациона, которая у некоторых размерных групп рыб весьма высока.
Известно, что конкуренция остается важным фактором, даже если она не происходит постоянно. Избегание конкуренции само по себе означает, что она имела место в про-
21
шлом и под ее влиянием виды приспособились к сосуществованию (Пианка, 1981). Результатом такой коадаптации и является, по-видимому, отсутствие значительной внутри- и межвидовой конкуренции у подавляющего большинства рассматриваемых нами рыб.
В целом же результаты проведенных исследований конкурентных отношений в де-мерсальных ихтиоценах зал. Петра Великого согласуются с современными представлениями (Чучукало, 2006), согласно которым в сообществах донных и придонных рыб дальневосточных морей сильная пищевая конкуренция в нагульный период встречается довольно редко и не может вызвать катастрофических последствий в силу пластичности питания этих рыб, небольшой степени перекрывания их экологических ниш и стабильных (в многолетнем плане) кормовых условий.
Выводы
- По характеру питания в летний период из 32 исследованных видов рыб зал. Петра Великого 11 относятся к бентофагам, 9 - к эврифагам и 12 - к хищникам. Трофический уровень рыб варьирует от 3.14 до 4.58. Как по числу видов (34.4%), так и по биомассе (58.5%) среди потребителей преобладают консументы П-Ш порядка.
- Максимальные средние величины суточного рациона в летний период наблюдаются у пятнистого терпуга (7.2%), наваги (5.3%), сельди (4.5%) и южного одноперого терпуга (4.3%), минимальные - у глубоководных рыб - щитоносного ската (0.9%) и чешуйчатого аллолеписа (0.4%). Средние рационы большинства остальных видов находятся в пределах 2-4% от массы тела.
- Наиболее интенсивный нагул рыб происходит на внутреннем шельфе залива (на глубинах менее 50 м). По мере перехода от сублиторального биотопа к мезобентальному наблюдается снижение интенсивности питания рыб всех трофических гильдий, ослабление их связей с нектоном и бентосом и усиление связей с нектобентосом и макропланктоном, что находится в соответствии со структурой кормовой базы.
- С глубиной уровень хищничества в демерсальных ихтиоценах возрастает, что обусловлено сокращением биомассы потребителей более низкого уровня (бентофагов) и замещением рыбной части рациона хищников и эврифагов жертвами не меньшего трофического статуса (крабами, креветками, головоногими моллюсками, хищными планктера-ми).
- За три летних месяца исследованные рыбы зал. Петра Великого выедают 220.9 тыс. т различных кормовых организмов, из них по 32% приходится на бентосных и некто-бентосных беспозвоночных, 18.3% - на рыб и 17% - на зоопланктон. Промысловые виды гидробионтов составляют 12.3% общего количества пищи и представлены в основном крабом-стригуном (5.3%), навагой (2.1%) и камбалами (2%). Основной вклад в формирование летнего рациона рыб вносят животные второго и третьего трофических уровней (соответственно 46.3 и 31.6%).
- Главными и почти равнозначными потребителями в заливе являются два самых массовых вида - южный одноперый терпуг и навага, на долю которых приходится 42.5%
22
суммарного рациона демерсальных рыб. Из других видов рыб наиболее существенную роль в выедании гидробионтов играют керчак-яок (9.6%) и минтай (8.2%).
7. В подавляющем большинстве случаев внутри- и межвидовая пищевая конкуренция среди рассматриваемых рыб отсутствует (72%) или находится на низком уровне (27.9%). Средняя и высокая степень конкуренции отмечаются очень редко и связаны, главным образом, с фактором плотности потребителей.
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ Работы, опубликованные в рецензируемых ведущих научных журналах:
- Пущина О.И. Питание и суточные рационы трех видов камбал залива Петра Великого (Японское море) в летний период // Изв. ТИНРО. - 1998. - Т. 123. - С. 185-190.
- Пущина О.И. Особенности питания южного одноперого терпуга Pleurogrammusazonusв водах Приморья // Изв. ТИНРО. - 2000. - Т. 127. - С. 203-208.
- Антоненко Д.В., Пущина О.И. Основные черты биологии терпуговых рыб рода Hexagrammosв зал. Петра Великого (Японское море) // Изв. ТИНРО. - 2002. - Т. 131. - С. 164-178.
- Пущина О.И., Панченко В.В. Питание дальневосточного Myoxocephalusstelleriи снежного М. brandtiкерчаков (Cottidae) в прибрежье Амурского залива Японского моря // Вопр. ихтиологии. - 2002. - Т 42, № 4. - С. 536-542.
- Панченко В.В., Пущина О.И. Биологическая характеристика керчаковых рыб рода Myoxocephalus(Cottidae) зал. Петра Великого Японского моря // Изв. ТИНРО. - 2004. -Т. 138.-С. 120-153.
- Антоненко Д.В., Пущина О.И., Калчугин П.В. Чешуйчатый аллолепис Bothrocarahollandi(Zoarcidae) в водах Приморья (Японское море) // Вопр. ихтиологии. - 2005. - Т. 45, №1.-С. 81-85.
- Пущина О.И. Питание и пищевые взаимоотношения массовых видов донных рыб в водах Приморья в весенний период // Изв. ТИНРО. - 2005. - Т. 142. - С. 246-269.
- Калчугин П.В., Пущина О.И., Панченко В.В., Соломатов С.Ф. Распределение и некоторые черты биологии стихея Григорьева Stichaeusgrigorjewi(Stichaeidae) в водах северного Приморья // Вопр. ихтиологии. - 2006. - Т. 46, № 4. - С. 512-518.
- Антоненко Д.В., Пущина О.И., Соломатов С.Ф. Распределение и некоторые черты биологии щитоносного ската Bathyrajaparmifera(Rajidae, Rajiformes) в северо-западной части Японского моря//Вопр. ихтиологии. -2007. -Т. 47, № 3. -С. 311-319.
- Антоненко Д.В., Пущина О.И., Соломатов С.Ф., Калчугин П.В. Распределение и некоторые черты биологии бычка-ворона Hemitripterusvillosus(Pallas, 1814) (Hemitripteri-dae) в северо-западной части Японского моря // Вопр. ихтиологии. - 2010. - Т. 50, № 5. - С. 665-674.
- Панченко В.В., Пущина О.И., Антоненко Д.В. и др. Распределение и некоторые черты биологии красного бычка Alcichthyselongatusв северо-западной части Японского моря // Вопр. ихтиологии. - 2011. - Т. 51, № 2. - С. 195-204.
23
- Вдовин А.Н., Пущина О.И., Соломатов С.Ф. Возможность корректировки оценок запасов рыб с учетом данных трофологических исследований // Вопр. рыболовства. -2011.-Т. 12, №4 (48).-С. 813-821.
- Черноиванова Л.А., Соломатов С.Ф., Пущина О.И. и др. Особенности распределения и питания дальневосточной наваги Eleginusgracilis(Tilesius, 1810) в зал. Петра Великого (Японское море) в летний период // Вопр. рыболовства. - 2011. - Т. 12, № 4 (48). -С. 678-689.
Работы, опубликованные в сборниках региональных и международных научно-практических конференций:
- Пущина О.И. Питание камбал залива Петра Великого (Японское море) в летний период // Рыбохозяйственные исследования океана. Материалы юбилейной научной конференции. - Владивосток : Дальрыбвтуз, 1996. - С. 121-122.
- Pushchina O.I. The size composition of daily ration of the atca mackerel Pleuro-grammus azonus in Primorye coastal waters (Japan sea) // Ninth. Ann. Meet. PICES. - Hakodate, 2000. - P. 120.
- Пущина О.И., Антоненко Д.В. Питание раздельноперых терпугов рода Неха-grammosв Амурском заливе (Японское море) // Биологические основы устойчивого развития прибрежных морских экосистем. Тез. докл. международной конференции. - Мурманск: ММБИ РАН, 2001. - С. 194-196.
- Пущина О.И., Панченко В.В. Питание керчака-яока Myoxocephalusjaokв заливе Петра Великого (Японское море) в осенний период // Биологические основы устойчивого развития прибрежных морских экосистем. Тез. докл. международной конференции. -Мурманск : ММБИ РАН, 2001. - С. 196-197.
- Пущина О.И., Калчугин П.В., Соломатов С.Ф. Питание тихоокеанской трески Gadusmacrocephalusв северо-западной части Японского моря в весенне-летний период // Морские прибрежные экосистемы. Водоросли, беспозвоночные и продукты их переработки. Тез. докл. Третьей Международной научно-практической конференции. - Владивосток: ТИНРО-Центр, 2008. - С. 127-128.
- Пущина О.И., Соломатов С.Ф. Трофические связи хищных рыб зал. Петра Великого в летний период // Актуальные проблемы освоения биологических ресурсов Мирового океана. Материалы Международной научно-технической конференции. Владивосток: Дальрыбвтуз, 2010. Ч. 1. С. 91-95.
Уч.-изд. л. 1,0аа Формат 60x84/16
Тираж 100 экз. Заказ № 16.
Отпечатано в типографии издательского центра ФГУП ТИНРО-Центр, г. Владивосток, ул. Западная, 10
24
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]