 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Характеристика химического и антигенного составов гликополимеров поверхности бактерий Herbaspirillum seropedicae Z78 и Herbaspirillum lusitanum P6-12
Автореферат кандидатской диссертации
На правах рукописи
Величко Наталья Сергеевна
ХАРАКТЕРИСТИКА ХИМИЧЕСКОГО И АНТИГЕННОГО СОСТАВОВ ГЛИКОПОЛИМЕРОВ ПОВЕРХНОСТИ БАКТЕРИЙ
HERBASPIRILLUM SEROPEDICAE Z78 И HERBASPIRILLUM LUSITANUM P6-12
03.01.04 - биохимия
03.02.03 - микробиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Саратов - 2012
Работа выполнена в Федеральном государственном бюджетном учреждении науки Институте биохимии и физиологии растений и микроорганизмов Российской академии наук (ИБФРМ РАН)
Научные руководители: |
доктор биологических наук, профессор Игнатов Владимир Владимирович Федеральное государственное бюджетное учреждение науки Институт биохимии и физиологии растений и микроорганизмов Российской академии наук |
|
кандидат биологических наук Смолькина Ольга Николаевна Научно-производственная фирма Винар, г. Москва |
|
|
Официальные оппоненты: |
доктор биологических наук Соколов Олег Игоревич Федеральное государственное бюджетное учреждение науки Институт биохимии и физиологии растений и микроорганизмов Российской академии наук |
|
доктор биологических наук, профессор Щербаков Анатолий Анисимович Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования Саратовский государственный аграрный университет имени Н.И. Вавилова |
|
|
Ведущая организация: |
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования Московский государственный университет имени М.В. Ломоносова |
|
|
Защита диссертации состоится л июня 2012 г. ваа ч. на заседании диссертационного совета Д 002.146.01 при Институте биохимии и физиологии растений и микроорганизмов РАН (410049, г. Саратов, просп. Энтузиастов 13).
Автореферат диссертации размещен на официальном сайте Минобрнауки РФ и на сайте ИБФРМ РАН:
С диссертацией можно ознакомиться в научной библиотеке ИБФРМ РАН.
Автореферат разослан лаа мая 2012 г.
Ученый секретарь диссертационного совета,
доктор биологических наук, профессора В.Е. Никитина
Актуальность темы. Для большинства растений характерны симбиозы с микроорганизмами (эндофитными и ризосферными), фиксирующими азот или оптимизирующими получение других необходимых веществ из почвы. Исследования особенностей таких взаимодействий являются основой отдельного направления в прикладной микробиологии. Перспективным модельным объектом для изучения эндофитной растительно-микробной ассоциации являются бактерии рода Herbaspirillum, благодаря потенциально высокой азотфиксирующей активности, способности продуцировать фитогормоны и иные физиологически активные вещества (Baldani etal., 1986; Bastia etal., 1998; Lambrecht etal., 2000; Souza etal., 2000; Pedrosaetal., 2001; Ongenaetal., 2007). Об интересе к исследованию гербаспирилл свидетельствует выполненное секвенирование нуклеотидных последовательностей генома бактерий H. seropedicae Z78 (Pedrosa and Genopar, 2005).
В прикреплении бактерий к корням, проникновении и распространении по макроорганизму участвуют как неспецифическая сорбция, так и специфические взаимодействия, которые на разных этапах опосредуются поверхностно локализованными белками и полисахаридами (ПС) (Michiels et al., 1991; Baldani et al., 1993; Mora and Newton, 2008). Уже сложилось представление о важной роли гликополимеров поверхности в обеспечении выживания бактерий в почве и взаимодействии их с растением (Dell Gallo and Haegi, 1990; Gulati et al., 2011). Анализ строения и функций различных структурных элементов клеточной поверхности эндофитных ассоциативных бактерий является ключевым направлением в изучении молекулярных механизмов формирования симбиотических отношений. В литературе отсутствуют данные, касающиеся исследований состава и функций экстраклеточных и капсульных гликополимеров гербаспирилл. Фрагментарно представлены сведения об исследовании липополисахаридов (ЛПС) - главного компонента внешней мембраны грамотрицательных бактерий. ЛПС, специфичность которых в контактных взаимодействиях определяют полисахаридные составляющие, играют важную роль в создании внутривидовых классификационных схем грамотрицательных бактерий (Caroff and Karibian, 2003). Известны результаты иммунохимических исследований ассоциативных азотфиксаторов, фитопатогенных бактерий (Варбанец, 1994; Pier, 2003; Коннова с соавт., 2009), в то время как аналогичные аспекты изучения эндофитных диазотрофов, за исключением представителей рода Rhizobium, находятся на периферии исследовательских интересов. Изучение структурных особенностей и антигенного состава индивидуальных препаратов гликополимеров гербаспириллявляется актуальным как для таксономических исследований, так и для понимания механизмов индукции и развития их биологического действия при формировании эндофитного симбиоза с растениями.
В связи с этим, целью работы было выявление особенностей структуры и антигенного состава гликополимеров поверхности бактерий H. seropedicae Z78и H. lusitanum P6-12.
Для реализации цели в ходе исследования решали следующие задачи:
1) выделение полисахаридов из культуральной жидкости, капсулы и внешней мембраны
H. seropedicae Z78 и H. lusitanum P6-12;
2) анализ химического состава углеводсодержащих биополимеров H. seropedicae Z78 и
H. lusitanum P6-12;
3) исследование антигенного состава полисахаридов гербаспирилл с применением кроличьих антител и фаговых мини-антител к препаратам экстраклеточных, капсульных и мембранных гликополимеровH. seropedicae Z78;
4) выделение О-специфических полисахаридов (ОПС) из липополисахаридов и определение структуры повторяющегося звена ОПСH. seropedicae Z78.
Научная новизна полученных результатов заключается в следующем:
- Получены приоритетные данные о составе экстраклеточных, капсульных гликополимеров и О-антигенов H. seropedicae Z78 и H. lusitanum P6-12.
- Впервые для типового штамма H. seropedicae Z78 установлен состав повторяющихся звеньев О-специфической части липополисахарида внешней мембраны, имеющих нетипичные для грамотрицательных бактерий составляющие - N-ацетил-d-глюкозамин и неуглеводный заместитель - глицерин. Необходимо отметить, что подобные компоненты часто встречаются в структуре тейхоевых кислот грамположительных (Наумова с соавт., 1987; Varbanetsetal., 1990; Cтрешинская с соавт., 1998) бактерий и крайне редко обнаруживаются у грамотрицательных представителей.
- С применением поликлональных кроличьих и фаговых мини-антител впервые получены сведения об антигенных свойствах гликополимеровH. seropedicae Z78 и
H. lusitanum P6-12.
Научно-практическая значимость. Данные о составе и структуре мембранных, экстраклеточных и капсульных гликополимеров Herbaspirillumнеобходимы для понимания механизмов индукции и развития их биологического действия при формировании симбиоза с растениями. Они также могут служить основой внутривидовых классификационных схем этих бактерий.
Препараты полисахаридов Herbaspirillum, а также фаговые мини-антитела к ним применяются при проведении плановых НИР сотрудниками лаборатории биохимии и иммунохимии ИБФРМ РАН. Полученные антитела планируется использовать для дальнейшего серологического анализа коллекционных культурHerbaspirillum, а также вновь изолированных из природной среды микроорганизмов.
Результаты диссертационной работы использованы при подготовке курсовых и дипломных работ студентами биологического факультета СГУ.
Апробация работы. Материалы исследований, изложенные в диссертации, были представлены на 4-ой Международной конференции молодых ученых Биология - от молекулы до биосферы (Харьков, Украина, 2009); на Всероссийском с международным участием симпозиуме Современные проблемы физиологии, экологии и биотехнологии микроорганизмов (Москва, Россия, 2009); на 5-ой Межрегиональной конференции молодых ученых Стратегия взаимодействия микроорганизмов и растений с окружающей средой (Саратов, Россия, 2010); на 1-ой Общероссийской электронной научной конференции Актуальные вопросы современной науки и образования (Красноярск, Россия, 2010); на 14-ой международной Пущинской школе-конференции молодых ученых Биология - Наука XXI века (Пущино, Россия, 2010); на Международной научной студенческой конференции Студент и научно-технический прогресс (Новосибирск, Россия, 2010); на 3-ем и 4-ом Всероссийских с международным участием конгрессах студентов и аспирантов-биологов Симбиоз-Россия 2010, 2011 (Нижний Новгород, Воронеж, Россия, 2010, 2011); на 5-ой школе-симпозиуме Адаптация к климатическим изменениям в регионе Балтийского моря: вклад биотехнологии растений и микроорганизмов (Миккели, Финляндия, 2010); на 4-ой Всероссийской школе-конференции Химия и биохимия углеводов (Саратов, Россия, 2011); на 1-ой Всероссийской с международным участием школе-конференции молодых ученых Современные проблемы микробиологии, иммунологии и биотехнологии (Пермь, Россия, 2011); на 24-ой зимней молодежной научной школе Перспективные направления физико-химической биотехнологии (Москва, Россия, 2012).
Доклад Химическая и иммунохимическая характеристика мембранных, капсульных и экстраклеточных гликополимеров Herbaspirillumseropedicae Z78, представленный на 3-ем Всероссийском с международным участием конгрессе студентов и аспирантов-биологов Симбиоз-Россия 2010 (Нижний Новгород, Россия, 2010) был удостоен диплома первой степени.
Публикации. По теме диссертации опубликовано 17 работ, в том числе 5 статей в журналах рекомендованных ВАК РФ для опубликования основных научных результатов диссертаций на соискание ученой степени кандидата наук.
Работа выполнена в лаборатории биохимии ИБФРМ РАН в соответствии с плановыми темами: Биополимеры и низкомолекулярные соединения во взаимодействии растений и микроорганизмов, Структурно-функциональные особенности поверхностных гликополимеров ризобактерий (№№ гос. рег. 01200904391, 01200403358, научный руководитель - зав. лаб. засл. деятель науки РФ, д.б.н. проф. Игнатов В.В.).
Работа поддержана грантом Российского фонда фундаментальных исследований в 2011 - 2013 гг. Исследование строения и свойств липополисахаридов ризобактерий в связи с существованием в различных экологических нишах № 11-04-00533, а также грантом Президента РФ на поддержку молодых российских ученых и ведущих научных школ НШ-3171.2008.4 в 2008 - 2009 гг.
Ряд работ выполнен совместно с сотрудниками лаборатории химии углеводов ИОХ РАН имени Н.Д. Зелинского (г. Москва).
Объем и структура диссертации. Диссертация состоит из введения, обзора литературы, экспериментальной части, изложения полученных результатов и их обсуждения, заключения, выводов и списка цитируемой литературы, содержащего 332 источника, в том числе - 273 зарубежных. Работа изложена на 160 страницах машинописного текста, содержит 21 рисунок и 8 таблиц.
На защиту выносятся следующие основные положения и результаты:
- Выявлен сложный многокомпонентный состав гликополимеров культуральной жидкости, капсулы и внешней мембраны бактерий H. seropedicae Z78 и H. lusitanum P6-12. ЛПС внешней мембраны отличны по структуре от экстраклеточных и капсульных гликополимеров липополисахаридной природы. В капсульном материале H. seropedicae Z78 дополнительно присутствует гликолипид, а в культуральной жидкости - свободный полисахарид.
- В составе всех исследуемых гликанов H. seropedicae Z78 обнаружены общие антигенные детерминанты, наряду с наличием индивидуальных иммунодоминантных групп в мембранных и капсульных полисахаридах. H. seropedicae Z78 иH. lusitanum P6-12 являются серологически различными.
- В О-специфической цепи ЛПСH. seropedicae Z78 показано наличие двух типов повторяющихся звеньев: 1,3-глицерофосфат и 1,3-глицерофосфат, замещенный во втором положении N-ацетил-d-глюкозамином.
Автор выражает глубокую признательность своим научным руководителям заслуженному деятелю науки Российской Федерации, доктору биологических наук, профессору В.В. Игнатову и кандидату биологических наук О.Н. Смолькиной за неоценимую поддержку на всех ключевых этапах выполнения данной работы. Автор выражает благодарность за плодотворное сотрудничество коллегам из лаборатории биохимии - доктору биологических наук, профессору С.А. Конновой, кандидату биологических наук, доценту Ю.П. Федоненко, кандидату биологических наук И.В. Егоренковой, сотрудникам ИБФРМ РАН доктору биологических наук Л.Ю.Матора, кандидату биологических наук, доценту Г.Л. Бурыгину, кандидату химических наук О.Е. Макарову, кандидату биологических наук М.П. Чернышевой, а также другим сотрудникам ИБФРМ РАН и сотрудникам лаборатории химии углеводов ИОХ РАН им. Н.Д. Зелинского (г. Москва).
СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
Материалы и методы исследования
В работе были использованы бактерии H. seropedicaeZ78, впервые выделенные из корней сорго и любезно предоставленные в коллекцию ИБФРМ РАН доктором Дж. Доберейнер (Empresa Brasileira de Pesquisa Agropecuaria, Rio de Janeiro, Бразилия), и
H. lusitanum P6-12, выделенные из клубеньков фасоли обыкновенной и предоставленные доктором Ж. Игуал (IRNA, Salamana, Испания).
Исследуемые микроорганизмы выращивали на синтетической среде с малатом и глюкозой (American Type Culture Collection. Catalogue of Bacteria and Bacteriophages 18th edition, 1992, Rockville, Maryland 20852-1776. ISBN: 0-930009-44-4).
Для выделения суммарных препаратов ПС использовали методы осаждения, ультрацентрифугирования и экстракции. После процедур очистки водные растворы ПС лиофилизировали.
Количественное содержание углеводов, белков, нуклеиновых кислот, 2-кето-3-дезокси-D-октолузоновой кислоты (КДО) определяли общепринятыми спектрофотометрическими методами (Dubois etal., 1956; Скоупс, 1985; Спирин, 1958; Karkhanisetal., 1978 соответственно).
Для гель-фильтрации использовали колонки с носителями Sepharose CL-4B, Sephadex G-50 и Toyopearl TSK HW-40. В качестве элюентов применяли раствор бикарбоната аммония (0.025 M, рН 8.3), пиридин-ацетатный буфер (0.05 М, рН 5.3) и 1% уксусную кислоту. Детекцию продуктов разделения в элюате проводили с помощью дифференциального проточного рефрактометра LKB 2142 (LKB, Швеция). Дополнительно строили элюционные профили по содержанию углеводов в отдельных фракциях (Dubois etal., 1956).
Электрофорез препаратов ПС выполняли в полиакриламидном геле (ПААГ) с додецилсульфатом натрия по методу Хичкок и Браун (Hitchcock and Brown, 1983), визуализацию полисахаридов осуществляли окрашиванием гелей красителем на основе азотнокислого серебра (Tsai and Frash, 1982).
Поликлональные антитела (Ат) получали иммунизацией кроликов целыми клетками бактерий, обработанными 2% глутаровым альдегидом (Матора с соавт., 1998), и осаждали из антисыворотки сульфатом аммония (Кэбот и Мейер, 1968). С использованием овечьей фаговой библиотеки Ат были получены фаговые мини-Ат (м-Ат) к ЛПСZ78, ЭПСIZ78, ЭПСIIZ78, КПСIZ78 и КПСIIZ78 (м-АтЛПС, м-АтЭПСI, м-АтЭПСII, м-АтКПСI и м-АтКПСII соответственно). Для селекции м-Ат использовали принцип аффинного взаимодействия между фаговой частицей и иммобилизованным на твердой фазе (полистироловом планшете или нитроцеллюлозной мембране) антигеном (Аг). Компетентными вирусами инфицировали клетки E. coliXL-1 Blue, и после трехдневной инкубации из культуральной жидкости выделяли м-АтЛПС, м-АтЭПСI, м-АтЭПСII, м-АтКПСI и м-АтКПСII. Концентрацию фаговых частиц определяли спектрофотометрическим методом.
Иммуноферментный анализ проводили в полистироловых 96-ти луночных планшетах. Тестируемые соединения иммобилизировали за счет простой адсорбции. В качестве ферментной метки использовали пероксидазу хрена, конъюгированную с козьими анти-кроличьими антителами (Sigma, США). В качестве субстратного реагента использовали о-фенилендиамин с перекисью водорода. Измерения оптической плотности исследуемых проб проводили на иммуноферментном анализаторе Multiskan Ascent с последующей обработкой результатов с помощью программы Ascent Software for Multiskan Ascent (Thermo Electron, China).
Нейтральные моносахариды, аминосахариды и неуглеводные заместители идентифицировали методом тонкослойной хроматографии (ТСХ) (Захарова и Косенко, 1982). Количественное определение нейтральных моносахаридов проводили методом газо-жидкостной хроматографии (ГЖХ) в виде ацетатов полиолов (Слонекер, 1975) на хроматографе Hewlett-Packard 5890 (США). Метилирование ПС проводили СН3I в присутствии щелочи и анализировали методом ГЖХ-масс-спектрометрии (ГЖХ-МС) на газовом хромато-масс-спектрометре Finnigan Trace DSQ (США).
ОПС гербаспирилл получали рутинным методом гидролиза ЛПС 2% уксусной кислотой (Muller-Seitz etal., 1968). Выделенные препараты очищали хроматографически.
Определение состава жирных кислот (ЖК) в виде метиловых эфиров жирных кислот (МЭЖК) гликополимеров проводили с помощью ГЖХ на хроматографе GC-2010 (Shimadzu, Япония) с капиллярной колонкой EQUTY-1 (Supelco, Чехия). Метилирование выполняли согласно методу, описанному в работе (Mayer etal., 1985).
Спектры ЯМР снимали на спектрометре DRX-500 (Bruker, Германия), используя стандартное математическое обеспечение фирмы Bruker. Для сбора и обработки данных использовали программу XWINNMR 2.1.
Результаты всех экспериментов подвергали статистической обработке (Лакин, 1980). Данные представлены в виде средних значений (как минимум трех экспериментов, каждый из которых проводился в трех повторностях) со средней квадратичной ошибкой. Доверительные интервалы определены для надежности 95%.
Результаты исследований и их обсуждение
В настоящем разделе работы представлены результаты сравнительного исследования химического состава, полисахаридной и липидной составляющих капсульных, экстраклеточных и липополисахаридов бактерий рода H. seropedicae Z78 и
H. lusitanum P6-12, а также данные, касающиеся характеристики антигенных детерминант данных гликополимеров.
1 Исследование химического состава капсульных и экстраклеточных полисахаридов
Интерес к исследуемым культурам связанс тем, чтоH. seropedicaeZ78 является типовым, ассоциированным с экономически важными сельскохозяйственными культурами, а H. lusitanum P6-12 - первый представитель рода гербаспирилл, обнаруженный в клубеньках бобовых. При выращивании микроорганизмов H. seropedicaeZ78 и H. lusitanum P6-12 на жидкой синтетической среде с малатом и глюкозой в качестве источников углерода, культуры достигают окончания экспоненциальной фазы роста к 16 и 12 часам соответственно. При данных условиях клетки образуют капсулу, наличие которой было выявлено негативным контрастированием по методу Гинса. В результате проведенного эксперимента на темно-сером фоне были хорошо видны овальные участки капсул, не воспринимающие краситель, внутри которых располагались окрашенные в розово-малиновый цвет клетки бактерий (рис. 1). В качестве примера приведен рисунок только для H. seropedicae Z78, так как внешний вид картины был одинаков для обоих исследуемых видов.
Из культуральной жидкости и капсульного материала бактерий H. seropedicae Z78и
H. lusitanum P6-12 были выделены, хроматографически очищены и охарактеризованы ЭПСZ78, КПСZ78, ЭПСР6-12 и КПСР6-12.
Показано, что в состав препаратов, помимо углеводов, белка и фосфора, входит КДО (табл. 1). Известно, что КДО является маркером молекулы ЛПС. Однако для некоторых штаммов E. coli (Whitfield etal., 1993), Azospirillum (Konnovaetal., 1994) было показано ее присутствие в КПС, а у бактерий рода Rhizobium КДО является компонентом повторяющихся звеньев КПС (Carlsonetal., 1985).

Рис. 1. Клетки H. seropedicae Z78, окруженные капсулами. Негативное контрастирование по методу Гинса. Длина масштабной линейки 25 мкм.
В липидных составляющих гликополимеров гербаспирилл выявлено присутствие предельных, непредельных алкановых и гидроксиалкановых кислот с длиной углеродной цепи от С10 до С18.
На основании наличия КДО и гидроксикислот в ЭПСZ78, КПСZ78, ЭПСР6-12 и КПСР6-12 было сделано предположение, что они представлены экстраклеточными формами ЛПС или представляют собой смесь ЭЛПС и КПС и/или ЭПС. В связи с этим, была предпринята попытка выделения ЛПС из исходных препаратов ЭПСZ78, КПСZ78, ЭПСР6-12, КПСР6-12 методом ультрацентрифугирования. В результате были получены гелеобразные осадки (ЭПСIZ78, КПСIZ78, КПСIP6-12), предположительно являющиеся липополисахаридами, и супернатанты, содержащие экстраклеточные и капсульные ПС (ЭПСIIZ78, КПСIIZ78 и ЭПСIIP6-12) Для ЭПСР6-12 прозрачного гелеобразного осадка обнаружено не было. Все образцы были хроматографически очищены. Специфическими реакциями на соответствующие компоненты в составе всех выделенных образцов ПС были найдены углеводы, КДО, фосфор и белок (табл. 1).
В составе липидной части ЭПСIZ78, КПСIZ78, КПСIIZ78, ЭПСIIP6-12, КПСIP6-12 и КПСIIP6-12 были идентифицированы насыщенные, ненасыщенные и гидроксикислоты (табл. 2), в препарате ЭПСIIZ78 жирных кислот не обнаружено. Профили ЖК КПСIZ78 и КПСIIZ78 (за исключением С16:0) были идентичны таковым мажорных и минорных ЖК в КПСZ78. Это указывает на преобладание в пуле КПСZ78 липидной составляющей КПСIZ78, что хорошо согласуется с результатами исследования выхода КПСIZ78, который был в четыре раза выше, чем КПСIIZ78. Содержание гидроксикислот в КПСIZ78 составило 44.3%, а в КПСIIZ78 - только 8.1% от общей массы МЭЖК. Наличие небольшого количества гидроксикислот в КПСIIZ78 может быть связано с тем, что этот препарат, несмотря на наличие КДО, не является ЛПС, а представляет собой полисахарид, ассоциированный с липидным компонентом.
Несмотря на то, что при ультрацентрифугировании ЭПСР6-12 не произошло осаждения гелеобразного осадка ЭЛПС, как в случае с ЭПСZ78, наличие в ЭПСIIР6-12 КДО и присутствие ~ 40% гидроксилированных ЖК, позволяет предположить, что он представляет собой ЛПС, отличный от капсульного ЛПС составом ЖК. Сумма гидроксикислот для КПСIР6-12 и КПСIIР6-12 была ~ 60% (табл. 2), что, наряду с достаточно высоким содержанием углеводов и КДО (табл. 1) в образцах КПСIР6-12 и КПСIIР6-12, также свидетельствует об их липополисахаридной природе.
Анализ моносахаридного состава ЭПСIZ78, ЭПСIIZ78, КПСIZ78, КПСIIZ78, ЭПСIIР6-12, КПСIР6-12 и КПСIIР6-12 выполняли методом ГЖХ в виде ацетатов полиолов. В составе ЭПСIZ78 и ЭПСIIZ78 было выявлено небольшое содержание неидентифицированного компонента и показано преобладание маннозы (Man), глюкозы (Glc) и галактозы (Gal) в соотношении 1:4:3. На их долю приходилось до 95% от суммы пиков всех идентифицированных ацетатов полиолов.
Таблица 1
Биополимерный состав и выходы гликополимеров бактерий H. seropedicaeZ78 и H. lusitanumP6-12
Образец |
Содержание, % |
Выход, % |
|||
Углеводы |
Белки |
КДО |
Фосфор |
||
КПСZ78 |
10.8 0.6 |
1.3 0.1 |
2.9 0.1 |
5.0 0.8 |
0.7* |
КПСIZ78 |
7.3 0.8 |
1.5 0.1 |
0.7 0.1 |
1.1 0.2 |
15.6' |
КПСIIZ78 |
4.2 0.4 |
0.2 0.0 |
0.5 0.0 |
4.5 0.2 |
63' |
ЭПСZ78 |
35.4 1.2 |
4.0 0.1 |
0.3 0.0 |
1.0 0.1 |
1.5* |
ЭПСIZ78 |
66.1 3.6 |
6.9 1.7 |
0.4 0.0 |
1.6 0.1 |
8.3' |
ЭПСIIZ78 |
47.3 1.7 |
0.8 0.1 |
0.2 0.0 |
0.8 0.1 |
37' |
КПСP6-12 |
48.3 3.3 |
8.3 0.1 |
2.3 0.1 |
3.9 0.6 |
1.1* |
КПСIP6-12 |
22.9 1.1 |
7.8 0.2 |
0.7 0.0 |
1.2 0.3 |
49.7' |
КПСIIP6-12 |
27.2 3.2 |
6.7 0.4 |
0.7 0.0 |
3.3 0.2 |
43.4' |
ЭПСP6-12 |
41.3 2.6 |
5.6 0.2 |
0.4 0.0 |
5.8 0.9 |
8.6* |
ЭПСIIP6-12 |
29.8 0.8 |
4.0 0.3 |
0.3 0.0 |
4.7 0.2 |
48.6' |
Примечание: л* - выход ПС от веса сухих микробных клеток, л' - выход от навески исходного ПС.
В ЭПСIZ78 были обнаружены следовые количества (менее 0.5%) GlcN и GalN. В составе капсульных ПС H. seropedicae Z78, кроме упомянутых выше нейтральных сахаров, были выявлены рамноза (Rha), арабиноза (Ara), глюкозамин (GlcN) и галактозамин (GalN), а также два неидентифицированных компонента. Основными по содержанию (~ 82% от суммы площадей пиков ацетатов полиолов) были Glc, Gal, GlcN и GalN в соотношении ~ 3:3:1:1. Количество Ara, Man, Rha и каждого из неидентифицированных компонентов не превышало 3 - 5%. Определение неидентифицированных компонентов выполняли методом ГЖХ-МС в виде ацетатов полиолов.
Анализ проводили для каждого отдельного образца ПС. Результат анализа ГЖХ-МС ацетатов полиолов КПСIZ78 (рис. 2) показал, что он содержит в своем составе дезоксигексапиранозу (dHexp - Rha), по два остатка гексоз (Hexp), один остаток пентозы (Pent - Ara), два остатка N-ацетилгексапираноз (HexpNAc). КПСIZ78 содержал в своем составе два неидентифицированных компонента, которые, исходя из данных масс-спектров, представляют собой глицерин (Gro) и 1,2,3,4-бутантетраол (рис. 2). Масс-спектры ацетатов полиолов КПСIIZ78, ЭПСIZ78 и ЭПСIIZ78 также содержали пики соответствующие 1,2,3,4-бутантетраолу, а КПСIIZ78 еще и пик Gro.
В составе ЭПСIIР6-12 было показано преобладание Man и Glc в соотношении 1:3. На их долю приходилось до 70% от суммы пиков всех идентифицированных ацетатов полиолов. В ЭПСIIР6-12 также было выявлено небольшое содержание Gro и GlcN (~ 5%). В составе ЭПСIIР6-12, кроме упомянутых моносахаридов и неуглеводного компонента, были обнаружены Rha, Ara и Gal. Содержание Rha, Ara, Gal и Gro не превышало 4 - 7% для каждого компонента. Моносахаридный состав КПСIР6-12 и КПСIIР6-12 отличался от
ЭПСIIР6-12 отсутствием Man и был представлен Gro, 1,2,3,4-бутантетраолом, Gal, GlcN и гептозой (Hep) (обязательной структурой коровой области ЛПС) в соотношении 1:1:2:2:2.5.
Таблица 2
Состав жирных кислот гликополимеров, выделенных из капсульного материала и культуральной жидкости H. seropedicaeZ78иH. lusitanumP6-12
Компоненты |
Содержание МЭЖК (в % от суммы площадей всех пиков) |
|||||
ЭПСIZ78 |
КПСIZ78 |
КПСIIZ78 |
ЭПСIIP6-12 |
КПСIP6-12 |
КПСIIP6-12 |
|
2-OH-C10:0 |
12.4 |
- |
8.1 |
- |
- |
- |
3-OH-C10:0 |
17.3 |
21.1 |
- |
14.2 |
17.8 |
17.9 |
C12:0 |
10.6 |
2.6 |
- |
10.1 |
21.3 |
16.8 |
С14:0 |
6.2 |
29.6 |
- |
- |
- |
- |
2-OH-C12:0 |
- |
- |
- |
13.4 |
17.3 |
19.4 |
3-OH-C12:0 |
- |
23.2 |
- |
15.4 |
19.1 |
20.8 |
С15:0 |
- |
- |
9.0 |
- |
- |
- |
i-C15:0 |
5.4 |
- |
12.9 |
- |
- |
- |
а-C15:0 |
6.2 |
- |
22.3 |
- |
- |
- |
i-С16:0 |
4.8 |
- |
18.1 |
- |
- |
- |
С16:0 |
15.4 |
20.7 |
12.3 |
- |
13.9 |
11.2 |
С16:1 |
5.0 |
2.7 |
- |
- |
1.9 |
3.1 |
i-C17:0 |
- |
- |
8.0 |
- |
2.8 |
3.4 |
а-C17:0 |
- |
- |
9.3 |
- |
- |
- |
С18:1 |
13.3 |
- |
- |
- |
4.4 |
5.2 |
С18:0 |
3.3 |
- |
- |
- |
- |
- |
ЖК1 |
- |
- |
- |
14.0 |
- |
- |
ЖК2 |
- |
- |
- |
16.3 |
- |
- |
ЖК3 |
- |
- |
- |
12.6 |
- |
- |
?гидроксикислот |
29.7 |
44.3 |
8.1 |
43.0 |
54.2 |
58.1 |
Примечание: л- - компоненты отсутствуют.
В составе КПСIР6-12 и КПСIIР6-12, кроме упомянутых моносахаридов и неуглеводных компонентов, были обнаружены Rha, Ara и Glс, содержание которых не превышало 1 - 7% для каждого компонента.
Учитывая идентичность моносахаридного состава КПСIР6-12 и КПСIIР6-12 и состава жирных кислот, а также близкие значения содержания различных компонентов при определении биополимерного состава, можно сделать вывод о том, что эти препараты являются одним и тем же высокомолекулярным гликолипидом липополисахаридной природы. Однако они имеют некоторые отличия по составу ЖК и моносахаридов от экстраклеточного гликолипида бактерий этого штамма. Наличие в составе гликополимеров ЭПСIZ78, ЭПСIIZ78, КПСIZ78 и КПСIIZ78 неуглеводного компонента могло объяснить низкое содержание углеводов (табл. 1) в этих препаратах. Однако содержание бутантетраола в капсульных гликанах было в два раза выше, чем в экстраклеточных. Мы предположили, что ацетилированию подверглись не все остатки бутантетраола.
Действительно, анализ ГЖХ-МС ацетатов полиолов показал, что на долю этого полиспирта в капсульных ПС приходилось до 80% от суммы пиков всех идентифицированных мономеров, а в экстраклеточных ~ 20%, что хорошо сопоставимо с данными по содержанию углеводов в образцах.
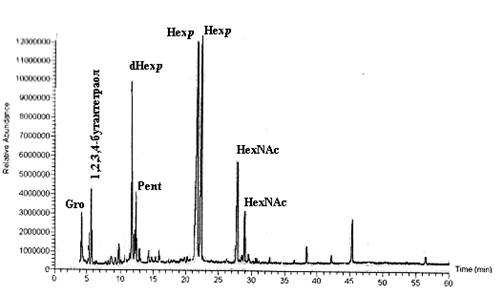
Рис. 2. Спектр ГЖХ-МС ацетатов полиолов КПСIZ78.
Необходимо отметить, что остатки полиолов (глицерина, рибитола, маннитола) являются неотъемлемой частью тейхоевых кислот грамположительных бактерий. Однако существуют данные, указывающие на наличие остатков спиртов в структуре повторяющихся звеньев ЛПС и КПС грамотрицательных микроорганизмов, причем полиолы обнаруживаются как в виде боковых заместителей, так и в структуре главной цепи, соединяясь с остатками сахаров через фосфодиэфирную связь (Zych etal., 2001).
Таким образом, в составе капсульного материала H. seropedicae Z78 были обнаружены два вида гликополимеров. Один из них липополисахаридной природы и полисахарид, ассоциированный с липидным компонентом. Для H. lusitanum P6-12 характерно образование лишь полимера липополисахаридной природы. В культуральную жидкость
H. seropedicae Z78 иH. lusitanum P6-12 выделяют экстраклеточные формы ЛПС, а
H. seropedicae Z78 еще и полисахарид. ЭПС H. lusitanum P6-12 отличается от капсульного гликана моносахаридным составом, а также составом липидной компоненты. Капсульные и экстраклеточные ПС H. seropedicae Z78 имеют близкий моносахаридный и значительные различия в составе жирных кислот. Полисахаридные части капсульных полимеров
H. seropedicae Z78 и H. lusitanum P6-12 содержат остатки глицерина и бутантетраола. В то время как ПС части экстраклеточных гликополимеров обоих штаммов характеризуются присутствием только глицерина. Остатки полиспиртов с большей долей вероятности соединены посредством фосфодиэфирных связей и несут на себе высокую плотность отрицательного заряда. Известно, что низкомолекулярные ЭПС ризобий могут служить супрессорами растительных защитных реакций. Возможно, по аналогии с полианионными ЭПС ризобий и различных фитопатогенов (Aslam etal., 2009; Silipoetal., 2010), КПС и ЭПС гербаспирилл могут хелатировать ионы Ca2+, участвуя в подавлении защитных реакций растения. Для многих микроорганизмов было показано, что ЛПС, наряду с другими микробными метаболитами, индуцируют защитные механизмы растительных клеток. Однако в случае симбиотических отношений, бактериальные ПС, в том числе и ЛПС, часто выступают как ее супрессоры, подавляя выделение NO, активных форм кислорода и приток ионов кальция (Silipoetal., 2010). КПСIZ78, ЭПСIZ78, КПСIР6-12 и КПСIIР6-12, являясь экстраклеточной формой ЛПС, также могут оказывать подобное воздействие на растение, для оптимизации условий эндофитного существования. Гетерогенность полисахаридсодержащих полимеров поверхности H. seropedicae Z78 и
H lusitanum P6-12, очевидно, связана с их различной ролью в процессе колонизации растения и реализации эффективного симбиоза, а также адаптации к существованию в тканях растения.
2 Исследование химического состава липополисахаридов
В настоящее время известна только одна работа, посвященная исследованию состава ЛПС H. seropedicae (Serratoetal., 2010). Авторы получали ЛПС с поверхности клеток, не отмытых от капсулы. Нами показано, что капсульные гликополимеры исследуемых бактерий являются экстраклеточной формой ЛПС. При экстракции О-антигена они также могут попадать в состав препарата и существенно влиять на результаты дальнейших исследований. Мы осуществили параллельное выделение ЛПСиз внешней мембраны
H. seropedicae Z78 и H. lusitanum P6-12 по модифицированной методике Галаноса (РСР-экстракция) и стандартной Вестфаля (PW-экстракция) с разделением (ЛПСPWw и ЛПСPWPh) и без разделения слоев (ЛПСPW). В отдельных экспериментах, для исключения коэкстракции фосфолипидов из микробной массы, проводили предварительную процедуру очистки. Выход ЛПС варьировал от 1 до 6% от веса сухой микробной массы в зависимости от способа экстракции (табл. 3). Электрофоретический анализ ЛПС обоих видов показал сосредоточение большей части макромолекул в нижней части трека. Для H. seropedicae Z78 визуализированы две узкие полосы в верхней части фореграммы, а для H. lusitanum
P6-12 - три. Сравнительный анализ выходов и макромолекулярной организации выделенных полисахаридов позволили провести детальный анализ компонентов внешней мембраны и подобрать оптимальный метод экстракции. Результаты анализа биополимерного состава представлены в табл. 3. Показано, что на долю углеводов в образцах приходится от 9 до 23% от массы препаратов (табл. 3). Разброс в содержании углеводов, учитывая, что результаты электрофоретического анализа говорят о значительном преобладании в пуле мембранных ЛПС молекул R- и лишь незначительном присутствии S-форм, может быть объяснен возможностями методов экстракции давать при выделении более высокомолекулярные и низкомолекулярные фракции. В составе всех выделенных ЛПС была идентифицирована КДО. Во всех образцах ЛПС H. seropedicae Z78 обнаружено небольшое (менее 1%) количество общего фосфора, в то время как в ЛПС
H. lusitanum P6-12 его содержание было значительным (табл. 3). Разницу в содержании данного компонента в ЛПС исследуемых микроорганизмов можно объяснить различной длиной их полисахаридной цепи. Известно, что фосфатные группы, локализованные в липиде А и во внутренней части кора, являются высокоэффективными катионсвязывающими участками в молекуле ЛПС. Степень ионизации отрицательно заряженных групп определяет силу отталкивания между ними, гидратацию полярной части и образование водородных связей, что влияет, в конечном итоге, на субмолекулярную организацию ЛПС в мембране (Mayer etal., 1985).
В составе липидной части ЛПС были идентифицированы насыщенные, ненасыщенные и гидроксикислоты с длиной углеродной цепи от С10 до С18 (табл. 4).
Метод PW-экстракции позволил разделить весь пул мембранного ЛПС H. seropedicae Z78 на гидрофобную и гидрофильную фракции. Преобладающими в препаратах оказались 3-гидроксидекановая (3-ОН-С10:0), 3-гидроксидодекановая (3-ОН-С12:0), тетрадекановая (С14:0), гексадекановая (С16:0) кислоты, а также октодеценовая (С18:1) в ЛПСZ78PWPh и
2-гидроксидодекановая (2-ОН-С12:0) в ЛПСZ78PWw (табл. 4).
Исследование состава ЖК фосфолипидов препарата H. seropedicae Z78 (ФЛZ78), полученных экстракцией с поверхности клеток смесью хлороформа и метанола методом ГЖХ показало, что эти макромолекулы построены из изопентановой (i-С15:0), С16:0, гексадеценовой (C16:1), С18:1 и нонадекановой (С19:0) кислот (табл. 4). В связи с этим, присутствие в препарате ЛПСZ78PWPh С18:1 и следовых количеств C16:1 и i-С15:0 можно объяснить наличием примеси ФЛZ78, которые, вероятно, попадают при выделении ЛПС в фенольную часть экстракта за счет своей гидрофобности.
Таблица 3
Биополимерный состав и выходы ЛПС бактерий H. seropedicae Z78иH. lusitanum P6-12, выделенных разными методами
Компоненты |
ПСZ78PWw |
ПСZ78PWPh |
ПСZ78PCP |
ПСР6-12PCP |
ПСР6-12PW |
|
Содержание, % |
Углеводы |
23.31.6 |
18.71.1 |
8.80.2 |
12.70.5 |
22.12.5 |
Белок |
1.50.1 |
2.00.1 |
0.50.1 |
0.80.1 |
2.70.1 |
|
Фосфор |
0.80.1 |
0.60.1 |
0.40.1 |
5.50.4 |
6.10.1 |
|
КДО |
1.60.0 |
1.90.1 |
1.90.2 |
0.60.1 |
0.40.1 |
|
Выход ЛПС, % от веса сухих клеток |
1.0 |
1.5 |
6.0 |
3.0 |
5.4 |
|
Из обезжиренных клеток PW-экстракцией выделяли ЛПСZ78PW'w и ЛПСZ78PW'Ph (табл. 4). Составы и соотношения ЖК ЛПСZ78PW'w и ЛПСZ78PW'Ph оказались одинаковыми. На основании этого можно констатировать, что распределение макромолекул в водную и фенольную части экстракта связано с размерами их полисахаридной составляющей. Таким образом, показано, что в состав липида А ЛПС H. seropedicae Z78 входят 3-ОН-С10:0, 2-ОН-С12:0, 3-ОН-С12:0, С14:0, 2-ОН-С14:0 и С16:0 кислоты. Сумма гидроксикислот в образцах ЛПС, полученных после обезжиривания клеток, составила ~ 63% (табл. 4), что согласуется с литературными данными о количестве гидроксикислот в липидах А (Красикова с соавт., 1989).
Анализ, проведённый методом ГЖХ после метанолиза ЛПС H. lusitanum P6-12, выявил, что основными по содержанию были С12:0, 2-ОН-С12:0, 3-ОН-С12:0, 2-ОН-С14:0 и С16:0. В ЛПС H. lusitanum P6-12 также были обнаружены С16:1 и С18:1, но в меньшем количестве (4.9 и 4.1% соответственно). Общее содержание ЖК в образце ЛПС составило ~ 70%. Профиль ЖК ФЛ H. lusitanum P6-12 оказался похожим на профиль ЖК ФЛ H. seropedicae Z78, однако он отличается наличием в качестве мажорного компонента гептадекановой (С17:0) и полным отсутствием С19:0 кислот (табл. 4).
Из обезжиренных клеток PW-экстракцией без разделения слоев, выделяли ЛПСР6-12PW'. После экстракции не проводили разделения на водную и фенольную составляющие, в связи с тем, что по предварительным экспериментам и по аналогии с ЛПСZ78PW'w и ЛПСZ78PW'Ph мы показали, что составы и соотношения ЖК во фракциях одинаковы. Полученные препараты характеризовались присутствием C16:1 и С18:1 кислот. Было отмечено снижение содержания С16:0, а также увеличение С12:0, 2-ОН-С12:0, 3-ОН-С12:0 и
2-ОН-С14:0 кислот (табл. 4). Показано, что гидроксикислоты в ЛПС H. lusitanum P6-12 составляли ~ 30% от содержания МЭЖК. В исследуемом образце также были обнаружены ненасыщенные ЖК (9%).
Обнаруженные небольшие отличия в количественном соотношении отдельных жирных кислот, входящих в состав липидных компонентов ЛПС H. seropedicae Z78 и H. lusitanum P6-12, могут оказывать существенное влияние на их биологическую активность. Также необходимо отметить наличие отличий состава ЖК мембранных ЛПС данных микроорганизмов от капсульных и экстраклеточных полисахаридов.
Проведённые эксперименты показали, что наиболее эффективным способом экстракции ЛПС из внешней мембраны H. seropedicae Z78 и H. lusitanum P6-12 является метод Вестфаля из обезжиренных клеток. Данная процедура позволяет получить препараты с достаточно высокими выходами, не содержащие примесей посторонних компонентов, которые наиболее подходят для дальнейших исследований структуры и биологической функции. В связи с этим, нами для дальнейших исследований применялись препараты ЛПС, полученные по методу Вестфаля из обезжиренных клеток H. seropedicae Z78 и H. lusitanum P6-12, обозначенные далее как ЛПСZ78 и ЛПСР6-12.
Таблица 4
Соотношение жирных кислот в препаратах липополисахаридов и фосфолипидов бактерий
H. seropedicae Z78 и H. lusitanum Р6-12
ЖК |
Содержание МЭЖК (в % от суммы площадей всех пиков) |
|||||||
ПСZ78PWw |
ПСZ78PWPh |
ФЛZ78 |
ПСZ78PW'w |
ПСZ78PW'Ph |
ПСР6-12PW |
ФЛР6-12 |
ПСР6-12PW' |
|
С12:0 |
- |
- |
- |
- |
- |
11.1 |
- |
21.1 |
3-ОН-С10:0 |
14.0 |
10.2 |
- |
14.3 |
16.8 |
сл |
- |
сл |
2-ОН-С12:0 |
9.1 |
сл |
- |
11.8 |
11.3 |
11.1 |
- |
17.9 |
3-ОН-С12:0 |
20.2 |
14.2 |
- |
28.7 |
25.7 |
9.4 |
- |
14.2 |
С14:0 |
28.0 |
16.4 |
- |
27.0 |
28.1 |
сл |
- |
сл |
i-С15:0 |
сл |
сл |
26.6 |
- |
- |
- |
- |
- |
2-ОН-С14:0 |
сл |
сл |
- |
8.3 |
8.6 |
8.6 |
|
16.2 |
С16:0 |
14.8 |
26.5 |
31.0 |
6.7 |
9.5 |
22 |
49.1 |
7.2 |
С16:1 |
сл |
сл |
14.2 |
- |
- |
4.9 |
12.3 |
- |
С17:0 |
- |
- |
сл |
- |
- |
сл |
15.8 |
- |
С18:1 |
- |
10.7 |
14.2 |
- |
- |
4.1 |
22.7 |
- |
С19:0 |
- |
- |
14.0 |
- |
- |
- |
- |
- |
?гидрокси кислот |
43.3 |
24.0 |
- |
63.1 |
62.4 |
29.1 |
- |
48.3 |
Примечание: л- - компоненты отсутствуют.
3 Иммунохимическое исследование гликополимеров бактерий рода Herbaspirillum
Сотрудниками лаборатории иммунохимии ИБФРМ РАН были любезно предоставлены для исследований поликлональные кроличьи Ат, полученные к целым клеткам бактерий H. seropedicae Z78, обработанным глутаровым альдегидом (АтZ78) (Матора c соавт., 1998; 2005). Хроматографически очищенные препараты ЛПСZ78, ЭПСIZ78, ЭПСIIZ78, а также КПСIZ78 и КПСIIZ78 тестировали на способность взаимодействовать с АтZ78 методом твердофазного ИФА (рис. 3). Было показано, что ЛПСZ78, ЭПСIIZ78 и КПСIIZ78 взаимодействовали с АтZ78. Максимальный ответ наблюдался для ЛПСZ78, тогда как ЭПСIZ78 и КПСIZ78 не преципитировались АтZ78, что может свидетельствовать об антигенных различиях препаратов ЭПСIZ78 и КПСIZ78 от ЛПСZ78.
Фаговые Ат отличаются более высокой специфичностью, по сравнению с поликлональными. С использованием овечьей фаговой библиотеки антител были получены м-АтЛПС, м-АтЭПСI, м-АтЭПСII, м-АтКПСI и м-АтКПСII. Селекцию полученных специфических м-Ат проводили с использованием фагового дисплея антител, любезно предоставленного профессором У. Харрисом (Университет Абердина, Великобритания),
Результаты ИФА показали высокую эффективность использованной в данной работе процедуры увеличения специфичности м-Ат. От раунда к раунду увеличивалось число фагов, несущих специфичные вариабельные домены к соответствующим Аг (рис. 4). В качестве примера на рис. 4 приведены результаты ИФА после первого и четвертого раундов селекции м-Ат к КПСIIZ78. м-АтКПСII после первого раунда селекции взаимодействовали со всеми исследуемыми препаратами, а после четвертого - на одном уровне с гомологичным Аг, с ЛПСZ78 и с КПСIZ78, но не взаимодействовали с экстраклеточными полисахаридами.

Рис. 3. Твердофазный иммуноферментный анализ ЛПСZ78 (1), КПСIIZ78 (2), ЭПСIIZ78 (3), ЭПСIZ78 (4), КПСIZ78 (5) cАтZ78.
Для выявления наличия или отсутствия общих АгД гликополимеров H. seropedicae Z78 и H. lusitanumP6-12 был проведён сравнительный анализ с использованием м-Ат к ЛПСZ78, ЭПСIIZ78, КПСIIZ78, ЭПСIZ78 и КПСIZ78, а также поликлональных кроличьих АтZ78 методами ИФА и двойной радиальной иммунодифузии.
Анализы показали, что препараты ЛПС, КПС и ЭПС H. lusitanum P6-12 не реагировали с поликлональными, а также со всеми м-Ат к Аг H. seropedicae Z78, что свидетельствует об отсутствии в составе гликополимеров исследуемых штаммов общих АгД. Степень связывания м-АтЛПС с гомологичным Аг в ИФА характеризовалась достоверным отличием от контроля. Также отмечалось достоверное различие уровня взаимодействия м-АтЛПС с КПСIZ78 и КПСIIZ78, причем наибольшая активность выявлялась в отношении КПСIIZ78, что говорит о большей представленности в их составе специфичных АгД. ЭПСIIZ78 и ЭПСIZ78 характеризовались очень слабой, почти на уровне контроля, преципитацией с м-АтЛПС и
м-АтКПСII. Для м-АтКПСII реакция с ЛПСZ78 была слабее, а с КПСIZ78 сильнее, чем с гомологичным Аг (табл. 5). М-АтЭПСI и м-АтЭПСII проявляли активность со всеми выделенными препаратами H. seropedicae Z78, при этом реакция с гомологичными Аг была слабее, чем с КПСIIZ78, в случае которого достигалась максимальная оптическая плотность продуктов в реакции ИФА. Взаимодействие м-АтЭПСI и м-АтЭПСII с ЛПСZ78 было более активным, чем КПСIZ78 (табл. 5).
М-АтКПСI проявляли активность со всеми Аг H. seropedicae Z78, однако наиболее высокий уровень наблюдался для ЛПСZ78, ЭПСIIZ78 и КПСIIZ78.
Результаты анализа полученных данных указывают на сложную природу полисахаридсодержащих антигенов поверхности H. seropedicae Z78. Очевидно, что ЛПСZ78, КПСIIZ78 и КПСIZ78 имеют индивидуальные АгД, которые узнаются м-АтЛПС и
м-АтКПСII, а также отсутствуют в ЭПСIZ78 и ЭПСIIZ78. А м-АтЭПСII позволяют обнаружить в составе ЛПСZ78, КПСIZ78 и КПСIZ78 АгД, присутствующие в ЭПСIIZ78 и ЭПСIZ78.
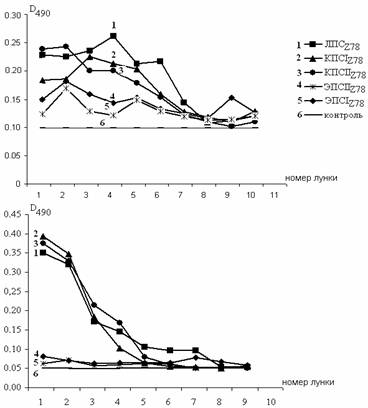
(б)
а(а)
аРис. 4. Твердофазный иммуноферментный анализ КПСIZ78, КПСIIZ78, ЭПСIZ78, ЭПСIIZ78 и ЛПСZ78с м-АтКПСII, полученными после 1 (а) и 4 (б) раундов селекции.
Полученные результаты хорошо коррелируют с данными о моносахаридном составе исследуемых препаратов. Для ЛПСZ78, КПСIIZ78 и КПСIZ78 характерно наличие Rha, GlcN и GalN, которые могут входить в состав АгД этих гликанов. Это объясняет преципитацию
м-АтЛПС, м-АтКПСI и м-АтКПСII не только с гомологичными Аг, но и перекрестные реакции с ЛПСZ78, КПСIIZ78 и КПСIZ78. Из-за отсутствия в составе ЭПСIIZ78 и ЭПСIZ78 Rha и наличия GlcN и GalN лишь в следовых количествах не наблюдается реакции этих гликанов с
м-АтЛПС и м-АтКПСII.
Взаимодействие м-АтЭПСI и м-АтЭПСII с ЛПСZ78, КПСIIZ78 и КПСIZ78 можно объяснить присутствием Glc и Gal в составе этих Аг. На основании всего изложенного, можно предположить, что м-АтЛПС и м-АтКПСII должны проявлять большую специфичность к детерминантам, содержащим Rha, GlcN и GalN, м-АтЭПСI и м-АтЭПСII - к детерминатам содержащим Glc и Gal, а м-АтКПСI - и к детерминантам несущим и те и другие сахара в равной степени.
Методом иммунодиффузии была проведена оценка ингибирующего эффекта моносахаридов, входящих в состав ЛПСZ78, - коммерческих препаратов Gal, Glc, GlcN, ОПСZ78 и корового олигосахарида Z78 (полученных нами в результате мягкого кислотного гидролиза ЛПСZ78), а также, выделенный из полисахарида бактерий рода Azospirillum, по модифицированной методике препарат D-Rha. Для сравнения в качестве отрицательного
Таблица 5
Результаты сравнительного иммуноферментного анализа гликополимеров бактерий
H. seropedicae Z78 и H. lusitanum P6-12
Аг/Ат |
м-АтЛПС |
м-АтКПСI |
м-АтКПСII |
м-АтЭПСI |
м-АтЭПСII |
ПСZ78 |
++++ |
+++ |
++ |
+++ |
+++ |
КПСIZ78 |
++ |
++ |
++++ |
++ |
++ |
КПСIIZ78 |
+++ |
+++ |
+++ |
++++ |
++++ |
ЭПСIZ78 |
- |
++ |
- |
++ |
++ |
ЭПСIIZ78 |
- |
+++ |
- |
+++ |
+++ |
ПС штамма Р6-12 |
- |
- |
- |
- |
- |
Примечание: л++++ - максимальное взаимодействие (D490~0.6), л+++ - сильное взаимодействие (D490~0.4), л++ - взаимодействие средней силы (D490~0.3), л- - взаимодействие отсутствует (D490~0.1).
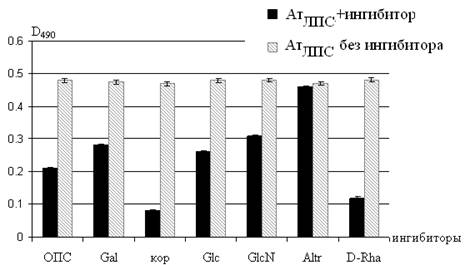
Рис. 5. Оценка действия ингибиторов в реакции ЛПСZ78 с м-АтЛПС методом ИФА.
контроля была взята альтроза (Altr). Концентрацию моносахаридов 10-4М выбирали с заведомым избытком по отношению к концентрации специфических Ат. Концентрация
м-АтЛПС составляла 2.4?1011 вирионов/мл, а липополисахарида 0.015 мг/мл.
Результаты, представленные на рис. 5, показывают, что по убыванию степени торможения иммунохимических реакций, данные ингибиторы можно расположить в следующей последовательности: коровый олигосахарид, D-Rha, ОПСZ78, Glc, Gal и GlcN. Altr не проявляет эффекта ингибирования. Степень взаимодействия Ат, обработанных этим моносахаридом, совпадает с контрольным образцом для необработанных Ат. Показано, что кор полностью ингибировал м-АтЛПС. ОПСZ78 также ингибировал м-АтЛПС, но в меньшей степени. Glc, Gal, GlcN одинаково ингибировали м-АтЛПС, но сильнее чем ОПСZ78.
На основании полученных результатов можно констатировать, что м-АтЛПС проявляют большую специфичность к коровой области ЛПСZ78, а из моносахаридов к D-Rha (рис. 5). Эти результаты согласуются с выдвинутым нами предположением о наибольшей специфичности м-АтЛПС к детерминантам несущим именно этот моносахарид. Ингибирование м-АтЛПС в различной степени широким набором сахаров, вероятно, указывает на значительную разветвленность и гетерогенность корового олигосахарида.
4 Выделение О-специфических полисахаридов, коровых олигосахаридов
H. seropedicae Z78 и H. lusitanum P6-12 и исследование химической структуры повторяющегося звенаH. seropedicae Z78
В связи с отсутствием в литературе данных о структуре ОПС ассоциативных диазотрофных бактерий рода Herbaspirillum, которыеаиграют важную роль в функционировании бактериальной клетки и взаимодействии микроорганизмов с другими биологическими системами, было проведено выделение и исследование этих гликополимеров.
Для получения ОПС и коровых олигосахаридов H. seropedicae Z78 и H. lusitanum P6-12 был проведен кислотный гидролиз соответствующих ЛПС. Выходы ОПСZ78, ОПСP6-12, корIZ78, корIIZ78, корIP6-12 и корIIP6-12 составили 6.1, 10.6, 17.0, 23.0, 7.7 и 16.1% от навесок ЛПС соответственно. Низкие выходы ОПС и высокие олигосахаридов кора в сочетании с данными электрофореза ЛПС в ПААГ, свидетельствует о преобладании в пуле мембранного ЛПС молекул R-формы.
В препаратах ОПСZ78 методом ГЖХ показано наличие Rha, Man, Glc, Gal, GlcN, GalN и неидентифицированного компонента, а в ОПСP6-12 - Rha, Gal, GlcN и также неидентифицированного компонента. Эти препараты также характеризовались значительным содержанием гептоз. Разнообразие моносахаридного состава и данные электрофореза ЛПС позволяют предположить присутствие корового олигосахарида в выделенном препарате ОПС.
Неидентифицированным компонентом, как и в случае с КПСIZ78 и КПСIIZ78, является глицерин. Для определения типов замещения моносахаридных остатков, полисахариды были подвергнуты метилированию в присутствии твердой щелочи, гидролизу и исследованию методом ГЖХ-масс-спектрометрии в виде частично метилированных ацетатов полиолов. Показано, что ОПС H. seropedicae Z78 почти на 80% состоял из замещенного глицерина. Помимо этого в составе ОПС были обнаружены 3-замещенная дезоксигексапираноза (dHexp), два остатка терминальных гексоз (Hexp), 2,3-замещенная dHexp, остатки 4- и 6-замещенных Hexp, 3,4,7-замещенная Hep, по два терминальных остатка N-ацетил гексапираноз (HexpNAc), 4-замещенных HexpNAc и неидентифицированных аминосахаров.
КорIZ78 характеризовался наличием Rha, Man, Glc, Gal, GlcN, GalN и Hep в соотношении 2:5:4:11:1:1, тогда как корIIZ78 включал в свой состав Rha, Glc, Gal, GlcN и Hep в соотношении 1:4:2:6.
КорIР6-12 и корIIР6-12 имели идентичный моносахаридный состав, представленный Rha, Gal, GlcN, но показаны различия в соотношении сахаров (1:3:2 и 3:1:1 соответственно).
Коровая область ЛПС H. seropedicae Z78 характеризовалась полным отсутствием четырехатомного спирта и неидентифицированных аминов. Было показано, что корIZ78 содержал два остатка терминальных Hexp, остатки 2-, 4-, 3-, 6-замещенных Hexp, 2-замещенную Hep, терминальную и 4-замещенную HexpNAc. В составе корIIZ78 почти полностью отсутствовали гексозы, за исключением одного остатка терминальной Hexp. В этом препарате также были обнаружены терминальная Hep, 2- и 6,7-замещенные Hep.
Анализируя данные моносахаридного состава было сделано предположение, что структура повторяющегося звена ОПС представлена глицерином и одним из аминов, в то время как сахара, найденные в корIZ78, представляют собой составляющие внешнего, а в корIIZ78 - внутреннего коров липополисахарида.
Использование физико-химических методов не позволило нам установить структуру повторяющегося звена ОПСZ78. Гетерогенная природа ОПСZ78 явилась причиной того, что не полностью был определен состав ПС и конфигурации некоторых остатков. Для установления тонкой химической структуры исследуемого ОПС, включающей определение последовательности моносахаридов и неуглеводных заместителей, типов связей между остатками моносахаридов, а также степени разветвления повторяющихся звеньев, был проведен анализ методом 1Н- и 13С-ЯМР спектроскопии.
31P ЯМР спектр ОПС показал наличие сигнала одной монофосфатной группы при 1.43 м.д. ОПС был дефосфорилирован 48% HF. Гель-фильтрация полученной смеси на колонке с TSK HW-40 позволила выделить две низкомолекулярных фракции, которые были проанализированы ГЖХ после восстановления и ацетилирования. В их составе были идентифицированы Gro и GlcNAc в разном соотношении, что позволило нам предположить, что именно эти компоненты образуют повторяющееся звено ОПС и остаток Gro фосфорилирован.
В 13C ЯМР спектре (табл. 6) исследуемых фракций присутствовали сигналы одного моносахаридного остатка и глицерола, которые включали в себя сигнал аномерного углерода при 98.3 м.д., трех OCH2ЦC групп (С-6 GlcNAc, C-1 и C-3 Gro) при 61.8 - 62.8 м.д., трех сигналов вторичных углеродов моносахаридного цикла при 71.4 - 73.4 и С-2 глицерола при 80.5 м.д., одного атома углерода, связанного с азотом (С-2 GlcN) при 55.2 м.д. и сигналы N-ацетильной группы при 176.1 и 23.5 м.д. В 1Н ЯМР спектре (табл. 6) присутствовал сигнал одного аномерного протона при 5.04 м.д., одной N-ацетильной группы при 2.04 м.д., и других сигналов в области 3.49 - 3.92 м.д. Полученные данные свидетельствуют о том, что повторяющееся звено представлено остатками глицерола и
N-ацетилглюкозамина.
Одномерные 1Н- и 13С-ЯМР спектры были отнесены с помощью двумерных экспериментов COSY, TOCSY, ROESY и 1Н,13С HSQC. TOCSY спектр демонстрировал корреляции H-1 с H-2ЦH-6 для моносахаридного остатка, что подтвердило его глюко конфигурацию. Относительно низкое значение константы спин-спинового взаимодействия (КССВ) J1,2 ~ 3 Гц указывало на то, что остаток глюкозамина присоединен ?-гликозидной связью. Отсутствие сигналов в области 82 - 88 м.д., характерных для фуранозидов, свидетельствует о пиранозной форме глюкозамина. Отнесение сигналов H-1/C-1, H-2/C-2 и H-3/C-3 глицерола было проведено на основании корреляций 1Н,13С HSQC спектра.
Двумерный ROESY эксперимент показал присутствие кросс-пиков между аномерным протоном GlcNAc и протоном при С-2 Gro 5.04/3.75 м.д., в то же время в 1H,13C HMBC спектре была выявлена корреляция между Н-1/С-2 GlcNAc/Gro и Н-2/С-1 Gro/GlcNAc соответственно. На основании полученных данных была установлена последовательность заместителей в повторяющемся звене ОПС. Исходный ОПС был подвергнут серии экспериментов 1H и 13C ЯМР спектроскопии, включающих 1H,1H COSY, TOCSY, ROESY, 1H,13C HSQC и HMBC. Отнесение сигналов было осуществлено по аналогии с описанным выше. Характерной особенностью ОПС было смещение химических сдвигов Н-1, Н-3 Gro в слабопольную область (табл. 6), обусловленное наличием связи с монофосфатным остатком. Помимо этого в спектрах присутствовали сигналы не связанного с GlcNAc глицерофосфата.
Таблица 6
Данные спектров 1Н-ЯМР и 13С-ЯМР ОС после дефосфорилирования ОПС и ОПС
H. seropedicae Z78
Остаток |
Ядра |
1 (а/б) |
2 |
3 (а/б) |
4 |
5 |
6 (а/б) |
CH3CO |
|
ОС после дефосфорилирования ОПС |
|||||||||
a-d-GlcpNAc |
1Н 13С |
5.04 98.3 |
3.92 55.2 |
3.77 72.3 |
3.49 71.4 |
3.85 73.4 |
3.79/3.84 61.9 |
2.04 23.5/176.1 |
|
о2)-Gro |
1Н 13С |
3.67* 61.8* |
3.75 80.5 |
3.72* 62.8* |
|||||
ОПС1 |
|||||||||
a-d-GlcpNAc |
1Н 13С |
5.10 98.1 |
3.95 72.3 |
3.82 72.3 |
3.49 71.3 |
3.97 73.3 |
3.80/3.9061.8 |
2.09 23.4/175.9 |
|
о2,3)-Gro-1-Р-(Оо |
1Н 13С |
3.99* 65.9* |
4.07 66.5 |
4.05* 66.5* |
|||||
ОПС2 |
|||||||||
о3)-Gro-1-Р-(Оо |
1Н 13С |
3.91* 67.5 |
4.06 70.7 |
3.98* 67.5 |
|||||
Примечание: * - отнесение может быть обратным.
Полученные нами результаты свидетельствуют о том, что изученный ОПСZ78 содержит в своем составе два вида повторяющихся звеньев следующего строения:
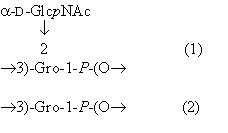
Остается неясным входит ли в состав ЛПС два независимых ОПС или они являются достаточно длинными блоками внутри одной О-цепи.
Необходимо отметить, что подобные структуры являются характерными для тейхоевых кислот грамположительных (Наумова с соавт., 1987; Varbanetsetal., 1990; Cтрешинская с соавт., 1998) и редко встречаются у представителей грамотрицательных бактерий. В составе ОПС некоторых из них были обнаружены компоненты кислой неуглеводной природы, такие как фосфат рибита или этаноламинфосфат, находящиеся в боковой цепи полимера (Krytstynaetal., 2001). Показано, что ОПС бактерий рода Salmonella содержит 2-ацетимидоиламино-2,6-дидезокси-L-галактозу и фосфат рибита в основной цепи (Перепелов с соавт., 2009). ОПС малоизученного вида Budviciaaquatica построен из глицерофосфатов в основной цепи, замещенных во втором положении остатками Glc (Здоровенко с соавт., 2011). Для бактерий E. coli O29 было показано сходство структуры ОПС со структурой тейхоевой кислоты (Perepelov etal., 2006). ОПС, содержащий глицерин в качестве повторяющегося звена, был обнаружен в составе ЛПС Proteus mirabilis O40 (
ЗАКЛЮЧЕНИЕ
В данной работе для бактерий рода Herbaspirillum, произведен подбор оптимального метода выделения ЛПС внешней мембраны. Впервые для О-специфического полисахарида бактерий H. seropedicae Z78 установлена структура повторяющегося звена, в состав которого входит компонент неуглеводной природы - глицерин. Необычная для грамотрицательных бактерий структура О-специфической части липополисахарида внешней мембраны, возможно, связана с их различной ролью в процессе колонизации растения и реализации эффективного симбиоза, а также адаптации к существованию в тканях растения.
С помощью оптимизированных методов впервые для гербаспирилл выделены и охарактеризованы капсульные и экстраклеточные гликополимеры. Полисахаридные части КПС H. seropedicae Z78 и H. lusitanum P6-12 содержат остатки глицерина и бутантетраола. В то время как ПС части ЭПС обоих штаммов отличаются присутствием только глицерина. Возможно, присутствие данных компонентов в составе выделенных гликополимеров обусловлено эндофитным образом жизни изучаемых микроорганизмов и позволяет подавлять защитные реакции растений.
ВЫВОДЫ
- Впервые в капсульном материале и культуральной жидкости бактерий H. seropedicae Z78 и H. lusitanum P6-12 обнаружен компонент липополисахаридной природы. Для H. seropedicae Z78 дополнительно в составе капсульного материала выявлено присутствие полисахарида, ассоциированного с липидным компонентом, и полисахарида в культуральной жидкости.
- Капсульные и экстраклеточные полисахариды H. seropedicae Z78 имеют близкий моносахаридный состав, представленный глюкозой и галактозой, в отличие от таковых H. lusitanum P6-12, у которых в экстраклеточных гликополимерах преобладают манноза и глюкоза, а в капсульных - галактоза и глюкозамин. Кроме того, в составе капсульных и экстраклеточных гликанов обоих штаммов выявлено присутствие многоатомных спиртов (глицерина и эритрита).
- Впервые для H. seropedicae Z78 установлен состав двух типов повторяющихся звеньев О-специфической части липополисахарида внешней мембраны. Первый тип представлен редким для грамотрицательных бактерий компонентом - 1,3-глицерофосфатом, а второй - 1,3-глицерофосфатом, замещенным N-ацетил-d-глюкозамином.
- Преобладающими компонентами липидных составляющих гликополимеров H. seropedicae Z78 иH. lusitanum P6-12 являются 3-гидроксидекановая, додекановая, 3-гидроксидодекановая, гексадекановая и октадеценовая кислоты. Гликолипид и липополисахарид из капсулы H. seropedicae Z78 существенно отличаются составом жирных кислот между собой и от всех исследуемых гликополимеров.
- Для бактерий H. seropedicae Z78 с применением поликлональных кроличьих и высокоспецифичных фаговых мини-антител показано, что экстраклеточные полисахариды содержат общие антигенные детерминанты с мембранными и капсульными гликанами, которые характеризуются наличием дополнительных индивидуальных иммунодоминант.
- В состав антигенных детерминант капсульных гликополимеров и липополисахарида H. seropedicae Z78 входят рамноза, глюкозамин и галактозамин, ответственные за перекрёстные реакции с мини-антителами (м-АтЛПС, м-АтКПСI и м-АтКПСII). Наибольшим эффектом ингибирования взаимодействия препаратов с гомологичными м-Ат обладали коровый олигосахарид ЛПСZ78 и d-рамноза.
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
Работы в рецензируемых журналах и изданиях:
- Смолькина О.Н., Шишонкова (Величко) Н.С., Юрасов Н.А., Игнатов В.В. Капсульные и экстраклеточные полисахариды диазотрофных ризобактерий Herbaspirillumseropedicae Z78 // Микробиология. - 2012. - Т. 81, № 3. - С. 345 - 352.
- Smol?kina O.N., Shishonkova (Velichko) N.S., Fedonenko Yu.P., Zdorovenko E.L., Konnova S.A., Ignatov V.V. An impoved rapid method for preparation of D-rhamnose // Carbohydr. Res. - 2012. - V. 347. - P. 161 - 163.
- Шишонкова (Величко) Н.С., Смолькина О.Н., Чернышова М.П., Игнатов В.В. Выделение и характеристика липополисахарида Herbaspirillumseropedicae Z78 // Известия Саратовского университета. Серия Химия. Биология. Экология. - Саратов: Изд-во Сарат. ун-та, 2011. - Т. 11, Вып. 2. - С. 79 - 85.
- Величко Н.С., Смолькина О.Н., Староверов С.А., Дыкман Л.А., Игнатов В.В. Особенности состава и иммунохимическая характеристика мембранного липополисахарида бактерий Herbaspirillumseropedicae Z78 // Вестник Уральской медицинской академической науки. Тематический выпуск по микробиологии, иммунологии и биотехнологии. - 2011. - Т. 4, № 1. - С. 94.
- Шишонкова (Величко) Н.С., Смолькина О.Н., Игнатов В.В. Выделение и исследование липополисахарида ассоциативных азотфиксирующих бактерий Herbaspirillumseropedicae Z78 // Бюллетень Московского общества испытателей природы. Отдел биологический. - 2009. - Т. 114, Вып. 2. - С.119 - 121.
Статьи в сборниках и тезисы докладов
- Шишонкова (Величко) Н.С., Смолькина О.Н., Игнатов В.В. Выделение и исследование капсульного полисахарида бактерий Herbaspirillumseropedicae Z78 // Биология: от молекулы до биосферы: сборник тезисов / IV Международная конференция молодых ученых. Харьков, 17Ц21 ноября 2009. - Харьков, 2009. - С. 58 - 59.
- Шишонкова (Величко) Н.С., Смолькина О.Н., Игнатов В.В. Исследование липополисахаридов бактерий Herbaspirillumseropedicae Z78 // Современные проблемы физиологии, экологии и биотехнологии микроорганизмов: материалы симпозиума / Всероссийский симпозиум с международным участием. Москва, 24Ц27 декабря 2009. - Москва, 2009. - С. 208.
- Шишонкова (Величко) Н.С. Сравнительная характеристика мембранных и экстраклеточных гликополимеров бактерий Herbaspirillumseropedicae Z78 // Исследования молодых ученых и студентов в биологии и экологии: Сборник научных статей. - Саратов: Изд-во Сарат. Ун-та, 2010. - Вып. 8. - С. 118 - 122.
- Шишонкова (Величко) Н.С., Смолькина О.Н., Игнатов В.В. Характеристика капсульного полисахарида бактерий Herbaspirillumseropedicae Z78 // Стратегия взаимодействия микроорганизмов и растений с окружающей средой: сборник тезисов / V-я Межрегиональная конференция молодых ученых. Саратов, 28 сентября - 1 октября 2010. - Саратов, 2010. - С. 83.
- Шишонкова (Величко) Н.С., Смолькина О.Н., Игнатов В.В.Состав и характеристика полисахаридсодержащих полимеров внешней мембраны бактерийHerbaspirillumseropedicae Z78. // Актуальные вопросы современной науки и образования: материалы конференции / I Общероссийская электронная научная конференция. Красноярск, декабрь 2010. - Красноярск: Изд-во Научно-инновационный центр, 2010. - С. 1051 - 1054.
- Шишонкова (Величко) Н.С., Смолькина О.Н., Игнатов В.В. Экстраклеточные полисахариды бактерий Herbaspirillumseropedicae Z78 // Биология - Наука XXI века: сборник тезисов / 14-я Пущинская международная школа-конференция молодых ученых. Пущино, 19Ц23 апреля 2010. - Пущино, 2010. - С. 72.
- Шишонкова (Величко) Н.С., Смолькина О.Н., Игнатов В.В. Капсульный полисахарид бактерий Herbaspirillumseropedicae Z78 // Студент и научно-технический прогресс: сборник тезисов / XLVIII Международная научная студенческая конференция. Новосибирск, 10Ц14 апреля 2010. - Новосибирск, 2010. - С. 211.
- Шишонкова (Величко) Н.С., Смолькина О.Н., Бурыгин Г.Л., Игнатов В.В. Химическая и иммунохимическая характеристика мембраны, капсульных и экстраклеточных гликополимеров Herbaspirillumseropedicae Z78 // Симбиоз-Россия 2010: сборник тезисов / III Всероссийский с международным участием конгресс студентов и аспирантов-биологов, Нижний Новгород, 24Ц29 мая 2010. - Нижний Новгород, 2010. -
С. 85.
- Shishonkova (Velichko) N.S., Smol'kina O.N., Ignatov V.V. An extracellular and a membrane glycopolymer of the bacterium Herbaspirillum seropedicae Z78 // 5th Postgraduate Course and Minisymposium of AB-RMS,16th Biotechnology Summer School of University of Gdansk, and 2nd Workshop of PAS and RAAS on Plant Molecular Biotechnology. - Finland, Mikkeli, July 24Ц31, 2010. - Р. 17.
- Шишонкова (Величко) Н.С., Смолькина О.Н., Бурыгин Г.Н.,Игнатов В.В. Иммунохимические особенности экстраклеточных и мембранных гликополимеров IV // Симбиоз-Россия 2011: сборник тезисов / IV Всероссийский с международным участием конгресс студентов и аспирантов-биологов. Воронеж, 24Ц29 мая 2011. - Воронеж, 2011. - С. 112.
- Шишонкова (Величко) Н.С., Смолькина О.Н., Дедюкина Д.А., Бурыгин Г.Н.а Игнатов В.В.Иммунохимическая характеристика мембранных и экстраклеточных полисахаридов Herbaspirillumseropedicae Z78 с использованием рекомбинантных антител scFv // Химия и биохимия углеводов: сборник тезисов / 4-й Всероссийская школа-конференция. Саратов, 14Ц16 сентября 2011. - Саратов, 2011. - С. 123.
- Величко Н.С., Смолькина О.Н., Дедюкина Д.А., Игнатов В.В. Характеристика полисахаридов Herbaspirillumlusitanum P6-12 // Перспективные направления физико-химической биологии и биотехнологии: сборник тезисов / XXIV зимняя молодежная научная школа. Москва, 7Ц9 февраля 2012. - Москва, 2012. - С. 70.
а![]()
Подписано в печать 23.05.12. Формат 60?84 1/16. Бумага офсетная.
Гарнитура Times New Roman. Объем 1 усл. печ. л. Тираж 100 экз.
![]()
Отпечатано с готового оригинал-макета в ИБФРМ РАН
410049 Саратов, пр. Энтузиастов, 13
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
