 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Разработка комплекса методов молекулярной диагностики парвовирусной инфекции свиней
Автореферат кандидатской диссертации
На правах рукописи
ЕЛИСЕЕВА
Олеся Васильевна
РАЗРАБОТКА КОМПЛЕКСА МЕТОДОВ МОЛЕКУЛЯРНОЙ ДИАГНОСТИКИ ПАРВОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ
03.01.06 - биотехнология (в том числе бионанотехнологии)
Автореферат
диссертации на соискание учёной степени
кандидата биологических наук
Щёлково - 2012 г.
Работа выполнена в лаборатории молекулярной диагностики ФГБУ Научно-исследовательский институт вирусологии им. Д.И. Ивановского Минздравсоцразвития России, г. Москва
Научный руководитель:аа Гребенникова Татьяна Владимировна - доктор биологических наук, профессор.
Официальные оппоненты: Матвеева Ирина Николаевна - доктор биологических наук, ГНУ Всероссийский научно-исследовательский и технологический институт биологической промышленности, заведующая отделом молекулярной биологии и вирусологии.
Сидорчук Александр Андреевич - лауреат премии Совета Министров СССР, доктор ветеринарных наук, профессор, ФГБОУ ВПО Московская государственная академия ветеринарной медицины и биотехнологии им.К.И. Скрябина, заведующий кафедрой эпизоотологии и инфекционных болезней.
Ведущая организация:аа ФГБУ Федеральный центр охраны здоровья животных.
Защита состоится 25 мая 2012 г. в 10 часов на заседании диссертационного совета по защите диссертаций на соискание учёной степени доктора наук Д 006.069.01 при ГНУ Всероссийский научно-исследовательский и технологический институт биологической промышленности РАСХН по адресу: 141142, Московская обл., Щёлковский район, п/о Кашинцево, пос. Биокомбината, ВНИТИБП; тел./факс: 8 (496) 56-732-63;
e-mail: vnitibp@mail.ru.
С диссертацией можно ознакомиться в библиотеке ГНУ Всероссийский научно-исследовательский и технологический институт биологической промышленности Россельхозакадемии.
Автореферат разослан 24 апреля 2012 г.
Учёный секретарь совета:
кандидат биологических наукаа Фролов Ю.Д.
1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Парвовирус свиней (ПВС) относится к категории важных патогенов, вызывающих нарушения репродуктивной функции свиноматок и наносящих значительный экономический ущерб свиноводческим хозяйствам [Maldonado et al., 2005]. Болезнь клинически проявляется только у супоросных свиноматок и характеризуется малочисленными помётами, гибелью эмбрионов и плодов с рассасыванием и мумификацией, рождением мёртвых плодов, бесплодием, прохолостами и реже абортами [Орлянкин и др., 1986; Сергеев и др., 2007]. У животных других возрастных групп заболевание обычно протекает в латентной форме, но может вызывать кожные поражения у поросят, интерстициальный нефрит у свиней убойного возраста и негнойный миокардит у поросят-сосунов [Kresse et al., 1985; Lager et al.,1994; Whitaker et al.,1990; Drolet et al., 2002; Bolt et al.,1997]. Установлено, что ПВС усиливает проявление клинических признаков синдрома послеотъёмного мультисистемного истощения (СПМИ), одним из возбудителей которого является цирковирус свиней второго типа (ЦВС-2). Наличие двух вирусов приводит к значительному усугублению болезни, вплоть до тяжёлого системного заболевания с летальным исходом [Krakowka et al., 2000].
Для определения ПВС методом реакции гемагглютинации (РГА) на исследование направляют мумифицированные плоды, внутренние органы абортированных плодов длиной не более 15см (до 65-го дня развития). Плоды старше 70-дневного возраста (длиной более 17см) и мёртворожденные поросята не пригодны для выявления вируса, поскольку содержат вирусный антиген, связанный с антителами [Орлянкин и др., 1985; Straw et al., 1999].
В последнее время для диагностики широко применяют метод полимеразной цепной реакции (ПЦР), основанный на ферментативной амплификации специфических участков генома [Гребенникова и др., 2008; Molitor et al.,1991]. Данный метод чувствительный, специфичный, прост в исполнении и, кроме того, позволяет выявлять вирус, несмотря на его связанность с антителами.
Также широкое распространение получает метод ПЦР в реальном времени, который обладает рядом преимуществ по сравнению с обычной ПЦР, сокращая время проведения анализа и снижая риск контаминации. Также ПЦР в реальном времени позволяет проводить количественный анализ.
Таким образом, разработка комплекса методов молекулярной диагностики ПВИС на основе ПЦР и ПЦР в реальном времени, а также разработка теста, позволяющего одновременно выявлять и дифференцировать ПВС и ЦВС-2, являются актуальными направлениями ветеринарной диагностики.
Цель и задачи исследований. Цель исследований: разработка комплекса методов молекулярной диагностики ПВИС и дифференцирования ПВС и ЦВС-2. В соответствии с поставленной целью необходимо было решить следующие задачи:
- Разработать диагностическую ПЦР тест-систему для выявления ПВС на основе анализа нуклеотидных последовательностей гена неструктурного белка NS1.
- Разработать диагностическую ПЦР тест-систему в реальном времени для выявления ПВС на основе анализа нуклеотидных последовательностей гена неструктурного белка NS1.
- Провести сравнительный анализ диагностических тест-систем на основе ПЦР, ПЦР в реальном времени и метода РГА.
- Разработать тест-систему на основе множественной ПЦР в реальном времени для одновременного обнаружения и дифференцирования ПВС и ЦВС-2.
- Разработать рекомбинантные положительные контроли для использования в качественном и количественном анализе.
- С помощью разработанных тест-систем провести исследование образцов от животных.
Научная новизна работы.
Проведен сравнительный анализ последовательностей геномов различных штаммов ПВС. Разработаны специфические праймеры и зонды на консервативный участок генома данного вируса.
Впервые в РФ предложен способ диагностики ПВИС на основе молекулярных методов ПЦР и ПЦР в реальном времени.
Впервые в РФ разработана методика количественного определения ПВС в образцах от животных на основе ПЦР в реальном времени.
Впервые в РФ разработан множественный вариант ПЦР в реальном времени, позволяющий одновременно выявлять ПВС и ЦВС-2.
Практическая значимость работы.
Разработан комплекс методов молекулярной диагностики ПВИС и дифференцирования ПВС и ЦВС-2.
Разработанная Тест-система для обнаружения парвовируса свиней методом полимеразной цепной реакции сертифицирована во Всероссийском Государственном Центре качества и стандартизации лекарственных средств для животных и кормов (ФГБУ ВГНКИ). Инструкция по применению от 21.05.2009, СТО 42418073-002-2007. Данная тест-система широко применяется на территории РФ с 2007г.
Тест - система для обнаружения парвовируса свиней методом ПЦР в реальном времени успешно прошла доклинические исследования и клинические испытания с использованием образцов от животных. Подготовлена необходимая нормативная документация для регистрации в РФ.
По результатам доклинических исследований Тест - система для обнаружения и дифференцирования ПВС и ЦВС-2 методом множественной ПЦР в реальном времени показала высокую чувствительность и специфичность и может быть представлена для широких клинических испытаний с использованием образцов от животных.
Основные положения, выносимые на защиту:
- Возможность выявления ПВС с помощью диагностической ПЦР тест-системы на основе анализа нуклеотидных последовательностей гена неструктурного белка NS1.
- Возможность выявления ПВС с помощью диагностической ПЦР тест-системы в реальном времени на основе анализа нуклеотидных последовательностей гена неструктурного белка NS1.
- Высокая диагностическая чувствительность разработанных тест-систем на основе ПЦР, ПЦР в реальном времени в сравнении с методом РГА.
- Возможность одновременного выявления ПВС и ЦВС-2 с помощью диагностической тест - системы на основе множественной ПЦР в реальном времени.
- Возможность применения рекомбинантных положительных контролей для качественного и количественного обнаружения ПВС и ЦВС-2 в тест-системах на основе ПЦР и ПЦР в реальном времени.
- Возможность использования тест - систем на основе ПЦР и ПЦР в реальном времени для диагностики ПВИС.
Апробация работы. Основные положения диссертационной работы отражены в итоговых отчётах ФГБУ НИИ вирусологии им. Д.И.Ивановского Минздравсоцразвития России за 2005-2011 гг. Материалы доложены и обсуждены на заседаниях учёного совета ФГБУ НИИ вирусологии им. Д.И.Ивановского Минздравсоцразвития России за 2005-2011 гг., а также на заседании отдела прикладной вирусологии ФГБУ НИИ вирусологии им. Д.И.Ивановского Минздравсоцразвития России 28 марта 2012г.
Публикации научных исследований. По результатам диссертации опубликовано 6 печатных работ, в том числе 3 статьи в журналах, входящих в перечень ВАК.
Объём и структура диссертации. Материалы диссертации изложены на 115 страницах машинописного текста и содержат: введение, обзор литературы, собственные исследования, обсуждение результатов, выводы, список литературы и приложения. Работа иллюстрирована 16 таблицами и 11 рисунками. Список литературы включает 161 источник, в том числе 18 отечественных и 143 зарубежных авторов.
2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
2.1. Материалы и методы
Исследуемые образцы. Для разработки тест - систем использовали эпизоотический штамм Ил-82 парвовируса свиней (ПВС) любезно предоставленный Орлянкиным Б.Г. Для выращивания ПВС применяли перевиваемую линию клеток почек эмбрионов свиней (ППЭС). Культуру клеток выращивали в среде ДМЭМ, содержащей 5 % сыворотки эмбрионов коровы. Накопление вируса оценивали по гемагглютинирующей активности с использованием эритроцитов морской свинки.
Для проведения ПЦР и ПЦР в реальном времени использовали 20% суспензию паренхиматозных органов абортированных и мумифицированных плодов, мёртворожденных, павших поросят, кровь и сыворотку крови свиноматок, полученные из свиноводческих хозяйств РФ (Пермской обл., Волгоградской обл., Московской обл., респ. Татарстан). Для исследования специфичности тест-систем использовали вирус классической чумы свиней (КЧС): вакцинный шт. КС, любезно предоставленный Сергеевым В.А., ЦВС-2 шт. ISU-31, вирус репродуктивно-респираторного синдрома свиней (РРСС) шт. Lelystad, NADC-2, вирус болезни Ауески шт. К юбезно предоставленные В. Менгелингом (NADC, Iowa, США), вирусы гриппа А подтип H9N2 шт. A/swine/HongKong/9/98, шт. A/Moscow/01/09 swine-like были получены из коллекции вирусов ФГБУ НИИ вирусологии им. Д.И.Иавновского. Микроорганизмы Leptospira (серогруппы, Pomona, Tarassovi, Icterohaemorrhagia), Escherichia coli (серогруппы О8, О9, О138, О139, О78, О141, О147), Mycoplasma hyopneumoniae, Pasteurellа multocida (серовары А, В, Д), Chlamydophilaabortus, pecorum, Chlamydiasuis, Salmonella сholeraesuis, typhimurium, Toxoplasmagondii были получены из Международной коллекции микроорганизмов (США).
Выделение ДНК из вируссодержащей культуры клеток ППЭС, органов и тканей свиней проводили, используя набор для выделения с применением неорганического сорбента (ООО Ветбиохим, Россия).
Праймеры. Анализ нуклеотидной последовательности референтных штаммов ПВС проводили с использованием информационной базы данных GenBank при помощи программ AssemblyLign, Oligo 4.0, BioEdit 7.0.1 (США). Подбор праймеров проводили с использованием компьютерных программ Amplify 1.0, Oligo 4.0 (США).
ПЦР проводили в объёме 25 мкл. Реакционная смесь содержала 10ммоль Tris-HCl (pH 9.0), 50 ммоль KCl, 0.1% Triton X-100, 1.5ммоль MgCl2, 10пмоль каждого праймера, 0.25ммоль каждого dNTP, 1.25ед. Taq-полимеразы и 5 мкл выделенной ДНК. Результаты ПЦР анализировали методом электрофореза в агарозном геле.
ПЦР в реальном времени проводили в объёме 25 мкл. Реакционная смесь содержала 10ммоль Tris-HCl (pH 9.0), 50 ммоль KCl, 0.1% Triton X-100, 1.5ммоль MgCl2, 10пмоль каждого праймера, 5пмоль зонда, 0.25ммоль каждого dNTP, 1.25ед. Taq-полимеразы и 5 мкл матрицы ДНК. Постановку ПЦР в реальном времени и учёт результатов проводили с использованием детектирующего амплификатора ДТ-96 (НПО ДНК-Технология, Россия).
Множественную ПЦР в реальном времени проводили в объёме 25 мкл. Реакционная смесь содержала 10ммоль Tris-HCl (pH 9.0), 50 ммоль KCl, 0.1% Triton X-100, 1.5ммоль MgCl2, 20пмоль каждого праймера, 10пмоль каждого зонда, 0.5ммоль каждого dNTP, 1.25ед. Taq-полимеразы и 5 мкл матрицы ДНК. Постановку реакции и учёт результатов проводили с использованием детектирующего амплификатора ДТ-96 (НПО ДНК-Технология, Россия).
Для конструирования рекомбинантных плазмид использовали те же праймеры, что и при разработке соответствующих тест-систем. В качестве матрицы использовали ДНК, выделенную из культуральных ПВС и ЦВС-2. Амплифицированые фрагменты ДНК выделяли из геля с использованием набора для очистки ПЦР-продуктов (лFermentas, Литва) согласно методике производителя.Для получения рекомбинантных плазмид использовали плазмидный вектор pGEM T-Easy (лPromega, США). Для выделения плазмидной ДНК использовали набор фирмы Promega, (США). Выделение проводили в соответствии с инструкцией производителя. Массовую концентрацию раствора рекомбинантной плазмиды определяли на спектрофотометре при длине волны ?=260 нм. Молекулярную концентрацию n (молекул/мкл) рассчитывали из массовой по формуле:
n = (С ? NA) / (Xп. о. ? M1 п. о.),
где n (молекул/мкл) - молекулярная концентрация плазмиды; С (г/мкл) - массовая концентрация плазмиды в растворе; NA = число Авогадро; Xп. о. = число пар нуклеотидных оснований (п. о.) в составе плазмиды; M1 п. о. = 660 (г/моль) - средняя молярная масса 1 п.о.
Определение нуклеотидных последовательностей. Для подтверждения конструирования рекоминантные плазмиды секвенировали с использованием стандартных праймеров М13: прямого 5'-gtaaaacgacggccagt-3' и обратного 5'-caggaaacagctatgac-3'.
Определение нуклеотидных последовательностей проводили на автоматическом секвенаторе ДНК (Applied Biosystems 3130, США) и анализировали с использованием компьютерных программ MacVector/AssemblyLign (Accelrys Inc., США), BioEdit 7.0.1.
Реакцию гемагглютинации ставили микрометодом в лунках полистироловых планшет с U-образным дном в объёме 50 мкл. В РГА использовали 0.75% суспензию эритроцитов морской свинки. Кровь брали общепринятыми методами, помещали в раствор Альсевера или 4% раствор цитрата натрия в соотношении 1:10 и хранили при 40С в течение 2-3 недель. Перед постановкой реакции эритроциты трижды отмывали фосфатным cолевым буферным раствором ФБР (рН 7.2-7.4) и готовили из них суспензию необходимой концентрации.
Статистическая обработка результатов. Анализ и статистическую обработку результатов проводили с использованием программы Microsoft Excel, входящую в пакет программ Microsoft office, 2007. Обработку данных ПЦР в реальном времени проводили с помощью программного обеспечения RealTime_PCR v 7.3 детектирующего амплификатора ДТ-96 (НПО ДНК-Технология, Россия).
2.2. Результаты собственных исследований
2.2.1. Разработка тест - системы на основе ПЦР для обнаружения ДНК парвовируса свиней
Подбор праймеров и оптимизация условий проведения ПЦР. Для подбора праймеров использовали участки гена белка NS1, которые являются наиболее консервативными для известных штаммов ПВС. Всего использовали 16 различных последовательностей гена белка NS1. На основе сравнительного компьютерного анализа последовательностей подбирали праймеры для проведения ПЦР (табл. 1).
Таблица 1
Набор праймеров, специфичных гену белка NS1парвовируса свиней
Название праймеров |
Последовательность праймеров |
Величина фрагмента ДНК |
PPV-F |
TAG TTG GTA ATG TTG GTT GC |
356 п.о. |
PPV-R |
CTT TAC CAA CCA AGC ACA TA |
|
PPV-F' |
ACC AAA AAG GTA AAG GAA GCA |
157 п.о. |
PPV-R' |
CTA AAA GTC CAA AAT CAC CTG |
В ходе оптимизации условий амплификации определили, что данные праймеры работают специфически в реакционной смеси со стандартной концентрацией MgCl2 (1.5 ммоль) при выбранных температурно-временных режимах (табл. 2).
Таблица 2
Температурно-временные режимы, использованные для проведения ПЦР
Первая амплификация |
|||
Температурно-временные режимы |
Количество циклов |
||
Пауза |
940С |
|
|
Цикл |
940С 620С 720С |
30 сек 30 сек 30 сек |
35 |
Цикл |
720С |
7 мин |
1 |
Вторая амплификация |
|||
Пауза |
940С |
|
|
Цикл |
940С 580С 720С |
30 сек 30 сек 30 сек |
35 |
Цикл |
720С |
7 мин |
1 |
Определение специфичности ПЦР тест-системы. Специфичность тест-системы исследовали, используя панель образцов, содержащую гетерологичные вирусы и бактерии, которые вызывают нарушения воспроизводительной функции свиноматок. В качестве положительного контроля использовали культуру клеток ППЭС, заражённую ПВС (титр в РГА 1:2048). В качестве отрицательного контроля использовали незаражённую культуру клеток ППЭС и стерильный физиологический раствор (табл. 5).
Полученные результаты демонстрируют 100% специфичность разработанной тест-системы на основе ПЦР для обнаружения ПВС.
Определение чувствительности ПЦР тест-системы. При исследовании чувствительности проводили два варианта ПЦР: одностадийный и гнездовой. Гнездовой вариант повышает чувствительность метода по сравнению с одностадийным. Однако при проведении двух стадий амплификации возрастает риск контаминации, а также увеличивается время проведения анализа.
В качестве исследуемого материала брали культуральную жидкость, содержащую ПВС с титром в РГА 1:4096 (107 - 108 ТИД50/мл). Готовили её десятикратные разведения в культуре клеток ППЭС. Пределом чувствительности считали последнее разведение, в котором при проведении электрофореза обнаруживался специфический фрагмент ДНК. При исследовании чувствительности двух вариантов ПЦР выяснили, что одностадийная ПЦР выявляет ДНК ПВС в разведении до 10-6, что соответствует 101 - 102ТИД50/мл; гнездовой вариант ПЦР выявляет ДНК ПВС в разведении до 10-8, что соответствует 101 - 10-1 ТИД50/мл. При анализе чувствительности двух вариантов определили, что для обнаружения ПВС достаточно проведения одностадийной ПЦР (рис.1). аа
аа 1а а2 3аа 4 5аа 6а 7 8 9а 10
а Рис. 1. Чувствительность одностадийной ПЦР, на матрице ДНК парвовируса свиней.
![]() 1 - метчик молекулярного веса pUC19/MspI; 2 - культура клеток ППЭС, заражённая ПВС (титр в РГА 1:4096); 3 - 9 - культура клеток ППЭС, заражённая ПВС (10-1-10-7); 10 - незаражённая культура клеток ППЭС.
1 - метчик молекулярного веса pUC19/MspI; 2 - культура клеток ППЭС, заражённая ПВС (титр в РГА 1:4096); 3 - 9 - культура клеток ППЭС, заражённая ПВС (10-1-10-7); 10 - незаражённая культура клеток ППЭС.
Также для определения чувствительности тест-системы использовали рекомбинантную плазмиду, содержащую фрагмент генома ПВС (п.2.2.4). Определяли её молекулярную концентрацию (молекул/мкл) и готовили серию растворов с диапазоном концентраций 2,3?1010 -2,3?10. В ходе работы определили чувствительность тест-системы, которая составила 2,3?103 амолекул/мкл. 4а 5а 6аа 7а 8
Обнаружение ПВС в образцах от животных. Изучили возможность выявления ДНК ПВС в образцах от животных методом ПЦР. За период времени с 2005 по 2007 год методами ПЦР и РГА был исследован 171 образец от свиней, полученный из свиноводческих хозяйств РФ. Из них 4% оказались положительными (рис.2 А). Все положительные образцы в РГА были положительными в ПЦР. Однако положительных образцов, исследованных методом ПЦР, оказалось больше, поскольку данный метод позволяет использовать для диагностики плоды любого возраста, а также органы мёртворожденных поросят и цельную кровь (рис. 2Б).
А
аа
Б
а а а
а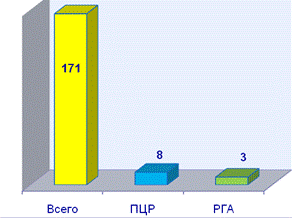
Рис.2. Исследование образцов от животных на наличие ПВС методами ПЦР и РГА. А- ![]() а- положительные образцы;
а- положительные образцы; ![]() а- отрицательные образцы; Б - выявление ПВС методами ПЦР и РГА.
а- отрицательные образцы; Б - выявление ПВС методами ПЦР и РГА.
Таким образом, разработанная тест-система для обнаружения ПВС на основе ПЦР пригодна для выявления ПВС в пробах, полученных от животных.
2.2.2. Разработка тест - системы на основе ПЦР в реальном времени
для обнаружения ДНК ПВС
Подбор праймеров и оптимизация условий. Для подбора праймеров и зондов использовали последовательность гена белка NS1. Подобрали две пары праймеров и три специфических зонда. Зонды метили на 5'-конце флуорофором FAM и на 3'-конце гаситетелем флуоресценции BHQ1 (табл. 3).
В ходе работы определили, что комбинация праймеров rt PPV-F, rt PPV-R и зонда Probe-rt PPV показала большую чувствительность и специфичность по сравнению с другими комбинациями.
Таблица 3
Праймеры и зонды, специфичные гену белка NS1парвовируса свиней
Название праймеров |
Последовательность праймеров и зондов |
F-NS1 |
CAA CAA TGG CTA GCT ATA TGC A |
R-NS1 |
CTC CTC CCA TTT TTC GGA C |
Probe-NS1-1 |
Fam - GG GAA ATG TAC CTG ATT GGT CCG AA - BHQ1 |
Probe-NS1-2 |
Fam - TG GGG AAA TGT ACC TGA TTG GTC CG - BHQ1 |
rt PPV-F |
CCA AAA ATG CAA ACC CCA ATA |
rt PPV-R |
TCT GGC GGT GTT GGA GTT AAG |
Probe-rt PPV |
Fam - CT TGG AGC CGT GGA GCG AGC C - BHQ1 |
Для оптимизации условий проведения ПЦР в реальном времени брали десятикратные разведения культуральной жидкости, содержащей ПВС (титр в РГА 1:1024) и проводили реакцию. Результаты отражались на экране монитора в виде графика зависимости роста интенсивности флуоресценции от количества циклов. Выбрали оптимальный температурно-временной режим для праймеров и зондов (табл. 4).
Таблица 4
Температурно-временной режим для проведения
ПЦР в реальном времени
Температурно-временные режимы |
Количество циклов |
||
Цикл |
940С |
5 мин |
1 |
Цикл |
940С 600С 720С |
15 сек 15 сек 1 мин* |
35 |
* - регистрация флуоресценции
Чувствительность и специфичность тест-системы ПЦР в реальном времени исследовали с использованиемдесятикратных разведений культуральной жидкости, содержащей ПВС (титр в РГА 1:2048, 106-107 ТИД50/мл). Пределом чувствительности считали последнее разведение вируса, в котором при проведении реакции наблюдается увеличение роста кривой флуоресценции. При оценке чувствительности выяснили, что ПЦР в реальном времени выявляет ДНК ПВС в разведении до 10-5, что соответствует примерно 101Ц102 ТИД50/мл (рис.3).
7
а5
а6
а4
а3
а2
а1
а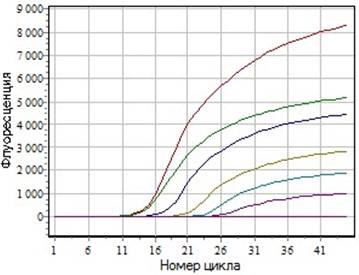 Рис. 3. Чувствительность ПЦР в реальном времени на матрице ДНК ПВС (106-107 ТИД50/мл).
Рис. 3. Чувствительность ПЦР в реальном времени на матрице ДНК ПВС (106-107 ТИД50/мл).Кривые флуоресценции соответствуют положительным результатам обнаружения ДНК ПВС. 1 - культура клеток ППЭС, заражённая ПВС (титр в РГА 1:2048); 2 - 6 - культура клеток ППЭС, заражённая ПВС (10-1-10-5), 7-незаражённая культура клеток ППЭС.
Также для определения чувствительности использовали рекомбинантную плазмиду, содержащую фрагмент генома ПВС (п.2.2.4). Определяли её молекулярную концентрацию (молекул/мкл) и готовили серию растворов с диапазоном концентраций 3,7?1010-3,7?10. В серии экспериментов определили чувствительность разработанной тест-системы, которая составила 3,7?101 амолекул/мкл (рис.4).
1
а2
а3
а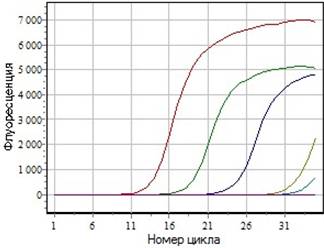 Рис 4. Чувствительность ПЦР в реальном времени на матрице разведений рекомбинантной плазмиды.
Рис 4. Чувствительность ПЦР в реальном времени на матрице разведений рекомбинантной плазмиды.
4
а Кривые флуоресценции соответствуют разведениям плазмиды. 1-3,7?108;2- 3,7?106; 3-3,7?104; 4-3,7?102;
5
а5-3,7?101; 6-деионизованная вода
6
ааДля проведения количественного анализа строили калибровочный график с использованием стандартных растворов рекомбинантной плазмиды с известной концентрацией. График выражал линейную зависимость значений порогового цикла Ct от концентрации ДНК. По значению порогового цикла с помощью компьютерной программы проводили расчёт концентрации ДНК ПВС в нескольких положительных пробах от животных. Концентрации ДНК ПВС в исследуемых пробах составили (молекул/мкл): проба 1 - 1,4?104, проба 2 - 1,7?104 , проба 3 - 4,2?103, проба 4 - 8,4?109
(рис. 5).
1
а2
а3
а Рис. 5. Определение количества ПВС (молекул/мкл) в пробах от животных.
Рис. 5. Определение количества ПВС (молекул/мкл) в пробах от животных.
4
а
![]() а- исследуемые образцы.
а- исследуемые образцы.
1-1,4?104; 2-1,7?104; а3-4,2?103; 4-8,4?109
lg количества молекул в мкл
ааСпецифичность тест-системы исследовали с использованием панели образцов описанной в п. 2.2.1. (табл. 5).
Таблица 5
Специфичность тест-систем на основе ПЦР и ПЦР в реальном времени
Исследуемый материал |
Детекция ДНК парвовируса свиней методом ПЦР |
Детекция ДНК парвовируса свиней методом ПЦР в реальном времени |
Культура клеток ППЭС, заражённая ПВС шт. Ил-82 |
+ |
+ |
Вирус РРСС шт. Lelуstad, NADC-2 |
- |
- |
Вирус КЧС шт. КС |
- |
- |
ЦВС-2 шт. ISU-31 |
- |
- |
Вирус гриппа А A/swine/HongKong/9/98, A/Moscow/01/09 swine-like |
- |
- |
Вирус болезни Ауески шт. К |
- |
- |
Leptospira(серогр.Pomona,Tarassovi,Icterohaemorrhagia) |
- |
- |
E. coli (серогр.О8, О9, О138, О139, О78, О141, О147) |
- |
- |
Mycoplasma hyopneumoniae |
- |
- |
Pasteurella multocida (серовары А, В, Д) |
- |
- |
Chlamydophila abortus, pecorum. Chlamydia suis |
- |
- |
Salmonella сholeraesuis, typhimurium |
- |
- |
Toxoplasmagondii |
- |
- |
Незаражённая культура клеток ППЭС |
- |
- |
Стерильный физиологический раствор |
- |
- |
Результаты исследований показали, что разработанные праймеры и зонд специфически реагируют только с ПВС, не дают перекрёстной реакции с другими вирусными и бактериальными патогенами и демонстрируют 100 % специфичность разработанной тест-системы.
Обнаружение ПВС в образцах от животных с помощью ПЦР тест-системы в реальном времени. За период времени с 2010 по 2011 год исследовали 206 образцов, включая цельную кровь, сыворотку крови свиноматок с нарушением репродуктивной функции, суспензии паренхиматозных органов абортированных и мёртворожденных поросят, полученные из свиноводческих хозяйств РФ. Количество положительных образцов составило 4%. Наличие ДНК ПВС в положительных пробах подтвердили с помощью ПЦР тест-системы, разработанной нами ранее. Результаты исследований представлены на рисунке 6.
 Рис. 6. Обнаружениеа ПВС в полевых образцах методом ПЦР в реальном времени.
Рис. 6. Обнаружениеа ПВС в полевых образцах методом ПЦР в реальном времени.
![]() а- положительные образцы;
а- положительные образцы;
![]() а- отрицательные образцы.
а- отрицательные образцы.
Таким образом, разработанная тест-система ПЦР в реальном времени пригодна для обнаружения ПВС в пробах, полученных от животных.
Сравнительный анализ разработанных диагностических тест-систем на основе ПЦР, ПЦР в реальном времени и РГА. В ветеринарных лабораториях РФ для выявления ПВС преимущественно используется метод РГА. В нашей работе мы провели сравнительный анализ чувствительности разработанных тест-систем и метода РГА (табл. 6). В качестве исследуемого материала брали десятикратные разведения культуральной жидкости, содержащей ПВС (титр в РГА 1:1024) и исследовали методами ПЦР, ПЦР в реальном времени и РГА.
Таблица 6
Сравнение чувствительности методов ПЦР, ПЦР в реальном времени и РГА
Разведения культуры клеток ППЭС, заражённой ПВС (титр в РГА 1:1024) |
Метод исследования |
||
ПЦР в реальном времени |
ПЦР |
РГА |
|
исх. |
+ |
+ |
+ |
10-1 |
+ |
+ |
+ |
10-2 |
+ |
+ |
+ |
10-3 |
+ |
+ |
+ |
10-4 |
+ |
+ |
- |
10-5 |
+ |
- |
- |
10-6 |
- |
- |
- |
10-7 |
- |
- |
- |
Культура клеток ППЭС |
- |
- |
- |
Данные, приведенные в таблице, показывают, что чувствительность методов уменьшается на порядок в ряду: ПЦР в реальном времени > ПЦР > РГА.
Также сравнили результаты, полученные методами ПЦР, ПЦР в реальном времени и РГА, при исследовании панели образцов, содержащей различные биологические образцы. Результаты сравнения методов представлены в таблице 7.
Таблица 7
Обнаружение парвовируса свиней методами ПЦР,
ПЦР в реальном времени и РГА
Исследуемый материал |
Титр в РГА |
ПЦР |
ПЦР в реальном времени |
Культура клеток ППЭС, заражённая ПВС |
1:1024 (+) |
+ |
+ |
20% суспензия внутренних органов павших поросят |
1:2 (-) |
+ |
+ |
20% суспензия мумифицированных плодов |
1:512 (+) |
+ |
+ |
20% суспензия внутренних органов плодов здоровых животных |
- |
- |
- |
Культура клеток ППЭС |
- |
- |
- |
Стерильный физиологический раствор |
- |
- |
- |
Анализ проведённых исследований показал, что результаты, полученные различными методами, коррелируют между собой. Однако положительный результат в ПЦР и ПЦР в реальном времени при отрицательном результате в РГА свидетельствует о возможности определения возбудителя, агрегированного с антителами, демонстрируя тем самым преимущество молекулярных методов.
2.2.3. Разработка тест-системы на основе множественной ПЦР в реальном времени для обнаружения и дифференцирования
ПВС и ЦВС-2
Значительный экономический ущерб свиноводческим хозяйствам наносят цирковирусные заболевания свиней. Из них наиболее распространенным заболеванием свиней является СПМИ. Одним из главных возбудителей данного заболевания является ЦВС-2 [Allan et. аl., 2000; Choi et. аl., 2000]. Однако патологии, обусловленные только этим возбудителем, развиваются не часто. Наличие сопутствующих факторов: ПВС, вируса РРСС, бактерий рода Mycoplasmataceae, иммуностимуляции, стресса, нарушения питания и содержания приводит к усугублению болезни, вплоть до летального исхода [Allan et. аl., 1999; Kennedy et. al, 2000].
Учитывая основную роль ЦВС-2 в этиологии СПМИ, влияние ПВС на степень протекания инфекции, сходную клиническую картину, мы разработали диагностическую тест-систему на основе множественной ПЦР в реальном времени для выявления и дифференцирования ПВС и ЦВС-2.
Оптимизация условий проведения множественной ПЦР в реальном времени. Для обнаружения ПВС праймеры подбирали на участки генома ПВС, кодирующие белок NS1 и на участки генома ЦВС-2, захватывающие часть открытой рамки считывания 1 и часть участка начала репликации вирусного генома. Данные области являются высококонсервативными и позволяют выявлять все известные штаммы вирусов. При выборе зондов в ходе оптимизации условий проведения множественной ПЦР в реальном времени подбирали такую комбинацию флуорофоров, которая позволила независимо регистрировать накопление нескольких продуктов ПЦР в одной пробирке. Данный подбор флуорофоров осуществляли по принципу минимизации перекрывания спектров поглощения и испускания разных флуорофоров. Это делали для исключения перекрёста отдельных каналов регистрации флуоресценции. Учитывая эти особенности, зонд для обнаружения ПВС метили на 5'-конце флуорофором FAM и на 3'-конце гасителем флуоресценции BHQ1, зонды для обнаружения ЦВС-2 метили на 5'-конце флуорофорами HEX и R6G и на 3'-конце гасителем флуоресценции BHQ2 (табл. 8).
Таблица 8
Праймеры и зонды для выявления ПВС и ЦВС-2 методом
ПЦР в реальном времени
Название праймеров |
Последовательность праймеров и зондов |
rt PPV-F |
CCA AAA ATG CAA ACC CCA ATA |
rt PPV-R |
TCT GGC GGT GTT GGA GTT AAG |
Probe-rt PPV |
FAM - CT TGG AGC CGT GGA GCG AGC C - BHQ1 |
rt PCV2-F |
ATG CTC TCT ATC GGA GGA TTA C |
rt PCV2-R |
ATA TAA AAA CCA TTA CGA TGT GAT A |
Probe- PCV2-1 |
HEX - CCA TGC CCT GAA TTT CCA TAT GAA AT - BHQ2 |
Probe- PCV2-2 |
R6G - CCA TGC CCT GAA TTT CCA TAT GAA AT - BHQ2 |
Подбирали оптимальную комбинацию праймеров и зондов. Для этого использовали десятикратные последовательные разведения рекомбинантных плазмид, содержащие фрагменты геномов ПВС и ЦВС-2 (п.2.2.4). При анализе графиков роста интенсивности флуоресценции различных комбинаций праймеров и зондов достоверных различий между ними выявлено не было. Для дальнейшей работы выбрали комбинацию зондов, меченных флуорофорами FAM (для ПВС) и R6G (для ЦВС-2).
В ходе оптимизации температурно-временного режима проведения реакции обращали внимание на то, чтобы температуры отжига обеих пар праймеров (Tа) различались не более чем на 20С, а Tа зонда была на 100С выше Tа праймеров. Расчётная температура отжига праймеров и зондов составила 550С и 610С соответственно. Оптимизацию условий множественной ПЦР в реальном времени проводили с использованием Tа, находящихся в интервале 55-610С. Эффективность реакции при исследовании различных Tа была одинаковой. Для дальнейшей работы использовали среднюю Tа = 580С.
Выбранные оптимальные температурно-временные режимы для обеих пар праймеров и зондов представлены в таблице 9.
Таблица 9
Температурно-временные режимы для проведения множественной
ПЦР в реальном времени
Температурно-временные режимы |
Количество циклов |
||
Цикл |
940С |
5 ми |
1 |
Цикл |
940С 580С 720С |
15 сек 15 сек 1 мин * |
40 |
* - регистрация флуоресценции
В ходе работы определили, что для эффективного проведения множественной ПЦР в реальном времени необходимо увеличение концентрации специфических и неспецифических компонентов реакционной смеси. Определили, что оптимальной является реакционная смесь с содержанием 20пмоль каждого праймера, 10пмоль каждого зонда, 0.5ммоль каждого dNTP. Также выявили, что данные праймеры и зонды работают специфически в реакционной смеси с концентрацией MgCl2 (1.5 ммоль).
Определение чувствительности тест-системы. Для исследования чувствительности брали десятикратные разведения рекомбинантных плазмид, содержащие фрагменты геномов ПВС и ЦВС-2. Пределом чувствительности считали последнее разведение плазмиды, при котором наблюдается увеличение роста кривой флуоресценции.
При оценке чувствительности выяснили, что множественная ПЦР в реальном времени выявляет ДНК ПВС в разведении рекомбинантной плазмиды до 10-8, что соответствует примерно 102 молекул/мкл и ДНК ЦВС-2 в разведении рекомбинантной плазмиды до 10-7, что соответствует примерно 103 молекул/мкл (рис. 7).
А
Б
1010
106
109
107
105
103
108
102
103
105
106
107
108
1010
109
а
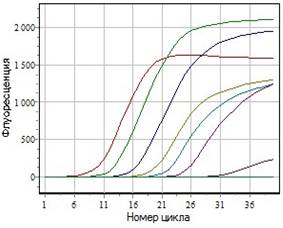
Рис. 7. Чувствительность множественной ПЦР в реальном времени для выявления и дифференциации ПВС и ЦВС-2. А- зависимость флуоресценции канала FAM от номера цикла; Б- зависимость флуоресценции канала HEX от номера цикла. 102-1010 Цзначения концентраций ДНК, молекул/мкл.
Таким образом, результаты исследований разработанной тест-системы показали, что она может быть использована для лабораторной диагностики с целью одновременного выявления и дифференцирования ДНК ПВС и ЦВС-2.
2.2.4. Конструирование рекомбинантных плазмид
Три рекомбинантные плазмиды: PPV, rt PPV и PCV2 получили с помощью векторной системы клонирования продуктов ПЦР - pGEM-T-Easy (лPromega, США). С использованием праймеров PPV-F, PPV-R и rt PPV-F, rt PPV-R амплифицировали фрагменты участка гена NS1 ПВС для клонирования. С использованием праймеров rt PCV2-F и rt PCV2-R амплифицировали фрагмент генома ЦВС-2. Полученные фрагменты выделили из геля, очистили и встроили в искусственные векторы pGEM-T Easy.
После трансформации клеток E.coli (шт. TopTen) лигазной смесью получили колонии, содержащие рекомбинантные плазмиды. Плазмиды, положительные при исследовании в ПЦР, секвенировали для подтверждения правильности клонирования. Полученные плазмиды использовали для оценки чувствительности тест-систем, а также в количественном анализе.
Массовую концентрацию плазмид определяли спектрофотометрически при длине волны ?=260 нм. Среднее значение концентраций рассчитывали по результатам 6-ти измерений. Молекулярные концентрации пересчитывали из массовых в соответствии с формулой (п.2.1.). Результаты измерений и расчётов приведены в таблице 10.
Таблица 10
Массовые и молекулярные концентрации рекомбинантных плазмид
Исследуемый образец |
Массовая концентрация, мкг/мкл |
Средняя массовая концентрация, мкг/мкл |
Молекулярная концентрация, молекул/мкл |
Плазмида PPV |
0,085 0,088 0,084 0,086 0,084 0,090 |
0,086 |
2,3 ? 1010 |
Плазмида rt PPV |
0,11 0,11 0,12 0,14 0,16 0,15 |
0,13 |
3,7 ? 1010 |
Плазмида PCV2 |
0,065 0,063 0,072 0,070 0,064 0,068 |
0,067 |
1,91 ? 1010 |
Для определения чувствительности разработанных тест-систем делали серию последовательных десятикратных разведений плазмид (до 10-10) и проводили ПЦР и ПЦР в реальном времени.
Важным преимуществом метода ПЦР в реальном времени является возможность проведения количественного анализа, для которого необходимо построение калибровочного графика. При этом используют стандартные растворы с известной концентрацией матрицы. Калибровочная кривая отражает линейное отношение между значением порогового цикла Ct аи количеством копий матрицы ДНК. Определение концентрации матрицы в неизвестных образцах проводят на основе значений их Ct. Точность результатов при этом зависит от качества и стабильности стандартных растворов. В нашей работе для количественного выявления ПВС методом ПЦР в реальном времени мы использовали рекомбинантную плазмиду rt PPV.
Рекомбинантные плазмиды также могут быть использованы в качестве положительных контролей в диагностических тест-системах на основе ПЦР и ПЦР в реальном времени. Данные контроли обладают высокой специфичностью, поскольку содержат фрагмент вирусного генома, но вместе с тем безопасны для окружающей среды, человека и животных. Наличие положительных контролей в составе тест-систем облегчает интерпретацию полученных результатов, повышает их надёжность, обеспечивает проверку работы компонентов реакции, а также работы оператора.
В нашей работе рекомбинантные плазмиды со вставками фрагментов геномов ПВС и ЦВС-2 использовали в качестве положительных контролей в разработанных тест-системах. При проведении ПЦР использовали средние разведения рекомбинантных плазмид, которые дали положительный результат.
3. ВЫВОДЫ
- Разработана диагностическая Тест-система для обнаружения парвовируса свиней методом полимеразной цепной реакции на основе консервативной последовательности гена неструктурного белка NS1. Специфичность данной тест-системы, исследованная на панели контрольных образцов, составила 100%. Чувствительность тест-системы составила 2,3?103 амолекул/мкл исследуемого образца.
- Разработана диагностическая Тест-система для обнаружения парвовируса свиней методом полимеразной цепной реакции в реальном времени на основе консервативной последовательности гена неструктурного белка NS1. Специфичность данной тест-системы составила 100%. Чувствительность тест-системы составила 3,7?101 амолекул/мкл исследуемого образца.
- Сравнительный анализ разработанных тест-систем на основе ПЦР, ПЦР в реальном времени и РГА показал, что чувствительность методов уменьшается на порядок в ряду: ПЦР в реальном времени > ПЦР > РГА.
- Показана возможность одновременного выявления и дифференцирования ПВС и ЦВС-2 методом множественной ПЦР в реальном времени. Чувствительность данного метода составила 102 молекул/мкл для ПВС и 103 молекул/мкл для ЦВС-2.
- Применение высокоспецифичных рекомбинантных положительных контролей повышает надёжность результатов диагностики ПВС. Показана возможность их использования для качественного и количественного анализа образцов.
- Показана возможность применения разработанного комплекса методов молекулярной диагностики для исследования ПВИС в пробах от животных любого возраста, а так же там, где диагностика методом РГА не применяется.
4. ПРАКТИЧЕСКИЕ ПРИЛОЖЕНИЯ
Предложена Тест-система для обнаружения парвовируса свиней методом полимеразной цепной реакции. Тест-система успешно прошла комиссионные испытания, и организовано её серийное производство в РФ. Разработана и утверждена в установленном порядке нормативная документация: СТО 42418073-002-2007, Инструкция по применению от 21.05.2009.
5. СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Елисеева О.В., Мусиенко М.И., Гибадулин Р.А., Алексеев К.П., Гребенникова Т.В. Применение рекомбинантного VP-2 белка парвовируса свиней в качестве антигена в иммуноферментном анализе.//Ветеринарная медицина. - Харьков. - 2005. - С. 418-423.
- Елисеева О.В., Гребенникова Т.В., Верховский О.А., Орлянкин Б.Г. Разработка тест-системы для определения антител к парвовирусу свиней методом иммуноферментного анализа.//Международный конгресс Современные проблемы генетики. - Минск. - 2005.
- Елисеева О.В., Гребенникова Т.В., Орлянкин Б.Г., Забережный А.Д. Разработка тестов для лабораторной диагностики парвовирусной инфекции свиней.//Вопросы физико-химической биологии в ветеринарии: Сб. науч. тр. - М.: ФГОУ ВПО МГАВМиБ им. К.И. Скрябина, 2006, с.121-131.
- Елисеева О.В., Гребенникова Т.В., Забережный А.Д., Орлянкин Б.Г., Алипер Т.И. Тест-система на основе ПЦР для обнаружения парвовируса свиней.//Ветеринария, 2008, №8, с.58-60.
- Елисеева О.В. Выявление парвовируса свиней и вирусспецифических антител методами полимеразной цепной реакции и иммуноферментного анализа.//Вопросы вирусологии, 2008, №6, с.46-48.
- Елисеева О.В., Латышев О.Е., Гребенникова Т.В., Алипер Т.И. Тест-система на основе ПЦР в реальном времени для обнаружения парвовируса свиней.//Российский ветеринарный журнал, 2012, №1, с.37-40.
 Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]
Авторефераты по темам >>
Разные специальности - [часть 1] [часть 2]

