Все авторефераты докторских диссертаций
Все авторефераты докторских диссертаций
Факторы патогенности нехолерогенных штаммов Vibrio cholerae
Автореферат докторской диссертации
На правах рукописи
МОНАХОВА Елена Владимировна ФАКТОРЫ ПАТОГЕННОСТИ НЕХОЛЕРОГЕННЫХ ШТАММОВ
Vibrio eh olerае
03.02.03 - микробиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора биологических наук
Ростов-на-Дону 2012
Работа выполнена в ФКУЗ Ростовский-на-Дону научно-исследовательский
противочумный институт Федеральной службы по надзору в сфере защиты
прав потребителей и благополучия человека
Официальные оппоненты:
Тараненко Татьяна Михайловна - доктор биологических наук, профессор ФКУЗ
Российский научно-исследовательский противочумный институт Микроб
Роспотребнадзора, ведущий научный сотрудник лаборатории биохимии и протеомики
Швиденко Инна Григорьевна - доктор медицинских наук, профессор
ГБОУ ВПО Саратовский государственный медицинский университет
им. В.И. Разумовского Минздравсоцразвития Российской Федерации,
профессор кафедры микробиологии, вирусологии и иммунологии
Кацы Елена Ильинична - доктор биологических наук, профессор ФБУН Институт
биохимии и физиологии растений и микроорганизмов Российской академии наук,
заведующая лабораторией генетики микроорганизмов
Ведущая организация
Иркутскийаа научно-исследовательскийаа противочумныйаа институтаа Федеральной
службы по надзору в сфере защиты прав потребителей и благополучия человека
Защита состоится л_____ ____________ 2012 г. в_______ на заседании диссертаци
онного совета Д 208.078.01 по защите докторских и кандидатских диссертаций при
ФКУЗ Российский научно-исследовательский противочумный институт Микроб
Федеральной службы по надзору в сфере защиты прав потребителей и благополучия
человека (410005, г. Саратов, ул. Университетская, 46).
С диссертацией можно ознакомиться в научной библиотеке ФКУЗ Российский научно-исследовательский противочумный институт Микроб.
Автореферат разослан л___ ________________ 2012 г.
Ученый секретарь диссертационного совета,
старший научный сотрудник,
доктор биологических наукаа Слудский А.А.
2
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Несмотря на то, что в патогенезе холеры центральное место принадлежит холерному токсину (СТ), патогенность вида Vibrio cholerae носит выраженный полидетерминантный характер. В настоящее время уже описан целый ряд дополнительных токсинов, однако их роль в развитии заболеваний остается недостаточно изученной. Генетические детерминанты большинства токсинов известны и представлены в базах GenBank. К ним относятся Zot (zonula occludens toxin) и Ace (accessory cholera enterotoxin), гены которых входят в состав генома умеренных филаментозных фагов СТХср [Waldor М.К., Mekalanos J.J., 1996] и pre-CTXcp [Boyd E.F., Heilpem A.J., 2000]; MARTX (multifunctional autoprocessing repeats-in-toxin) [Fullner Satchell K.J., 2007]; гемагглютинин/протеаза (HA/P) [Wu Z. et al, 2000; Ghosh A. et al, 2006], Cef (CHO cell elongating factor) [McCardell B.A. et al, 2000, 2002], термостабильный токсин (ST) [Arita M. et al, 1986], гемолизин/цитолизин HlyA [Walia K., Ganguly N.K., 2010], cholix-токсин [Jorgensen R. et al, 2008]. У отдельных штаммов не01/не0139 серогрупп были выявлены гены термостабильного прямого гемолизина (TDH) V.parahaemolyticus [Nishibuchi М. et al, 1990], а в одной публикации [O'Brien A.D. et al, 1984] сообщалось о способности V.cholerae к продукции токсина, иммунологически родственного шигаподобному (Siti). Кроме того, в литературе описаны токсины NMDCY (non-membrane-damaging cytotoxin) [Saha Р.К. et al, 1996], NCT (new cholera toxin) [Sanyal S., 1984, 1990] и W07 (novel cholera toxin) [Walia K. et al, 1999], гены которых до сих пор не идентифицированы. Правомерность их статуса как самостоятельных токсинов требует пересмотра с учетом новых данных.
Помимо собственно токсинов, холерные вибрионы продуцируют множество других факторов, таких как пили TCP (toxin coregulated pili), кодируемые кластером генов в составе острова патогенности VPI [Karaolis D.K.R. et al, 1998), Сер (core encoded pilin) - продукт одного из генов профага СТХ [Waldor М.К., Mekalanos J.J., 1996], MSHA (mannose sensitive hemagglutinin) [Watnick P.I. et al, 1999], нейра-минидаза (NanH), ген которой находится в составе острова VPI-2 [Jermyn W.S., Boyd E.F., 2002]. Недавно у V.cholerae non01/nonl39 были выявлены две контакт-зависимые системы секреции - третьего и шестого типов, соответственно T3SS [Dzeijman М. et al, 2005] и T6SS [Pukatzki S. et al, 2006]. Их структура, функции, особенности экспрессии и роль в патогенезе охарактеризованы лишь отчасти.
з
Наш интерес к дополнительным факторам патогенности V. cholerae обусловлен тем, что на территориях России и бывших республик СССР от больных с признаками диареи различной степени тяжести периодически выделяются штаммы 01 и не01/ не0139 серогрупп, лишенные генов ctxAB. Они не являются эпидемически опасными, но бывают связаны с локальными вспышками острых кишечных инфекций (ОКИ) и заслуживают особого внимания в связи с наносимым моральным и экономическим ущербом. С этой точки зрения представляет интерес изучение вирулентности нехоле-рогенных штаммов с различными генотипами на лабораторных моделях включая электронно-микроскопические исследования, которые ранее не проводились.
Для выявления конкретной роли отдельных факторов в патологии необходимы их препараты. Наиболее перспективным подходом является клонирование генов в штаммах кишечной палочки и создание активных продуцентов рекомбинантных белков. В распоряжении отечественных ученых до начала наших исследований отсутствовали такие продуценты Zot, а зарубежным авторам не удалось получить достаточно эффективной продукции штаммами E. coli таких факторов, как НА/Р, Cef и Асе.
Цель работы. Изучение структурно-функциональных особенностей и биологического действия токсинов холерных вибрионов, распространения и экспрессии генов факторов патогенности в пределах вида Vibriocholeraeи оценка их значимости в вирулентности нехолерогенных штаммов.
Основные задачи исследования:
- Клонирование генов гемагглютинин/протеазы hapA, СНО-удлиняющего фактора cef, дополнительного холерного энтеротоксина асе и zonula occludens-токсна zotV. choleraeв составе плазмидных векторов, обеспечивающих их контролируемую экспрессию, и создание штаммов E. coli - продуцентов кодируемых ими белков.
- Получение препаратов рекомбинантных белков, изучение их свойств и биологического действия на различных моделях. Выявление ультраструктурных изменений, вызываемых препаратами гемагглютинин/протеазы и СНО-удлиняющего фактора Cef в культурах клеток и в кишечнике мышей-сосунков.
- Биоинформационный анализ гемагглютинин/протеазы, СНО-удлиняющего фактора Cef, дополнительного холерного энтеротоксина Асе и zonula occludens-токсина Zot V. cholerae. Секвенирование гена cef V.cholerae 0139.
- Генотипическая и фенотипическая характеристика штаммов холерных вибрионов,
4
несущих профаг pre-CTX. Изучение возможности образования ими репликатив-ных форм (РФ) и инфекционных фаговых частиц.
- Сравнительный анализ свойств цитотоксина, не повреждающего мембрану (NMDCY), новых холерных токсинов NCT и W07 со свойствами известных факторов патогенности с использованием литературных и собственных данных.
- Определение с помощью ПЦР распространения среди холерных вибрионов различных серогрупп генов профагов СТХ, рге-СТХ и RS1, цитотоксического комплекса RTX, островов патогенности VPI и VPI-2; а также ряда других генов. Молекулярное зондирование V.choleraeна присутствие в их геномах генов термостабильного токсина (stn/sto), шигаподобного токсина (sit), термостабильного прямого гемолизина (tdh) и родственного ему гемолизина (trh) V.parahaemolyticus.
- ПЦР-детекция генов систем секреции третьего и шестого типов и изучение их экспрессии на модели лабораторного штамма амебы Dictyosteliumdiscoideim.
- Изучение фенотипического проявления вирулентности нехолерогенными штаммами V.choleraeс различными генотипами in vivo и in vitro. Сравнительное изучение ультраструктурных изменений, вызываемых холерогенными и нехолерогенными штаммами в кишечнике кроликов-сосунков.
Научная новизна и теоретическая значимость. Получены приоритетные данные о свойствах ряда дополнительных токсинов холерных вибрионов. Впервые сконструированы рекомбинантные плазмиды, экспрессирующие клонированные гены hapA и асе V.cholerae, и серия рекомбинантных плазмид, экспрессирующих гены cef V.cholerae 01, 0139 и non01/non0139 в штаммах E.coli. Сконструированы штаммы E. coli - высокоактивный продуцент рекомбинантного белка Zot и продуцент гемолизина proHlyA. Приоритет подтвержден получением авторского свидетельства № 1649809 от 15.01.91 Штамм бактерий E.coli - продуцент гемолизина Vibrio cholerae eltor; патентов на изобретения: № 2313577 от 27.12.07 Рекомбинантная плазмида, экспрессирующая клонированный ген се/(СНО cell elongating factor) Vibrio cholerae (варианты) и штамм Escherichia coli - продуцент Cef (CHO cell elongating factor) Vibrio cholerae (варианты); № 2313576 от 27.12.07 Рекомбинантная плазмида, экспрессирующая клонированный ген асе Vibrio cholerae, и штамм Escherichia coli -продуцент accessory cholera enterotoxin Vibrio cholerae и № 2306337 от 20.09.07 Рекомбинантная плазмида, экспрессирующая клонированный ген гемагглютинин/про-
5
теазы Vibrio cholerae, и штамм Escherichia coli - продуцент гемагглютинин/протеазы Vibrio cholerae. Получено свидетельство о регистрации в Реестре баз данных Федеральной службы по интеллектуальной собственности, патентам и товарным знакам базы данных Распространение холерных вибрионов в объектах окружающей среды на территории Российской Федерации в 2005-2008 годах № 2010620040 от 14.01.10.
Впервые доказана идентичность НА/Р и NMDCY, описанного в литературе как новый самостоятельный токсин. Впервые установлено, что Cef V.cholerae 0139, в отличие от Cef V.cholerae 01 и non01/non0139, не способен к гидролизу трибутирина при сохранении твиназной активности. Впервые секвенириован ген cef V.cholerae 0139, в нем выявлена точковая мутация, которая привела к несинонимичной замене остатка гидрофобной аминокислоты (валина) остатком гидрофильной (треонина), что явилось причиной сужения спектра субстратной специфичности его продукта. Впервые показана специфичность гена cef для холерных вибрионов 01, не01/не 0139 се-рогрупп и ctxAB штаммов 0139 серогруппы, а также отсутствие этого гена у ctxAB' вибрионов Бенгал, сопровождающееся утратой твиназной активности. Впервые выявлены ультраструктурные изменения в культурах клеток и в кишечнике мышей-сосунков под действием препаратов НА/Р и Cef холерных вибрионов, показана способность этих белков вызывать серьезные повреждения клеточных органелл.
Изучена структура и изменчивость профагов рге-СТХ в составе геномов более 20 штаммов холерных вибрионов, выделенных в СНГ, показана возможность их горизонтальной передачи за счет образования инфекционных вирионов.
Проведен комплексный анализ генотипических и фенотипических свойств большого числа нехолерогенных штаммов V.cholerae, выделенных на территориях бывшего СССР. В геноме ряда штаммов 01 серогруппы впервые выявлены последовательности, гомологичные гену tdh V. parahaemolyticus.
Получены экспериментальные данные, свидетельствующие в пользу того, что NCT, описанный в литературе как новый холерный токсин, представляет собой варьирующую по составу смесь секретируемых факторов патогенности.
Впервые установлено распространение генов T3SS среди ctxAB' штаммов V.cholerae 01 серогруппы. На модели D.discoideim впервые показана экспрессия T6SS нехолерогенными штаммами 01 серогруппы и определено, что устойчивостью к поеданию амебой обладают только штаммы с генотипом acd-vgrGl pbd-vgrG3 VPI .
6
Впервые исследованы ультраструктурные изменения в тонком кишечнике кроликов-сосунков при заражении холерогенными штаммами 0139 и не01/не0139 серог-рупп, нехолерогенными штаммами 01 и не01/не0139 серогрупп.
Практическая значимость работы. Штаммы E.coli, содержащие рекомби-нантные плазмиды рНР61, рАсе90, pZot69, pCef 69В, pCefуlB, pCef 49В, pCef31, депонированы в Государственной коллекции патогенных бактерий (ГКПБ) Микроб под номерами КМ 192, КМ 194, КМ 193, КМ 191, КМ 190, КМ 189, КМ 188 соответственно. Штамм E.coli - продуцент гемолизина V.cholerae eltor депонирован в музее живых культур ГИСК им. Л.А.Тарасевича под номером 182. Депонированы в ГКПБ Микроб штаммы V.cholerae 01 КМ 253 - продуцент репликативных форм и вирио-нов СТХср и RSlcp и V.cholerae non01/non0139 KM 209, одновременно содержащий профаг СТХ и кластер генов T3SS. Нуклеотидная последовательность гена cef V. cholerae 0139 и аминокислотная последовательность его продукта депонированы в базах GenBank под номерами JF499787 и АЕС04822.1 соответственно.
Отработаны методы выделения рекомбинантных белков. Подобраны адекватные биологические модели (культуры клеток) для тестирования токсинов in vitro. Штамм E.coli, экспрессирующий клонированный ген hapA V.cholerae, и полученный из него препарат НА/Р использован сотрудниками лаборатории биохимии микробов РостНИПЧИ в исследованиях системы активатор плазминоген/плазмин у холерных вибрионов (акт внедрения от 4.07.11). Осветленные ультразвуковые дезинтеграты этого же штамма и штамма E. coli - продуцента гемолизина вибриона эльтор используются сотрудниками группы гибридом в качестве контрольных препаратов при изучении соответственно цитотоксической и питодеструктивной активности холерных вибрионов на модели культур клеток (акт внедрения от 9.11.11). Сконструирован новый набор праймеров для детекции генов V.cholerae. Методы ПЦР используются в лаборатории микробиологии холеры РостНИПЧИ для проведения скрининга музейных и свежевыделенных культур на присутствие генов факторов патогенности с 2002 г. по настоящее время (акт внедрения от 12.09.11), а результаты ПЦР-генотипирования - для паспортизации штаммов холерных вибрионов, хранящихся в Музее живых культур Ростовского ПЧИ (акт внедрения от 16.07.11).
Методические подходы к детекции генов факторов патогенности у штаммов V.cholerae вошли в состав Методических рекомендаций по мониторингу наличия
7
холерных вибрионов в поверхностных водоемах и сточных водах на территории административного района или населенного пункта, одобренных Ученым советом Ро-стНИПЧИ и утвержденных директором института (протокол №7 от 22.10.07), МУК 4.2.2218-07 Лабораторная диагностика холеры, утвержденных Главным государственным санитарным врачом РФ Г.Г.Онищенко 31.05.07, и практического руководства Лабораторная диагностика опасных инфекционных заболеваний (под редакцией акад. РАМН Г.Г.Онищенко и чл.-корр. РАМН В.В.Кутырева, М.: Медицина, 2009). Основные положения, выносимые на защиту
- Клонирование гена hapA V.cholerae в E. coli позволило впервые установить, что рекомбинантная гемагглютинин/протеаза осуществляет не только самопроцессинг, но и деградацию белков чужеродного хозяина. Гемагглютинин/протеаза обладает гемагглютинирующей и протеолитической активностями, осуществляет процес-синг холерного токсина, термолабильного токсина кишечной палочки и гемолизина вибрионов эльтор, а также вызывает морфологические и ультраструктурные повреждения клеток и тканей. Впервые доказана идентичность гемагглюти-нин/протеазы и цитотоксина, не повреждающего мембрану (NMDCY).
- Рекомбинантные белки СНО-удлиняющего фактора Cef, выделенные из штаммов E.coli, экспрессирующих клонированные гены cef V.cholerae OН, 0139 и nonOl/ non0139, обладают твиназной активностью, вызывают удлинение культивируемых клеток и накопление жидкости в кишечнике мышей-сосунков, а также значительные повреждения ультраструктуры клеток и тканей. Впервые установлено, что ген cef холерных вибрионов Бенгал, в отличие от cef V.cholerae 01 и nonOl/ non0139, содержит точковую мутацию, приводящую к несинонимичной замене остатка гидрофобной аминокислоты на остаток гидрофильной, следствием чего является утрата его продуктом способности к гидролизу трибутирина.
- Активные домены (AT 1002) zonula occludens-токсинов Zot, кодируемые генами профагов СТХ и рге-СТХ, идентичны, что указывает на наличие у них одинаковой биологической активности. Белки Асе и Zot, выделенные из сконструированных нами рекомбинантных штаммов E. coli, биологически активны на моделях in vitro и in vivo. Холерные вибрионы, содержащие рге-СТХ, образуют инфекционные ви-рионы, способные к горизонтальному переносу генов факторов патогенности.
- Новый холерный токсин (NCT), описанный в литературе как отдельный самостоя-
8
тельный токсин, представляет собой варьирующую по составу смесь нескольких секретируемых биологически активных факторов, в состав которой могут входить гемагглютинин/протеаза и СНО-удлиняющий фактор Cef.
- Кластер генов системы секреции третьего типа распространен почти исключительно среди нехолерогенных штаммов. Впервые показано присутствие этого кластера в геномах штаммов 01 серогруппы. Все штаммы холерных вибрионов содержат кластер генов другой системы секреции - шестого типа, но у многих она находится в неактивном состоянии из-за отсутствия актин-связывающего домена ключевого эффектора VgrGl и/или острова патогенности VPI.
- Нехолерогенные штаммы V.cholerae могут обусловливать на модели кроликов-сосунков энтеропатогенный и сходный с холерогенным эффекты, однако интенсивность эффектов не коррелирует с генотипами. Морфологические и ультраструктурные изменения в кишечнике свидетельствуют о том, что факторы патогенности V. cholerae взаимозаменяемы, то есть отсутствие одних компенсируется повышенной продукцией других, результатом чего является развитие заболевания.
- Нехолерогенные штаммы V.cholerae содержат как консервативные (общие с холерогенными) гены факторов патогенности/персистенции, так и целый ряд генетических детерминант, которые могут присутствовать/отсутствовать в их геномах, образуя различные сочетания. С помощью молекулярного зондирования у многих штаммов V.cholerae 01 и non01/non0139 выявлены последовательности, гомологичные гену термостабильного токсина, а у штаммов одного клона 01 серогруппы - возбудителей локальной вспышки - термостабильного прямого гемолизина V. parahaemolyticus.
- Новый холерный токсин NCT, описанный в литературе как отдельный самостоятельный токсин, представляет собой варьирующую по качественному и количественному составу смесь нескольких секретируемых биологически активных факторов, которая может включать гемагглютинин/протеазу и СНО-удлиняющий фактор Cef.
- Кластер генов системы секреции третьего типа (T3SS) распространен почти исключительно среди нехолерогенных штаммов V.cholerae. Впервые показано присутствие этого кластера в геномах штаммов 01 серогруппы. Все штаммы содержат кластер генов системы секреции шестого типа (T6SS), но не у всех присутствуют последовательности, кодирующие ее активные домены - актин-связывающий (ACD-VgrGl) и пептидогликан-связывающй (PBD-VgrG3). Модель Dictyosteliumdiscoideum позволяет определить способность холерных вибрионов к экспрессии системы секреции шестого, но не третьего типа. Штаммы, устойчивые к поеданию амебой, всегда содержат не только генетические детерминанты активных доменов T6SS, но и остров патогенности VPI.
- Нехолерогенные штаммы V.cholerae варьируют по уровням продукции различных биологически активных факторов in vitro и могут вызывать различающиеся по интенсивности эффекты на модели кроликов-сосунков: энтеропатогенный и сходный с холерогенным; многие обладают инвазивностью. Однако интенсивность эффектов не коррелирует с генотипами использованных для заражения штаммов.
- Ультраструктурные изменения в кишечнике, обусловленные холерогенными и нехолерогенными штаммамиа V.cholerae, имеют существенные различия.а Если
- Власов В.П., Монахова Е.В., Ушакова И.Е., Михась Н.К., Данилкина Е.Б., Ломов Ю.М. Гемолизин Vibrio cholerae eltor: клонирование и экспрессия генов в Escherichia coli IIМол. генет., микробиол. и вирусол. - 1992. - № 7-8. -С.14-20. (Из Перечня ВАК)
- Ушакова И.Е., Власов В.П., Михась Н.К., Монахова Е.В. Клонирование и экспрессия гена гемолизина V.cholerae eltor IIГенетика и биохимия вирулентности возбудителей ООИ: Тез. докл. - Волгоград, 1992. - С.66.
- Власов В.П., Воронежская Л.Г., Михась Н.К., Иванова Л.В., Монахова Е.В. Выделение и характеристика токсигенных {vet) штаммов энтеропатогенных холерных вибрионов не01 группы на различных территориях // Холера: Матер. Рос. науч.-практ. конф. - Ростов н/Д, 1992. - С. 144-147.
- Подосинникова Л.С., Ломов Ю.М., Власов В.П., Монахова Е.В., Москви-тина Э.А., Лобанова Л.Н., Бардых И.Д., Шестиалтынова И.С., Глянько Е.В. О вирулентности Vibrio cholerae, выделенных в различных эпидситуациях // Журн. микробиол., эпидемиол. и иммунобиол. - 1993. - №3. - С.48-51. (Из Перечня ВАК)
- Подосинникова Л.С., Воронежская Л.Г., Лобанова Л.Н., Шестиалтынова И.С., Монахова Е.В., Власов В.П., Вуцан В.Н., Михась Н.К., Кудрякова Т.А., Ма-кедонова Л.Д., Лобанов В.В., Иванова Л.В. Характеристика и распространение холерных вибрионов на территории СССР в 1987-1991 годах // Пробл. особо опасных инф. - 1993. - Вып.1-2. - С.50-56. (Из Перечня ВАК)
- Власов В.П., Бардахчьян Э.А., Харланова Н.Г., Монахова Е.В., Винокур Н.И. Сравнительное изучение вирулентности vetи vcfхолерных вибрионов // Холера: Матер. Рос. науч.-практ. конф. - Ростов н/Д, 1995. - С.92-98.
- Власов В.П., Харланова Н.Г., Монахова Е.В., Винокур Н.И., Бардахчьян Э.А. Ультраструктурные изменения в тонкой кишке, вызванные холерогенным и нехолерогенным штаммами вибрионов // Доклады РАН. -1997. - Т.352, №2. -С. 278-280. (Из Перечня ВАК)
- Монахова Е.В., Михась Н.К., Мазрухо А.Б., Смоликова Л.М., Мишанькин Б.Н. Токсины холерных вибрионов // Холера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 1999. - Вып. 12. - С.56-60.
- Мазрухо А.Б., Монахова Е.В., Михась Н.К., Рожков К.К., Мазрухо Б.Л., Сальникова О.И., Овсова Л.М. Получение и изучение свойств препарата-сырца нового холерного токсина // Диагностика, лечение и профилакт. Инф. Забол. Биотехнол-гия. Ветеринария: Матер. Юбил. Науч. Конф., посвящ. 50-лет. Центра воен.-технич. Пробл. Биол. Защиты НИИ микробиол. МО РФ. - Екатеринбург, 1999. - С. 136-138.
- Бардахчьян Э.А., Ломов Ю.М., Харланова Н.Г., Монахова Е.В., Винокур Н.И. Особенности ультраструктурных изменений в тонкой кишке кроликов-сосунков при действии ve/-штамма холерных вибрионов// Архив патологии. -2000. - №1. -С.24-29. (Из Перечня ВАК)
- Мазрухо А.Б., Михась Н.К., Монахова Е.В., Рожков К.К. Изучение продукции ряда факторов вирулентности холерных вибрионов на универсальной триптоновой среде // Журн. микробиол., эпидемиол. и иммунобиол. - 2000. - №1.
- Монахова Е.В., Михась Н.К., Смоликова Л.М., Мишанькин Б.Н. Изучение генетических детерминант токсинов кассеты вирулентности и нейраминида-зы холерных вибрионов с помощью молекулярного зондирования // Жури, мик-робиол., эпидемиол. и иммунобиол. - 2001. - №2. - С.25-29. (Из Перечня ВАК)
- Монахова Е.В., Михась Н.К., Махрухо А.Б., Сальникова О.И., Мазрухо Б.Л., Овсова Л.М., Писанов Р.В. Диареегенные и цитотоксические факторы, продуцируемые нехолерогенными (vcf) штаммами холерных вибрионов // Холера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2001. - вып. 14. -С.75-78.
- Писанов Р.В., Монахова Е.В. Компьютерный анализ нуклеотидной и аминокислотной последовательности гена zot СТХср Vibrio cholerae IIХолера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2002. - Вып. 15. -С.97-99.
- Монахова Е.В., Михась Н.К., Мазрухо Б.Л. Изменчивость СТХ-элемента, интегрированного в геном некоторых токсигенных штаммов холерных вибрионов Бенгал // Пробл. особо опасных инф. - 2003. - Вып.85. - С.90-96. (Из Перечня ВАК)
- Писанов Р.В., Михась Н.К., Монахова Е.В. Генотипическая характеристика штаммов холерных вибрионов, содержащих неполный (ctxAB') СТХ-элемент // Сб. тезисов VI Российского съезда врачей-инфекционистов. - СПб., 2003. - Ч.З. - С.64-65.
- Монахова Е.В., Михась Н.К. Tol-кластер холерных вибрионов и его роль в горизонтальной передаче СТХ-элемента // Холера: Матер. VIII Рос. науч.-практ. конф. - Ростов н/Д, 2003. -аа С. 134-137.
- Монахова Е.В., Писанов Р.В., Михась Н.К. Изучение геномного полиморфизма с?х;АВ~-штаммов холерных вибрионов, содержащих проксимальную часть СТХ-элемента // Жури, микробиол., эпидемиол. и иммунобиол. - 2004. -№1. - С.23-29. (Из Перечня ВАК)
- Монахова Е.В., Михась Н.К., Писанов Р.В., Сальникова О.И., Мазрухо
- Монахова Е.В., Писанов Р.В. Токсины холерных вибрионов // Мол. ге-нет., микробиол. и вирусол. - 2005.- №1.- С.7-18. (Из Перечня ВАК)
- Авдеева Е.П., Мазрухо Б.Л., Воронежская Л.Г., Монахова Е.В., Кудрякова Т.А., Цедова Э.Г., Нъематов А.С., Иногамова И.А., Якубова И.С. Характеристика энтеропатогенности холерных вибрионов не01/0139серогрупп, выделенных в Узбекистане // Журн. микробиол., эпидемиол. и иммунобиол. - 2005. - №3. - С.80-82. (Из Перечня ВАК)
- Монахова Е.В., Ломов Ю.М., Писанов Р.В., Алексеева Л.П., Маркина О.В., Миронова А.В., Веркина Л.М., Михась Н.К., Асеева Л.Е., Каграманов B.C. Клонирование гена цитотонического фактора Cef (CHO-cell elongating factor) Vibriocholeraeв Escherichiacoli и его экспрессия под контролем РВАо_промотора // Биотехнология - 2005. - №6. - Р.12-18. (Из Перечня ВАК)
- Монахова Е.В., Ломов Ю.М., Писанов Р.В., Алексеева Л.П., Маркина О.В., Миронова А.В., Веркина Л.М., Михась Н.К., Асеева Л.Е., Каграманов B.C. Цитотони-ческий фактор Cef холерных вибрионов // Холера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2005. - Вып. 18. - С.66-68.
- Мазрухо Б.Л., Кругликов В.Д., Монахова Е.В., Михась Н.К., Шестиалтынова И.С, Авдеева Е.П., Ишина Е.В., Мазрухо А.Б., Лобанов В.В., Кудрякова Т.А., Каминский Д.П., Цедова Э.Г., Непомнящая Н.Б. Микробиологические аспекты мониторинга
- Пузанова Н.Г., Смоликова Л.М., Монахова Е.В., Подосинникова Л.С., Божко Н.В., Арутюнов ЮИ., Голенищева Е.Н., Кудрякова Т.А., Санамянц Е.М., Михась Н.К. Ретроспективная характеристика атоксигенных холерных вибрионов 01 серогруппы, выделенных от больных с явлениями диареи // Холера и патогенные для человека вибрионы: Матер. Пробл. комиссии. - Ростов н/Д, 2005. - Вып. 18. - С.57-59.
- Монахова Е.В., Писанов Р.В. Сравнительный анализ литературных и компьютерных данных о свойствах цитотоксического фактора NMDCY и ге-магглютинин/протеазы холерных вибрионов // Пробл. особо опасных инф. -2006. - Вып.91. - С.15-20. (Из Перечня ВАК)
- Монахова Е.В., Писанов Р.В., Гончарова Л.А., Михась Н.К., Непомнящая Н.Б., Асеева Л.Е., Каграманов B.C. Клонирование и экспрессия гена гемагглю-тинин/протеазы (hapA) Vibrio cholerae в Escherichia coli II Биотехнология - 2006. -№6. - C.8-15. (Из Перечня ВАК)
- Авдеева Е.П., Мазрухо БЛ.,.Воронежская Л.Г, Цедова Э.Г., Монахова Е.В., Михась Н.К., Нъематов А.С., Иногамова И.А., Якубова И.С, Оброткина Н.Ф., Малькова Г.И., Давыдова В.К., Агапов Б.Л. Особенности циркуляции различных по происхождению холерных вибрионов не01/0139 серогрупп // Эпидемиология и инф. болезни. - 2006. - №2. - С.19-22. (Из Перечня ВАК)
- Писанов Р.В., Монахова Е.В., Алексеева Л.П., Маркина О.В., Гончарова Л.А. Конструирование рекомбинантной плазмиды pZot69 и штамма Esherichia coli - продуцента zonula occludens toxin VibriocholeraeIIХолера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2006. - Вып. 19. - С.64-66.
- Монахова Е.В., Писанов Р.В., Алексеева Л.П., Маркина О.В., Миронова А.В., Веркина Л.М., Михась Н.К., Непомнящая Н.Б., Асеева Л.Е., Каграманов B.C. Цито-токсческий фактор NMDCY и гемагглютинин/протеаза холерных вибрионов // Холера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2006. -Вып. 19. - С.64-66. - С.66-69.
- Маркина О.В., Алексеева Л.П. Монахова Е.В. Культуры клеток в изучении биологической активности токсинов Vibrio cholerae, продуцируемых рекомбинант-ными штаммами Escherichia coli IIХолера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2006. - Вып. 19. - С.64-66. - С.91-93.
- Онищенко Г.Г., Ломов Ю.М., Москвитина Э.А., Подосинникова Л.С., Во-дяницкая С.Ю., Прометной В.И., Монахова Е.В., Водопьянов CO., Телесманич Н.Р., Дудина Н.А. Холера, обусловленная VibriocholeraeOН ctxAB'tcpA+ IIЖурн. микробиол., эпидемиол. и иммунобиол. - 2007. - №1. - С.23-29. (Из Перечня ВАК)
- Монахова Е.В., Ломов Ю.М., Михась Н.К., Писанов Р.В. Структура и изменчивость неполного СТХ-элемента холерных вибрионов // Пробл. особо опасных инф. - 2007. - Вып.1(93). - С.58-61. (Из Перечня ВАК)
- Писанов Р.В., Монахова Е.В., Маркина О.В., Алексеева Л.П., Гончарова Л.А. Штамм Esherichia coli - продуцент Zot-токсина Vibrio cholerae IIПробл. особо опасных инф. - 2007. - Вып.1(93). - С.62-65. (Из Перечня ВАК)
- Маркина О.В., Монахова Е.В., Алексеева Л.П., Писанов Р.В. Изучение биологического действия гемагглютинин/протеазы холерных вибрионов на модели культур клеток // Пробл. особо опасных инф. - 2007. - Вып.2 (94). - С.58-61. (Из Перечня ВАК)
- Монахова Е.В. Миронова А.В., Алексеева Л.П. О вирулентности возбудителей неэпидемической холеры, содержащих неполный СТХ-элемент (рге-СТХср) // Рос. журн. гастроэнтерол., гепатол., колопроктол. - 2007. - T.XVII, №5 (Прилож. №30. Матер. XIII РГЭН). - С.46.
- Бардахчьян Э.А., Харланова Н.Г., Монахова Е.В., Саямов СР., Ткачева Т.И. Ультраструктурные особенности действия рекомбинантной гемагглютинин/протеазы холерных вибрионов на тонкую кишку мышей-сосунков // Рос. журн. гастроэнтерол., гепатол., колопроктол. - 2007. - T.XVII, №5аа (Прилож. №30. Матер. XIII РГЭН). -
- Монахова Е.В., Смоликова Л.М. О выявлении генов системы секреции третьего типа (TTSS) у холерных вибрионов 01 и не01/не0139 серогрупп // Диагностика, лечение и профилакт. опасных и особо опасных инф. заболеваний. Биотехнология: Матер, всерос. науч. конф., посвящ. 80-лет. Со дня основ. ФГУ л48 ЦНИИ МО России. - Киров, 2008. - С. 193-198.
- Монахова Е.В., Кругликов В.Д., Смоликова Л.М., Божко Н.В., Авдеева Е.П. Генотипическая характеристика возбудителей холеры, выделяемых на территориях СНГ и стран Юго-Восточной Азии // Перспективы сотрудничества государств-членов ШОС в противодействии угрозе инф. болезней: Международ, науч.-практ. конф.: Тез. докл. - Новосибирск, 2009. - С. 149-152.
- Саямов СР., Монахова Е.В., Ткачева Т.И., Федоренко Г.М., Писанов Р.В. Ультраструктурныеа изменения ва тонкой кишке мышей-сосунков под действием ре-
- Монахова E.B., Смоликова Л.М., Божко H.B. ПЦР-детекция генов системы секреции третьего типа (TTSS) и других факторов патогенно-сти/персистенции у холерных вибрионов различных серогрупп // Эпидемиология и инф. болезни - 2010. - № 6. - С.20-25. (Из Перечня ВАК)
- Монахова Е.В., Божко Н.В. Изучение экспрессии контакт-зависимых систем секреции холерными вибрионами на модели DictyosteliumdiscoideumII Журн. микробиол., эпидемиол. и иммунобиол. - 2010. - № 4. - С.89-92. (Из Перечня ВАК)
- | Голубев Б.П.|, Кругликов В.Д., Авдеева Е.П., Шестиалтынова И.С, Часов-ских СВ., Монахова Е.В., Смоликова Л.М., Ускова Н.Н., Чемисова О.С, Кудрякова ТА. ГИС Распространение холерных вибрионов в объектах окружающей среды на территории Российской Федерации в 2005-2008 гг. // Холера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2010. - Вып.23. - С.35-39.
- Кругликов В.Д., Монахова Е.В., Архангельская И.В., Водопьянов А.С., Водопьянов CO., Авдеева Е.П., Божко Н.В., Смоликова Л.М. Характеристика штаммов холерных вибрионов не01/не0139 серогрупп, вызвавших заболевания людей в Ростовской области // Журн. микробиол., эпидемиол. и иммунобиол. -
- Монахова Е.В., Федоренко Г.М., [Бардахчьян Э.А.| Ультраструктурные изменения в тонкой кишке кроликов-сосунков, зараженных холерогенным и нехолероген-ным штаммами Vibrio cholerae non-0l/non-0139 // Рос. журн. гастроэнтерол., гепа-тол., колопроктол. - 2011. - T.XXI, №5 (Прилож. № 38, Матер. XVII РГЭН). - С.44.
- Монахова Е.В., Федоренко Г.М., Мазрухо А.Б., Писанов Р.В., Кругликов В.Д., Маркина О.В., Алексеева Л.П. Изучение биологического действия цитото-нического фактора Cef холерных вибрионов на моделях in vitro и in vivo IIПробл. особо опасных инф. - 2012. - Вып.1. - С.42-45. (Из Перечня ВАК)
- Писанов Р.В., Монахова Е.В., Шалу О.А. Точковая мутация в гене cef (СНО cell elongating factor) Vibriocholerae0139 приводит к изменению субстратной специфичности его продукта // Генетика. - 2012. - Т.48. - №2. - С.275-279. (Из Перечня ВАК)
Апробация работы. Материалы диссертации доложены на заседаниях проблемной комиссии Холера и патогенные для человека вибрионы межведомственного научного совета по санитарно-эпидемической охране территории РФ (1993-2010 гг.), Российских научно-практических конференциях по проблеме Холера (Ростов н/Д, 1992, 1995, 2003), международных симпозиумах VIBRIO-2007 (Париж, Франция, 2007) и Fifty years of discovery of cholera toxin: a tribute to S.N.De (Колката, Индия, 2009); представлены на научной конференции Генетика и биохимия вирулентности возбудителей ООП (Волгоград, 1992), на юбилейной научной конференции Диагностика, лечение и профилактика инфекционных заболеваний (Екатеринбург, 1999), международном конгрессе Ninth International Congress for Culture Collections (Brisbane, Австралия, 2000), VI Российском съезде врачей-инфекционистов (Санкт-Петербург, 2003); III, XIII, XV, XVII Российских Гастроэнтерологических неделях (Москва, 1997, 2007, 2009, 2011), Всероссийской конференции Диагностика, лечение и профилактика опасных и особо опасных инфекционных заболеваний к 80-летию ФГУ л48 ЦНИИ Минобороны России (Киров, 2008); международной научно-практической конференции Перспективы сотрудничества государств-членов ШОС в противодействии угрозе инфекционных болезней (Новосибирск, 2009).
9
Публикация результатов исследований. Материалы исследований отражены в 63 опубликованных работах, из них 28 - в периодических изданиях из перечня ведущих рецензируемых научных журналов, утвержденных ВАК Министерства образования и науки России и рекомендованных для публикации основных научных результатов диссертации на соискание ученой степени, и 1 - в зарубежном издании.
Структура диссертации. Диссертация написана в стиле монографии, изложена на 282 страницах, состоит из введения, шести глав, заключения и выводов, иллюстрирована 20 таблицами и 54 рисунками. Библиография содержит ссылки на 369 публикаций (в том числе 49 работ отечественных и 320 - зарубежных авторов). РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
1. Гемагглютинин/протеаза (НА/Р) и цитотоксин, не повреждающий мембрану (NMDCY). Поскольку холерные вибрионы продуцируют несколько протеаз, изучение свойств НА/Р с использованием штаммов V. cholerae крайне затруднено. До начала наших исследований в литературе имелось всего одно сообщение [Hгse С.С, Finkelstein R.A., 1991] о клонировании гена hapA с собственным промотором, но он совершенно не экспрессировался в E.coli. Поэтому мы клонировали этот ген в составе вектора pQE30, промотор которого обеспечивает экспрессию чужеродных генов при индукции ИПТГ. ПЦР-амплификат гена hapA длиной 1847 п.н., полученный на матрице ДНК штамма V. cholerae Р-9961 с помощью сконструированных нами прай-меров, был встроен в полилинкер pQE30 по сайтам BamHI и HindIII. В результате трансформации E.coli Jml03 были получены клоны, несущие рекомбинантную плаз-миду рНРб 1. Для определения способности рекомбинантов к продукции НА/Р их выращивали в среде LB с индупией 1 мМ ИПТГ. Контролем служил штамм, содержащий векторную плазмиду без вставки. Клетки разрушали ультразвуком, и прозрачные осветленные дезинтеграты (ОД) использовали для тестирования.
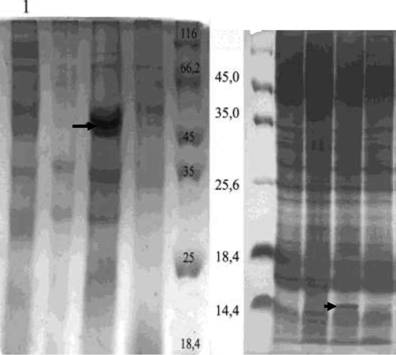
Известно, что первичный продукт гена hapA имеет молекулярную массу (ММ) 69,3 кДа, а зрелая форма НА/Р с ММ 32 кДа образуется в результате многоступенчатого процессинга [Hгse С.С, Finkelstein R.A., 1991]. Поскольку в штаммах E.coli про-цессинг рекомбинантных белков обьшно не осуществляется, мы ожидали обнаружить в полиакриламидном геле (ПААГ) после SDS-электрофореза лизатов и ОД клеток штамма Jml03pHP61 мажорную полосу с ММ около 70 кДа. Однако в геле присутствовало всего 3 белка, ММ одного из которых соответствовала таковой зрелой формы
10
НА/Р (рис. 1?), что указывало на способность НА/Р к самопроцессингу и протеолизу большинства внутриклеточных белков E. coli. Это позволило разработать ускоренный метод выделения из рекомбинантных штаммов зрелой формы НА/Р с помощью гель-фильтрации на колонке с Toyopearl HW55F. В полученном препарате была выявлена мажорная полоса с ММ 32 кДа, примеси других белков практически не поддавались визуализации (рис. 1Б). Выход продукта составлял до 5 мг на 1 г сырой биомассы.
|
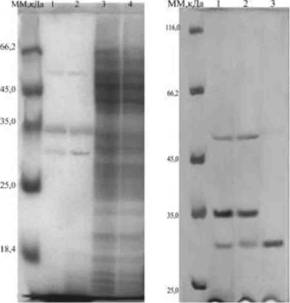
Рисунок 1. SDS-электрофорез:
А - лизатов клеток E.coli Jml03, содержащих рекомбинантную плазмиду рНР61 (дорожки 1,2) и векторную плазмиду pQE30 (3,4), выращенных без индукции (1,3) и с индукцией ИПТГ (2,4);
Б - препарата НА/Р (дорожка 3), полученного с помощью гель-фильтрации содержимого клеток E.coli Jml03pHP61 (дорожка 2). Дорожка 1 - ОД E.coli Jml03pHP61.
Рекомбинантный белок сохранил все свойства, известные для нативной НА/Р, продуцируемой V.cholerae: вызывал агглютинацию предварительно отобранных лагг-лютинабельных куриных эритроцитов, причем реакция не ингибировалась сахарами [Hгse С.С, Finkelstein R.A., 1991]; обладал еще более широким спектром субстратной специфичности по сравнению с описанным ранее [Silva A.J. et al, 2003; Halpern M. et al, 2003; Pal A. et al, 2007]; осуществлял процессинг CT, термолабильного токсина E.coli (LT) [Booth B.A. et al, 1984; Naka A. et al, 1998] и гемолизина pro-HlyA [Nagamune К. et al, 1996].
Биоинформационный анализ с помощью программ Blast Search и AlignX показал, что наиболее высоким уровнем гомологии с НА/Р V. choleraeобладали протеазы представителей родов Vibrio, Aeromonas, Pseudomonas, Chromobacteriumи Helicobac-ter. С помощью программы AlignX Blocks и у этих, и у намного менее гомологичных протеаз (Bacillus, Legionella, Shewanella, Myxococcus) был выявлен каталитический участок, близкий таковому НА/Р. Многие из сходных с НА/Р цинк-зависимых метал-
11
опротеаз ряда бактерий известны как факторы их патогенности [Hгse С.С, Finkel-stein R.A., 1990; Smith A.W. et al, 1996; Denkin S.M., Nelson D.V., 1999; Cascon A. et al, 2000]. Поэтому данные биоинформационного анализа свидетельствовали в пользу причастности НА/Р к патогенезу, но это предположение нуждалось в экспериментальной проверке. С этой целью мы провели исследования биологической активности
полученных нами препаратов на моделях in vitro и in vivo.
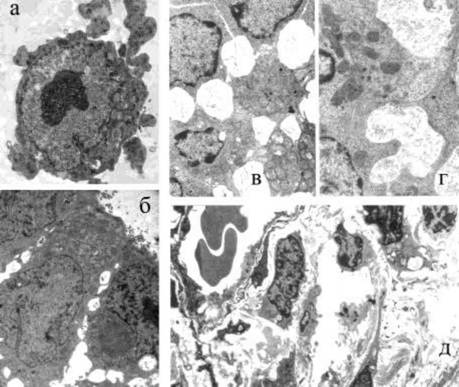
Рисунок 2. Ультраструктурные изменения в культурах клеток (а, б) и в тонкой кишке мышей-сосунков (в-г) под действием препатата НА/Р а - округление клетки HeLa, образование на поверхности пузырей и их отделение без повреждения цитоплазматической мембраны, набухание митохондрий, в цитоплазме видны липидные гранулы, х4200; б - ретракция клеток СаСо2 и увеличение межклеточных пространств в монослое при сохранении интактных tj, х4200; в - многочисленные полости между эпителиальными клетками крипт сообщаются друг с другом с помощью расширенных межэпителиальных пространств, х 5000; г - образование крупных полостей между эпителиоцитами ворсин, х 8000; д - усиление трансэндоте-лиального микропиноцитоза и появление микродефектов в эндотелиальной выстилке, хЗООО.
НА/Р вызывала округление клеток СНО, L-929, HeLa, НЕр2 и McCoy и разрушение плотного монослоя MDCK и СаСо2, а на модели мышей-сосунков - статистически достоверное увеличение веса их кишечника (Р < 0,003). Это сопровождалось серьезными ультраструктурными нарушениями, показанными на рис.2. Как и в куль-
12
турах тканей, в тонкой кишке в первую очередь обращало на себя внимание не затрагивающее плотных контактов (tj) появление крупных лакун между смежными эпите-лиопитами. В макроорганизме это происходило на фоне изменений в эндотелии капилляров и развития интерстициального отека вследствие дегрануляпии тучных и Ес-клеток, которая способствует выделению факторов сосудистой проницаемости.
В 1996 г. Saha Р.К. et al. был описан новый цитотоксин V.cholerae, обозначенный авторами NMDCY (non-membrane-damaging cytotoxin). Анализ литературных и собственных данных позволил нам предположить, что он идентичен НА/Р, поскольку оба белка имеют одинаковые ММ (32-35 кДа) [Saha Р.К. et al., 1996; Finkelstein R.A. et al, 1983; Finkelstein R.A., Hanne L.F., 1982; Naka A. et al, 1992; Ghosh A. et al, 2006; настоящее исследование] и полностью гомологичные 151Ч-концевые последовательности [Saha Р.К. et al, 1996]; обладают протеолитической активностью, которая ин-гибируется ЭДТА и ЭГТА [Mitra R. et al, 1998], что характерно для металлопротеаз; в условиях in vitro являются исключительно внеклеточными белками и синтезируются в стационарной фазе роста культуры [Saha Р.К. et al, 1996; Benitez J.A. et al, 2001; Silva A.J. et al, 2003; Silva A.J., Benitez J.A., 2004], причем в большем количестве СТХ" штаммами, чем СТХ+ [Saha Р.К., Nair G.B., 1997; Kimsey Н.Н., Waldor M.К., 1998]; при исследовании в камерах Юссинга NMDCY увеличивают ток короткого замыкания (Isc) [Mitra R. et al, 1998; Ghosh et al, 2006; Mel S.F. et al, 2000] и не ин-гибируются моносахарами [Finkelstein R.A., Hanne L.F., 1982 Saha; Р.К. et al, 1996], то есть не требуют наличия углеводсодержащих рецепторов. В дополнение к этому мы установили, что способность НА/Р вызывать округление клеток и разрушение плотного монослоя в культурах тканей подчиняется закономерностям, выявленным Saha Р.К. et al, (1996) для NMDCY, а ультраструктурные изменения в них под действием НА/Р полностью совпадают с результатами электронно-микроскопических исследований клеток Int407 и HeLa, обработанных NMDCY [Basu I. et al.,1999], что позволило сделать окончательное заключение об идентичности этих двух факторов.
2. Цитотонический фактор Cef (СНО-удлиняющий фактор). Cef, термолабильный белок с ММ ~85 кДа, обладающий эстеразной активностью, способностью вызывать удлинение клеток СНО и накопление жидкости в кишечнике мышей-сосунков - один из самых малоизученных предполагаемых факторов патогенности V.cholerae. До начала наших исследований все сведения о нем ограничивались тремя
13
публикациями [McCardell В.A. et al., 2000, 2002; Satyamorrthy et al., 2000]. Ранее ген cef холерных вибрионов обоих биоваров 01 серогруппы был клонирован McCardell В.А. et al. (2002) с использованием модели Pichiapastoris, поскольку авторам не удалось клонировать его в векторе pBAD. Однако в дрожжевом хозяине образовался гликозилированный продукт, утративший биологическую активность in vivo и поэтому непригодный для изучения характера его воздействия на макроорганизм. Нам удалось преодолеть эту проблему путем успешного клонирования генов cef штаммов V.cholerae 01 (эльтор и классического биовара), 0139 и не01/не0139 в составе рекомбинантных плазмид (соответственно pCefуlB, pCef69B, pCef3 IB и pCef49B) и их эффективной экспрессии в E. coli под контролем РВАо-промотора. ПЦР-амплификаты генов cef длиной 2473 п.н., полученные с помощью сконструированных нами прай-меров, были встроены в полилинкер pBAD18 по сайтам EcoRI-Xbal. Для выявления способности рекомбинантов к синтезу Cef использовали ОД их клеток (полученные как описано выше для НА/Р), выращенных с индукцией арабинозой.
В исследованиях McCardell В.А. et al. (2000, 2002) Cef проявлял эстеразную активность по отношению к р-нитрофениловым эфирам жирных кислот с длиной цепи С2-С14. Нами была выявлена эстеразная активность ОД рекомбинантных клонов по отношению к твинам 20, 40, 60, 80 и 85. Липазная активность по отношению к оливковому, подсолнечному и льняному маслам не выявлялась. ОД всех рекомбинантных штаммов, кроме продуцента Cef V.cholerae 0139 (E.coli Jml03pCef31B) разлагали трибутирин. Чтобы проверить, не является ли неспособность Cef вибриона Бенгал к гидролизу трибутирина штаммовой особенностью, мы дополнительно клонировали ген cef из другого штамма 0139 серогруппы - Р-16065, который имел существенные отличия от Р-16131 на уровне генома. ОД штамма E.coli Jml03, содержащего соответствующую плазмиду pCef65B, также не расщеплял трибутирин, сохраняя способность к гидролизу твинов, то есть это характерно для Cef вибрионов 0139 серогруппы.
ОД всех рекомбинантных клонов вызывали удлинение клеток СНО и L-929.
В отличие от полученных McCardell В.А. et al. (2002) рекомбинантных глико-зилированных белков Cef, утративших биологическую активность на модели мышей-сосунков, ОД сконструированных нами штаммов E.coli вызывали в их кишечнике статистически достоверное накопление жидкости (Р < 0,007). Таким образом, реком-бинантные белки сохранили все известные свойства. В дальнейшем было показано,
14
что теми же видами активности обладают и препараты Cef.
Метод выделения Cef и подходы к определению свойств полученных препаратов были подобраны на основе биоинформационного анализа. Прогностические данные о том, что Cef представляет собой термотолерантную сериновую липазу с доменом Куница и лейциновой молнией (рис.3), подтверждены экспериментально.
Домен Куница (АК 179-196) - домен ингибитора протеаз. Лейциновая молния -домен, характерный для некоторых ДНК-связывающих белков; обеспечивает формирование димерной структуры. GHSLG (549-553) - домен сериновых триапилглице-роллипаз (GXSXG), ответственный за связывание с субстратом и липаз-ную/эстеразную активность. а/ЬН (424-563) - домен белков суперсемейства альфа-бета-гидр о лаз. LIP (444-723) - домен, характерный для большинства триапилглице-роллипаз, перекрывающийся с доменом а/ЬН.
В частности, при гель-фильтрации Cef выходил с колонки (HW-55F) двумя фракциями: тяжелой и легкой, что указывает на его способность формировать диме-ры, вероятнее всего, за счет лейциновой молнии. После прогревания в течение 60 мин при 40-50С Cef сохранял 100% эстеразной активности, при 60С - 50%, при 70-90С - инактивировался. Таким образом была подтверждена предсказанная относительная термостабильность Cef Это позволило ввести дополнительный этап его очистки - прогревание при 56С в течение 60 мин для денатурации большинства примесей термолабильных белков. После SDS-электрофореза прогретых препаратов в гелях выявлялась мажорная полоса с ММ ~85 кДа, что соответствовало MM Cef Для подтверждения принадлежности Cef к сериновым липазам и выяснения причастности домена GHSLG к цитотонической активности мы провели эксперимент по его инактивации ингибитором сериновых ферментов PMSF. Инактивированный препарат полностью утратил эстеразную активность, но сохранил способность вызывать удлинение клеток L-929. Следовательно, цитотоническая активность Cef не определяется его субстрат-связывающим доменом (GHSLG).
15
Поскольку в литературе отсутствовали какие-либо данные о Cef V.cholerae 0139, мы секвенировали его ген и сравнили полученные данные с представленными в GenBank. Как видно из таблицы 1, нуклеотидная замена в позиции 2015 привела к появлению в Cef-0139 остатка гидрофильной аминокислоты треонина в позиции 672, вместо гидрофобных - изолейцина в Cef классического типа и валина в Cef вибрионов эльтор и не01/не0139 серогруппы. Чтобы убедиться в том, что треонин в этой позиции является маркером Cef-0139, мы дополнительно секвенировали соответствующий участок гена cef штамма Р-16065 и получили такой же результат. Эта несинонимичная замена слегка повлияла на вторичную (согласно данным программы PSIPRED, Таблица 1. Нуклеотидные и аминокислотные замены в генах cef и их продуктах
Позиция АК в белке |
671 |
672 |
673 |
674 |
Cef-eltor (AAV40602) |
-Ser |
Val |
Val |
Ser- |
-ТСТ |
GTA |
GTG |
AGC- |
|
Cef-classicae (AAV40603) |
-Ser |
Ile |
Val |
Ser- |
-ТСТ |
ATA |
GTG |
AGC- |
|
Cef-0139 (АЕС04822.1) |
-Ser |
Thr |
Val |
Ser- |
-ТСТ |
АСА |
GTG |
AGC- |
|
Cef-nonOl (AAV40604.1) |
-Ser |
Val |
Val |
Ser- |
-ТСТ |
GTG |
GTG |
AGC |
|
Позиции триплетов в гене |
2011-2012 |
2014-2016 |
2017-2019 |
2020-2023 |
Мы впервые изучили ультраструктурные изменения в культуре клеток L-929 и в тонкой кишке мышей-сосунков при действии препарата Cef. На обеих моделях Cef вызывал выраженную вакуолизацию цитоплазмы, свидетельствующую о нарушениях водно-электролитного баланса и обезвоживании клеток (рис.4). Вероятно, это явилось причиной нарушений структуры внутриклеточных органелл, продукты распада которых переваривались активизированным лизосомальным аппаратом. На уровне макроорганизма обезвоживание усугублялось вовлечением в процесс тучных клеток (продуцентов факторов сосудистой проницаемости - гистамина, гепарина, серотонина) и, как следствие, дополнительной потерей жидкости через стенки капилляров Эти данные определенно указывают на причастность Cef к проявлению холерными вибрионами патогенных свойств.
16
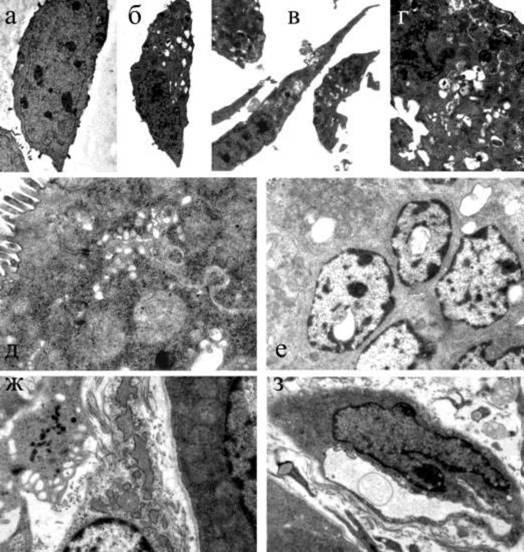
Рисунок 4. Ультраструктурные изменения в клетках L-929 (а-г) и в тонкой кишке мышей-сосунков (д-з) под действием препатата Cef а - контрольная клетка L-929, х8200; б - вакуолизация цитоплазмы, увеличение числа лизосом и смещение ядра на периферию клетки, обработанной Cef, хбООО; в - образование вакуолей и освобождение их содержимого через разрывы клеточной стенки, х4200; г - деформация ядра, вакуолизация цитоплазмы и увеличение числа лизосом, х11500; д - набухание митохондрий, разрушение их крист, образование в цитоплазме эпителиоцитов множественных вакуолей, х20500; e - вакуоли в цитоплазме, внутри набухших митохондрий и ядер, х 6000; ж - частичная дегрануляция тучной клетки, xl 1500; з - пиноцитозные везикулы в стенке капилляра стромы, х8200.
Ранее ничего не было известно о степени специфичности гена cef для V. cholerae. Мы провели ПЦР-детекпию этого гена в геномах нескольких сотен штаммов и выявили, что он всегда присутствовал у холерных вибрионов 01, не01/не0139 се-рогрупп и СТХ V.cholerae 0139, но отсутствовал у всех изученных СТХ" водных штаммов Бенгал, которые были лишены и твиназной активности, хотя были способны
17
к гидролизу трибутирина, по-видимому, за счет действия других липаз/эстераз. Эти данные, полученные с использованием природной модели - се/^негативных вибрионов 0139 серогруппы, подтвердили, что твиназная активность связана с продуктом гена cef Однако, учитывая принципиальные отличия в структуре геномов водных штаммов Бенгал от всех прочих представителей вида V.cholerae [Ерошенко Г.А., 2004], вопрос о том, является ли он единственной твиназой холерных вибрионов, требует дальнейшего исследования. Вместе с тем, широкое распространение гена cef среди клинических и водных штаммов различных серогрупп и достаточно высокий уровень его экспрессии позволяют полагать, что данный фактор может вносить существенный вклад в их выживаемость в водоемах и сточных водах, которые в настоящее время значительно загрязнены поверхностно-активными веществами. Таким образом, Cef, как и НА/Р, является фактором патогенности/персистенции.
3. Токсины, кодируемые генами профага СТХ, и неполный СТХ-элемент.
В состав генома СТХср [Waldor М.К., Mekalanos J.J., 1996] и его предшественника -ActxAB фага рге-СТХф [Boyd E.F., Heilpern A.J., 2000] входят гены zot (zonula occludens toxin) и ace(accessory cholera enterotoxin). Их продукты обладают двойной функцией, являясь составляющими фагового морфогенеза и обладая биологической активностью. Zot разрушает tj в тканях макроорганизма, обеспечивая более свободный доступ токсинов и других белков к мембране [Fasano А., 2000], а Асе может участвовать в развитии диареи благодаря свойствам ион-проницаемой поры [TracksisM. et al, 2000].
Из первичного продукта гена zot с ММ 45 кДа в результате процессинга под действием протеаз V.cholerae образуются 2 формы: ?-концевая (33 кДа), ответственная за вирогению, и С-концевая (12 кДа) - собственно токсин, обозначаемый как AG [Menon D. et al, 2005; Song K.H. et al, 2008]. Последний является аналогом эндогенного модулятора tj зонулина и использует его рецептор [Fasano А., 2001]. Ранее Писа-новым Р.В. (2004) было показано, что если 33 кДа форма обладает сходством с белками целого ряда филаментозных фагов, то собственно токсиновая оказалась уникальной, свойственной только Zot. В соответствии с задачами настоящего исследования наибольший интерес для нас представляла именно эта форма, и в первую очередь вопрос о том, обладает ли AG продукта гена zot pre-CTX (AGpre~ ) свойствами токсина или же они были приобретены только после образования полного СТХср с новым
18
З'-концом zot [Boyd E.F. et al., 2000]. Для ответа на этот вопрос мы провели сравнительный биоинформационный анализ первичной и вторичной структуры AG и AGP " и установили полную консервативность мотива, ответственного за связывание с рецептором Zot/зонулина [Di Pierre M.D. et al., 2001], активного домена AT 1002, которому принадлежит ключевая роль в разрушении tj [Motlekar A. et al., 2006; Goldblum S.E. et al., 2011], и потенциального трансмембранного домена. Что же касается существенно различающихся C-концов, то они, тем не менее, обладали очень близкими вторичными структурами. Это свидетельствовало о наличии у Zotpre" та-кой же биологической активности, как у Zot
Сравнительный анализ первичных структур Асе и Асерге" показал их полную гомологию, то есть Асерге" достоверно несет ту же функциональную нагрузку. Моделирование вторичной структуры Асе позволило установить, что большая часть его молекулы представлена двумя ?-спиралями - потенциальными трансмембранными доменами. Вероятно, способность Асе интегрировать в мембрану объясняет его токсичность для клеток кишечника за счет нарушения их ионного баланса.
С целью получения препаратов Zot и Асе мы клонировали их гены в составе рекомбинантных плазмид pZot69 и рАсе90. Для этого ПЦР-амплификаты генов zot (1,2 т.п.н.) и асе (311 п.н.) V.cholerae, полученные с помощью сконструированных нами праймеров, были встроены в вектор pQE30 по сайтам BamHI-HindlII. Ожидаемые продукты должны были содержать на ?-конце гексагистидиновый блок (6His). Для определения способности штаммов E. coli, содержащих рекомбинантные плазми-ды, к продукции Zot и Асе и локализации белков их, а также контрольный штамм, содержащий векторную плазмиду без вставки, выращивали и индуцировали ИПТГ так же, как описано выше для продуцента НА/Р. Затем разделяли растворимую и нерастворимую (HP) фракции клеток и исследовали их в электрофорезе (рис.5).
Как видно из рисунка 5А, 6His-Zot (белок с ММ ~46 кДа) находился в HP фракции (тельцах включения), где его содержание составляло, по данным программы Quantity One, -18-21% суммарных белков (рис.5А). Белок с ММ ~13 кДа (что соответствует MM 6His-Ace), был выявлен в основном в HP фракции и только после докрашивания ПААГ нитратом серебра (рис. 5Б). Следовательно, он действительно представляет собой Асе, который, как известно, не окрашивается Coomassi Blue [Trucksis М. et al., 1993]. Его выход составлял 7-10% суммарных белков.
19
 A
A
2аа 3аа 4
ММ.кДа
116,0-^ 66,2
Б
12 3аа 4
Рисунок 5. SDS-электрофорез:
А - нерастворимой (1,3) и растворимой (2,4) фракций клеток E.coli M15[pREP4], содержащих pQE30 (1,2) и pZot69 (3,4) в 10% ПААГ. Окраска Coomassi Blue;
Б - нерастворимой (1,3) и растворимой (2,4) фракций клеток E.coli M15[pREP4], содержащих pQE30 (1,2) и рАсе90 (3,4) в 16,5% ПААГ. Окраска Coomassi Blue и нитратом серебра.
Положение рекомбинантных белков 6His-Zot и 6His-Ace отмечено стрелками.
![]() Для тестирования на моделях in vitro и in vivo мы использовали как ОД клеток рекомбинантных клонов, так и их HP фракции после их растворения в 8 М мочевине и многоступенчатого диализа с постепенным снижением концентрации мочевины. Несмотря на присутствие в рекомбинантных молекулах ?-концевого гексагистидино-вого блока (и отсутствия процессинга Zot), оба белка обладали характерной для них биологической активностью. Zot вызывал заметное разрежение плотного монослоя в культурах клеток СаСо2, McCoy и L-929, а также проявление на модели мышей-сосунков энтеротоксичности содержащимися в ОД балластными белками E.coli, которые в отсутствие Zot абсолютно безвредны даже для такой чувствительной модели. Напротив, Zot из телец включения не вызывал накопления жидкости. Асе не оказывал существенного влияния на культуры клеток, но вызывал статистически достоверное накопление жидкости в кишечнике мышей-сосунков (Р<0,003).
Для тестирования на моделях in vitro и in vivo мы использовали как ОД клеток рекомбинантных клонов, так и их HP фракции после их растворения в 8 М мочевине и многоступенчатого диализа с постепенным снижением концентрации мочевины. Несмотря на присутствие в рекомбинантных молекулах ?-концевого гексагистидино-вого блока (и отсутствия процессинга Zot), оба белка обладали характерной для них биологической активностью. Zot вызывал заметное разрежение плотного монослоя в культурах клеток СаСо2, McCoy и L-929, а также проявление на модели мышей-сосунков энтеротоксичности содержащимися в ОД балластными белками E.coli, которые в отсутствие Zot абсолютно безвредны даже для такой чувствительной модели. Напротив, Zot из телец включения не вызывал накопления жидкости. Асе не оказывал существенного влияния на культуры клеток, но вызывал статистически достоверное накопление жидкости в кишечнике мышей-сосунков (Р<0,003).
Поскольку эти данные еще раз подтвердили токсический статус Zot и Асе, мы обратили особое внимание на 26 выделенных в СНГ клинических и водных штаммов, содержащих их гены в составе рге-СТХ, с точки зрения возможности образования ими инфекционных вирионов - факторов горизонтальной передачи. Присутствие в геномах этих штаммов рге-СТХ было подтверждено данными зондирования и
20
![]() ПЦР. У двух штаммов был также выявлен профаг RS1. Изменчивость профагов касалась в основном RS-элементов, особенно гена rstR. У некоторых штаммов удалось определить принадлежность этого гена к эльтор либо к классическому типу, а у одного - присутствие обоих типов. Остальные, возможно, содержали rstR другого типа [Davis В.М. et al, 1999; Mukhopadhyay А. К. et al, 2001]. Результаты ПЦР и блот-гибридизации HindIII- и BglII-рестриктов ДНК с мечеными Р зондами US (содержащим гены orfU, zot и асе) и RS позволили предположить наличие у многих штаммов тандемной дупликации рге-СТХ, которая является необходимым условием образования репликативных форм (РФ) и фаговых частиц [Davis В.М., Waldor М.К., 2000]. Эта способность была подтверждена экспериментально следующим образом.
ПЦР. У двух штаммов был также выявлен профаг RS1. Изменчивость профагов касалась в основном RS-элементов, особенно гена rstR. У некоторых штаммов удалось определить принадлежность этого гена к эльтор либо к классическому типу, а у одного - присутствие обоих типов. Остальные, возможно, содержали rstR другого типа [Davis В.М. et al, 1999; Mukhopadhyay А. К. et al, 2001]. Результаты ПЦР и блот-гибридизации HindIII- и BglII-рестриктов ДНК с мечеными Р зондами US (содержащим гены orfU, zot и асе) и RS позволили предположить наличие у многих штаммов тандемной дупликации рге-СТХ, которая является необходимым условием образования репликативных форм (РФ) и фаговых частиц [Davis В.М., Waldor М.К., 2000]. Эта способность была подтверждена экспериментально следующим образом.
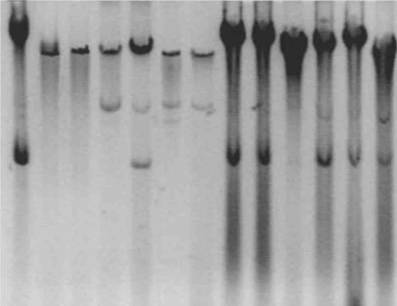
Известно, что размножение фага СТХср происходит без лизиса клетки-хозяина, при этом образуется небольшое число фаговых частиц, которое заметно увеличивается в культурах, содержащих в клетках РФ (рСТХ). Поэтому для повышения выхода вирионов и визуализации РФ и мы использовали соответственно индукцию митоми-цином С как описано Faruque S.M. et al. (1998) и амплификацию хлорамфениколом (как при выделении низкокопийных плазмид). Электрофорез тотальной ДНК исследуемых штаммов позволил выявить у 16 из 18 штаммов 01 и 2 из 8 штаммов не01/не0139 серогрупп поддающиеся визуализации плазмиды. Для доказательства того, что эти плазмиды являются РФ рге-СТХф, мы провели блот-гибридизацию с зондом Us, меченым дигоксигенином. Плазмиды гибридизовались с этим зондом, то есть действительно представляли собой РФ рге-СТХф (рис.6).
1а 2 3 4 *5а 6аа 7аа 8а 9аа 10 11* 12аа 13аа 14
|
Рисунок 6. Пример результатов блот-Iа гибридизации тотальной
жа ДНК штаммов холерных вибрионов, содержащих Iа профаг рге-СТХ, с зондом
I", На дорожках 1 и 4-14 видны по 1-2 формы РФ рге-СТХф.
21
![]() Препараты предполагаемой фаговой ДНК выделяли из супернатантов культур [Faruque S.M. et al., 1998] до индукции хлорамфениколом (так как последний ингиби-рует синтез белка и мог препятствовать фагосборке). В препаратах из супернатантов штаммов, содержащих РФ, с помощью ПЦР были выявлены гены рге-СТХ сер, orfU, асе, zot, rstA и не были выявлены гены бактериального генома toxR, hapA, cefn rtxA. Следовательно, в них присутствовала ДНК рге-СТХф. Напротив, штаммы, не образующие РФ, оказались неспособными и к вирогении. Один из штаммов 01 серогруп-пы (Р-9961) одновременно продуцировал РФ и вирионы двух фагов - рге-СТХф и RSlcp даже в отсутствие какой-либо индукции.
Препараты предполагаемой фаговой ДНК выделяли из супернатантов культур [Faruque S.M. et al., 1998] до индукции хлорамфениколом (так как последний ингиби-рует синтез белка и мог препятствовать фагосборке). В препаратах из супернатантов штаммов, содержащих РФ, с помощью ПЦР были выявлены гены рге-СТХ сер, orfU, асе, zot, rstA и не были выявлены гены бактериального генома toxR, hapA, cefn rtxA. Следовательно, в них присутствовала ДНК рге-СТХф. Напротив, штаммы, не образующие РФ, оказались неспособными и к вирогении. Один из штаммов 01 серогруп-пы (Р-9961) одновременно продуцировал РФ и вирионы двух фагов - рге-СТХф и RSlcp даже в отсутствие какой-либо индукции.
Таким образом, большинство выделенных в СНГ штаммов V.cholerae, содержащих рге-СТХ, могут служить источником фаговых частиц, осуществляющих специфическую трансдукцию - традиционный путь горизонтальной передачи. Однако и все остальные штаммы данной группы следует считать источником генов факторов патогенности Сер, Асе и Zot, которые могут быть переданы нетрадиционными способами, такими как неспецифическая TCP-независимая трансдукция фагами СР-Т1 [Boyd E.F., Waldor М.К., 2000] либо VGJcp [Campos J. et al, 2003].
4. Другие токсины и вспомогательные факторы патогенности. Кроме описанных выше, холерные вибрионы обладают еще целым рядом факторов, роль которых в патогенезе доказана либо только предполагается. К числу таких факторов относится высокомолекулярный цитотоксин MARTXvc, продукт гена rtxA в составе RTX-кластера [Boardman К.В., Fullner Satchell K.J., 2004, 2007]. Его биологическая активность выражается в деполимеризации и ковалентном связывании актина, что приводит к повреждению цитоскелета эукариотической клетки [Lin W. et al., 1999; Fullner K.J., Mekalanos J.J., 2000]. За эти процессы отвечает актин-связывающий домен ACD, сходный с ACD другого белка - VgrGl (ключевого эффектора системы секреции шестого типа), который обладает такой же активностью и, возможно, является предшественником ACD-RtxA [Sheanan K.L. et al., 2004]. Мы провели ПЦР-детекцию последовательностей, кодирующих 5'-конец rtxA, его ACD, и гена rtxC (предполагаемого ак-
22
тиватора MARTX). Подавляющее большинство штаммов содержало все 3 искомые последовательности, у некоторых были выявлены делеции acd-rtxA ибо rtxC. Одновременное присутствие детерминант доменов-лдвойников acd-rtxA и acd-vgrGl было выявлено у меньшинства штаммов, поэтому не исключено, что их сосуществование невыгодно для бактериальных клеток. По-видимому, ген rtxA может экспрессировать-ся многими нехолерогенными штаммами V. cholerae и вносить свой вклад в патогенез вызываемых ими заболеваний.
К факторам патогенности V.cholerae некоторые авторы относят нейраминидазу (НАНазу) [Мишанькин Б.Н. с соавт.,1989; Galen J.E. et al., 1992; Миронова Л.В. с со-авт., 2004], ген которой (папН) входит в состав острова патогенности VPI-2 [Jermin W.S., Boyd E.F., 2002]. Мы изучали целостность VPI-2 по наличию трех последовательностей - int(ллевый краевой ген VC1758), папН и vce(лправый краевой ген VC1806). Холерогенные штаммы 01 серогруппы за редким исключением содержали полный VPI-2, как и многие нехолерогенные, однако для последних более характерным было отсутствие vce. Меньшая часть штаммов имела делеции различных частей либо всего острова. У некоторых штаммов 01 и не01/не0139 серогрупп отсутствовала его центральная часть с геном папН, как у ctxABштаммов Бенгал. Аналогичные результаты были получены Топорковым А.В. с соавт. (2004) при исследовании генома штаммов V.choleraeклассического биовара. Эти данные свидетельствуют о том, что делеция части VPI-2, характерная для штаммов Бенгал, может иметь место и у вибрионов 01 серогруппы. Все изученные водные ctxAB' штаммы 0139 серогруппы, по видимому, содержали интактный VPI-2.
Мы также обратили внимание на токсины, гены которых встречаются у холерных вибрионов довольно редко. С помощью дот-гибридизации (но не ПЦР) у целого ряда ctxAB' штаммов 01 и не01/не0139 серогрупп удалось выявить последовательности, гомологичные гену термостабильного токсина (ST). Однако вопрос о том, способны ли они к продукции полноценного, биологически активного ST, требует дополнительного изучения. Это же относится и к группе штаммов 01 серогруппы - возбудителей вспышки и последующих случаев заболеваний в Донецке и Мариуполе 1970х годов, у которых также с помощью дот-гибридизации были выявлены последовательности, гомологичные гену термостабильного прямого гемолизина (tdh) - ключевого фактора патогенности V.parahaemolyticus. Эти результаты оказались неожи-
23
данными, поскольку в литературе имеются сведения о редком обнаружении tdh только у представителей не01/не0139 серогрупп [Yoh М. et al., 1986; Terai A. et.al., 1991]. Однако изученные нами штаммы V.cholerae non01/non0139 (около 150) не гибриди-зовались с зондом tdh. Что касается Донецких штаммов, то в пользу возможной экспрессии ими TDH свидетельствует лишь тот факт, что вспышка протекала по типу пищевой токсикоинфекции, что характерно для V.parahatmolyticus. Ни у одного из штаммов не было выявлено генов TDH-родственного гемолизина (trh) и шигаподоб-ного токсина (siti). По-видимому, они вообще не встречаются у V.cholerae, поскольку ген trh не был обнаружен у них и другими авторами и не связан с типичными мобильными элементами [Kishishita М. et al., 1992; Yamamoto К. et al., 1992], a слабая продукция холерными вибрионами токсина, близкого Siti, была выявлена исключительно серологическими методами [O'Brien A.D. et al., 1984].
В начале наших исследований, когда геном холерных вибрионов еще не был расшифрован полностью, наше внимание привлек ряд работ под руководством Sanyal S.C. (1983-1996), в которых был описан диареегенный фактор, названный авторами NCT (new cholera toxin). Мы полагали, что некоторые ctxAB' штаммы, выделенные в бывших республиках СССР от больных с признаками типичной холеры, могли быть способны к продукции такого токсина, и попытались определить свойства некоторых секретируемых ими биологически активных субстанций. Действительно, препараты-сырцы, полученные осаждением сульфатом аммония как описано Saha S., Sanyal S.C. (1990), вызывали повышение кожной проницаемости в пробе Крейга, отек лапок белых мышей, энтеропатогенный эффект у кроликов-сосунков и два типа реакции клеток СНО - округление в присутствии низких разведений препарата и удлинение под действием более высоких. С помощью гель-фильтрации на Toyopearl HW55F удалось разделить локругляющую и лудлиняющую фракции. При этом первая расщепляла белки молока, а вторая - трибутирин, то есть цитотоксический компонент, по-видимому, представлен в основном НА/Р (возможно, с примесью других протеаз), а питотонический - Cef. Анализ литературных и полученных нами данных позволил заключить, что NCT представляет собой не отдельный самостоятельный токсин, а варьирующую по составу смесь нескольких факторов. У исследованных нами штаммов она включала Cef, НА/Р, а также, возможно, другие протеазы и/или MARTXVc. Следует подчеркнуть, что авторы, описавшие NCT, не идентифицировали его генети-
24
ческих детерминант и работали фактически с тотальной смесью белков, осажденных из культуральных жидкостей сульфатом аммония. Этот же препарат был использован ими и для получения сывороток к NCT, которые, естественно, реагировали со всеми штаммами V. cholerae (как и полученные нами сыворотки к препарату-сырцу).
Важнейшая роль в патогенности и персистенции холерных вибрионов принадлежит факторам адгезии. К ним относятся, наряду с другими, TCP и маннозочувстви-тельные пили (MSHA) [Kaper J.B. et al., 1995]. Их специальное изучение не входило в цели настоящей работы, но для более полной характеристики исследуемых штаммов мы определяли наличие генов tcpA и mshA, кодирующих структурные единицы этих пилей. TCP считаются главным фактором колонизации, a MSHA связывают в основном с персистенцией в водоемах за счет формирования биопленок [Watnick P.I. et al., 1999; Chiavelli D.A. et al., 2001]. Результаты определения гена tcpA с помощью зондирования и ПЦР показали, что лишь небольшая часть ctxAB' штаммов V. cholerae 01 и non01/non0139 содержала этот ген. У tcpA штаммов почти всегда выявлялся и другой ген VPI, toxT, что свидетельствовало в пользу присутствия у них данного острова. Сам ген tcpA у большинства штаммов находился в виде аллеля tcpAe . Аллель tcpA0 ass был выявлен всего у 7 штаммов. У отдельных рге-СТХ штаммов ген tcpA не ампли-фицировался в ПЦР несмотря на положительные результаты гибридизации, что указывает на принадлежность его к другому(им) типу. Ген mshA содержали все исследованные CTX+VPI+ штаммы 01 и 0139, большинство ctxAB~YYl+ и ctxAB'WYY штаммов 01, но меньшинство представителей не01/не0139 серогрупп и ни один из 22 водных штаммов Бенгал. Отсутствие гена mshA у многих штаммов, циркулирующих в открытых водоемах, указывает на то, что MSHA, хотя и считаются существенными факторами персистенции, могут быть заменены другими адгезинами. Следует отметить, что у всех изученных штаммов были выявлены гены хромосомного локуса vps (vpsA, vpsL), также играющего важную роль в образовании биопленок [Yildiz F.H., Schoolnik G.K., 1999]. Еще одной заслуживающей внимания функцией пилей MSHA является их способность служить рецептором для адсорбции фага VGJcp, переносящего СТХср с более высокой частотой, чем при их собственной TCP-зависимой трансдукции [Campos J. et al., 2003]. Поэтому WYlmshA+ штаммы V.cholerae могут рассматриваться наряду с VPIа штаммами как потенциальные реципиенты генов факторов патогенности.
25
В настоящее время способность TCP служить рецептором СТХср общеизвестна [Faruque, S.M., Mekalanos J.J., 2003]. Однако их наличие является необходимым, но не достаточным условием эффективного проникновения фага в бактериальную клетку, для этого нужны также продукты генов /о/-кластера (TolQRA) [Heilpern A.J., Waldor М.К., 2000]. Они способны обеспечивать горизонтальную передачу СТХср даже в отсутствие TCP, хотя вероятность такого события довольно низка. Среди изсследован-ных нами нескольких сотен штаммов V.choleraeразличных серогрупп не было обнаружено ни одного лишенного генов tolQRA. Это вполне объяснимо с точки зрения показанного Heilpern A.J., Waldor М.К. (2000) участия их продуктов в поддержании целостности клеточной стенки. Повреждение любого из этих генов приводит к резкому снижению жизнеспособности, и такие мутации, по-видимому, летальны.
Таким образом, СТХТСР" штаммы могут использовать по меньшей мере два запасных пути приобретения профага СТХ - за счет продуктов генов toZ-кластера [Heilpern A.J., Waldor М.К., 2000] и MSHA [Campos J. et al., 2003], a представители 01 серогруппы располагают еще и третьим путем - за счет трансдукции СТХср фагом СР-Т1, рецептором которому служит Ol-антиген [Boyd E.F., Waldor М.К., 1999].
5. Контакт-зависимые системы секреции. Особое значение во взаимоотношениях бактерий с организмом хозяина имеют специализированные способы секреции токсических субстанций (эффекторов). Недавно у отдельных штаммов не01/не 0139 серогрупп было установлено наличие двух систем секреции (SS), действие которых основано на непосредственном контакте бактериальных клеток с эукариотиче-скими - третьего (T3SS) [Dziejman М. et al., 2005; Chen Y. et al., 2007] и шестого (T6SS) [Pukatzki S. et al., 2006] типов. Обе состоят из комплекса белков-транслоконов, напоминающего иглу, через которую эффекторы проникают из клетки возбудителя в клетку хозяина минуя внеклеточное пространство, что ограничивает подверженность антигенов действию защитных сил макроорганизма. Вместе с тем, T3SS и T6SS кодируются разными кластерами генов и имеют разные транслоконы и эффекторы. Поскольку данные о распространении кластеров этих двух SS среди штаммов V. cholerae были весьма немногочисленны [Ерошенко Г.А., с соавт., 2008, 2009], мы провели ПЦР-детекцию отдельных генов, выбранных в качестве маркерных, у 320 штаммов различных серогрупп.
26
Маркерами гаокластера (T3SS) служили гены vcsN2, vcsV2, vscC2 и vspD. Они были выявлены примерно у половины штаммов не только не01/не0139, но и 01 се-рогруппы (последнее установлено нами впервые). Практически все СТХ вибрионы были лишены генов T3SS. В группе рге-СТХ штаммов были как T3SS , так и T3SS", а среди клинических СТХ7рге-СТХ" штаммов преобладали T3SS . К их числу относились все CTX~VPI штаммы клона 01 серогруппы, вызвавшего эпидосложнения в Каменском районе Ростовской области в 2005 г., и вышеупомянутые CTX~VPI~ штаммы клона 01 серогруппы - возбудители заболеваний в Донецке и Мариуполе (1971-1973). Гены ves были обнаружены менее, чем у половины штаммов 01 и не01/не0139 серогрупп, выделенных из внешней среды в отсутствие эпидосложне-ний, и ни у одного из СТХ" штаммов Бенгал.
Для детекции vas-кластера (T6SS) мы использовали в качестве маркерных 4 гена - vasA, vasF, vasKи vgrG3 (его 3'-концевую последовательность, кодирующую пептидогликан-связывающий домен, PBD-VgrG3). Также выявляли локализованные за пределами этого кластера гены транслокона hepи последовательность, кодирующую ACD ключевого эффектора T6SS VgrGl. У 100% штаммов присутствовали гены vas и hep, тогда как acd-vgrGlnpbd-vgrG3 у многих не были обнаружены.
Для определения экспрессии этих SS мы использовали штамм амебы Dictyostelium discoideum - своеобразную модель макрофагов, предложенную Pukatski S. et al. (2006) для изучения T6SS у V.cholerae. При совместном культивировании эта амеба, передвигаясь по поверхности агара и питаясь бактериями, образует зоны просветления (бляшки) в газоне штаммов, не экспрессирующих T6SS, а экспрессирую-щие T6SS убивают амебу, и бляшки не образуются. Эта же модель оказалась адекватной для изучения экспрессии T3SS P.aeruginosa [Pukatzki S. et al., 2002], a все опубликованные экспериментальные данные о механизмах устойчивости V.cholerae к D.discoideum были получены с использованием всего одного штамма, лишенного T3SS (Pukatzki S. et al., 2006; Miyata S.T. et al., 2011). Поэтому вопрос о том, может ли устойчивость V.cholerae к поеданию амебой проявляться за счет T3SS, остался открытым. Мы определили Dictyo-фенотипы 152 штаммов с различными генотипами (СТХ, VPI, T3SS, acd-vgrGl). Анализ полученных результатов (табл.2) позволил установить следующие корреляции:
27
1). Устойчивость ctxAB' штаммов никак не зависела от присутствия генов T3SS, то есть она либо не экспрессируется в данных условиях эксперимента, либо у V.cholerae, в отличие от Pseudomonas, не является фактором антагонистической активности по отношению к простейшим, как предполагали Dziejman М. et al. (2005). Очевидно, эта система служит для колонизации кишечника, особенно у штаммов, не образующих TCP [Tarn V.C. et al., 2007, 2010; Alani A. et al., 2011]. Следовательно, модель D.discoideum позволяет достоверно оценить функционирование именно T6SS.
Таблица 2. Генотипическая характеристика 152 штаммов холерных вибрионов и их Dictyo-фенотипы |
||||||||||||
ctxAB+ |
ctxAB |
|||||||||||
T3SS |
T3SS+ |
T3SS |
||||||||||
Серо-группа |
N* |
acd-vgrGl |
VPI |
Die tyo |
N* |
acd-vgrGl |
VPI |
Die tyo |
N* |
acd-vgrGl |
VPI |
Die tyo |
01 |
20 |
+ |
+ |
S |
20 |
- |
- |
S |
7 |
- |
- |
S |
1 |
- |
+ |
S |
1 |
- |
+ |
S |
|||||
1 |
+ |
- |
S |
3 |
+ |
- |
S |
|||||
6 |
+ |
+ |
R |
21 |
+ |
+ |
R |
|||||
0139 |
10 |
+ |
+ |
S |
0 |
20 |
- |
- |
S |
|||
nonOl/ non 0139 |
5 |
- |
+ |
S |
14 |
- |
- |
S |
2 |
- |
- |
S |
ю** |
- |
+ |
S |
7 |
- |
+ |
S |
1 |
- |
+ |
s |
|
4 |
+ |
+ |
S |
2 |
+ |
- |
s |
6 |
+ |
- |
s |
|
*N - число штаммов, **T3SS -штамм
2). Устойчивостью (Dictyo -фенотипом) обладали всего 27 штаммов 01 серо-группы, и все они содержали не только acd-vgrGl, но и остров патогенности VPI, а acd-vgrGl VPI" штаммы были чувствительны (Dictyo ). Нам не удалось оценить значимости PBD, поскольку все без исключения Dictyo штаммы содержали pbd-vgrG3. Причины этой корреляции нам неизвестны. Учитывая, что активность ACD-VgrGl TуSS-зависима и проявляется только при эндоцитозе вибрионов клетками-мишенями [Ma А.Т. et al., 2009], можно допустить, что определенную роль во взаимодействии с клетками амебы могут играть TCP. Однако у вибрионов эльтор они практически не образуются вне кишечника теплокровного хозяина [Waldor М.К., Mekalanos J.J., 1996]. Предстоит еще выяснить, может ли их синтез индуцироваться в присутствии амебы. С другой стороны, VPI содержит ряд генов, функции которых до сих пор не установлены.
3). Большинство T3SS штаммов не содержало acd-vgrGl, а большинство T3SS - содержало. Это наводит на мысль о том, что для реализации стратегии контакт-
28
зависимой вирулентности in vivo холерным вибрионам достаточно одной из этих SS, а поддержание активности обеих одновременно, возможно, для них невыгодно.
4). СТХ штаммы не обладали устойчивостью несмотря на наличие всех генов T6SS. Не исключено, что данная стратегия вообще не используется штаммами, продуцирующими высокоактивный СТ, и присутствие у них генов vas, hep, pbd-vgrG3 и acd-vgrGlявляется своего рода рудиментом. Последний, кстати, был уже утрачен большинством представителей не01/не0139 серогрупп.
6. Фенотипическая и генотипическая характеристика вирулентности не-холерогенных штаммов холерных вибрионов. В предшествующих разделах была показана причастность к патогенезу отдельных факторов, но наибольший интерес представлял вопрос о том, каким(ими) из них обусловлена реальная опасность ctxAB' штаммов V.cholerae. Поэтому мы провели изучение фенотипических свойств, связанных с проявлением вирулентности, рядом штаммов с различными генотипами in vitro и in vivo. Все включенные в это исследование штаммы содержали гены toxR, attRS, tolQRA, rtxA, rtxC, hapA, hapR, cef, hlyA, T6SS (yasA, vasK, vasF, hep), vpsA, vpsL и не содержали sltln trh. По присутствию/отсутствию генов pre-CTX, VPI и VPI-2, T3SS, a также acd-vgrGl, pbd-vgrG3, mshA, stn/sto и tdh имелись межштаммовые различия.
Для определения активности секретируемых факторов использовали суперна-танты бульонных культур, выращенных с шуттелированием (то есть в условиях, исключающих синтез HlyA). Большинство их вызывало округление клеток СНО и L-929, возможно, за счет действия НА/Р, других протеаз и/или MARTX. Некоторые оказывали цитодеструктивное действие либо вызвали заметное, хотя и более слабое по сравнению с индуцируемым СТ удлинение, что было связано, по-видимому, с активностью Cef. Все супернатанты вызывали повышение кожной проницаемости в пробе Крейга, один (рге-СТХ+) инициировал некроз, и он же обусловливал гибель и деструкцию клеток СНО и L-929. Ранее точно такие же эффекты были отмечены Помухи-ной О.И. (1990) при изучении на модели СНО препаратов так называемого дермонек-ротического фактора (ДНФ).
Полученные данные свидетельствуют о том, что ctxAB' штаммы V. cholerae даже при одинаковых или близких генотипах варьируют по уровням продукции различных биологически активных факторов. Поскольку эти уровни могут существенно разли-
29
чаться в условиях in vitro и in vivo, следующим этапом работы явилось изучение эффектов, вызываемых живыми культурами в организме чувствительных животных.
Для изучения вирулентности на модели кроликов-сосунков было отобрано 39 ctxAB' штаммов V.cholerae 01 и non01/non0139, для сравнения использовали 11 СТХ штаммов различных серогрупп. Все СТХ штаммы 01/0139, содержащие также VPI, вызывали гибель почти всех зараженных крольчат с развитием выраженного хо-лерогенного (ХГ) эффекта, тогда как представители не01/не0139 серогрупп вызывали ХГ эффект только у части зараженных животных, а у другой части наблюдался эн-теропатогенный (ЭП) эффект. СТХ+ штаммы 0139 и не01/не0139, в отличие от 01, оказались способными к диссеминации в другие органы и ткани. Большинство ctxAB' штаммов вызывало гибель части зараженных животных при развитии у них выраженного ЭП эффекта с интенсивным размножением вибрионов в кишечнике, а более половины их были способны к диссеминации. Другие занимали промежуточное положение между ХГ и ЭП штаммами: у части животных они вызывали эффект, сходный с ХГ (СХГ) - накопление больших количеств полупрозрачной опалесцирующей жидкости, у другой части - выраженный ЭП эффект. Супернатанты содержимого кишечника кроликов, зараженных некоторыми штаммами, лизировали эритроциты барана, что указывало на продукцию HlyA. Однако ни один из перечисленных эффектов строго не коррелировал с генотипами использованных для заражения штаммов. Например, авирулентный для сосунков штамм Р-9337 имел такой же генотип, как высоковирулентный 14863 (CTX/pre-CTX~ VPI" acd-rtxA+ int+ nantt vce~ mshA+ T3SS + acd-vgrGT pbd-vgrG3~ mshA+ stn/sto+). Напротив, штаммы с разными генотипами могли обладать практически одинаковой вирулентностью. Очевидно, факторы патогенности взаимозаменяемы, то есть отсутствие одних компенсируется повышенной продукцией других, результатом чего является развитие заболевания. Для проверки этого предположения мы провели электронно-микроскопическое изучение тонкого кишечника кроликов-сосунков, зараженных несколькими штаммами V.cholerae.
При заражении кроликов-сосунков СТХ -штаммами ультраструктурные изменения не отличались от описанных в литературе [Авакян А.А. с соавт., 1972; Бардах-чьян Э.А. с соавт., 2001; Mathan М.М., 1995, 2009; Quadri F. et al, 2004]. Клетки кишечника погибали в основном в результате гидропической и баллонной дистрофии.
30
У сосунков, зараженных нехолерогенным штаммом 01 серогруппы, вибрионы выявлялись не только в просвете кишки, но и в строме ворсин, и даже проникали в подслизистый слой (рис. 7а, б). В результате в эпителии возникали необратимые повреждения и некроз. Происходила деструкция микроворсинок, клазматоз и слущива-ние отдельных клеток, разрушение их мембран, набухание митохондрий, расширение эндоплазматического ретикулума, активация лизосомального аппарата (рис. 76, в). В ЕС-клетках была заметна дегрануляция. Интересным свойством изучаемого штамма явилась способность вызывать апоптоз лимфоцитов собственной пластинки слизистой оболочки и межэпителиальных лимфоцитов (рис. 7д), следствием которого могут быть серьезные нарушения иммунного статуса и последующее развитие иммунодефицита. На этом фоне происходили изменения микроциркуляции: образование тромбов в просвете капилляров, усиление микропиноцитоза, вакуолизация цитоплазмы и локальные повреждения мембраны эндотелиоцитов. Экстравазальные нарушения характеризовались выходом жидкой части крови, фибрина и форменных элементов в интерстициальное пространство (рис. 7е, ж).
31
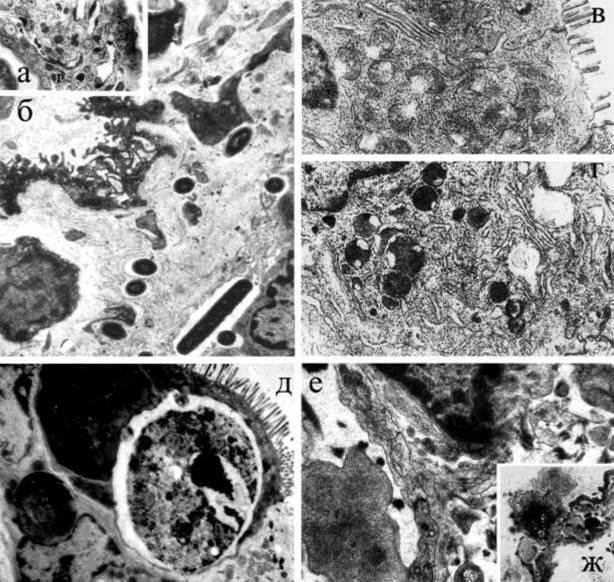
Рисунок 7. Ультраструктурные изменения в тонкой кишке, вызванные нехолерогенным штаммом V.cholerae 14863: а - вибрионы в строме ворсин, хбЗО и б - в подслизистом слое, хЗООО; в - набухание митохондрий и деструкция их мембран, хбООО; в - расширение гранулярного эндо-плазматического ретикулума, хбООО; г - увеличение числа лизосом и их активация, хбООО; д - апоптоз внутриэпителиального лимфоцита, хбООО; e - расхождение эндоте-лиопитов и выход крови в интерстициальное пространство, хЮООО; ж - адгезия тромбоцита в участке деструкции капилляра, х8000.
При заражении штаммом 013 серогруппы в первую очередь обращало на себя
внимание образование лакун между смежными эпителиоцитами (рис. 8а,б), аналогичное наблюдаемому под действием препарата НА/Р, а также два типа реакций митохондрий - набухание и конденсация (рис. 8в). Вакуолизация цитоплазмы (рис. 8г) была выражена значительно слабее, чем при заражении СТХ штаммом не01/не0139 серогруппы (рис.8д). Однако в 2011 г. Shin et al. показали способность другого ctxAB' tcpA' штамма (039 серогруппы) обусловливать за счет экспрессии T3SS точно такую
32
же гидропическую дистрофию, как изученный нами ctxAB tcpA T3SS" штамм. Это указывает на способность некоторых нехолерогенных штаммов к активной продукции дополнительных токсинов и/или других факторов, которые и в отсутствие СТ мо-
гут вызывать тяжелые диарейные заболевания.
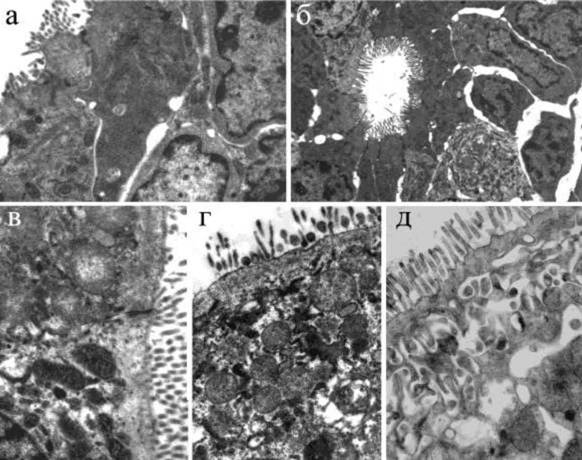
Рисунок 8. Ультраструктурные изменения в тонкой кишке, вызванные V.cholerae non01/non0139 17449 (рге-СТХ+, а-г) и 16150 (СТХ+, д): а - образование лакун по ходу границы между смежными эпителиоцитами щеточной каймы (х9900) и б - крипт (х4200); в - изменения митохондрий двух типов - набухание с разрушением крист и конденсация, х 16500; г - вакуолизация цитоплазмы и повреждение органелл, х 165 00; д - гидропическая дистрофия эпителиоцитов под действием СТХ штамма, х 10000.
Результаты изучения ультраструктурных изменений подтвердили наше предположение о взаимозаменяемости факторов патогенности ctxAB' вибрионов. Штамм V.cholerae 01 лишен генов pre-CTX, VPI, детерминант активных доменов T6SS (acd-vgrGl иpbd-vgrG3), но содержит гены T3SS. Несмотря на отсутствие TCP, он обладает высокой колонизирующей способностью и даже инвазивностью. Возможно, она обусловлена экспрессией T3SS in vivo, на что могут указывать незавершенный фагоцитоз вибрионов макрофагами и гибель лимфоцитов и эпителиоцитов
33
[Tarn V.C. et al., 2007], хотя мы не исключаем участия других факторов, таких как MARTX и HlyA [Olivier V. et al., 2007, 2009], тем более что гемолизин присутствовал в содержимом кишечника зараженных животных. Штамм не01/не0139 серогруппы отличается от него присутствием рге-СТХ и VPI. Если он образует TCP и/или Сер, то экспрессия T3SS, генами которой он также обладает, может не происходить или быть пониженной. T6SS лишена ACD-VgrGl, но имеет PBD-VgrG3, поэтому остается вероятность транслокации других, еще неизвестных эффекторов. В развитии диареи могут участвовать порообразователь Асе и модулятор актина Zot, отсутствующие у штамма 01 серогруппы. Уровни эспрессии генов, общих для обоих штаммов (rtxA, cef, hapA, ЫуА и, возможно, stn/sto) также могут быть разными. Например, образование лакун между смежными эпителиоцитами в кишечнике животных, зараженных штаммом 17449, наводит на мысль о преобладании НА/Р (ср. рис. 8а,б и 2в, г), а признаки быстрого обезвоживания под действием штамма 14863 - о повышенной продукции Cef (ср. рис.7в,г и 4д,е). Сходные повреждения клеточных органелл и капилляров, вызванные обоими штаммами, могут быть следствием активности общих либо различных токсических субстанций, количественное соотношение которых скорее всего неодинаково. Наконец, некоторые из эффектов имеют сходство с вызываемыми СТХ штаммами (вакуолизация цитоплазмы, разрушение органелл, реакции тучных и ЕС клеток, повышение сосудистой проницаемости). Это обстоятельство указывает на то, что в отдельных случаях даже основной фактор патогенности СТ вполне заменим теми или иными дополнительными факторами. Очевидно, эти случаи относятся большей частью к ослабленным людям с пониженной сопротивляемостью инфекциям в силу неблагоприятных экологических условий, возрастных особенностей либо наличия хронических соматических заболеваний.
ЗАКЛЮЧЕНИЕ
Нехолерогенные штаммы V.cholerae, способные вызывать спорадические случаи и вспышки ОКИ, привлекают к себе особое внимание. Молекулярно-генетические характеристики некоторых из них уникальны, что свидетельствует о формировании новых клонов с достаточно высоким патогенетическим потенциалом, таких как клон из Саудовской Аравии [Bubshait S.A. et al., 2000], Tukumбn из Аргентины [Pichel М. et al., 2003], Mexican из Мексики [Lizбrraga-Partida M.L., Quilici M.-L., 2009] и
34
Amazon из Бразилии [Figueiredo S.C. et al., 2005], представители которого были обнаружены и в Гане [Thompson C.C. et al., 2011]. Результаты наших исследований указывают на клональный характер вспышек ОКИ в Ростовской области РФ 2005 г., Украине 1971 г. и Узбекистане 1990 г. Риск распространения этих и, возможно, еще не выявленных подобных клонов продолжает существовать. Многие штаммы, лишенные генов ключевого фактора патогенности холерного токсина, компенсируют их отсутствие приобретением и экспрессией целого ряда других генов, восстанавливая таким образом реализуемую V.cholerae общую стратегию вирулентности.
Своеобразным путем приспособления холерных вибрионов к существованию в организме человека представляется лэксплуатация в качестве факторов патогенности продуктов генов, входящих в состав геномов умеренных фагов СТХср и рге-СТХф и необходимых для вирогении. Продукт гена сер является белком капсида СТХср, однако холерные вибрионы используют его в качестве дополнительного фактора колонизации кишечника. Асе, также белок капсида, обладает свойствами ион-проницаемой поры. Zot способствует сборке вирионов и их выходу из бактериальной клетки, но его C-терминальная часть (AG) представляет интереснейший пример своеобразной мимикрии, являясь аналогом эндогенного модулятора tj зонулина и используя его рецептор. Другими примерами такой мимикрии могут служить термостабильный токсин (ST) - суперагонист эукариотического гормона гуанилина, активатора гуанилатциклазы [Fasano А., 2002], и эффектор T3SS VopF с тремя доменами, сходными с эукариотическими нуклеаторами актина [Tarn V.C. et al., 2007].
Интенсивное развитие исследований геномов V.cholerae позволило наблюдать и такое интересное явление, как дублирование генов, доменов, структуры и функции их продуктов. Две копии в составе большой и малой хромосом имеет ген транс локона T6SS hep. Актин-связывающий домен ее эффектора, ACD-VgrGl, является гомологом и вероятным предшественником уникального домена ACD-RtxA. Вообще же функции модуляторов актина разными путями реализует целый ряд факторов: Zot - за счет активации протеинкиназы С [Fasano А., 2002], НА/Р - посредством расщепления окк-людина [Wu Z. et al., 2000], эффекторы T3SS VopF/VopN - благодаря нуклеации актина [Tarn V.C. et al., 2010], MARTXVc- вызывая его деполимеризацию и ковалентное связывание [Fullner Satchell K.J., 2007]. У отдельных штаммов даже отсутствие активатора аденилатциклазы СТ отчасти компенсируется активатором гуанилатциклазы
35
ST, ген которого был приобретен сравнительно недавно. Создается впечатление, будто холерные вибрионы накапливали и продолжают накапливать про запас гены, продукты которых не идентичны структурно, но сходны функционально. Тогда в случае повреждения либо утраты одних генов всегда можно активизировать другие. Очевидно, этим объясняются неудачи при попытке создания совершенно нереактогенных живых противохолерных вакцин. С другой стороны, иногда прослеживается и прямо противоположный процесс - утрата либо повреждение некоторых дублирующих генов или их доменов, поддержание экспрессии которых может быть энергетически невыгодно. Результаты наших исследований показали, что одновременное присутствие детерминант ACD-VgrGl и ACD-RtxA, ACD-VgrGl и кластера генов T3SS, про-фага СТХ и T3SS характерно лишь для меньшинства штаммов.
По образному выражению Fasano А. (2002), то, как бактерии приспособились приобретать новые гены, сохранять их в своем весьма небольшом геноме, да еще и делиться этой информацией с другими себе подобными, наводит на мысль о том, что они знали физиологию макроорганизма уже за тысячи, если не за миллионы лет до нас. Этому обмену генетической информацией способствует наличие в геноме V.choleraeбольшого числа мобильных элементов [Faruque S.M., Mekalanos J.J., 2003] и суперинтегрона [Clark С. A. et al., 2000; Heidelberg J.F. et al., 2000]. Постоянно продолжающееся формирование новых форм возбудителя требует дальнейшего изучения свойств известных дополнительных токсинов и идентификации неизвестных, поскольку нельзя исключить, что в скором времени может произойти отбор клонов с таким их сочетанием, которое обеспечит способность вызывать более тяжелые заболевания людей и распространяться на обширные пространства, как это уже происходит с токсигенными вибрионами, образующими гибридные варианты [Nair G.B. et al., 2007; Смирнова Н.И. с соавт., 2011 и др.].
ВЫВОДЫ
1. Рекомбинантные белки - продукты клонированных генов гемагглюти-нин/протеазы hapA, СНО-удлиняющего фактора cef, дополнительного холерного энтеротоксина асе и zonula occludens-токсина zot V. cholerae, экспрессируемых сконструированными штаммами E.coli, сохраняют все виды ферментативной и/или биологической активности.
36
Гемагглютинин/протеаза (НА/Р) V.cholerae осуществляет самопроцессинг и деградацию белков чужеродного хозяина, что позволяет выделять ее из рекомби-нантных штаммов E.coli в зрелой форме. НА/Р обладает широким спектром про-теолитической активности и способностью вызывать существенные морфологические и ультраструктурные нарушения в культивируемых клетках и в кишечнике чувствительных животных, то есть является фактором патогенно-сти/персистенции.
Результаты сравнительного анализа собственных и литературных данных свидетельствуют об идентичности гемагглютинин/протеазы и цитотоксина, не повреждающего мембрану (NMDCY), описанного в зарубежных публикациях как самостоятельный токсин V. cholerae.СНО-удлиняющий фактор Cef V. cholerae обладает эстеразной активностью и вызывает морфологические и ультраструктурные изменения в культурах клеток и в кишечнике чувствительных животных, то есть может играть существенную роль как патогенности, так и в персистенции. Его молекула содержит лейциновую молнию, домен Куница и активный центр сериновых липаз, который обусловливает эстеразную, но не цитотоническую активность.
СНО-удлиняющий фактор Cef холерогенных вибрионов Бенгал отличается от Cef V.cholerae 01 и non01/non0139 неспособностью к гидролизу трибутирина при сохранении твиназной активности. Это изменение спектра субстратной специфичности обусловлено точковой мутацией в кодирующем его гене, следствием которой явилась не синонимичная замена остатка гидрофобной аминокислоты на остаток гидрофильной. Ген cef присутствует в геномах всех холерных вибрионов, кроме нехолерогенных штаммов 0139 серогруппы, которые лишены и твиназной активности.
Активные домены zonula occludens-токсинов Zot, кодируемых генами профагов СТХ и рге-СТХ, идентичны, что указывает на наличие у них одинаковой биологической активности. Zot вызывает разрежение плотного монослоя культивируемых клеток in vitro и приобретение чувствительности к белкам E.coli клетками кишечника in vivo. Дополнительный холерный энтеротоксин Асе является консервативным белком; он вызывает накопление жидкости в кишечнике мышей-сосунков. В клетках холерных вибрионов, геномы которых содержат тандем из двух профагов
37
pre-CTX, могут образовываться инфекционные вирионы, способные к горизонтальному переносу генов токсинов {асе, zot) и пилина {сер).
38
первые вызывают, в основном, гидропическую (баллонную) дистрофию, приводящую к гибели клеток, то вторые - необратимые повреждения и некроз эпите-лиопитов, апоптоз лимфоцитов либо расширение межклеточных промежутков в щеточной кайме. Вместе с тем, те и другие инициируют и сходные повреждения клеточных органелл и капилляров, что является, однако, следствием активности разных токсических субстанций.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
39
7.аа Бардахчьян Э.А., Харланова Н.Г., Монахова Е.В. Ультраструктурные измене
ния в тонкой кишке, вызванные холерными вибрионами, продуцирующими холероген
и альтернативный токсин // Рос. журн. гастроэнтерол., гепатол., колопроктол. - 1997.
-а Т.VII, №5 (Прилож. № 4, Матер. III РГЭН). - С.75.
Ю.Монахова Е.В., Михась Н.К., Смоликова Л.М. О потенциальной вирулентности vcf-штаммов холерных вибрионов, циркулирующих на территориях бывшего СССР // Диагностика, лечение и профилакт. инф. забол. Биотехнология. Ветеринария: Матер. Юбил. Науч. Конф., посвящ. 50-лет. Центра воен.-технич. Пробл. Биол. Защиты НИИ микробиол. МО РФ. - Екатеринбург, 1999. - С. 156-157.
-аа С.21-24. (Из Перечня ВАК)
14.Monakhova E.V., Mikhas N.K., Smolikova L.M., Mishankin B.N. Investigation of Vibrio cholerae virulence cassette and neuraminidase genes by means of molecular probes // Ninth International Congress for Culture Collections. - Brisbane, Australia, 2000. - P. 140.
40
15.Подосинникова Л.С., Москвитина Э.А., Миронова А.В., Монахова Е.В. Характеристика популяции холерных вибрионов, циркулирующих в период различных эпидситуаций // Холера и патогенные для человека вибрионы: Матер, проб л. комиссии. - Ростов н/Д, 2000. - вып. 13. -аа С. 100-102.
41
А.Б., Овсова Л.М., Мазрухо Б.Л. Характеристика дополнительных диареегенных и цитотоксических факторов, продуцируемых холерными вибрионами // Пробл.особо опасных инф. - 2004. - Вып.1(87). - С.51-54. (Из Перечня ВАК)
24. Монахова Е.В., Писанов Р.В., Михась Н.К., Миронова А.В., Пасюкова Н.И. Генотипическая и фенотипическая характеристика штамма Vibrio cholerae eltor, стабильно образующего репликативную форму рге-СТХф // Холера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2004. - Вып. 17. - С.59-62.
25.Смоликова Л.М., Монахова.Е.В., Кудрякова Т.А., Подосинникова Л.С, Писанов Р.В., Божко Н.В., Михась Н.К., Голенищева Е.Н., Санамянц Л.М., Македонова Л.Д., Качкина Л.В., Пузанова Н.Г., Гаевская Н.Е. Характеристика атоксигенных вибрионов эльтор, выделенных от людей на территории России и стран ближнего зарубежья // Холера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2004. - Вып. 17. - С.65-67.
42
за наличием холерных вибрионов в водных объектах окружающей среды г. Ростова-на-Дону // Холера и патогенные для человека вибрионы: Матер. Пробл. комиссии. -Ростов н/Д, 2005. - Вып. 18. - С.22-25.
37.Кругликов В.Д., Мазрухо Б.Л., Авдеева Е.П, Монахова Е.В,. Шестиалтынова И.С, Михась Н.К., Сухарь В.В., Кудрякова Т.А., Качкина Г.В., Мазрухо А.Б., Цедова
43
Э.Г., Каминский Д.И. Генотипическая и фенотипическая характеристика штаммов холерных вибрионов, выделенных от людей и из объектов окружающей среды во время эпидосложнения по холере в Каменском районе Ростовской области в 2005 году // Холера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2006. - Вып. 19. - С.64-66. - С.33-39.
44
С. 127.
45.Monakhova E.V., Pisanov R.V., Bardakhchian E.A., Kharlanova N.G., Sayamov S.R., Markina O.V., Alekseeva L.P., Mironova A.V., Verkina L.M. Hemagglutinin/protease of Vibrio cholerae: gene cloning, expression in Escherichia coli, purification and characterization of biological activity // Vibrio 2007: The second conference on the biology of vibrios: Abstract book. - Paris, 2007. - P.69.
46. Монахова E.B., Миронова A.B., Алексеева Л.П., Мазрухо А.Б. Вирулентность холерных вибрионов, содержащих рге-СТХ(р: генотипическая и феноти-пическая характеристика // Журн. микробиол., эпидемиол. и иммунобиол. -2008. - №4. - С.27-32. (Из Перечня ВАК)
47.Бардахчьян Э.А., Монахова Е.В., Харланова Н.Г., Саямов СР., Писанов Р.В. Ультраструктурные изменения тонкой кишки мышей-сосунков, вызванные действием гемагглютинин/протеазы холерных вибрионов // Бюл. экперим. биол и медицины. - 2008. - Т.145, №4. - С.475-480. (Из Перечня ВАК)
48.Кругликов В.Д., Монахова Е.В., Авдеева Е.П., Цедова Э.Г., Мазрухо Б.Л., Шестиалтынова И.С, Мазрухо А.Б., Непомнящая Н.Б., Шалу О.А. Генотипическая характеристика штаммов холерных вибрионов 01 серогруппы, обнаруженых в водных объектах окружающей среды на территории г. Ростова-на-Дону в 2007 г. // Холера и патогенные для человека вибрионы:. Матер, совещания и пробл. комиссии. -Ростов н/Д, 2008. - Вып.21. - С. 58-60.
45
комбинантного цитотонического фактора Cef холерных вибрионов // Рос. журн. гаст-роэнтерол., гепатол., колопроктол. - 2009. - T.XIX, № 5 (Прилож. № 34, Матер. XV РГЭН). - С.52.
52.Monakhova E.V., Bozhko N.V. Contact-dependent secretion systems in 01 and non-01 Vibrio cholerae strains: genotypic and phenotypic characteristics // Int. Symp. on Fifty Years of Discovery of Cholera Toxin: a tribute to S.N.De. - Kolkata, India, 2009. -P.44.
55.Monakhova E.V. Phenotypic and molecular characteristics of epidemic and non-epidemic Vibrio cholerae strains isolated in Russia and certain countries of Commonwealth of Independent States (CIS) // Epidemiological and Molecular Aspects on Cholera / T. Ramamurthy, S.K. Bhattacharya (eds.). - Springer Science+Business Media, 2010. - Ch.4. -P.51-78.
56. Монахова E.В. Изучение способности холерных вибрионов к образованию репликативных форм и вирионов рге-СТХф // Холера и патогенные для человека вибрионы: Матер, пробл. комиссии. - Ростов н/Д, 2010. - Вып.23. - С.73-77.
46
2011.- №5.- С. 18-22. (Из Перечня ВАК)
59. Архангельская И.В., Монахова Е.В., Кругликов В.Д., Непомнящая Н.Б., Гри-горенко Л.В., Ускова Н.Н., Шалу О.А., Ежова М.И. Ретроспективный анализ свойств штаммов холерных вибрионов не01/не0139 серогрупп, вызвавших заболевания людей в Ростовской области // Холера и патогенные для человека вибрионы: Матер, совещания и пробл. комиссии. - Ростов н/Д, 2011. - Вып.24. - С. 111-114.
бО.Саямов СР., Монахова Е.В., Федоренко Г.М., Ткачева Т.И., Маркина
О.В., Алексеева Л.П., Писанов Р.В., |Бардахчьян Э.А.| Ультраструктурные изменения в культивируемых клетках под действием гемагглютинин/протеазы холерных вибрионов // Бюл. эксперим. биол. и медицины. - 2011. - Т.152, №10. -С.438-442. (Из Перечня ВАК)
47
 Все авторефераты докторских диссертаций
Все авторефераты докторских диссертаций