Книга вторая Дж. Эдвард Морган-мл. Мэгид С. Михаил Перевод с английского
| Вид материала | Книга |
- Книга первая Дж. Эдвард Морган-мл. Мэгид С. Михаил Перевод с английского, 10010.77kb.
- А. Конан-Дойль новоеоткровени е перевод с английского Йога Рàманантáты, 2314.23kb.
- Copyright Сергей Александровский, перевод с английского Email: navegante[a]rambler, 619.61kb.
- "книга непрестанности осириса " 177, 7373.41kb.
- Н. М. Макарова Перевод с английского и редакция, 4147.65kb.
- Трудового Красного Знамени гупп детская книга, 2911.61kb.
- Трудового Красного Знамени гупп детская книга, 2911.77kb.
- Уайнхолд Б., Уайнхолд Дж. У 67 Освобождение от созависимости / Перевод с английского, 11462.2kb.
- Малиновской Софьи Борисовны Специальность: журналистика Специализация: художественный, 969.08kb.
- Духовные истины в психических явлениях перевод с английского 3-е издание Москва «Философская, 1557.75kb.
Основной дыхательный ритм исходит из продолговатого мозга. Выделяют две группы медуллярных нейронов: дорсальную дыхательную группу, которая активизируется в основном при вдохе, и вентральную дыхательную группу, которая активизируется при выдохе. Хотя это и не установлено окончательно, происхождение основного ритма связано либо с собственной спонтанной электрической активностью дорсальной группы, либо с взаимосвязанной активностью дорсальной и вентральной групп. Тесная связь дорсальной дыхательной группы нейронов с солитарным трактом, возможно, объясняет рефлекторные изменения дыхания при стимуляции блуждающего и языкоглоточного нервов.
Две зоны варолиевого моста воздействуют на дорсальный медуллярный центр (центр вдоха). Нижний центр моста (апнейстический) — возбуждающий, верхний центр моста (пневмотаксичес-кий) — угнетающий. Дыхательные центры вароли-ева моста осуществляют тонкую регуляцию частоты и ритма дыхания.
^ 2. ЦЕНТРАЛЬНЫЕ РЕЦЕПТОРЫ
Наиболее важные из центральных рецепторов — хеморецепторы, которые реагируют на изменения концентрации ионов водорода. Считается, что центральные хеморецепторы располагаются на перед-небоковой поверхности продолговатого мозга и воспринимают изменения концентрации ионов водорода ([H+]) в цереброспинальной жидкости (ЦСЖ). Этот механизм эффективно регулирует PaCO2, потому что физически растворенный CO2, в отличие от ионов бикарбоната, проникает через гематоэнцефа-
^ ТАБЛИЦА 22-7. Содержание CO2 в плазме (ммоль/л)
| | Артериальная кровь | Венозная кровь |
| Растворенный CO2 Бикарбонат Карбаминовые соединения Общее содержание CO2 | 1,2 24,4 Незначительное 25,6 | 1,4 26,2 Незначительное 27,6 |
С разрешения. Из: Nunn J. F. ^ Applied Respiratory Physiology, 4 th ed. Butterworths, 1993.
лический барьер (гл. 25). Следовательно, на концентрацию ионов водорода в ЦСЖ влияют резкие изменения PaCO2, но не концентрация ионов бикарбоната ([HCO3-]) в артериальной крови:
CO2 + H2O- H+ +HCO3".
В течение нескольких дней [HCO3 ] в ЦСЖ может сравняться с [HCO3'] в артериальной крови.
Увеличение PaCO2 приводит к росту концентрации ионов водорода в ЦСЖ, что активирует хе-морецепторы. Опосредованная хеморецепторами стимуляция расположенных рядом медуллярных дыхательных центров увеличивает альвеолярную вентиляцию (рис. 22-25) и возвращает PaCO2 к норме. Наоборот, снижение концентрации ионов водорода в ЦСЖ, обусловленное падением
PaCO2, вызывает уменьшение альвеолярной вентиляции и компенсаторное возрастание PaCO2. Зависимость между минутной вентиляцией и PaCO2 практически линейна. Очень высокие уровни PaCO2 приводят к депрессии дыхательного ответа (так называемому углекислотному наркозу). Величина PaCO2, при которой вентиляция становится равной нулю, называется порогом апноэ. Если во время анестезии PaCO2 падает ниже порога апноэ, самостоятельное дыхание прекращается. (У пациента в состоянии бодрствования порог апноэ не достигается, что обусловлено влияниями коры больших полушарий.) Активность центральных хеморецепторов, в отличие от таковой у периферических хеморецепторов, угнетается при гипоксии.
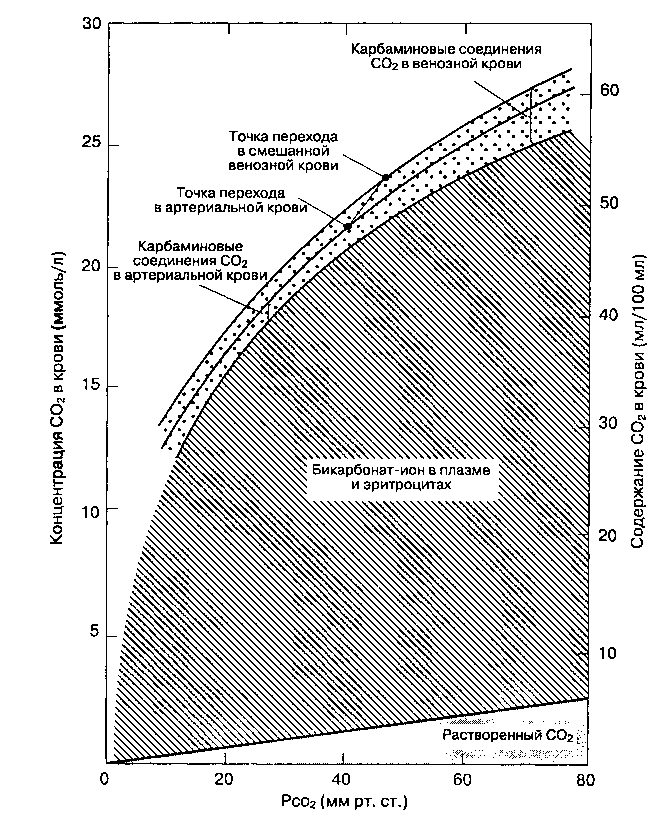
Рис. 22-24. Кривая диссоциации CO2 для цельной крови. (С разрешения. Из: Nunn J. F. Applied Respiratory Physiology, 3rd ed. Butterworths, 1987.)
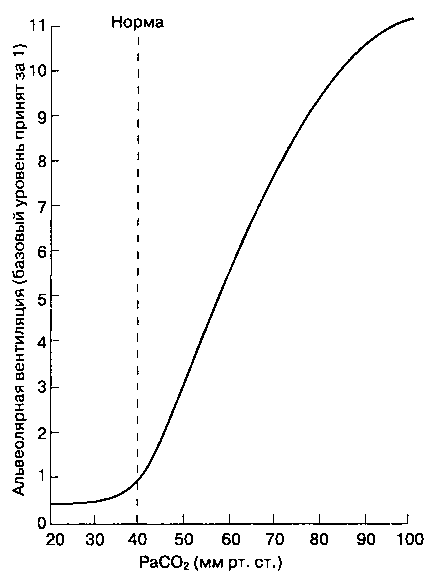
Рис. 22-25. Зависимость альвеолярной вентиляции от PaCO2. (С разрешения. Из: Guyton A. С. Textbook of Medical Physiology, 7th ed. Saunders, 1986.)
^ 3. ПЕРИФЕРИЧЕСКИЕ РЕЦЕПТОРЫ Периферические хеморецепторы
К периферическим хеморецепторам относятся ка-ротидные тельца (расположенные в области бифуркации общей сонной артерии) pi аортальные тельца (расположенные в области дуги аорты). Ka-ротидные тельца — это главные периферические хеморецепторы в организме человека, они реагируют на изменения PaO2, PaCO2, рН и артериального перфузнойного давления. Они связаны с дыхательными центрами через языкоглоточный нерв и обеспечивают рефлекторное увеличение альвеолярной вентиляции при снижении PaO2, артериальной перфузии, а также при повышении [H+] или PaCO2. Периферические хеморецепторы также чувствительны к цианидам, доксапраму и высоким дозам никотина. В отличие от центральных хемо-рецепторов, которые воспринимают главным образом изменения PaCO2 (в действительности [H+]), каротидные тельца наиболее чувствительны к PaO2 (рис. 22-26). Заметим, что активность рецепторов существенно не меняется, пока PaO2 не упадет ниже 50 мм рт. ст. Считается, что клетки каротидных телец (гломусные клетки) представляют собой дофаминергические нейроны. Анти-дофаминергические препараты (фенотиазины), большинство анестетиков, а также хирургическое вмешательство на обеих сонных артериях приводят к исчезновению периферического рефлекторного дыхательного ответа на гипоксемию.
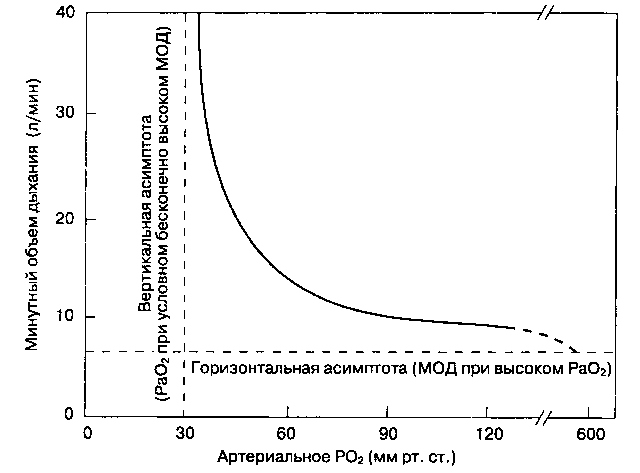
Рис. 22-26. Зависимость между PaO2 и минутным объемом дыхания (МОД) в покое и при нормальном PaCO2. (С разрешения. Из: Nunn J. F. Applied Respiratory Physiology, 3rd ed. Butterworths, 1987.)
^ Легочные рецепторы
Импульсы от этих рецепторов поступают в центральную нервную систему по блуждающему нерву. Рецепторы растяжения располагаются в гладких мышцах дыхательных путей; ohpi ответственны за прекращение вдоха, когда легкие перераздуты (инфляционный рефлекс Геринга-Брей-ера), и укорочение выдоха, когда легкие спадаются (дефляционный рефлекс). В обычных условиях у человека рецепторы растяжения играют незначительную роль. Двусторонняя блокада блуждающих нервов практически не сказывается на нормальном дыхании.
Ирритантные рецепторы, расположенные в слизистой оболочке трахеи и бронхов, реагируют на раздражающие газы, сигаретный дым, пыль и холодный воздух; pix актршация вызывает рефлекторное учащение дыхания, бронхоконстрикцию и кашель. J-рецепторы (юкстакапиллярные) расположены в интерстициальном пространстве внутри альвеолярной стенки; эти рецепторы играют роль в возникновении одышки в ответ на увеличение объема ирггерстирщального пространства и на воздействие различных химических медиаторов, выде-ляющихся при повреждении легочной ткани.
^ Другие рецепторы
К таковым относятся различные мышечные и суставные рецепторы дыхательной мускулатуры и грудной клетки. Импульсы из этих источников,
возможно, важны во время физической нагрузки и прр! патологических состояниях, сопровождающихся уменьшением растяжимости легких рыи грудной клетки.
^ 4. ВЛИЯНИЕ АНЕСТЕЗИИ НА РЕГУЛЯЦИЮ ДЫХАНИЯ
Болыиинство общих анестетиков потенцирует ги-повентиляцию. Этот эффект анестетиков имеет два компонента: центральный — угнетение центральных хеморецепторов pi периферический — угнетение активности наружных межреберных мышц. Выраженность гиповентиляции обычно пропорциональна глубине анестезии. С увеличением глубины анестезии кривая зависимости минутной вентиляция от PaCO2 становится более пологой, а порог апноэ возрастает (рис. 22-27). Данный эффект устраняется хирургической стимуляцией, по крайней мере частично.
^ Периферический ответ на гипоксемию, будучи еще более чувствительным к действию анестетиков, чем реакция дыхательного центра на PaCO2, практически исчезает под действием суб-анестетических доз большинства ингаляционных (включая закись азота) и многих внутривенных анестетиков. Анестетики могут также угнетать периферический возбуждающий эффект докса-прама, но его центральное действие при этом со-храняется (гл. 15). Влияние отдельных анестетиков на дыхаргае обсуждается в гл. 7 и 8.
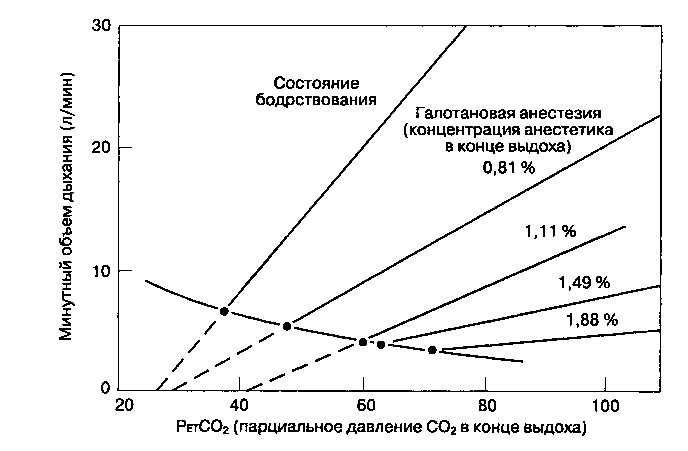
Рис. 22-27. Влияние ингаляционного анестетика (галотана) на кривую зависимости вентиляции от PETCO2. (С разрешения. Из: Nunn J. F'. Applied Respiratory Physiology, 3rd ed. Butterworths, 1987.)
Нереспираторные функции легких
^ Фильтрация и функция резервуара
А. Фильтрация. В легочные капилляры поступает вся венозная кровь из большого круга кровообращения, что позволяет им выполнять роль фильтра для различных частиц, попавших в кровоток. Высокое содержание гепарина и активатора плаз-миногена в легких облегчает расщепление задержанных фибриновых фрагментов. Хотя средний диаметр легочных капилляров составляет 7 мкм, обнаружено, что достигать левых отделов сердца могут частицы и большего размера.
Б. Функция резервуара. Роль малого круга кровообращения как резервуара для большого круга обсуждалась ранее.
Метаболизм
Легкие являются метаболически очень активным органом. Помимо синтеза сурфактанта пневмоциты осуществляют большую часть внепеченочного микросомального окисления. При инфекции, а также при синдроме системной воспалительной реакции (гл. 50) нейтрофилы и макрофаги легких вырабатывают свободные радикалы. Легочный эндотелий метаболизирует разнообразные вазоак-тивные соединения, включая норадреналин, серото-нин, брадикинин, простагландины и лейкотриены. Гистамин и адреналин не подвергаются метаболизму в легких. Легкие могут быть главным местом синтеза и высвобождения гистамина при аллергии. В легких ангиотензин I превращается в физиологически активный ангиотензин П. Ответственный за это ангиотензинпревращающий фермент (АПФ) локализован на поверхности эндотелия легочных сосудов.
^ Случай из практики: одностороннее ослабление дыхания во время общей анестезии
67-летнему мужчине со злокачественной опухолью толстой кишки выполняется резекция толстой кишки под общей анестезией. Сопутствующие заболевания: давний передний инфаркт миокарда и компенсированная застойная сердечная недостаточность. Перед операцией для мониторинга установлены катетеры в периферическую артерию и в легочную артерию. После неосложненной индукции тиопента-лом и фентанилом и атравматичной интубации
трахеи с использованием сукцинилхолина поддержание анестезиии выполнялось смесью закиси азота с кислородом (2 : 1), изофлюраном и векуронием. Через 30 мин после начала операции хирург попросил перевести больного в положение Тренделенбур-га для улучшения хирургического доступа. Насыщение гемоглобина кислородом по пульсоксиметру, которое до этого равнялось 99 %, резко снизилось и осталось на уровне 93 %. Амплитуда и форма сигнала пульсоксиметра не изменились. Аускультация легких показала ослабление дыхания над левым легким.
^ Каково наиболее вероятное объяснение случившегося?
Одностороннее ослабление дыхания во время общей анестезии чаще всего обусловлено непреднамеренной установкой или смещением эндотра-хеальной трубки в один из главных бронхов. В результате вентилируется только одно легкое. Другие причины одностороннего ослабления дыхания (пневмоторакс, обтурация крупного бронха мокротой, долевой ателектаз или невыявленное ранее образование в средостении) диагностировать сложнее, но pi встречаются они во время анестезии значительно реже.
Для положения Тренделенбурга (с опущенным головным концом) характерно смещение эндотра-хеальной трубки на 1-2 см по направлению к килю трахеи. В данном случае трубка, очевидно, располагалась над самым килем трахеи, когда пациент лежал горизонтально, но сместилась в правый бронх после перевода больного в положение Тренделенбурга. Диагноз можно подтвердить подтягиванием трубки на 1-2 см при одновременной аус-культации легких. Когда конец трубки окажется в трахее, дыхательные шумы станут одинаковыми с обеих сторон. После интубации трахеи необходимо проконтролировать положение эндотрахеаль-ной трубки. Для этого выслушивают грудную клетку, проверяют глубину введения трубки с помощью меток, нанесенных на ней (обычно 20-22 см на уровне зубов у взрослого пациента), и пальпируют манжетку трубки в надгрудной выемке. Положение эндотрахеальной трубки можно быстро определить с помощью фибробронхоскопа.
^ Одинакова ли вероятность попадания эндотрахеальной трубки в правый и левый главный бронхи?
В большинстве случаев непреднамеренной эндо-бронхиальной интубации трубка оказывается в правом бронхе, потому что он отходит от трахеи под более тупым углом, чем левый (гл. 24).
^ Почему снизилось насыщение гемоглобина?
Из-за отсутствия вентиляции одного легкого при сохраненной его перфузии возникает выраженный внутрилегочный шунт, возрастает венозная примесь, поэтому PaO2 и насыщение гемоглобина снижаются.
^ Можно ли исключить эндобронхиальную интубацию, если SaO2 составляет 93 %?
Нет. Если бы кровоток в обоих легких оставался одинаковым, то венозная примесь теоретически возросла бы до 50 % и привела к тяжелой гипоксемии и очень выраженному снижению насыщения гемоглобина. К счастью, гипоксическая вазокон-стрикция является мощным компенсаторным механизмом, который уменьшает кровоток через невентилируемое легкое и снижает величину ожидаемой венозной примеси. В реальности, если фракционная концентрация кислорода во вдыхаемой смеси высока (50-100 %), то падение напряжения O2 в артериальной крови может и не обнаруживаться при пульсоксиметрии благодаря характеристикам кривой насыщения гемоглобина. Например, эндобронхиальная интубация при FiO2 50 %, может привести к снижению РлО2 с 250 до 95 мм рт. ст.; соответствующее изменение показаний пульсоксиметра (со 99-100 до 97-98) будет практически незаметным.
^ Анализ газов артериальной и смешанной венозной крови дал следующие результаты:
PaO2 = 69 мм рт. ст.; PaCO2 = 42 мм рт. ст.; SaO2 = 93 %; PvO2 = 40 мм рт. ст. и SvO2 = 75 %. Концентрация гемоглобина — 15 г/100 мл.
^ Какова величина рассчитанной венозной примеси?
В данном случае Рс'О2 = РлО2 = [(76O - 47) X 0,4] -42 = 243 мм рт. ст. Следовательно, Cc'O2 = (15 х х 1,31 х 1,0) + (243 х 0,003) = 20,4 мл/100 мл.
CaO2 = (15 х 1,31 х 0,93) + (69 х 0,003) = = 18,5 мл/100 мл.
CVO2 - (15 х 1,31 х 0,75) + (40 х 0,003) = = 14,8 мл/100 мл.
Qs/Qt = (20,4 - 18,5)/(20,4 - 14,8) - 0,34 (34 %).
^ Как эндобронхиальная интубация влияет на PaCO2 и PEiCO2?
Если МОД остается неизменным, то PaCO2 тоже существенно не меняется (см. Однолегочная вентиляция; гл. 24). Клинически часто возрастает разница между PaCO2 и PErCO2 — вероятно, из-за увеличения альвеолярного мертвого пространства (перераздутие вентилируемого легкого). Таким образом, РнтСО2может снизиться или остаться неизменным.
Избранная литература
Ganong W. F. Rewiew of Medical Physiology, 17th ed. Appleton & Lange, 1993.
Guyton A. C. Textbook of Medical Physiology, 8th ed. Saunders, 1990.
Nunn J. F. Applied Respiratory Physiology, 4th ed. Butterworths, 1993.
Stoelting R. K. Pharmacology and Physiology in Anesthetic Practice, 2nd ed. Lippincott, 1991.
West J. B. Respiratory Physiology, 4th ed. Williams & Wilkins, 1990.
23
Анестезия при сопутствующих заболеваниях легких
Существует четкая закономерность: чем тяжелее заболевание легких, тем сильнее нарушается функция дыхания во время операции (гл. 22) и, тем выше риск легочных осложнений в послеоперационном периоде. Если заболевание легких не удается выявить до операции, то риск развития осложнений возрастает. В настоящей главе рассматриваются факторы риска легочных осложнений, а также обсуждаются наиболее распространенные заболевания легких.
^ Факторы риска легочных осложнений
Дисфункция легких — самое распространенное послеоперационное осложнение. Частота ателектазов, пневмонии, эмболии легочной артерии и дыхательной недостаточности после хирургических вмешательств значительно варьируется (от 6 до 60 %) и зависит от состояния больного и типа операции. Существуют шесть главных факторов риска легочных осложнений (табл. 23-1). За исключением типа и длительности операции, факторы риска характеризуют собой функцию легких в предоперационном периоде. Два наиболее достоверных фактора риска легочных осложнений — тип хирургического вмешательства и одышка в анамнезе. Наименее достоверный фактор риска — продолжительность операции.
Установлена достоверная зависимость между курением и заболеваниями легких; у курильщиков
^ ТАБЛИЦА 23-1. Прогностические факторы риска
возникновения легочных осложнений
| Заболевание легких Оперативное вмешательство на органах грудной полости или верхнем этаже брюшной полости Курение Ожирение Возраст > 60 лет Длительность общей анестезии > 3 ч |
изменения максимальной объемной скорости потока в середине выдоха (МОС25-75%) появляются значительно раньше клинических симптомов хронического обструктивного заболевания легких. С возрастом даже у здоровых людей увеличивается емкость закрытия, а также часто возникает дисфункция легких. Ожирение снижает функциональную остаточную емкость (ФОБ), повышает работу дыхания и предрасполагает к тромбозу глубоких вен.
Операции на органах грудной полости и верхнем этаже брюшной полости оказывают выраженное влияние на функцию легких. Оперативные вмешательства в области диафрагмы часто приводят к нарушениям ее функции и, соответственно, к рестриктивным нарушениям вентиляции. Операции на верхнем этаже брюшной полости снижают ФОБ (на 60-70 %); данный эффект наиболее выражен в первые сутки после вмешательства и сохраняется 7-10 дней. При вертикальных разрезах функция дыхания подавляется сильнее, чем при горизонтальных. Частое поверхностное дыхание с неэффективным кашлем (обусловленное ригидностью мышц вследствие боли), уменьшение количества глубоких вдохов и ухудшение мукоцилиарного клиренса — все эти факторы ведут к микроателектазам и уменьшению легочного объема. Внутрилегочное шунтирование способствует гипоксемии (гл. 22). Остаточное действие анестетиков, седативный эффект наркотических анальгетиков, положение лежа на спине, вздутие живота и сдавливающие повязки также ухудшают функцию дыхания. Устранение боли с помощью регионарной анестезии уменьшает степень дисфункции легких, но не ликвидирует ее полностью. Сохраняющиеся микроателектазы и неполноценная эвакуация мокроты увеличивают риск возникновения послеоперационной пневмонии.
Хотя общая анестезия неблагоприятно влияет на функцию легких (гл. 22), преимущество регио-
нарнои анестезии над общей при сопутствующем заболевании легких твердо не установлено.
^ Обструктивные заболевания легких
Обструктивные заболевания легких — наиболее распространенная группа легочных расстройств. Они включают бронхиальную астму, эмфизему, хронический бронхит, муковисцидоз, бронхоэктазы и бронхиолит. Отличительный признак этих заболеваний — увеличенное сопротивление дыхательных путей потоку воздуха. При обструктивных заболеваниях легких как ОФВЬ так и отношение ОФВЬ/ФЖЕЛ не превышают 75 % от нормы. На ранней стадии обструктивных нарушений единственным их признаком может быть снижение максимальной объемной скорости потока в середине выдоха (МОС25-75%> гл. 22). В норме величина МОС25_7г>% У взрослых мужчин и женщин должна составлять более 2,0 л/с и 1,6 л/с соответственно. Повышенное сопротивление дыхательных путей увеличивает работу дыхания; при значительном возрастании сопротивления страдает и газообмен. Сопротивление потоку возрастает в основном на выдохе, поэтому возникает так называемая "воздушная ловушка" (синоним — экспираторное закрытие дыхательных путей), увеличиваются остаточный объем и общая емкость легких. Наиболее распространенным симптомом служит свистящее дыхание, которое свидетельствует о турбулентности воздушного потока в дыхательных путях. Легкая обструкция проявляется только удлинением выдоха; свистящее дыхание при этом часто отсутствует. При прогрессировании обструкции свистящее дыхание вначале слышно только на выдохе, а затем и на вдохе. При тяжелой обструкции, когда воздушного потока практически нет, свистящее дыхание может исчезать.
