Биохимия витаминов и гормонов занятие 24 Витамины Цель занятия
| Вид материала | Документы |
- Урок биологии. 8 класс. Тема «Витамины», 113.2kb.
- Конспект урока по теме: "Витамины", 128.92kb.
- Занятие Государственные гербы в XX веке. Цель занятия, 201.64kb.
- Семинарского занятия по теме «Физиология эндокринной системы», 22.12kb.
- Правда и вымысел вокруг витаминов Витамины, 191.49kb.
- Семинарского занятия по теме По теме: «Физиология эндокринной системы», 22.75kb.
- Тема: Витамины. Чудесные вещества. Цель урока, 37.36kb.
- Молоко полезный продукт. Самое ценное в нём специальный белок, который усваивается, 24.15kb.
- Учебный комплекс. М.: Изд-во мэи, 2000. Практические занятия 1 занятие, 129.1kb.
- Витамины, 717.21kb.
Занятие 33
Биохимия мышечной ткани и миокарда
Цель занятия: изучить особенности метаболизма мышечной ткани и миокарда, биохимическую основу мышечного сокращения. Изучить биохимическую основу острой и хронической сердечной недостаточности. Научиться определять содержание макроэргических соединений мышечной ткани (АТФ и креатинфосфата).
Исходный уровень знаний и навыков
Студент должен знать:
- Морфо-функциональную характеристику мышечной ткани.
- Саркомер, миофибриллы, мембранный аппарат мышечной ткани.
- Понятие «моторная бляшка», систему Т-трубочек, триады.
- Сократительный аппарат гладких мышц.
- Метаболизм и механизм действия "вторичных" посредников.
- Реакции энергетического обмена и его регуляцию.
- Механизмы электрогенеза в мышечной ткани.
- "Весельный" механизм мышечного сокращения.
- Механизмы нейро-гуморальной регуляции мышечного сокращения.
Студент должен уметь:
- Проводить качественные реакции на фосфат, колориметрический анализ.
Структура занятия
- Теоретическая часть
- Основные функции мышечной системы (движение, стимуляция метаболизма и вегетативных функций). Ограничение двигательной активности (гипокинезия). Основные элементы патогенеза гипокинетического синдрома.
- Особенности метаболизма мышечной ткани, обеспечивающие ей относительную автономию.
- Наличие эндогенного запаса субстратов энергетического обмена (гликоген, ТГ). Особенности их обмена.
- Наличие запаса макроэргов. Метаболизм креатинфосфата (синтез и распад). Характеристика креатинфосфокиназы.
- Своеобразный набор ферментов стабилизирующих уровень АТФ (креатинфосфокиназа, аденилаткиназа, ферменты цикла пуриновых нуклеотидов, АМФ-дезаминаза). Особенности дезаминирования аминокислот.
- Наличие депо кислорода. Строение и характеристика оксимиоглобина.
- Своеобразный набор белков и их характеристика: миозин, актин (G, F), тропомиозин, тропонин (I, T, C).
- Наличие дипептидов (карнозин, ансерин), их строение и биологическая роль.
- Наличие депо Ca2+, особенности метаболизма Ca2+ в мышечной ткани, характеристика саркоплазматического ретикулума.
- Наличие эндогенного запаса субстратов энергетического обмена (гликоген, ТГ). Особенности их обмена.
- Особенности энергообразования в мышечных волокнах. Типы мышечных волокон, их морфо-функциональная характеристика. Особенности метаболизма миокарда.
- Пути утилизации АТФ в мышечной ткани (миозиновая АТФ-аза, ионные АТФ-азы, биосинтезы и др.).
- Роль мышечной ткани в межорганном обмене субстратами: циклы – глюкозо-лактатный (цикл Кори) и глюкозо-аланиновый (цикл Фелига).
- Особенности метаболизма миокарда.
- Теория мышечного сокращения. Механизм электромеханического сопряжения (роль АЦ, мембран саркоплазматического ретикулума, ионов Ca++, кальмодулина, белков мышечной ткани, АТФ-аз). Механизм расслабления. Механизм образование ригорного комплекса (трупное окоченение).
- Особенности сокращения гладкой мускулатуры.
- Механизм развития сердечной недостаточности. Адаптивные изменения структуры и метаболизма миокарда при хронической сердечной недостаточности. Биохимическое обоснование лечения сердечной недостаточности:
- Основные функции мышечной системы (движение, стимуляция метаболизма и вегетативных функций). Ограничение двигательной активности (гипокинезия). Основные элементы патогенеза гипокинетического синдрома.
а) препараты, увеличивающие сократимость миокарда (сердечные гликозиды, их механизм действия, ингибиторы фосфодиэстеразы, Са-сенситезаторы и др.)
б) препараты, уменьшающие нагрузку на миокард (вазодилятаторы и др.)
в) препараты, блокирующие нейро-эндокринную регуляцию миокарда (бета-адреноблокаторы и др.)
г) препараты, улучшающие метаболизм миокарда (коронаролитики, субстраты энергетического обмена, рибоксин, фосфокреатин, антигипоксанты, антиоксиданты, анаболики, Ca2+ антагонистов и др.).
- Практическая часть
- Решение задач.
- Лабораторная работа.
- Проведение контроля конечного уровня знаний.
- Решение задач.
Задачи
1 Диагностическим критерием заболеваний мышечной системы является уровень выделения с мочой:
а) аминокислот; б) мочевины; в) мочевой кислоты; г) аммонийных солей; д) креатина; е) креатинина; ж) глютатиона; з) тионеина?
2 При каких заболеваниях увеличивается экскреция креатина с мочой:
а) обтурационная желтуха; б) острый гепатит; в) закупорка мочевых путей; г) значительные оперативные вмешательства; д) прогрессирующая мышечная дистрофия; е) инфаркт миокарда; ж) пневмония; з) акромегалия; и) сахарный диабет; к) гипертиреоз?
3 При каких состояниях увеличивается концентрация креатинина в сыворотке крови:
а) прогрессирующая мышечная дистрофия; б) опухоли мочевых путей; в) кишечная непроходимость; г) гломерулонефрит; д) острый панкреатит; е) цирроз печени; ж) диарея; з) акромегалия; и) сахарный диабет; к) гипертиреоз?
4. Гипокальциемия обнаруживается у больных, страдающих:
а) рахитом; б) хронической почечной недостаточностью; в) закупоркой желчевыводящих путей; г) гипопаратиреоидизмом; д) метастазами рака в костную ткань; е) гипотиреозом; ж) сахарным диабетом; з) дефицитом магния; и) циррозом печени; к) алкоголизмом?
5 Гипокалиемия клинически проявляется в виде:
а) снижения тонуса гладкой и скелетной мускулатуры; б) усиления рефлексов; в) появления вялых параличей; г) расширения сердца; д) усиления перистальтики кишечника; е) общей слабости; ж) гиперкинезов; з) пареза кишечника; и) тахикардии; к) брадикардии?
6 Накопление молочной кислоты в организме происходит при:
а) полном прекращении кровообращения (клиническая смерть); б) сердечно-сосудистой недостаточности; в) кровопотере; г) гипоксии; д) усиленной мышечной работе; е) гипероксии; ж) диарее; з) гиповитаминозе В1?
7 Что является характерным для мышечной дистрофии:
а) креатинемия; б) кетонурия; в) глюкозурия; г) креатинурия; д) креатининурия; е) аминацидурия; ж) фосфатурия; з) гипераммонемия?
8 При каких заболеваниях повышается концентрация миоглобина в крови:
а) хроническом гепатите; б) инфаркте миокарда; в) пневмонии; г) туберкулезе легких; д) остром панкреатите; д) остром холецистите; е) краш-синдроме; ж) пиелонефрите?
9 Для диагностики инфаркта миокарда в первые 6–8 часов после приступа целесообразно исследовать плазму крови на:
а) содержание тропонина; б) уровень миоглобина; в) активность креатинкиназы; г) активность АСТ; д) активность гамма-глутамилтранспептидазы; е) активность АЛТ; ж) активность амилазы; з) активность аргиназы?
10 Для диагностики инфаркта миокарда в первые сутки после приступа целесообразно исследовать плазму крови на:
а) изоферменты ЛДГ; б) миоглобин; в) альдолазу; г) АСТ; д) аргиназу; е) изоферменты КФК; ж) АЛТ; з) щелочную фосфатазу; и) кислую фосфатазу; к) тропонин Т?
11 Какие тесты целесообразно исследовать на 2–3-е сутки после инфаркта миокарда:
а) креатинфосфокиназа (КФК); б) бета-оксибутират ДГ; в) гамма-глутамилтрансфераза; г) изоферменты АСТ; д) изоферменты ЛДГ; е) церулоплазмин; ж) изоферменты КФК; з) АСТ; и) АЛТ; к) амилаза?
12 Активность каких ферментов информативна на 4–6-е сутки после инфаркта миокарда:
а) креатинфосфокиназы; б) холинэстеразы; в) гамма-глутамилтрансферазы; г) изоферментов АСТ; д) изоферментов ЛДГ; е) церулоплазмина; ж) изоферментов КФК; з) АСТ; и) ЛДГ; к) бета-оксибутират ДГ?
13 При каких заболеваниях увеличивается концентрация креатинина в крови:
а) остром бронхите; б) значительных оперативных вмешательств; в) сахарном диабете; г) обширных травмах; д) хроническом гастрите; е) инфаркте миокарда; ж) хроническом гломерулонефрите?
14 Специфичными для скелетной мышечной ткани ферментами являются:
а) фруктозомонофосфат-альдолаза; б) аргиназа; в) алкогольдегидрогеназа; г) креатинфосфокиназа; д) бета-оксибутират ДГ; е) BB изоформы КФК; ж) MВ изоформы КФК; з) MM изоформы КФК; и) амилаза; к) ЛДГ1 и ЛДГ2; л) ЛДГ4 и ЛДГ5?
15 Специфичными для миокарда ферментами являются:
а) фруктозомонофосфат-альдолаза; б) аргиназа; в) алкогольдегидрогеназа; г) креатинфосфокиназа; д) бета-оксибутират ДГ; е) BB изоформы КФК; ж) MВ изоформы КФК; з) MM изоформы КФК; и) амилаза; к) ЛДГ1 и ЛДГ2; л) ЛДГ4 и ЛДГ5?
16 Какой из ферментных тестов отражает процессы репарации после инфаркта миокарда:
а) креатинкиназа; б) АСТ; в) гамма-глутамилтранспептидаза; г) холинэстераза; д) церулоплазмин; е) лейцинаминопептидаза; ж) амилаза; з) ЛДГ?
17 Появление миоглобина в крови при инфаркте миокарда отмечается через:
а) 2,5–3 часа; б) 8 часов; в) 24 часа; г) 48 часов; д) неделю; е) 0,5–1 час?
18 Наиболее ранний срок появления миоглобина в моче при инфаркте миокарда (через):
а) 1,5–3 часа; б) 8 часов; в) 24 часа; г) 48 часов; д) неделю; е) 2–3 недели?
19 Для диагностики каких заболеваний исследуют содержание миоглобина в сыворотке крови:
а) инфаркта миокарда; б) вирусного гепатита; в) гемолитической анемии; г) патологии костной ткани; д) пневмонии; е) язвы желудка; ж) постгеморрагической анемии; з) ожоговой болезни; и) сахарного диабета I типа; к) краш-синдрома?
20 Фосфорилированная форма креатина в мышцах является:
а) источником неорганического фосфата для образования АТФ; б) компонентом цикла Фелига; в) одним из факторов электромеханического сопряжения; г) важным источником макроэргов; д) компонентом цикла Кори; е) переносчиком цитрата через мембрану митохондрий; ж) транспортной формой макроэргов в кардиомиоците?
21 Что из указанного включается в биосинтез креатинфосфата:
а) пиридоксальфосфат; б) АТФ; в) метионин; г) цистеин; д) валин; е) NADP; ж) аргинин; з) триптофан; и) АМФ; к) глицин; л) биотин; м) аскорбат?
22 Мышечные клетки, инкубированные с 3H-тимидином, быстрее аккумулируют радиоактивную метку:
а) в митохондриях; б) рибосомах; в) гяРНК; г) гладком ЭПР; д) ядре; е) аппарате Гольджи; ж) лизосомах; з) шероховатом ЭПР?
Лабораторные работы
Лабораторная работа №1. Количественное определение макроэргических соединений мышц (АТФ и креатинфосфата)
В мышечной ткани содержится два основных макроэргических соединения – АТФ и креатинфосфат. Основным путем образования АТФ в тканях является окислительное фосфорилирование, осуществляемое в процессе тканевого дыхания. Креатинфосфат образуется в мышце при участии АТФ в состоянии покоя (см. уравнение) и является транспортной и резервной формой макроэргического фосфата при активной мышечной работе.
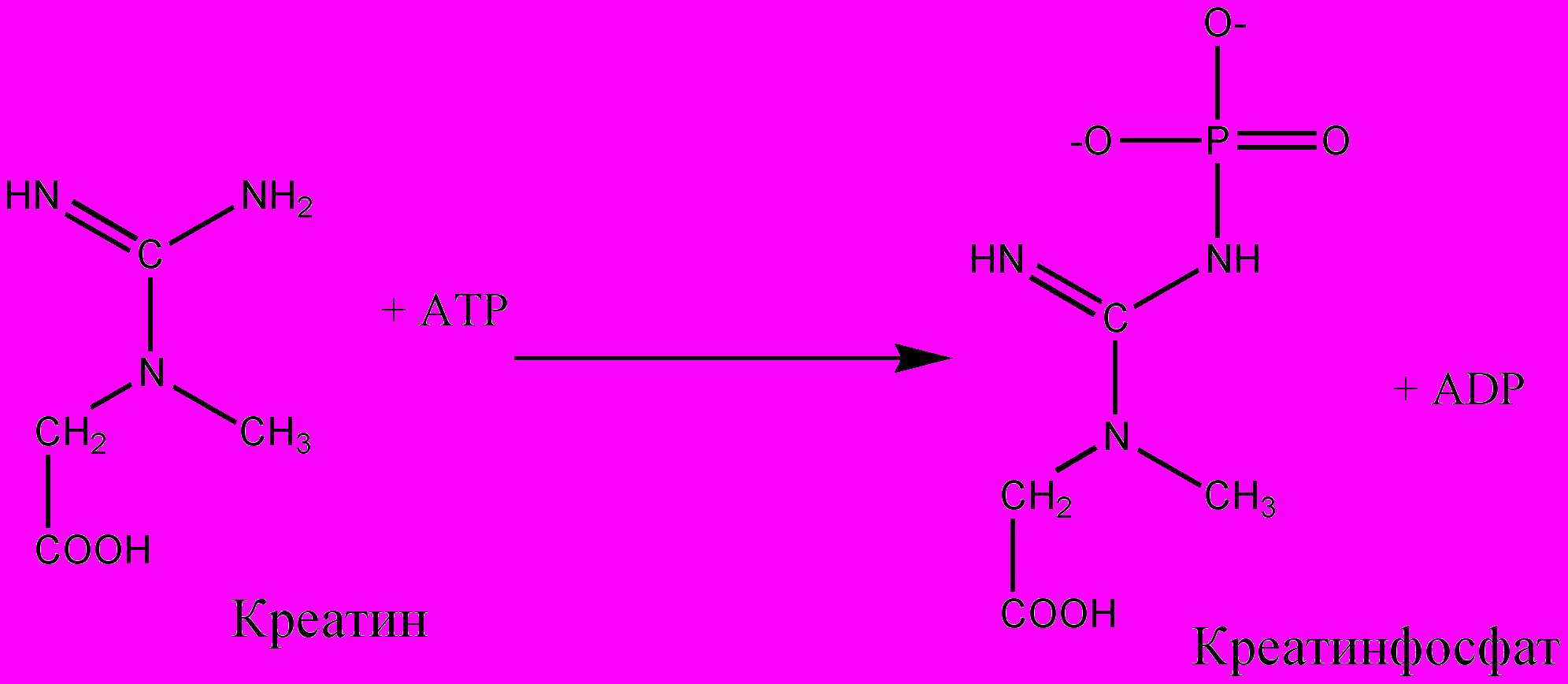
Принцип метода. Метод основан на количественном определении (по цветной реакции с молибдатом аммония в присутствии аскорбиновой кислоты) макроэргического фосфата в молекулах АТФ и креатинфосфата, который легко отщепляется при непродолжительном гидролизе в кислой среде (так называемый лабильно связанный фосфор).
Определение содержания неорганического фосфора в пробах мышечного экстракта, до гидролиза и после него, дает представление о количестве лабильно связанного фосфора, макроэргических соединений мышцы.
Ход работы. Работа состоит из 5 этапов:
1 Экстракция органического фосфата. 0,5 г мышечной кашицы помещают в пробирку, стоящую в ледяной бане, и добавляют в нее 5 мл охлажденного 3 %-го раствора ТХУ. Содержимое пробирки перемешивают стеклянной палочкой для экстрагирования АТФ и креатинфосфата в течение 5 мин. Экстракт фильтруют в мерную пробирку, стоящую в ледяной бане. Остаток мышечной кашицы в пробирке заливают 5 мл дистиллированной воды, продолжают экстракцию в течение 5 мин на холоде. Полученный экстракт фильтруют в ту же мерную пробирку и доводят общий объем до 10 мл дистиллированной водой.
2 Гидролиз органического фосфата. В две пробирки отбирают по 0,5 мл безбелкового фильтрата. Первая пробирка – контрольная, вторая – опытная. В опытную пробирку добавляют 1 мл 1 М раствора HCl. Закрывают фольгой и помещают в кипящую баню на 10 мин для гидролиза фосфорных связей. Затем раствор охлаждают и добавляют 1 мл 1 М раствора NaOH. В контрольную пробирку (без предварительного кипячения) добавляют 1 мл 1 М раствора NaOH и 1 мл 1 М раствора HCl. В опытную и контрольную пробирки добавляют из бюретки по 7,5 мл дистиллированной воды для получения объема 10 мл.
3 Проведение качественной реакции. Дальнейшие процедуры обязательно проводят одновременно с опытной и контрольной пробами. Из обеих пробирок отбирают по 0,8 мл жидкости, переносят в две другие пробирки, содержащие по 5 мл активного буфера, затем добавляют по 0,5 мл 1 М раствора молибдата аммония, 0,5 мл 1 %-го раствора аскорбиновой кислоты. Содержимое каждой пробирки быстро перемешивают и оставляют стоять при комнатной температуре точно 10 мин.
4 Фотометрия окрашенного комплекса. Контрольную и опытную пробы колориметрируют на ФЭКе с красным светофильтром (длина волны 670 нм) против воды. В опытной пробе (после гидролиза) определяемый неорганический фосфор представляет собой сумму лабильно связанного фосфора и фосфатных солей, присутствующих в тканях. В контрольной пробе – только фосфатные соли.
5 Расчет содержания макроэргических фосфорных соединений. Из величины оптической плотности, найденной для опытной пробы, вычитают величину оптической плотности, полученную для контрольной пробы. Концентрацию лабильно связанного неорганического фосфора в пробе находят по калибровочному графику.
Расчет. Рассчитывают количество лабильно связанного фосфора (в мг) на 100 г сырой ткани, учитывая разведение:
x = А 3,3 400 100,
где x – содержание (мг/100 г) макроэргических соединений в перерасчете на 1 мг АТФ в 100 г сырой ткани;
А – содержание АТФ в пробе, мг;
3,3 и 400 – коэффициенты перерасчета на 1 г ткани с учетом разведения растворов.
Выводы. Записать полученный результат и дать его клинико-диагностическую оценку.
Рекомендуемая литература
Основная
- Материал лекций.
- Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 504–517; 1998. С. 645–660.
Дополнительная
- Бэгшоу К. Мышечное сокращение. М.: Мир, 1985.
- Марри Р. и др. Биохимия человека. М.: Мир, 1993. Т. 2. С. 332–351.
- Уайт А. и др. Основы биохимии. М.: Мир, 1981. Т. 3. С. 1400–1424.
- Албертс Б. и др. Молекулярная биология клетки. М.: Мир, 1994. Т. 2. С. 254–274.
Занятие 34
Биохимия нервной системы
Цель занятия: изучить особенности метаболизма нервной ткани, биохимическую основу ее функционирования в норме и при различных патологических состояниях. Научиться определять активность холинэстеразы сыворотки крови.
Исходный уровень знаний и навыков
Студент должен знать:
- Особенности строения и функции нейрона и нейроглии.
- Строение и функции синапса.
- Метаболизм глюкозы, липидов и аминокислот.
- Метаболизм этанола и гидрофобных ксенобиотиков.
- Низкоэнергетические состояния, причины и механизм развития.
- Строение, локализацию и функции ионных АТФ-аз (Na/K, Са и др.).
- Биофизические механизмы возникновения и проведения потенциалов.
Студент должен уметь:
- Выполнять качественные реакции на активность ферментов биологических жидкостей.
Структура занятия
- Теоретическая часть
- Общая характеристика метаболизма и химического состава мозга.
- Особенности метаболизма в мозге:
- Общая характеристика метаболизма и химического состава мозга.
а) углеводов (гликолиз, пентозный цикл, ЦТК), роль инсулина в метаболизме мозга;
б) макроэргов (АТФ и креатинфосфата);
в) белков, их состав, специфические белки нервной ткани S-100, белки миэлина, тубулин, факторы роста нервов и др. Олиго- и полипептиды нервной ткани – ансерин, карнозин, гомокарнозин, либерины, статины, вещество P, кальцийнейрин и др., их функции. Энкефалины, эндорфины, их природа, механизм действия и физиологическая роль;
г) аминокислот, роль дикарбоновых аминокислот – глу и асп в метаболизме мозга (цикл Робертса, цикл пуриновых нуклеотидов – реакции, ферменты, субстраты, физиологическая роль);
д) нуклеиновых кислот;
е) липидов – липиды миэлина, особенности биосинтеза и роль холестерина.
- Основные функции нейронов:
а) электрогенез (механизм электрогенеза);
б) метаболизм (синтез и распад) медиаторов, типы медиаторов. Краткая характеристика (синтез, биохимические и физиологические эффекты, распад) – ацетилхолин, катехоламины, серотонин, дофамин, ГАМК, ГОМК, аминокислоты, гистамин. Состояние медиаторного обмена в норме и при некоторых патологических состояниях (паркинсонизм, шизофрения, маниакальные состояния, депрессии и др.);
в) строение синапса, механизмы синаптической и аксональной передачи. Понятие об аксональном транспорте и его физиологической роли;
г) биохимические механизмы памяти.
- Особенности метаболизма мозга при гипоксии.
- Биохимические механизмы действия на мозг алкоголя, наркотиков (опиоиды, кокаин, ЛСД-25 и др.) и гидрофобных токсических соединений. Биохимические механизмы развития алкоголизма, наркоманий и токсикоманий.
- Понятие о гематоэнцефалическом барьере.
- Практическая часть
- Решение задач.
- Лабораторная работа.
- Проведение контроля конечного уровня знаний.
- Решение задач.
Задачи
1 Основным источником аммиака в ткани мозга является реакция (напишите реакции):
а) дезаминирования асп; б) дезаминирования глу; в) дезамидирования асн; г) дезамидирования глн; д) дезаминирования АМФ; е) дезаминирования АТФ; ж) трансаминирования; з) распада нуклеиновых кислот?
2 В каких случаях увеличивается активность холинэстеразы в сыворотке крови:
а) нефротический синдром; б) инфекционный гепатит; в) бронхиальная астма; г) миома матки; д) инфаркт миокарда; е) отравление фосфорорганическими веществами; ж) травма мозга; з) отек мозга; и) гипертоническая болезнь?
3 Активность холинэстеразы сыворотки крови понижается при:
а) инфаркте миокарда; б) отравлении фосфорорганическими инсектицидами; в) отравлении боевыми фосфорорганическими веществам; г) панкреатите; д) язвенной болезни желудка; е) вирусном гепатите; ж) токсическом гепатите; з) отравлении миорелаксантами; и) гемолитической анемии?
4 Развитие печеночной комы при тяжелом вирусном гепатите связано главным образом:
а) с нарушением синтеза альбумина; б) дисглобулинемией; в) увеличением содержание в крови аммиака; г) снижением содержание в крови глюкозы; д) увеличением содержание в крови билирубина; е) повышением осмолярности крови; ж) кетоацидозом?
5 Какие из указанных реакций обезвреживания аммиака характерны для ткани мозга (напишите реакции):
а) восстановительное аминирование -кетоглутарата; б) амидирование глу; в) амидирование асп; г) аминирование ИМФ; д) дезаминирование АМФ; е) амидирование белков; ж) орнитиновый цикл?
6 Какие из указанных ферментов участвуют в реакциях инактивации биогенных аминов:
а) холинэстераза; б) моноаминооксидаза; в) оксидазы D-аминокислот; г) оксидазы L-аминокислот; д) цитохром Р450; е) катехол-o-метилтрансфераза; ж) глютатионпероксидаза; з) супероксиддисмутаза?
7 Наркотическое действие алкоголя связано:
а) с ингибированием Са каналов; б) гиперпродукцией NADH; в) торможением первого комплекса дыхательной цепи; г) торможением третьего комплекса дыхательной цепи; д) ингибированием сукцинатдегидрогеназы; е) продукцией эндогенных медиаторов торможения; ж) дефицитом эндогенных медиаторов торможения; з) ингибированием цитохромоксидазы; и) активацией сукцинатдегидрогеназы?
8 Наркотическое действие гидрофобных веществ связано:
а) с ингибированием Са каналов; б) гиперпродукцией NADH; в) торможением первого комплекса дыхательной цепи; г) торможением третьего комплекса дыхательной цепи; д) ингибированием сукцинатдегидрогеназы; е) продукцией эндогенных медиаторов торможения; ж) дефицитом эндогенных медиаторов торможения; з) ингибированием цитохромоксидазы; и) активацией сукцинатдегидрогеназы?
9 Тормозным медиатором нейронов спинного мозга и ствола мозга является:
а) ГАМК; б) ГОМК; в) глу; г) глн; д) гли; е) таурин; ж) гистамин; з) эндорфины; и) серотонин; к) белок S-100?
10 Главным тормозным медиатором нейронов головного мозга является:
а) ГАМК; б) ГОМК; в) глу; г) глн; д) гли; е) таурин; ж) гистамин; з) эндорфины; и) серотонин; к) белок S-100?
11 Антагонистом серотониновых рецепторов мозга является:
а) ЛСД-25; б) алкоголь; в) кокаин; г) теофиллин; д) резерпин; е) новокаин; ж) стрихнин; з) аммиак?
12. Антагонистом рецепторов норадреналина в мозге является:
а) ЛСД-25; б) алкоголь; в) кокаин; г) теофиллин; д) резерпин; е) новокаин; ж) стрихнин; з) аммиак?
13 В везикулах пресинаптических адренэргических нервных окончаний находятся:
а) связанный норадреналин; б) серотонин; в) АТФ; г) свободный норадреналин; д) хромогранин; е) дофамингидроксилаза; ж) ГАМК; з) моноаминооксидаза?
14 Антагонистом глициновых рецепторов спинного мозга является:
а) ЛСД-25; б) алкоголь; в) кокаин; г) теофиллин; д) резерпин; е) новокаин; ж) стрихнин; з) аммиак?
15 Для паркинсонизма характерно:
а) увеличение содержания в мозге дофамина;
б) резкое снижение содержания в мозге дофамина;
в) резкое снижение содержания в мозге норадреналина;
г) резкое увеличение содержания в мозге норадреналина;
д) ингибирование сукцинатдегидрогеназы;
е) увеличение содержания в мозге серотонина?
16 Тормозное действие медиатора ГАМК связано:
а) с ингибированием Са каналов;
б) гиперпродукцией NADH;
в) торможением первого комплекса дыхательной цепи;
г) торможением третьего комплекса дыхательной цепи;
д) ингибированием сукцинатдегидрогеназы;
е) продукцией эндогенных медиаторов торможения;
ж) гиперполяризацией постсинаптической мембраны;
з) ингибированием цитохромоксидазы;
и) увеличением проводимости для ионов Сl-?
Лабораторная работа Ингибирование активности холинэстеразы сыворотки крови прозерином
Принцип метода. Основан на том, что при гидролизе ацетилхолина холинэстеразой происходит подкисление среды за счет накопления уксусной кислоты:
Холинэстераза
СН3-СO-О-СН2-СН2-N(СН3)3 + H2 O НО-СН2-СН2-N(СН3)3+ СН3-СОO- + Н+,
которую можно обнаружить по изменению окраски в присутствии индикатора – бромтимолового синего. В нейтральной среде этот индикатор сине-зеленый, а в кислой он имеет красную окраску. В присутствии антихолинэстеразного препарата – прозерина, а также инсектицидов или других фосфорорганических соединений, которые ингибируют активность холинэстеразы, расщепления ацетилхолина не происходит, и индикатор не меняет своей окраски.
Ход работы. В две пробирки вносят по 0,2 мл 0,1 %-го раствора бромтимолового синего и по 0,2 мл 0,1 %-го раствора ацетилхолина (предварительно нейтрализованного NaOH). В одну из пробирок (контрольную) добавляют 3 капли 0,05 %-го раствора прозерина.
В каждую пробирку вносят по 0,02 мл крови, содержимое пробирок перемешивают и ставят в термостат при температуре 38 °C на 15–20 мин. По истечении этого времени наблюдают изменение окраски в опытной пробе и сохранение исходной окраски в контрольной.
Клинико-диагностическое значение. В организме человека существует два типа холинэстераз:
а) ацетилхолинэстераза (АХЭ), которая встречается преимущественно в мозге, эритроцитах, мышцах, нервах; это высокоспецифический фермент, катализирующий гидролитическое расщепление ацетилхолина на холин и уксусную кислоту;
б) холинэстераза (ХЭ), которая содержится в основном в печени, поджелудочной железе и плазме крови. ХЭ обладает более широкой субстратной специфичностью, т. е. расщепляет ацетилхолин и другие эфиры холина.
Определение активности АХЭ сыворотки и тканей имеет большое клинико-диагностическое значение.
Сывороточная ХЭ представляет собой высокомолекулярный гликопротеид, связанный в крови с альбумином. Функция этого фермента выяснена недостаточно. Предполагают, что ХЭ плазмы крови выполняет защитную функцию, предотвращая накопление и распространение ацетилхолина по тканям, при попадании его в кровяное русло.
В норме активность ХЭ сыворотки крови колеблется в широких пределах – 160–340 мкмоль/(мл ∙ ч). При патологических состояниях ее активность чаще всего снижается. Значительное снижение активности ХЭ сыворотки крови отмечается при заболеваниях печени, гипотиреозе, суставном ревматизме, инфаркте миокарда, ожогах, а также отравлениях различными фосфорорганическими соединениями.
Угнетение активности ХЭ в сыворотке крови наблюдается значительно раньше проявления других симптомов интоксикации.
Выводы. Записать полученный результат и дать его клинико-диагностическую оценку.
