II. Квантово-механическое представление в органической химии
| Вид материала | Реферат |
СодержаниеVII. Органические кислоты 2. Карбоновые кислоты Деструктивное окисление алканов и алкенов 1. Сложные эфиры |
- Етодические особенности изучения органической химии место органической химии в школьном, 462.44kb.
- Программа элективного курса «Теоретические основы органической химии», 128.29kb.
- Элективный курс по химии для 10 класса естественнонаучного профиля «Механизмы реакций, 49.19kb.
- Тематическое планирование по органической химии для 10 класс, 550.27kb.
- Примерный перечень экзаменационных вопросов по органической химии, специальность 260303, 53.85kb.
- Элективный курс по химии для 10 класса профильного уровня. Тема: «Избранные вопросы, 93.44kb.
- Новые органические лиганды n 2 s 2 -типа и их комплексные соединения с ni(II), Co(II),, 232.86kb.
- Утверждаю, 425.07kb.
- Утверждаю, 318.85kb.
- Методы органической химии, 158.45kb.
VII. Органические кислоты
.. ..
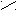


 O : O :
O : O :R
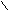


 – C .. R – C ..
– C .. R – C .. О : О :
О : О :¨ ¨
1. Примеры органических кислот
| Муравьиная | 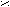 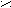 О ОН 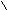 С СОН |
| Уксусная |   О ОН  3С – С 3С – С ОН |
| Молочная | 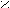  О ОН 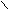 3С – СН – С 3С – СН – С | ОН ОН |
| Щавелевая | 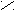 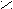 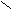 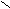 О О О О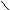 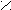 С – С С – С НО ОН |
| Янтарная | 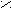 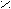 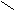 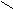 О О О О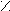 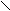 С – (СН2)2 – С С – (СН2)2 – С НО ОН |
| Бензоль(й)ная | 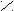 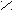 О О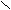 С С| ОН  |
| Салициловая (2-гидрокси бензоль(й)ная) | СООН 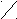 | ОН | ОН |
| Винная | НО – СН – СООН | НО – СН – СООН |
| Лимонная (2-гидрокси-1,2,3-пропантрикарбоновая кислота) | Н2С – СООН | НО – С – СООН | Н2С – СООН |
2. Карбоновые кислоты
Наиболее характерные свойства карбоновых кислот связаны с превращением [СООН] группы в разнообразные функциональные производные COOHall. Все производные способны к реакции гидролиза с образованием кислот.
Получение карбоновых кислот
- Муравьиная кислота;
Твердый NaOH спекают с СО.
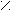
 ↑p;T O
↑p;T ON

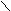 aOH + CO HC
aOH + CO HCONa
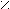


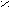 O O
O O2

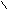 HC + H2SO4 → 2HC + Na2SO4
HC + H2SO4 → 2HC + Na2SO4ONa OH
- Уксусная кислота;
Из уксусного альдегида.
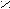

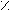
 O O
O O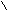
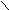 5H3C – C + 2KMn+7O4 + 3H2SO4 → 5H3C – C + 2Mn+2SO4 + K2SO4 + 3H2O
5H3C – C + 2KMn+7O4 + 3H2SO4 → 5H3C – C + 2Mn+2SO4 + K2SO4 + 3H2OH OH
M
 n+7O4¯ + 5e + 8H+ → Mn2+ + 4H2O 2
n+7O4¯ + 5e + 8H+ → Mn2+ + 4H2O 2 2C ¯ 1 – 2e → 2Cº 5
- Каталитическое окисление бутана (промышл.);
C4H10 + 3O2 → 2H2C – COOH + 2H2O
- Деструктивное окисление алканов и алкенов;
5CH3 – CH = CH – CH2 – CH3 + 8KMnO4 + 12H2SO4 → 5CH3 – COOH + 5CH3 – CH2 – COOH +
+ 8MnSO4 + 4K2SO4 + 12H2O
- Окисление первичных спиртов;
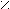


 [O] O [O] O
[O] O [O] OR


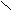
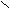 – CH2OH R – C R – C
– CH2OH R – C R – C H OH
Обычно в роли окислителя участвует KMnO4.
- Окисление алкинбензолов (получение ароматических кислот);
KMnO4 или K2Cr2O7
A
 r – R Ar – COOH
r – R Ar – COOH- Гидролиз тригалогенидов;
СH3 CH2Cl CHCl2 CCl3 COOH


гидролиз
| Cl2 | Cl2 | Cl2 | HOH; tº |







- Карбоксилирование реактива Гриньяра;
ионы H+
CO2
R


т.е. кислая среда
Hall + Mg → RMgHall R(COO)MgHall R – COOH +
- Г


 идролиз нитрилов ( N)
идролиз нитрилов ( N)
↑T
R



 – С N + НОН R – COOH + NH3↑
– С N + НОН R – COOH + NH3↑Реакция идет в присутствии либо кислот, либо щелочи.
П


 ример нитрила: H – C N (синильная кислота).
ример нитрила: H – C N (синильная кислота).
Химические свойства
- Образование солей;
R – COOH + NaOH → R – COONa + H2O
- Превращение в функциональные производные;
O
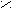
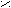
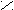
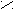
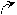 δ¯ O
δ¯ OR
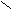
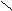
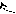 – C + NaOH → R – C
– C + NaOH → R – C 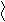 O H+ ONa
O H+ ONa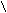
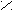
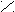
SOCl
O
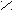
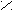

 O R – C + SO2 + HCl
O R – C + SO2 + HClR
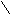
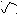

PCl3
– C Cl
 OH H3PO4
OH H3PO4PCl5
 POCl3 + HCl
POCl3 + HCl- Превращение кислоты в ангидриды;
P2O5; tº
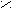
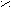
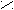
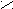 O O
O O H


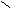 3C – C H3C – C
3C – C H3C – C 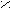 OH O
OH O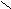
 H3C – C
H3C – C O
- Превращение в сложные эфиры;
tº
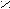
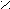
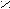
 O O
O O R

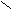
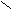 1 – C + R2OH R1 – C + H2O
1 – C + R2OH R1 – C + H2OOH OR2
- Превращение кислот в амиды;
O
tº


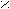

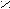
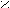 O O
O O R

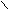

 – C + NH3 → R – C R – C + H2O
– C + NH3 → R – C R – C + H2OOH ONH4 NH2
(амид)
- Превращение в нитрилы;
P2O5; tº

 O
O R

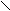


 – C R – C N + H2O
– C R – C N + H2ONH2 (нитрил)
- Восстановление в спирты;
HOH
4
 R – COOH + 3Li+1Al+3H4¯ → 4H2 + 2LiAlO2 + (R – CH2O)4LiAl R – CH2OH
R – COOH + 3Li+1Al+3H4¯ → 4H2 + 2LiAlO2 + (R – CH2O)4LiAl R – CH2OH - α
 – галогенирование;
– галогенирование;
Cl




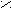
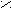
Cl2
α O O | O
H

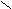

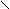 3C – CH – CH2 – C + Cl2 H3C – CH – CH – C H3C – CH – CH – C
3C – CH – CH2 – C + Cl2 H3C – CH – CH – C H3C – CH – CH – C| OH | | OH | | OH
CH3 CH3 Cl CH3 Cl
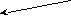
До полного замещения водорода в α-глеродном атоме
- Декарбоксилирование натриевых солей;
R
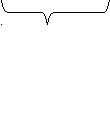 – COONa + NaOH → RH + CO2 + NaOH
– COONa + NaOH → RH + CO2 + NaOHNa2CO3 (сода)
- В ароматических кислотах.
За счет электронного перекрывания в кольце, группа СООН ориентирует реакции электрофильного присоединения в метаположение.
 COOН COOH
COOН COOH HCO3 или H2SO4
|


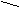
 NO2
NO2Пример.
COONa
| + NaOH → Na2CO3 + C6H6

Особые свойства муравьиной кислоты
- Разлагается концентрированной серной кислотой;
H2SO4 (k)

 O
O H

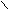 C CO + H2O
C CO + H2OOH
- Реакция серебряного зеркала;
NH3 (p-p); tº

 O
O H

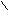 C + Ag2O 2Ag↓ + H2O + CO2
C + Ag2O 2Ag↓ + H2O + CO2OH
- Окисление хромом.
HCOOH + Cl2 → CO2 + 2HCl
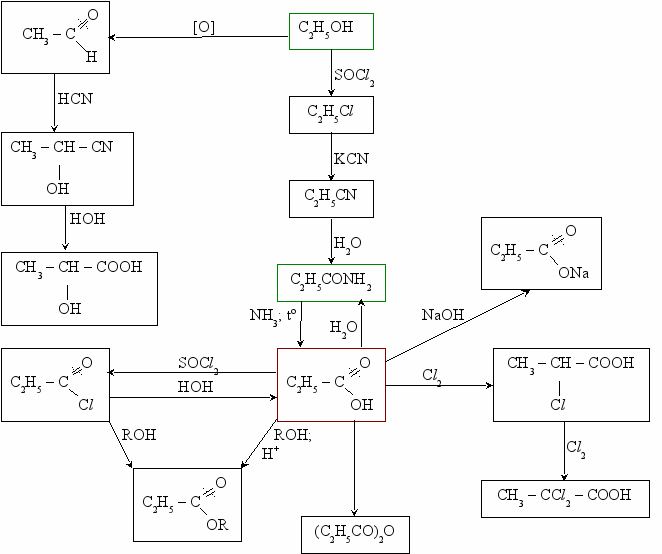
Взаимосвязь карбоновых кислот с другими соединениями
VIII. Сложные эфиры
1. Сложные эфиры
Сложные эфиры – это продукты взаимодействия кислот со спиртами и фенолами.

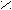 О
О R1 – C
R1 – C O – R2
Пример.
 2 О
2 ОС
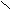
 Н3 – С 1 Этиловый эфир уксусной кислоты
Н3 – С 1 Этиловый эфир уксусной кислотыО – С2Н5 (этилацетат)
Примеры
- Этилацетат;
Этилацетат используют в парфюмерии из-за приятного фруктового запаха.
- Амилацетат;

 О
ОС
 Н3 – С Амилацетат обладает запахом бананов.
Н3 – С Амилацетат обладает запахом бананов. О – (СН2)4 – СН3
- Метилбутерат;

 О
ОС
 3Н7 – С Метилбутерат имеет запах ананасов.
3Н7 – С Метилбутерат имеет запах ананасов. О – СН3
- Амилбутерат.

 О
ОС
 3Н7 – С Амилбутерат имеет запах абрикосов.
3Н7 – С Амилбутерат имеет запах абрикосов. О – (СН2)4 – СН3
Гидролиз сложных эфиров
Гидролиз идет до кислоты и спирта и катализируется Н+.


Н+
О
С

 Н3 – С + НОН С2Н5ОН + СН3СООН
Н3 – С + НОН С2Н5ОН + СН3СООН NaOH
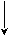 ОС2Н5
ОС2Н5 СН3СООNa
В присутствии щелочи кислота превращается в соль, которая выводится, что обуславливает протекание реакции до конца.
Химические реакции сложных эфиров
- Гидролиз;
Смотри выше.
- Превращение в амиды при взаимодействии с аммиаком;



 О O
О OС

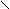 Н3 – С + NH3 → СН3 – С + С2Н5OH
Н3 – С + NH3 → СН3 – С + С2Н5OHОС2Н5 NH2
- Восстановление;
- 3.1. Каталитическое гидрирование;
-
При каталитическом гидрировании сложные эфира переходят в смесь первичных спиртов.


kat; tº; p
О
R
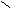
 1 – С + 2Н2 R1 – CH2ОН + R2ОН
1 – С + 2Н2 R1 – CH2ОН + R2ОН ОR2
- 3.2. Химическое восстановлении.


LiAlH4
О
R
 1 – С R1 – CH2ОН + R2ОН
1 – С R1 – CH2ОН + R2ОН ОR2
