Литература 21
| Вид материала | Литература |
- Класс: 12 Зачёт №2 «Русская литература 1917-1941», 186.43kb.
- Литература 7 класс Зачетная работа№2 Содержание, 40.79kb.
- Литература Форш О. «Одеты камнем», 38.6kb.
- Литература английского декаданса: истоки, становление, саморефлексия, 636.47kb.
- Тема: «Библейские мотивы в творчестве Б. Пастернака», 211.88kb.
- Литература 11 класс Программы общеобразовательных учреждений. Литература, 331.28kb.
- Учебника. Учитель Кулябина Зинаида Григорьевна. Выступление на Краевой научно-практической, 48.58kb.
- Жиркова Р. Р. Жондорова Г. Е. Мартыненко Н. Г. Образовательный модуль Языки и культура, 815.79kb.
- Английская литература. , 57.37kb.
- Планирование курса литературы 8 класса по программе, 14.4kb.
НАЦИОНАЛЬНАЯ АКАДЕМИЯ НАУК УКРАИНЫ
ИНСТИТУТ ПРОБЛЕМ МАШИНОСТРОЕНИЯ
Н. Н. Зипунников, В. Б. Трошенькин
РАЗРАБОТКА ПРОЦЕССА ПОЛУЧЕНИЯ ВОДОРОДА ИЗ ВОДЫ
С ИСПОЛЬЗОВАНИЕМ ЭНЕРГОАККУМУЛИРУЮЩИХ ВЕЩЕСТВ
Харьков 2008
УДК 661. 961. 1
Разработка процесса получения водорода из воды с использованием
энергоаккумулирующих веществ/ Зипунников Н. Н., Трошенькин В. Б. - Харьков, 2008. - 23 с./Препр. НАН Украины, Ин - т проблем машиностроения, №
В работе изложен обзор основных методов получения водорода.
Рассмотрены варианты получения водорода для автономных потребителей, с
использованием энергоаккумулирующих веществ.
Основное внимание уделено движущей силе и сопротивлениям
химических реакций.
© Институт проблем машиностроения НАН Украины, 2008
СОДЕРЖАНИЕ
Введение 4
1 Классификация методов производства водорода 6
2 Термодинамические закономерности реакций взаимодействия
алюминия, кремния и сплавов на их основе с водой и водными
растворами щелочи 8
3 Физико-химические закономерности процесса выделения водорода
из воды 12
4 Кинетика взаимодействия сплавов с водными растворами едкого
натра 15
5 Тепломассообмен сплавов с водой при получении водорода 17
Литература 21
ВВЕДЕНИЕ
Широкое использование водорода в качестве универсального
экологически чистого энергоносителя позволяет успешно решать многие важные энергетические и экологические проблемы. В связи с этим в большинстве высокоразвитых стран интенсивно разрабатываются технологии получения водорода.
Способы производства водорода из воды с помощью энергоаккумули-
рующих веществ (ЭАВ) имеют свое длительное развитие. В прошлом веке
водород для наполнения радиозондовых и шаропилотных установок в полевых условиях получали растворением железных опилок в разбавленной серной кислоте [1]. По мере развития технологий получения водорода, его стали получать путем реакций растворения алюминия или кремния в растворе едкой щелочи и взаимодействия гидрида кальция с водой. Данные методы использовались для воздухоплавательных установок [2-3].
Одним из основных способов производства водорода на
аэрологических станциях и др. автономных объектах является силиколевый метод, который сохранил свое значение и в настоящее время.
Силиколем называют сплав кремния и железа. Кремний является
основным элементом, вытесняющим водород из воды в присутствии щелочи.
Простота обслуживания и сравнительно высокая производительность –
главные достоинства установок, использующих силиколевый способ. Однако, значительный расход реагентов и их дороговизна значительно снижают конкурентоспособность рассматриваемого процесса. Поиск путей удешевления производства водорода продолжается.
В последнее время разработана технология изготовления более
дешевых ЭАВ - сплавов, на основе кремния, алюминия и железа, которые
получают из неорганической части низкокалорийных углей.
Запасы веществ, используемых в качестве ЭАВ должны быть в больших количествах, легко доступны и находиться вблизи добычи угля. Этим требованиям как раз и удовлетворяют компоненты минеральной части углей, содержащие оксиды кремния, алюминия, железа, кальция и других элементов.
Водород применяется во многих отраслях промышленности:
химической, пищевой, металлургической, машиностроительной и др.
Главное свое применение водород находит в химической
промышленности при производстве аммиака, идущего в свою очередь на производство азотной кислоты и азотных удобрений, получение метилового спирта, синтетических топлив, при глубокой переработке нефти, газификации угля, производстве высокооктанового моторного топлива, гидрогенизации жиров и получении различных химических соединений [4-6].
При гидрогенизации угля и нефти бедные водородом низкосортные
виды топлива превращаются в высококачественные.
Другой областью применения водорода в машиностроении является очистка нагара с деталей двигателя при их ремонте.
Водород также может быть основным сырьем в производстве белка.
Одна тонна водорода дает 1,4 тонны питательного белка. Производство
основано на выращивании водородоокисляющих бактерий.
В настоящее время сырьем для получения водорода служат
углеводороды. В связи с повышением их стоимости для производства
водорода целесообразно использовать воду.
В данной работе сделан обзор основных методов получения водорода
из воды с использованием ЭАВ.
1 КЛАССИФИКАЦИЯ МЕТОДОВ ПРОИЗВОДСТВА ВОДОРОДА
Способы классифицированы по выходу водорода [7]:
I. Получение из воды:
1 электролиз;
2 термическое и термомагнитное разложение;
3 взаимодействие со специальными металлами:
а) щелочные и щелочноземельные;
б) железо;
в) гидриды металлов.
4 с помощью ЭАВ [8];
5 взаимодействие с неметаллами:
а) углеродом - промышленное получение водяного газа;
б) углеводородами и оксидом углерода;
в) фосфором.
6 фотолиз воды:
а) фотокаталитическое разложение;
б) электрохимический фотолиз;
в) биофотолиз.
II. Получение из других соединений:
1 путем разложения углеводородов;
2 из кислот и щелочей.
III. Процесс переработки угля и кокса:
1 коксование и окисление кокса в расплаве;
2 газификация кокса и угля паром, паровоздушной и парокислородной
смесью;
3 плазменная парокислородная газификация угля.
IV. Разделение водородсодержащих смесей:
1 глубокое охлаждение коксового газа.
V. Использование атомной энергии [9]:
1 термохимическое получение водорода;
2 радиолиз;
3 комбинированные методы.
Нами рассмотрены способы получения водорода для автономных потребителей, находящихся в удаленной местности, где доставка водорода в баллонах затруднена: аэростатные организации и метеостанции. Для данных целей химическими энергоносителями могут быть сплавы ферросиликоалюминия (ФСА). Сплавы способны при определенных условиях вытеснять водород из воды.
К данному моменту разработана технология производства водорода взаимодействием со щелочными растворами ряда стандартных алюминиевых
порошков, а также алюминия активированного индием, галлием и оловом
АГ5О5И5 (масс. доля: Al-85 %, Ga-5 %, Sn-5 %, In-5 %) [10, 11].
Из кремниевых сплавов проведены опыты с ферросилицием ФС75 и
синтетическими сплавами ФСА17, ФСА18, ФСА25 и ФСА34. Сплавы
получены сплавлением алюминия, кремния и железа. В исследованиях
использованы сплавы ФСА11 и ФСА16, полученные восстановлением
неорганической части высокозольных углей. Изучена также химическая
активность сплавов ФСА38, ФСА57, ФСА62, ФСА77, которые получены путем сплавления ФСА11 и ФСА16 с определенным количеством железа и
алюминия. Кроме того исследованы алюминиевые сплавы САС - 1 и АПВ,
полученные путем распыла в потоке азота [12].
При исследовании реакционной способности вышеупомянутых
сплавов в качестве эталона взят сплав АГ5О5И5. Сплав выплавлен в электротермической печи Института проблем машиностроения им. А. Н. Подгорного НАН Украины (ИПМаш, г.Харьков) по технологии Института органического катализа и электрохимии (ИОКЭ, г.Алма-Ата) и Института общей и неорганической химии НАН Украины (ИОНХ, г.Киев).
Ранее были проведены опыты по получению водорода из воды с
использованием соединения натрийборгидрид NaBH4 [11].
2 ТЕРМОДИНАМИЧЕСКИЕ ЗАКОНОМЕРНОСТИ РЕАКЦИЙ
ВЗАИМОДЕЙСТВИЯ АЛЮМИНИЯ, КРЕМНИЯ И СПЛАВОВ
НА ИХ ОСНОВЕ С ВОДОЙ И ВОДНЫМИ РАСТВОРАМИ ЩЕЛОЧИ
Классическая термодинамика многофазных и гетерофазных систем
изложена в работах Гиббса [13, 14]. Фундаментальные уравнения выражают функции тел в тех независимых переменных, которые определяют их состояние.
Термодинамика рассматривает фазовые превращения как химический
процесс, поэтому слово „реакция” относится как к испарению, так и к газообразованию [15].
Термодинамический метод позволяет определить: энергетическую
возможность и направление химических взаимодействий; тепловые изменения во время реакций; устойчивость образующихся соединений; максимальные равновесные концентрации продуктов реакции и предельный их выход; оптимальный режим процесса (температуру, давление и концентрации реагирующих веществ).
Для реакций осуществляющихся в изобарно-изотермических условиях
возможность химических и фазовых превращений в закрытой системе
определяется уравнением
∆G = ∆H – T∆S, (1)
где ∆G - энергия Гиббса, кДж;
∆H - изменение энтальпии, кДж;
Т - абсолютная температура, К.
Отрицательные значения ∆G свидетельствуют о высокой вероятности реакций. При низких температурах множитель Т∆S в формуле (1) мал и изменение энергии Гиббса определяется основным образом изменением энтальпии. При увеличении температуры усиливается влияние члена уравнения T∆S.
Энтропия - функция состояния термодинамической системы.
Изменение S в равновесном процессе равно отношению количества теплоты, сообщенной системе или отведенной от нее, к термодинамической температуре системы.
Если процесс проводится обратимо и при постоянной температуре, то
изменение энтропии связано с поглощаемой теплотой уравнением
∆S = Qобр/Т, (2)
где Qобр - количество теплоты, поглощенной системой в изотермическом обратимом процессе, кДж;
Т - абсолютная температура, К.
Энтальпия есть функция состояния термодинамической системы при независимых параметрах энтропии и давления, которая связана с внутренней
энергией. При постоянном давлении изменение энтальпии равно количеству
теплоты, подведенной к системе, поэтому энтальпию называют тепловой функцией.
При обратимом и изотермическом проведении процесса ∆G равно по абсолютной величине, но обратно по знаку максимальной полезной работе А, которую система производит в данном процессе
∆G = – Амакс. (3)
Полезной работой называется вся производимая в ходе процесса работа
за вычетом работы расширения
А = Амакс – Р∆V, (4)
где Р∆V - работа расширения, кДж.
Можно сказать, что в условиях постоянства температуры и давления
реакции протекают самопроизвольно в сторону уменьшения энергии Гиббса.
Исходя из формулы (3) можно сказать, что самопроизвольно могут протекать
только те реакции, за счет энергии которых можно совершить полезную
работу [4].
Зная уравнения реакций, термодинамические свойства взаимодейству-
щих веществ и продуктов их взаимодействия, несложно рассчитать изменение энергии Гиббса [4].
С повышением температуры абсолютные значения энергии Гиббса
снижаются, т.е. система приближается к состоянию равновесия. Для реакций с образованием гидрооксидов и водорода исходные вещества находятся в
конденсированном состоянии и, следовательно, увеличение давления смещает реакцию влево. Таким образом для осуществления реакции в оптимальных условиях необходимо работать при низком давлении и невысокой температуре.
Основной движущей силой процесса выделения водорода является
химический потенциал i - го компонента в многокомпонентной смеси, который представляет собой увеличение свободной энергии Гиббса смеси при введении единичного количества i - го в смесь при постоянных температуре, давлении и концентрации (массе) других компонентов (число зарядов здесь не рассматривается).
Экспериментальные данные обычно представляют в виде зависимости полноты реакции от времени при фиксированной температуре [8]
 α =1 – е – kτ
α =1 – е – kτ , (5)
, (5)где α - полнота реакции;
к - константа скорости реакции, зависящая от температуры и природы
вещества;
τ - время реакции, с;
n - постоянная, учитывающая на каких геометрических элементах
поверхности развивается реакция.
Полнота реакции показывает, на сколько прореагировало вещество.
Реакция начинается с момента появления зародышей новой фазы вблизи
различных дефектов структуры твердого тела, где их образование энергетически облегчено. После индукционного периода скорость реакции возрастает, что происходит как за счет увеличения числа зародышей, так и благодаря их росту. Площадь реагирующей поверхности увеличивается до
тех пор, пока растущие зародыши не начинают касаться, перекрывать и поглощать друг друга.
3 ФИЗИКО - ХИМИЧЕСКИЕ ЗАКОНОМЕРНОСТИ ПРОЦЕССА
ВЫДЕЛЕНИЯ ВОДОРОДА ИЗ ВОДЫ
При взаимодействии алюминия или его оксида с влажной атмосферой образуется ряд продуктов: гидраргиллит γ - Al(OH)3, байерит α - Al(OH)3,
бемит γ - AlО(ОН), диаспор α - AlО(ОН), γ - и α - Al2O3[16].
С повышением температуры продукты претерпевают ряд изменений. Так, гидраргиллит при нагреве до 200-250 °С переходит в бемит. Байерит при нагреве 200-300 °С - в бемит. Бемит при 300-450 °С превращается в η - или
γ - Al2O3, при 450-500 °С в α - Al2O3 [17, 18].
По химическому составу смесь гидраргиллита и байерита можно
рассматривать как бетагиббсит - Al2O3 · 3H2О, а смесь бемита и диаспора -
как метагидрооксид - Al2O3·H2О [13, 17]. При температуре 20-90 °С оксидная пленка трехслойная. Непосредственно на поверхности алюминия находится аморфный оксид или гидрооксид толщиной в несколько нанометров, далее слой псевдобемита и поверх него слой байерита. Толщины псевдобемита и байерита измеряются микронами. В интервале температур 100-374 °С оксидная пленка состоит из бемита, однако на наружной поверхности обнаружены столбчатые кристаллы диаспора [16]. Наружный слой отделен от поверхности металла тонким слоем γ - Al2O3. При температуре выше 374 °С оксидная пленка состоит из γ - Al2O3 и α - Al2O3 (корунда).
Кроме того, при температуре 500-900 °С возможна реакция
расплавленного алюминия и продуктов его взаимодействия с парами воды.
Согласно правилу Пиллинга и Бэдворса, если объем образующегося
оксида меньше объема замещаемого им металла или металлоида, то пленка
оксида имеет рыхлую, ячеистую структуру и не может надежно защитить
металл от дальнейшего окисления [19].
Если же отношение объема оксида к объему металла ε больше
единицы, то образующаяся пленка оксида имеет компактную сплошную
структуру [17]
 , (6)
, (6)где Мок - молекулярный вес оксида;
ρок - плотность оксида, кг/м3;
ρме - плотность металла, кг/м3;
Аме - атомный вес металла;
n - число атомов металла в формуле оксида.
Такая пленка надежно изолирует металл от воздействия водяных паров
или кислорода и препятствует их дальнейшему окислению.
Ниже в таблице 3.1 приведены значения ε для различных металлов и
кремния.
Таблица 3.1 - Отношение объема оксида к объему металла по Пиллингу и Бэдворсу
| Na 0.55 | Al 1.45 | Cu 1.70 |
| K 0.45 | Pd 1.31 | Ti 1.73 |
| Li 0.58 | Cd 1.32 | Fe 2.06 |
| Sr 0.69 | Sn 1.33 | Mn 2.07 |
| Ba 0.78 | Zr 1.45 | Co 2.10 |
| Ca 0.64 | Zn 1.59 | Cr 3.92 |
| Mg 0.81 | Ni 1.68 | Si 2.04 |
Судя из данных, приведенных в таблице 3.1 видно, что для легких
металлов - щелочных, щелочноземельных и магния ε < 1, для тяжелых металлов и алюминия ε > 1. Значение коэффициента ε определяет поведение металлов при коррозии. Если ε < 1, то металл легко и быстро корродирует. При 1,31 < ε < 1,7 пленка оксида надежно охраняет металл от коррозии.
В интервале значений 2,04 <ε <3,92 оксидный слой получает
значительные напряжения, что может приводить к его разрушению.
Ниже приведены реакции взаимодействия с водой основных элементов входящих в состав сплавов ФСА, в зависимости от температуры.
Кремний при низкой температуре разлагает воду по уравнению
Si + 2H2О ↔ SiO2 + 2H2↑. (7)
В случае если температура превышает 600 °С, реакция развивается по зависимости
Si + 2H2О (пар) ↔ SiO2 + 2H2↑. (8)
Во время железо-парового способа получения водорода при 570 °С равновероятно присутствие компонентов: Fe3O4, FeO и Fe [20]. Выше 570 °С образуется оксид Fe(II) и водород. При более низких температурах наиболее
устойчивым является Fe3O4
3Fe + 4H2О ↔ Fe3О4 + 4H2↑. (9)
Скорость окисления чистого алюминия в водяном паре при 500-540 °С
значительно ниже, чем при 300-450 °С.
2Al + 3H2О ↔ Al2O3 + 3H2↑, (10)
2Al + 6H2О (пар) ↔ 2Аl(OH)3 + 3H2↑. (11)
Это объясняется тем, что при более высоких температурах
формируется оксидная пленка с повышенными защитными свойствами [21].
Для получения водорода применяют различные сплавы и поэтому
тепломассообмен будет иметь свои особенности в каждом конкретном случае.
Таким образом, на скорость и эффективность процесса получения водорода из воды с использованием ЭАВ существенное влияние оказывает
оксидная пленка. Скорость реакции также зависит от температуры, давления, структуры и состава ЭАВ, и свойств контактирующей с ней части окружающей среды.
4 КИНЕТИКА ВЗАИМОДЕЙСТВИЯ СПЛАВОВ С ВОДНЫМИ РАСТВОРАМИ ЕДКОГО НАТРА
В качестве основных водородгенерирующих сплавов приняты (масс. %):
ФСА11 – Fe - 18.15, Si - 61.9, Al - 11.13, Ti - 0.68, Mg - 0.15, Ca - 4.0, P- 0.059,
S - 0.04;
ФСА16 – Fe - 17.5, Si - 60.4, Al - 15.8, Ti - 0.84, Mg - 0.22, Ca - 3.6, P - 0.088,
S - 0.04;
ФСА25 – Fe - 10, Si - 65, Al - 25.
Основные кинетические исследования выполнены в реакторе объемом 1.13 л, обеспечивающем изохорное ведение процесса [8].
Сплавы ФСА11 и ФСА16 произведены на Запорожском производствен-
ном алюминиевом комбинате из неорганической части высокозольных углей.
Синтетический сплав ФСА25 получен в научно-исследовательском институте металлургии (г. Челябинск) путем сплавления алюминия, кремния и железа. Сплавы размалывали в шаровой мельнице.
При исследовании реакционной способности порошков использованы различные фракции. Сплав ФСА11 имеет удельную площадь поверхности 0,0167 м2/г, а в некоторых опытах этот же сплав обладает удельной
площадью поверхности 0,0785 м2/г. В остальных опытах порошки сплавов
имеют размер частиц 0,5-0,8 мм, Sуд ≈ 0,035 м2/г.
Активацию реакции производили введением определенного количества щелочи, что способствовало активному размыванию оксидного слоя сплава и
соответственно увеличению скорости вытеснения водорода.
По своей активности и полноте реакции сплавы из неорганической
части угля мало отличаются друг от друга. Так, при концентрации щелочи 30 % наблюдается следующая закономерность: при удельной площади поверхности порошка 0,0167 м2/г полнота реакции составляет 67-86,2 %, а при удельной площади поверхности 0,0785 м2/г - α достигает 94,8-98,4 %.
Синтетические сплавы менее активны, а полнота их реакции при
равных условиях на 15-20 % ниже, чем у сплавов из угля. Даже с повышением концентрации щелочи до 30 % доля прореагировавшего синтетического сплава при температуре 100 °С не превышает 74,6 %.
Повышенная активность ФСА, полученного из угля, объясняется
значительной неоднородностью поверхности и рыхлой структурой частиц. Другой причиной является наличие естественных примесей, которые в растворе щелочи создают микрогальванопары, способствующие интенсивному размыванию оксидного слоя.
У синтетических сплавов оксиды, находящиеся на поверхности частиц,
попадают в основной объем и, по-видимому препятствуют реакции. Кроме того, с уменьшением размера частиц скорость реакции возрастает.
Таким образом, сплавы ФСА, полученные из неорганической части угля, полнее удовлетворяют требованиям автономного производства водорода, чем синтетические сплавы.
- ТЕПЛОМАССООБМЕН СПЛАВОВ С ВОДОЙ ПРИ ПОЛУЧЕНИИ
ВОДОРОДА
В данном разделе ставится задача выявить роль тепломассообмена в ходе химических и физических превращений сплавов.
Значительные математические трудности не позволяют дать единое описание тепломассообмена, охватывающее все многообразие процесса
взаимодействия частиц с водой. Выделяют четыре этапа процесса с помощью которых можно упростить поставленную задачу [8].
Во время взаимодействия на реакционной поверхности образуется
водород под определенным давлением. Затем следует процесс расширения выделившегося газа. Одновременно происходит испарение части воды. После отделения пара и водорода в основной поток жидкость вновь опускается к реакционной поверхности, где нагревается, повышая свою температуру на величину ∆t
∆t = tc – td, (12)
где tc - температура реакционной поверхности, °С;
td - температура потока, омывающего частицы, °С.
Периодичность образования пузырей и прерывистость поступления жидкости к реакционной поверхности вызваны природой распределения двух
встречных потоков в пространстве [8]
∆t = ∆ti + ∆tр + ∆tе, (13)
∆t = tc – tп, (14)
∆t = tп – tm, (15)
∆t = tm – td, (16)
где ∆ti - температурный напор в слое жидкости, находящийся вблизи реакционной поверхности, °С;
∆tр - перепад температур в слое продуктов реакции, °С;
∆tе - температурный напор в слое жидкости, прилегающем к частице, °С;
tп - температура внутренней поверхности оксидного слоя, °С;
tm - температура внешней поверхности гидрооксидного слоя в местах газообразования, °С.
Теплоотдача от реагирующей поверхности к циркулирующей жидкости определяется зависимостями для конвективного теплообмена. Для расчета теплоотдачи от реагирующей частицы к омывающей ее жидкости
необходимо найти скорость естественной циркуляции потока.
В случае кипения расчет скорости потока a ведут через изменения
энтальпии вскипающей жидкости [22, 23]. Одновременно применяют
зависимость [24]

 , (17)
, (17) где U - отношение объемов газа и жидкости в потоке (Vг/Vж);
ρж - плотность жидкости при заданной температуре, кг/м³;
Рг - давление газа, МПа.
Формулу (16) применяют для расчета газожидкостных и парожидкост- ных потоков. Данная зависимость разработана для струйных аппаратов.
Поскольку циркуляция определяется интенсивностью гравитационного поля, необходимо применить зависимость для эргазлифтов [25].
Как известно, с повышением расхода газа в канале газлифта количество выносимой жидкости вначале увеличивается до определенного предела, а
затем постепенно снижается. С уменьшением диаметра подъемной трубы КПД эргазлифта увеличивается. Величина КПД выражается отношением полезной работы к работе, совершаемой рабочим агентом. Известна зависимость для расчета влагосодержания φ в подъемном потоке [26]

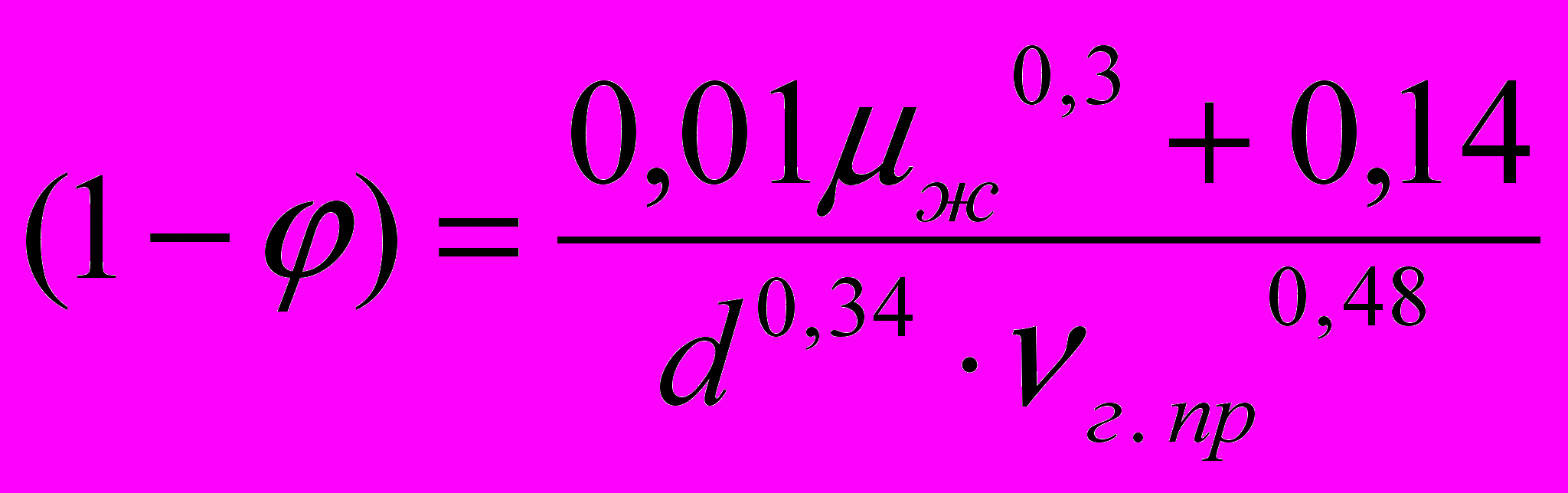 , (18)
, (18)где μж - вязкость жидкости, МПа ∙с;
d - диаметр подъемного канала, м;
νг. пр - приведенная скорость течения газа, м/с.
Количество поднимаемой жидкости определяют с учетом
сопротивления подъемного канала и трения возникающего в результате скольжения фаз [27].
Степень влияния чисел Рейнольдса (Re) находится в пределах 0.5-0,58.
При омывании реагирующей частицы обнаружено более существенное
влияние критерия Re. При прохождении потока в трубах степень при Re равна 0,8. В нашем случае степень критерия Рейнольдса составляет 1,6 [12]
Nu = 1.85∙10-6 Re1,6 Pr0,33 . (19)
Отклонение расчетных значений критерия Nu от опытных не
превышает 13,5%.
С ростом скорости омывания возрастает паро- и газообразование, что сопровождается турбулизацией пограничного слоя. Близкие условия
тепломассообмена наблюдаются при испарении воды в собственные перегретые пары [28].
В условиях гетерогенной системы предельное значение скорости
химической реакции определяется интенсивностью теплоотдачи при естественной циркуляции. Отмечают два основных фактора, определяющие скорость реакции.
Во-первых, при сопряжении основной экзотермической реакции
(образование водорода) с параллельной эндотермической (вскипание воды)
процесс идет при малых температурных напорах, т.е. в условиях, близких к
равновесию второй реакции.
Во-вторых, в гетерогенной системе взаимодействующие компоненты реагируют послойно.
Внешний теплообмен не вносит ограничения в скорость реакции. Судя по измеренным температурным напорам рыхлая часть оксидного слоя также не оказывает серьезного сопротивления течению реакции. Отсюда можно сделать вывод о том, что сопротивление плотного оксидного слоя,
расположенного вблизи реакционной поверхности является основным [8].
Целью дальнейших исследований является определение скорости
реакций и интенсивности теплообмена при получении водорода для широкого круга сплавов, включая высокоактивные.
ЛИТЕРАТУРА
1. Тейлор Г. Производство водорода. - Л.: Науч. хим. техн. изд. - во. Всехим-
пром ВСНХ СССР, 1930. - 180 с.
2. Родякин В. В. Кальций, его соединения и сплавы. - М.: Металлургия,
1967. - 188 с.
3. Когутов И. Л. Газовое дело в дирижаблестроении. - М.: Редакцион.- издат.
отд. Аэрофлота, 1938. - 328 с.
4. Глинка Н. Л. Общая химия: Учебное пособие для вузов. - 23-е изд.,
стереотипное/Под ред. В. А. Рабиновича. - Л.: Химия, 1983. - 704 с.
5. Козин Л. Ф., Волков С. В. Водородная энергетика и экология. - Киев: Наук. думка, 2002. - 336 с.
6. Козин Л. Ф., Волков С. В. Современная энергетика и экология: проблемы и перспективы. - Киев: Наук. думка, 2006. - 775 с.
7. Лебедев В. В. Физико-химические основы процессов получения водорода
из воды. - М.: Наука, 1969. - 135 с.
8. Получение водорода из воды с использованием сплава ферросиликоалю-
миния/В. Б. Трошенькин, Г. А. Ткач, Б. А. Трошенькин и др. - Харьков:
1996. - 28 с. (Препр./НАН Украины. Ин-т проблем машиностроения;
№ 396).
9. Водород. Свойства, получение, хранение, транспортирование,
применение. Справ. изд./Д. Ю. Гамбург, В. П. Семенов, Н. Ф. Дубовкин,
Л. Н. Смирнова. Под ред. Д. Ю. Гамбурга, Н. Ф. Дубовкина. - М.: Химия;
1989. - 672 с.
10. Козин Л. Ф., Сахаренко В. А., Бударина А. Н. Кинетика и механизм
взаимодействия активированного алюминия с водой // Укр. хим. ж - л. -
Киев, 1984. - 50, - Вып.2. - С. 161-169.
11. Трошенькин Б. А., Долгих Т. Н., Олейник Т. Б. Тепломассообмен при выделении водорода в реакциях борогидрида натрия и алюминиевых
сплавов с водой //Тепломассообмен - ММФ. Тепломассообмен в
химически реагирующих системах: Избранные докл., - Минск: ИТМО АН
БССР, 1989. - 3. - С. 153 - 160.
12. Трошенькин В. Б. Совершенствование процесса и реактора по
производству водорода из воды при помощи сплавов, из неорганической
части углей: Автореф. дис. … канд. техн. наук. - Х.: Харьк. гос. политехн.
ун-т, 1999. -16 с.
13. История учения о химическом процессе. Всеобщая история химии. -
М.: Наука, 1981. - 448 с.
14. Гиббс Дж. В. Термодинамика. Статистическая механика. - М.: Наука,
1982. - 584 с.
15. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии, в 2-х т.- М.:
Мир, 1982. - 1. - 652 с., - 2. - 620 с.
16. Дзисько В. А., Карнаухова А. П., Тарасова Д. В. Физико-химические
основы синтеза окисных катализаторов. - Новосибирск: Наука, 1978. -
384 с.
17. Добаткин В. И., Габидуллин Р. М., Колачев Б.А. и др. Газы и оксиды в
алюминиевых деформируемых сплавах. - М.: Металлургия, 1976. - 264 с.
18. Латимер В. Н. Окислительное состояние элементов и их потенциалы в
водных растворах. - М.: Иностр. лит., 1954. - 396 с.
19. Трошенькин Б. А. Возобновляемая энергия. В 2-х частях. - Ч.2 -
Термодинамика литосферы. Геотермические электростанции. - Х.: Изд-во
“Форт”, 2004. - 156 с.
20. Некрасов Б. В. Основы общей химии. - М.: Химия, 1973. - 1. - 656 с., - 2. -
688 с.
21. Улиг Г.Г., Ревин Р. У. Коррозия и борьба с нею. - Л.: Химия, 1989. - 456 с.
22. Ястржембский А. С. Техническая термодинамика. - М.; Л.: Госэнерго-
издат, 1960. - 495 с.
23. Трошенькин Б. А. Циркуляционные и пленочные испарители и
водородные реакторы. - Киев: Наук. думка, 1985. - 174 с.
24. Соколов Е. Я., Зингер А. М. Струйные аппараты. - М.: Энергоатомиздат,
1989. - 351 с.
25. Пороло Л. В. Воздушно-газовые подъемники жидкости (эргазлифты). -
М.: Машиностроение, 1969. - 160 с.
26. Гейер В. Г., Козыряцкий Л.Н., Пащенко В. С. и др. Эрлифтные
установки. - Донецк: Донецкий политехнический ин - т, 1982. - 64 с.
27. Зысин В. А., Баранов П. А., Барилович В. А., и др. Вскипающие
адиабатные потоки. - М.: Атомиздат, 1976. - 152 с.
28. Лыков А. В., Михайлов Ю.А. Теория тепло- и массопереноса. - М.; Л.:
Госэнергоиздат, 1963. - 536 с.
