Митрейкин Владимир Филиппович список основных сокращений и условных обозначений, испол ьзуемых в тексте автореферат
| Вид материала | Автореферат |
- Список условных сокращений и обозначений, 424.88kb.
- Отчет о научно-исследовательской работе структура и правила оформления, 299.55kb.
- 1 Геолого-физическая характеристика месторождения, 24.62kb.
- Содержание: Перечень сокращений и условных обозначений, 683.11kb.
- Перечень сокращений, условных обозначений, символов, 30.97kb.
- Реферат Перечень сокращений, условных обозначений, символов, единиц и терминов, 46.85kb.
- Реферат Перечень сокращений, условных обозначений, 101.56kb.
- Промежуточный контроль знаний, умений и навыков включает совокупную оценку работы студента, 58.7kb.
- Апанасевич Татьяна Антоновна Минск 2010 г. Оглавление Оглавление 3 Список условных, 450.52kb.
- Доклад посвящен проблемам установления кореферентности обозначений персон и организаций, 452.78kb.
На правах рукописи
Горячкина
Ксения Александровна
Влияние генетического полиморфизма CYP2D6, негенетических факторов и пароксетина на фармакокинетику и фармакодинамику метопролола у больных в раннем постинфарктном периоде
14.00.25 – фармакология, клиническая фармакология;
14.00.06 – кардиология.
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2008
Работа выполнена в ГОУВПО «Санкт-Петербургская государственная медицинская академия имени И.И.Мечникова Федерального агентства по здравоохранению и социальному развитию РФ»
Научные руководители:
Доктор медицинских наук, профессор Бурбелло Александра Тимофеевна
Доктор медицинских наук, профессор Болдуева Светлана Афанасьевна
Официальные оппоненты:
Доктор медицинских наук, профессор Андреев Борис Владимирович
Доктор медицинских наук, Шубик Юрий Викторович
Ведущая организация: Военно-медицинская академия им. С.М. Кирова
Защита состоится «_____» ________________200 г. в ______ часов на заседании диссертационного совета Д 208.090.03 в Санкт-Петербургском государственном медицинском университете им. акад. И. П. Павлова (197022, Санкт-Петербург, ул. Льва Толстого, д. 6/8, зал заседаний Ученого Совета).
C диссертацией можно ознакомиться в библиотеке Санкт-Петербургского государственного медицинского университета им. акад. И. П. Павлова
Автореферат разослан «____» _________200 г.
Ученый секретарь
диссертационного совета
доктор медицинских наук
профессор Митрейкин Владимир Филиппович
список основных сокращений и условных обозначений, используемых в тексте автореферата
| AU(E)C – Area Under the (Effect) Curve – площадь под кривой концентрации (эффекта) во времени |
| Css – Стационарная концентрация |
| CYP2D6 – Cytochrome P450 2D6 – цитохром Р450 2D6 |
| EM – Extensive metabolizer – нормальный метаболизатор |
| HADS – госпитальная шкала тревоги и депрессии |
| IM – Intermediate metabolizer – промежуточный метаболизатор |
| MR – Метаболическое Отношение (AUC метаболита/AUC метопролола) |
| PM – Poor metabolizer – медленный метаболизатор |
| SD – Standard Deviation - Стандартное Отклонение |
| STEMI –Инфаркт миокарда с подъемом сегмента ST |
| UM – Ultrarapid metabolizer – ультрабыстрый метаболизатор |
| βАБ – β адреноблокаторы |
| АД – Артериальное давление |
| ВКС – Внезапная кардиальная смерть |
| ВЭЖХ – Высокоэффективная жидкостная хроматография |
| ДНК – Дезоксирибонуклеиновая кислота |
| ЖНР – Желудочковые нарушения ритма |
| ИБС – Ишемическая болезнь сердца |
| ОИМ – Острый инфаркт миокарда |
| ПС – Постинфарктная стенокардия |
| ПЦР – Полимеразная цепная реакция |
| САС – Симпатоадреналовая система |
| СИОЗС – Селективные ингибиторы обратного захвата серотонина |
| СН – Сердечная недостаточность |
| ФВЛЖ – Фракция выброса левого желудочка |
| ЧСС – Частота сердечных сокращений |
| ЭКГ – Электрокардиограмма |
Актуальность проблемы
Ишемическая болезнь сердца (ИБС) занимает первое место среди причин смерти во всем мире. Смерть больных ИБС наступает чаще всего в результате острого инфаркта миокарда (ОИМ) с подъемом сегмента ST (STEMI), 50% больных ИБС умирают внезапно.
Использование βАБ рекомендуется на всех этапах лечения заболевания (уровень доказательности А, класс 1). Кроме этого βАБ являются одним из наиболее эффективных и безопасных средств фармакологического лечения Желудочковых Нарушений Ритма (ЖНР) у пациентов после ОИМ, и классом антиаритмиков, способных предотвращать внезапную кардиальную смерть (ВКС). Большая часть исследований, на которых основаны современные клинические рекомендации по применению βАБ, проводилась с использованием метопролола. Самый длительный период наблюдения пациентов, получавших этот препарат после ОИМ, составил 10 лет, что делает его изученность уникальной. В клинической практике дозы метопролола широко варьируют и как правило значительно отличаются от фиксированных доз в клинических испытаниях, где препарат доказал свою эффективность. По данным А. Hjalmarson et al. (2000) применение метопролола в низких дозах приводит к увеличению смертности после ОИМ, в то время как использование высоких доз препарата повышает частоту развития побочных эффектов терапии. Изучение фармакокинетики и фармакодинамики метопролола показало, что его эффект напрямую зависит от концентраций. Переносимость и эффективность препарата могут изменить такие индивидуальные факторы как характер заболевания, пол, возраст. Однако в клинических условиях они не изучены, а ограниченные и противоречивые результаты экспериментальных исследований, проведенных на здоровых волонтерах, невозможно экстраполировать на практическое применение препарата.
Особенную роль в вариабельности эффектов метопролола может играть генетический полиморфизм ферментов метаболизма. Индивидуальные концентрации препарата в значительной степени определяются полиморфной экспрессией цитохрома Р450 2D6 (CYP2D6). В исследоваиях на здоровых волонтерах были показаны различия в фармакокинетике и фармакодинамике метопролола у носителей мутаций, обусловливающих замедленный и ускоренный метаболизм. До настоящего момента в литературе отсутствовали данные о том, в какой степени ускоренный метаболизм влияет на концентрации метопролола и производимые им эффекты у пациентов, принимающих препарат длительно. Не была изучена роль генетически различной активности фермента CYP2D6 в эффективности и переносимости терапии метопрололом у пациентов с ИБС и ОИМ.
Известно, что CYP2D6 участвует в метаболизме более 20% всех применяющихся в клинической практике препаратов, эти субстраты способны изменять его активность, и, следовательно, эффективность. Для пациентов с ОИМ специфично развитие депрессивных расстройств – они выявляются у 50% больных, перенесших STEMI, и, возникнув в раннем периоде после ОИМ, значительно ухудшают прогноз в отдаленном будущем. У пациентов с депрессией коморбидной ОИМ смертность выше, чем у пациентов с ОИМ без аффективных расстройств, на 13,5% через 6 месяцев, и на 14% через 18 месяцев после инфаркта (Frasure-Smith N. et al., 1995; Nemeroff Ch. et al., 2003). Поэтому им рекомендовкано лечение антидепрессантами группы Селективных Ингибиторов Обратного Захвата Серотонина (СИОЗС). Среди всех представителей СИОЗС наиболее хорошо изученным и наиболее мощным является пароксетин. Его применение благоприятно влияет не только на эмоциональный статус, но и оказывает непосредственное кардиопротекторное действие – улучшает вариабельность сердечного ритма (ВСР), оказывает антиагрегантный эффект. В то же время экспериментально доказано, что пароксетин ингибирует активность CYP2D6. Поскольку активность CYP2D6 влияет на фармакокинетику метопролола, велика вероятность изменения его клинической эффективности и безопасности у пациентов с ОИМ, принимающих метопролол и пароксетин одновременно. В пользу этой гипотезы говорят исследования, проведенные in vitro и на небольшом числе здоровых волонтеров, где было показано изменение метаболизма метопролола и соответственное изменение его фармакодинамики при взаимодействии с пароксетином (Hemeryck A. et al., 2000). Вероятность и значимость этого взаимодействия у пациентов, принимающих метопролол длительно, в дозах, необходимых для поддержания клинического эффекта, не изучены; также отсутствует информация о том, каковы особенности этого взаимодействия у носителей мутантных аллелей в генотипе CYP2D6.
Цель исследования:
Изучить особенности фармакокинетики и фармакодинамики метопролола в зависимости от генотипа CYP2D6 и индивидуальных негенетических факторов у больных в раннем постинфарктном периоде, и их изменения при взаимодействии с пароксетином, при его назначении с целью коррекции эмоциональных расстройств депрессивного спектра.
Задачи исследования:
- Изучить особенности фармакокинетики и фармакодинамики метопролола у больных с ОИМ и их зависимость от индивидуальных клинических и демографических характеристик
- Изучить встречаемость наиболее значимых генетических вариантов CYP2D6 в популяции пациентов, перенесших ОИМ, госпитализирующихся в стационары г. Санкт Петербурга
- Изучить фармакокинетику и фармакодинамику метопролола в зависимость от генетически детерминированных особенностей метаболизма у больных в раннем постинфарктном периоде
- Изучить изменения фармакокинетики и фармакодинамики метопролола при его взаимодействии с пароксетином у пациентов с ОИМ, их зависимость от активности CYP2D6
Личный вклад автора:
Лично автором выполнен скрининг пациентов с ОИМ, диагностика эмоциональных расстройств, включение в исследование соответственно критериям, подготовка протокола и изучение фармакокинетики и фармакодинамики метопролола. Адаптирован метод высокоэффективной жидкостной хроматографии (ВЭЖХ) для количественного определения метопролола и α-гидроксиметопролола в плазме крови, выполнено аналитическое определение концентраций и расчет параметров фармакокинетики метопролола, α-гидроксиметопролола и пароксетина, а также выделение ДНК и выявление мутаций CYP2D6 при помощи анализа ПЦР (полимеразной цепной реакции). Все лабораторные исследования проводились автором на базе научно-исследовательской лаборатории отделения лабораторной медицины кафедры клинической фармакологии Каролинского Института, Стокгольм, Швеция.
Научная новизна:
- Впервые изучена взаимосвязь метаболизма и клинических эффектов метопролола с индивидуальными особенностями пациентов с ОИМ (пол, возраст, фракция выброса левого желудочка (ФВЛЖ))
- Впервые выявлена взаимосвязь клинических эффектов метопролола с генетическим полиморфизмом его метаболизирущей системы у пациентов с ОИМ
- Впервые получены данные, свидетельствующие о неблагоприятной роли удвоения гена CYP2D6 для подбора эффективной дозы метопролола
- Впервые выдвинута гипотеза о возможном существовании взаимосвязи активности гена CYP2D6 и тяжести течения ОИМ
- Впервые оценена клиническая значимость взаимодействия метопролола и пароксетина у пациентов с ОИМ
Практическая значимость:
- У пациентов, получающих метопролол для лечения ОИМ, проведение генетического анализа на мутации в гене CYP2D6 позволит оптимизировать режим приема препарата. Пациентам со сниженной активностью CYP2D6 при низкой дозе метопролола может быть рекомендован двукратный, а при высокой – однократный прием препарата; пациентам с повышенной активностью фермента обоснован прием метопролола только в формах замедленного высвобождения.
- Генетический анализ на предмет выявления повышенной активности CYP2D6, проводимый всем лицам с имеющимися факторами риска ИБС, позволит выделить категорию людей с вероятностью большей степени повреждения миокарда и развития осложнений при возникновении первого ОИМ.
- У пациентов с ОИМ, получающих метопролол, при лечении депрессивных расстройств пароксетином рекомендуется проводить контроль ЧСС и оценивать необходимость коррекции дозы на 7й день совместного применения препаратов.
- Пол и возраст не имеют значения при подборе дозы метопролола у пациентов с ОИМ.
Положения, выносимые на защиту:
- Частота мутаций (*3, *4, удвоение) в гене, кодирующем CYP2D6, выявляемая среди пациентов Санкт-Петербурга с ОИМ, соответствует частоте их встречаемости в общей европейской популяции.
- Генетический полиморфизм CYP2D6 определяет различия индивидуальных концентраций метопролола независимо от дозы и веса пациентов.
- Метаболизм метопролола независимо от активности CYP2D6 незначительно замедлен у пациентов женского пола, пожилого возраста и при снижении ФВЛЖ.
- Снижение ЧСС в ходе терапии под влиянием метопролола зависит от генотипа CYP2D6, наибольшая эффективность достигается у пациентов с генотипом, определяющим замедленный метаболизм (гомозиготная мутация *4), а наименьшая – у пациентов с генетически обусловленным ускоренным метаболизмом (удвоение гена CYP2D6).
- На фоне приема пароксетина активность CYP2D6 снижается, в результате чего увеличиваются концентрации метопролола, и усиливается выраженность и продолжительность его действия, при этом степень снижения активности CYP2D6 зависит от ее исходного уровня, побочные эффекты не возникают.
Реализация и апробация работы:
Материалы диссертации доложены на: 20-й Европейской конференции «Социальные перемены и новые задачи для психологии в здравоохранении» (Варшава, август-сентябрь 2006), 7-м Международном Балтийском Форуме (СПб, сентябрь 2006), 8-й конференции Европейской Ассоциации Клинической Фармакологии и Терапии (Амстердам, август 2007), международной конференции «Современная кардиология – наука и практика» (СПб, май 2007), 2-м съезде ассоциации фармакогенетиков (Стокгольм, май 2007), 3-м Всероссийском съезде «Фармакология – практическому здравоохранению» (СПб, сентябрь 2007). Результаты диссертационного исследования используются в практической деятельности клиники кардиологии больницы Петра Великого, отделения кардиологии городской многопрофильной больницы N2; в учебном процессе при подготовке студентов на кафедре госпитальной терапии с курсами клинической фармакологии, семейной медицины и лабораторной диагностики, и кафедре факультетской терапии с курсом интервенционной кардиологии СПбГМА им. И.И.Мечникова. По теме диссертации опубликовано 16 печатных работ, в том числе статьи в центральных журналах РФ и зарубежной печати.
Структура и объем диссертации:
Диссертация изложена на 180 листах машинописного текста и включает введение, обзор состояния вопроса, описание характеристик пациентов и использованных в исследовании методов, главы с описанием результатов собственных исследований, обсуждения полученных результатов, выводов, практических рекомендаций и списка литературы. Работа иллюстрирована 19 рисунками и 27 таблицами. Список литературы включает 393 наименования, из них 69 отечественных и 324 зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования:
Ретроспективный анализ частоты назначения β-адреноблокаторов пациентам с ОИМ проводили по данным электронных резюме историй болезни клиники кардиологии больницы Петра Великого за 2004-2005 год.
В основное проспективное исследование было включено 187 пациентов (114 мужчин, 73 женщины, возраст 60±11 [36-80] лет), подписавших информированное согласие. Критериями включения служили подтвержденный диагноз ОИМ и факт назначения метопролола. Пациентов не включали в исследование, если их основному заболеванию сопутствовали: некомпенсированный сахарный диабет, некомпенсированные заболевания щитовидной железы, заболевания печени или почек. Кроме того, в исследование не включали пациентов, которым были назначены препараты, оказывающие существенное влияние на ритм сердца помимо метопролола (другие антиаритмики, сердечные гликозиды) и препараты, являющиеся субстратами или ингибиторами CYP2D6. Всем пациентам был произведен забор крови на генетический анализ. Из общей группы первые 115 (99 мужчин, 16 женщин, возраст 60±11 [39-80] лет) в порядке очередности включения в исследование составили подгруппу анализа фармакокинетики метопролола. В среднем на 7–10е сутки госпитализации пациентам проводили скрининговое обследование на предмет наличия нарушений в эмоциональной сфере. На следующий за этим день производили забор четырех проб крови на анализ фармакокинетики метопролола (0, 2, 6 и 12 часов после приема утренней дозы), соответственно точкам, характеризующим основные моменты кинетики в течение одного интервала дозирования. Одновременно с каждым забором крови регистрировали ЧСС и АД в покое.
У 25 пациентов были выявлены клинически выраженные депрессивные расстройства. У семнадцати из них было получено согласие на лечение и назначена терапия пароксетином. Этим пациентам на следующее утро после забора крови на анализ фармакокинетики метопролола был назначен пароксетин в единой стандартной дозе 20 мг однократно утром. В течение последующей недели пациенты получали оба препарата без изменения доз. На 7-8й день терапии произведен повторный забор четырех проб крови на анализ фармакокинетики метопролола в те же моменты времени. Одновременно с забором крови повторно регистрировали ЧСС и АД в покое. Помимо метопролола в пробах определяли концентрацию пароксетина.
Эффективность терапии оценивали по ЧСС в покое в начале и в конце госпитализации по записям первой и последней плановой ЭКГ у 187 пациентов, включенных в исследование исходно. Появление любых побочных эффектов терапии оценивали по результатам физикального обследования, ежедневно проводимого врачом, результатам инструментальных исследований (интервал PQ на ЭКГ) и жалобам пациентов. По показателям ЭХО КГ, наличию постинфарктной стенокардии, нарушений ритма сердца проводили оценку течения заболевания.
Для изучения активности CYP2D6 у пациентов с желудочковыми нарушениями ритма (ЖНР) после ОИМ из всех пацинтов, включенных в исследование, были выбраны те, у кого течение ОИМ осложнилось ЖНР класс II и выше по классификации Lown (Lown et al., 1971) (n=12). У десяти из них была изучена фармакокинетика метопролола. В качестве дополнительного параметра сравнения из подгруппы 115 пациентов с изученной фармакокинетикой метопролола и генотипом CYP2D6 выделили тех, у кого течение ОИМ осложнилось развитием постинфарктной стенокардии (ПС) (n=47). Для более полного изучения вопроса ретроспективно были выбраны пациенты с ЖНР, осложнившими ОИМ с сентября 2004 по июль 2005 г. (n=31), одиннадцать из них подписали информированное согласие и были включены в исследование.
Влияние удвоения гена, кодирующего CYP2D6, на развитие ЖНР оценивали по способу «случай-контроль». В качестве объекта изучения («случай») были выбраны все пациенты с ЖНР (n=23), включенные как проспективно (n=12), так и ретроспективно (n=11). Группу контроля составили все пациенты, включенные в основное исследование, у которых течение ОИМ не осложнялось развитием ЖНР (n=175).
Лабораторные методы: ДНК выделяли из размороженной цельной крови с помощью мини-набора QIAamp (QIAGEN, США). Генотипирование на *3 и *4 проводили методом аллель-специфичного 5’ нуклеазного анализа с использованием готовых реагентов TaqMan (Applied Biosystems, Foster City, CA, США) на аппарате ABI PRISM 7700 Sequence Detection System (PE Applied Biosystems, Великобритания) (Livak et al., 1999). Мутацию *10 определяли по методу аллель-специфичной nested ПЦР, аналогично методу Garcia-Barcello et al. (2000), удвоение гена – методом «длинной» ПЦР по Lundquist et al. (1999).
Концентрации метопролола и его метаболита определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) обратной фазы (модификация метода Kirchheiner et al. (2004)). Использовали аналитическую колонку eclipse XDB-phenyl 5 мкм (15x4 мм) с предколонкой (“Zorbax” Agilent technologies, США). Мобильная фаза состояла из 50 ммоль калиевого фосфатного буфера (pH 3.0): ацетонитрила: тетрагидрофурана (85:13:2). Искомые компоненты определяли флуоресцентным детектором при 216 и 312 нм длин волн возбуждения и эмиссии на 2.7, 8.4 и 10.1 мин для α-ОН метаболита, метопролола и декстрорфана (внутренний стандарт) соответственно при скорости потока 1 мл/мин. Экстракцию метопролола и метаболита из плазмы осуществляли с помощью дихлорометана: 1-бутанола (85:15) с выпариванием органической фазы под током азота. Калибрационные кривые были линейны в промежутке концентраций 12,5 – 400 нмоль. Нижняя граница определяемой концентрации составила 6 нмоль для метопролола и 3 нмоль для -гидрокси метопролола. Вариабельность показателей в разное время была меньше 10%.
Пароксетин в плазме крови определяли с помощью ВЭЖХ по методу Laine et al. (2001). Разделение осуществляли в колонке Waters XTerra RP 18 3,3 мкм (100 x 3 мм) с градиентным элюированием со скоростью 0,6 мл/мин (мобильная фаза - 20-80% ацетонитрил с добавлением 20 ммоль аммиака и 6 ммоль ацетиловой кислоты). Время анализа составило 18 минут. Интервал определяемых концентраций - 20-200 нмоль. Площади под кривой концентраций определяли методом трапеций.
Депрессивные и тревожные расстройства выявляли с помощью самоопросника HADS – госпитальная шкала тревоги и депрессии (Zigmond et al. (1983)) для пациентов соматических стационаров. Пациентам, у кого были выявлены расстройства депрессивного спектра, дополнительно проводили собеседование по методике оценке депрессии Гамильтона (HamDRS (Hamilton et al., 1960)). Беседу проводили в специальном помещении в отсутствии третьих лиц.
Статистический анализ полученных данных осуществляли с помощью статистической программы GraphPad Prism v.4.0. Результаты представлены в виде средних SD для параметрических, или медиан [25%-75%] для непараметрических данных. Парный t-тест для логарифмических значений использовали при сравнении величин в начале и по окончании исследования. При сравнении генотипически различных групп использовали тест Mann-Whitney для непараметрических данных. Взаимосвязь между качественными признаками оценивали с помощью χ2. Результаты считались значимыми при P меньше 0.05.
Результаты и обсуждение:
В результате ретроспективного анализа было выявлено, что β-адреноблокаторы назначались пациентам с ОИМ в 97% случаев, из которых метопролол – в 85%. Это подтвердило актуальность нашего исследования для клинической практики. Среди пациентов с ОИМ частота встречаемости мутантных аллелей гена CYP2D6 соответствовала частоте их обнаружения в общей популяции. Генотипы были распределены в соответствии с законом Харди-Вайнберга. Генотип CYP2D6*4/*4, связанный с замедлением метаболизма субстратов (PM) присутствовал у 1,7% пациентов; генотип CYP2D6*2хn, являющийся основой ускоренного метаболизма (UM) – у 4%. Еще один пациент (0,6%) был носителем удвоения гена, однако в его генотипе присутствовала одна функционально неактивная аллель. Суммарное количество гетерозигот по мутантной аллели CYP2D6*3 или CYP2D6*4, а также гомозигот по аллели CYP2D6*10, которые могут обуславливать снижение количества или активности синтезируемого белка CYP2D6, составило 31,2% (или 31,8% с учетом одного носителя мутантной аллели CYP2D6*4, сопряженной с удвоением гена).
Изучение фармакокинетики метопролола, ее связь с фармакодинамикой: При средней дозе метопролола 75±38 (25-150) мг мы наблюдали большую вариабельность концентраций препарата в плазме крови. Стационарные концентрации метопролола были низкими у большинства пациентов, и неопределимыми у 41%; через шесть часов после его приема концентрации были ниже эффективного уровня у 36% пациентов, и ниже предела определения - у 15% пациентов. Через двенадцать часов после приема препарата концентрации были неопределимы у 33% пациентов. В момент достижения максимальной концентрации – через два часа после приема – концентрации были высокими у большинства пациентов, что говорит об адекватной биодоступности, но значительной вариабельности клиренса метопролола. Для оценки зависимости распределения концентраций от генотипа CYP2D6, мы разделили пациентов на группы PM, EM, IM и UM соответственно генетически предопределенному фенотипу. Группы были сопоставимы по основным клиническим и демографическим параметрам. В ходе анализа мы выявили, что концентрации метопролола, пересчитанные на дозу препарата и вес пациента, были тем выше, чем ниже была генетически детерминированная активность CYP2D6. Метаболическое отношение (Metabolic Ratio - MR), отражающее путь метаболизма метопролола, целиком зависимый от активности CYP2D6, было значительно ниже в группах пациентов с более высокой активностью фермента (таб. 1).
Таблица 1.
Параметры фармакокинетики метопролола в группах пациентов с различными генотипами CYP2D6
| параметр | CYP2D6 *4/*4, n=2 | CYP2D6 *1/*3(*4), n=24 | CYP2D6 *1/*1, n=60 | CYP2D6 dupl, n=5 | p |
| AUC концентраций метопролола (нМ*ч/мг/кг) | 5185±25 | 1322±1013 | 794±845 | 319±159 | 0.002 |
| AUC концентраций α-гидрокси метопролола (нМ*ч/мг/кг) | 5±1 | 983±820 | 1363+868 | 781+365 | <0.0001 |
| MR | 1032±233 | 19±94 | 0.7±0.9 | 0.6±0.7 | <0.0001 |
Среднее±SD; р вычислено с помощью анализа ANOVA log величин
Несмотря на одинаковые средние дозы метопролола в пересчете на вес пациента, его концентрации в плазме крови различались у пациентов с разными генотипами CYP2D6 во всех точках измерения, и несколько различалась скорость снижения концентраций (рис. 1).
Закономерно возник вопрос, отражаются ли различия в концентрациях метопролола на его эффективности. Сопоставляя площади под кривой концентраций метопролола и площади под кривой соответствующих изменений ЧСС (AUEC), мы выявили их значимую отрицательную корреляцию (Spearman r=-0.37, p=0.0006). Различия площадей под кривой ЧСС в группах разных генотипов CYP2D6, не достигли статистической значимости, хотя наблюдалась тенденция к более низким ЧСС у пациентов с генотипом, обуславливающим низкую активность CYP2D6. Это можно объяснить следующим образом. Метопролол применяется в виде рацемической смеси, при этом активным является S-стереоизомер, а R-стереоизомер не обладает β-адреноблокирующими свойствами. В ходе метаболизма в системе CYP2D6 преимущественно метаболизируется неактивный компонент смеси, поэтому при увеличении общей концентрации доля неактивного компонента выше. Учитывая большую вариабельность показателей фармакокинетики и фармакодинамики метопролола в группе пациентов, не имеющих мутаций в гене CYP2D6, мы решили изучить другие факторы, определяющие эффективность метопролола в данной категории пациентов.
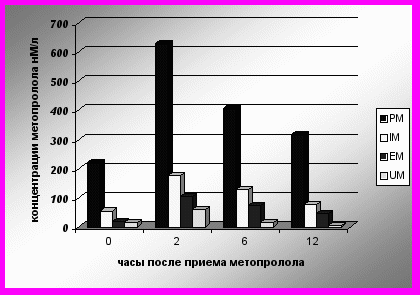
Рисунок 1. Концентрации метопролола в плазме крови пациентов с различными генотипами CYP2D6
Влияние негенетических факторов на фармакокинетику и фармакодинамику метопролола: Мы выбрали три основных негенетических фактора – ФВЛЖ, пол и возраст. При сниженной ФВЛЖ снижается скорость печеночного кровотока, что может замедлить клиренс препаратов с высокой печеночной экстракцией, таких как метопролол. Разделив пациентов на группы по ФВЛЖ (ФВЛЖ ≤50% (n=20) и ФВЛЖ>50% (n=73)), мы не обнаружили между ними различий в концентрациях метопролола. Однако у пациентов, не имеющих мутаций в гене CYP2D6, концентрации метопролола были с пограничной значимостью выше при сниженной ФВЛЖ, что говорит о незначительном влиянии скорости печеночного кровотока на клиренс препарата. У пациентов с низкой ФВЛЖ более высокими оказались и концентрации метаболита метопролола, что свидетельствовало о сохраненной активности CYP2D6. Тем не менее, наши данные не позволили выявить усиления действия метопролола, по изменениям ЧСС в покое. Это может быть связано с компенсаторным усилением симпато-адреналовой стимуляции в связи с развитием сердечной недостаточности (СН), в результате чего баланс исходного адренергического тонуса и противодействия ему βАБ в этой группе мог быть существенно нарушен. Данные литературы позволяют предположить существование различий в метаболизме метопролола у мужчин и женщин, есть данные о возможных различиях и в активности CYP2D6. В нашем исследовании группы мужчин и женщин были сопоставимы по ФВЛЖ и дозе метопролола. Женщины были старше мужчин, что отражает известный факт более раннего начала ИБС у лиц мужского пола. Несмотря на наличие тенденции к более высоким концентрациям метопролола у женщин, мы не выявили статистически значимых различий ни по одному из параметров его фармакокинетики и фармакодинамики. В 2006 году были опубликованы данные эпидемиологического исследования Thurman et al., в котором было показано, что частота побочных реакций, связанных с препаратами, метаболизирующимися CYP2D6, выше у представительниц женского пола. Исходя из этого, авторы предположили, что активность CYP2D6 у женщин ниже, чем у мужчин. Наши результаты не подтвердили эту гипотезу. На основе собственных и литературных данных мы можем сделать вывод, что различия в метаболизме метопролола у мужчин и женщин не имеют клинического значения. Сопутствующие старшему возрасту уменьшение мышечной массы, замедление тканевого кровоснабжения и почечной фильтрации тоже могут приводить к изменениям фармакокинетики препаратов. Мы оценили связь фармакокинетики и фармакодинамики метопролола, а также активности CYP2D6 с возрастом пациентов. AUC метопролола не зависела от возраста при анализе параметра у всех пациентов (Pearson r=0,1), однако в группе без фенотипически значимых мутаций в гене CYP2D6 (генотип CYP2D6*1/*1 и *1/*10) концентрации метопролола, пересчитанные на дозу и вес, были выше у пациентов старшего возраста, Pearson r=0,25; p=0,047. Концентрации α-гидрокси метопролола, а также MR не были связаны с возрастом пациентов по результатам корреляционного анализа, что говорит об отсутствии значимых изменений в активности CYP2D6 с возрастом. Мы не выявили также и зависимости AUEC метопролола от возраста пациентов.
Таким образом, генотип CYP2D6 представляется фактором, оказывающим наиболее значимое в практическом отношении влияние на эффективность терапии метопрололом, в то время как пол и возраст, а также снижение ФВЛЖ существенной роли не играют.
Влияние изучаемых факторов на общую эффективность метопролола в ходе госпитализации. В клинической практике адекватное снижение ЧСС в покое служит основным критерием оценки эффективной β-адреноблокады у пациентов с ОИМ. Мы оценивали влияние факторов, определяющих концентрацию метопролола, на ЧСС в покое в конце госпитализации как максимальный достигнутый результат терапии. При равных исходных показателях, ЧСС в конце госпитализации была значимо ниже у пациентов с низкой активностью CYP2D6, обладателей фенотипа PM, медленного метаболизма. Гетерозиготные по мутантной аллели пациенты, обладатели фенотипа IM, метаболизма промежуточной скорости, и гомозиготные по «дикому типу» нормальные метаболизаторы, EM, достигли в среднем одинаковой, промежуточной величины ЧСС. У пациентов с удвоением гена, фенотипом повышенной скорости метаболизма, UM, ЧСС при выписке была максимально высокой (69±8 ударов/мин). Степень снижения ЧСС за время госпитализации, с коррекцией на дозу метопролола и вес пациента, была минимальной у пациентов с повышенной активностью CYP2D6, и максимальной у пациентов со сниженной его активностью, статистически это наблюдение имело характер тенденции. Тем не менее, исходя из наших данных ясно, что при терапии метопрололом генотип CYP2D6 оказывает влияние не только на дневные колебания ЧСС, но и на способность препарата уменьшать среднесуточную ЧСС за время госпитализации. При этом наиболее благоприятным является генотип, определяющий медленный метаболизм (PM), а наименее благоприятным – удвоение гена CYP2D6, и ускоренный метаболизм (UM).
В результате проведенного нами скрининга пациентов на 7-10 день госпитализации в 63% случаев были выявлены расстройства в эмоциональной сфере. Однако мы не обнаружили их влияния на ЧСС, что позволило сделать вывод, что эмоциональные расстройства, выявляемые посли ОИМ, не увеличивают потребность в βАБ. Мы также оценивали ЧСС у пациентов со средними значениями АД меньше и больше 100 мм рт. ст.. При анализе всех пациентов как одной группы, различия в показателях ЧСС не были выявлены, однако при устранении влияния генотипа CYP2D6 (анализе подгруппы пациентов с генотипом EM) мы выявили значительно более высокую ЧСС при выписке у пациентов с АД < 100 мм рт. ст. Таким образом, низкое систолическое АД определяло более высокие ЧСС в конце госпитализации независимо от генотипа CYP2D6.
Влияние различий в генотипе CYP2D6 и концентрациях метопролола на течение раннего постинфарктного периода.
Показателями эффективности терапии ИМ в ранние периоды является развитие осложнений. Поэтому мы оценивали активность CYP2D6 у пациентов, течение заболевания у которых осложнилось желудочковыми нарушениями ритма, или постинфарктной стенокардией. Пациенты в группе ПС были старше, и среди них было больше женщин. Дозы метопролола не различались во всех группах пациентов. Средняя суммарная активность CYP2D6 (общее количество активных аллелей, разделенное на количество пациентов) была значимо выше у пациентов с ЖНР, чем у пациентов, не имеющих этого осложнения после ИМ. Мы не выявили различий в активности фермента у пациентов, у которых течение ИМ осложнилось или не осложнилось ПС. Различия концентраций метопролола и его α-гидрокси метаболита у данных пациентов оказались статистически не значимыми (таб. 2).
Таблица 2.
Средняя активность CYP2D6 и концентрации метопролола и его метаболита у пациентов с осложнениями течения ОИМ и без осложнений (n=115)
| показатель | ЖНР | ПС | ||
| есть | нет | есть | нет | |
| количество пациентов, n | 10 | 105 | 47 | 68 |
| средняя активность CYP2D6 | 2,2±0,8** | 1,7±0,5** | 1,6±0,6 | 1,7±0,5 |
| AUC концентраций метопролола нМ*ч/ мг/кг | 669±595 | 1146±1190 | 1323±1364 | 999±1039 |
| AUC концентраций α-гидрокси метопролола нМ*ч/мг/кг | 799±378 | 1243±901 | 1371±1137 | 1130±714 |
| MR | 0,9±0,8 | 27,7±156 | 20±115 | 34±196 |
Звездочками отмечены статистически значимые различия по критерию t.
** p <0,01
Для того чтобы более достоверно оценить роль генетически повышенной активности CYP2D6 в развитии данных осложнений ОИМ, мы провели дополнительное исследование типа «случай-контроль». По данным электронных резюме историй болезни ретроспективно были выбраны пациенты, госпитализированные по поводу ОИМ, если течение ОИМ у них осложнилось развитием ЖНР (n=31). Из всех пациентов обследование проведено у 11ти. У одного пациента было выявлено удвоение гена CYP2D6, остальные не имели мутаций в гене. Таким образом, группу пациентов с известным генотипом CYP2D6 и осложненным течением ОИМ составили 23 пациента. Пятеро из них были носителями удвоения гена CYP2D6, двое имели генотип CYP2D6*1/*4, и 16 не имели изучаемых мутаций в гене CYP2D6. Средняя активность CYP2D6 в данной группе пациентов составила 2,1, что с высокой статистической значимостью (р=0,0002) отличалось от средней его активности (1,6) в группе пациентов с неосложненным ОИМ (n=175). Частота наличия удвоения гена составила 22% (пять из 23х пациентов) в первой группе, и 2% (четверо из 175 пациентов) во второй, р=0,0002.
Полученные нами в двух вариантах анализа данные не позволяют отрицать связь генотипа CYP2D6, и в особенности удвоения соответствующего гена, с развитием у пациентов ЖНР. Концентрации метопролола, судя по всему, не могут объяснить это явление, поскольку они были значительно ниже тех, которые по данным литературы способны влиять на ЖНР, к тому же осложнения развивались чаще всего в очень ранние сроки, когда терапия метопрололом была только начата, и стабильные концентрации не достигнуты. Однако, в свете актуального сейчас поиска эндогенных субстратов CYP2D6, нельзя исключить и не опосредованную лекарственной терапией роль его активности. Современные исследования предполагают, что CYP2D6 активно участвует в обмене норадреналина и серотонина. В этой связи можно предполагать повышенную активацию САС, или повышенную активацию тромбоцитов при повышении активности фермента, как факторы, предрасполагающие к большей тяжести повреждения миокарда и развития осложнений в раннем периоде ИМ.
Активность CYP2D6, фармакокинетика и фармакодинамика метопролола при добавлении к терапии пароксетина для лечения депрессивных расстройств у пациентов с ОИМ.
Среди обследованных нами пациентов (n=115) депрессивное расстройство (> 9 баллов по шкале депрессии HADS) встречалось в 25 случаях (21,5%). Это соответствует частоте, которую можно ожидать исходя из публикуемых статистических данных. У 17 пациентов, которым был назначен пароксетин для коррекции эмоционального статуса, на 7й день совместной терапии мы наблюдали четырехкратное увеличение среднего значения площади под кривой концентрации метопролола и уменьшение среднего значения площади под кривой концентрации α-гидрокси метопролола (рис. 2). Такая же степень изменений соответствующих параметров наблюдалась и в исследовании Hemeryck et al. (2000) у восьми здоровых волонтеров.
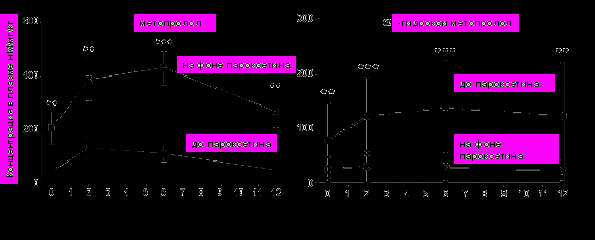
Рисунок 2. Концентрации метопролола в плазме крови (слева) и концентраций -гидрокси метопролола (справа) (нМ/мг/кг) у пациентов исходно и на 8й день терапии пароксетином. Средние ±SD ** p< 0.1; *** p<0.01.
Несмотря на то, что среди обследованных нами пациентов не было гомозиготных носителей мутаций, как не было их у участников упомянутого выше исследования, восемь из семнадцати пациентов были носителями одной мутантной аллели CYP2D6. Исходные концентрации метопролола были в этой группе несколько выше, чем у гомозиготных носителей аллелей «дикого типа», такие же различия наблюдали исследователи (Rau et al., 2002) у пациентов, длительно принимающих метопролол по разным показаниям. Степень изменения концентраций (ингибирования метаболизма) также оказалась несколько различной. Менее выраженные изменения наблюдались в группе носителей мутантной аллели, так что при анализе концентраций метопролола через неделю лечения пароксетином, различий между генотипами уже не наблюдалось (рис. 3). Мы впервые обнаружили зависимость степени ингибирования CYP2D6 от исходного уровня его активности у пациентов с ОИМ. Полученные нами данные находят подтверждение в экспериментальном исследовании Ozdemir et al. (1998).
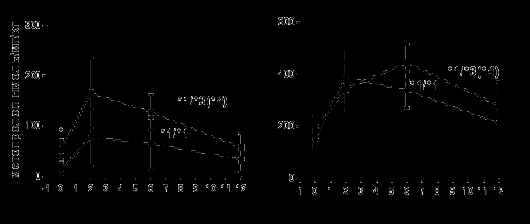
Рисунок 3. Концентрации метопролола в плазме перед началом (слева) и на 8й день (справа) терапии пароксетином.
* p <0,05
Интересно отметить, что через неделю применения пароксетина исчезла корреляция концентраций метопролола с ЧСС. В качестве объяснения можно предложить несколько гипотез. Во-первых, могла быть достигнута максимально возможная степень снижения ЧСС и выход кривой фармакодинамики в фазу плато. Во-вторых, наблюдавшееся нами явление могло быть отражением увеличения чувствительности βАР в ответ на значительное увеличение концентраций метопролола. В третьих, в связи с небольшим числом пациентов в подгруппе, мы могли наблюдать это явление случайно .
Таким образом, мы наблюдали существенное подавление метаболизма и эффектов метопролола при совместном применении с пароксетином в течение недели. Для клинической практики важно ответить на вопрос, насколько значимо это взаимодействие для пациента. Как AUEC, так и средние ЧСС значимо уменьшились на 8й день терапии пароксетином. Двум пациентам потребовалось снижение подобранной ранее дозы метопролола по окончании наблюдения. У одного из них (CYP2D6 *1/*4) - в результате появления резкой гипотензии в ортостазе, у другого (CYP2D6 *1/*3) – в связи с плохо переносимой брадикардией (<45 ударов/мин). Еще у четырех пациентов наблюдалась чрезмерная гипотензия (<100 мм рт ст), наиболее вероятной причиной которой, однако, было влияние сопутствующей терапии (мононитраты, иАПФ), и проявления СН. Других побочных эффектов метопролола или пароксетина выявлено не было. Таким образом, комбинация представляется относительно безопасной, но следует проявлять осторожность в применении пароксетина совместно с метопрололом у пациентов со скомпрометированной проводящей системой сердца, или внесердечными факторами (бронхиальная астма и др.), уязвимыми для усиления β-адреноблокады. Этим пациентам следует проводить коррекцию дозы на 7й день совместной терапии метопрололом и пароксетином. Наши исследования показали, что необходимо дополнительное наблюдение за пациентами при совместном назначении метопролола и пароксетина, особенно при отмене последнего.
Выводы:
- Среди пациентов СПб с ОИМ мутация *3 в гене, кодирующем CYP2D6, встречается с частотой 0,8%, мутация *4 – 17%, *10 – 3%; удвоение гена встречается у 4,6% пациентов, что соответствует их распределению в общей европейской популяции.
- Концентрации метопролола и его α-гидрокси метаболита различны у пациентов с разными генетическими вариантами CYP2D6 во всем интервале дозирования. Площади под кривыми концентраций метопролола (р=0,002) и α-гидрокси метопролола (р<0,0001) в группах пациентов с разными генотипами CYP2D6 значимо различаются независимо от дозы препарата и веса пациентов.
- У пациентов женского пола, пожилого возраста и сниженной ФВЛЖ без мутаций в гене CYP2D6 концентрации метопролола и α-гидрокси метопролола увеличены, что однако не играет значимой клинической роли.
- Степень снижения ЧСС при терапии метопрололом в течение госпитализации зависит от генотипа CYP2D6. Наибольший эффект терапии наблюдался у пациентов с генетически сниженной активностью CYP2D6, а наименьший – с генетически увеличенной его активностью.
- У пациентов с ЖНР II-V класса по Lown в раннем периоде ОИМ средняя активность CYP2D6 значимо выше, чем у прочих пациентов с ОИМ за счет большей встречаемости удвоения гена CYP2D6 (р<0,001), что может указывать на существование взаимосвязи степени активности гена CYP2D6 и проявлениями острой ишемии миокарда при ОИМ.
- Через неделю приема пароксетина у пациентов, получающих метопролол при ОИМ, концентрации метопролола значимо возрастают (р=0,0001), а концентрации α-гидрокси метопролола значимо уменьшаются (р<0,0001), что свидетельствует о подавлении активности CYP2D6. Одновременно происходит увеличение площади под кривой ЧСС (р=0,005) в отсутствие значимых побочных эффектов терапии. У пациентов с мутациями в гене CYP2D6 подавление активности метаболизма происходит в меньшей степени, чем у пациентов с неизмененным генотипом.
Практические рекомендации:
- У пациентов, получающих метопролол для лечения ОИМ, проведение генетического анализа на мутации в гене CYP2D6 позволит оптимизировать режим приема препарата: пациентам со сниженной активностью CYP2D6 может быть рекомендован двукратный прием метопролола в низкой, или однократный – в высокой дозе; пациентам с повышенной активностью фермента может быть рекомендован прием метопролола в формах замедленного высвобождения.
- Генетический анализ на предмет выявления повышенной активности CYP2D6, проводимый всем лицам, имеющим факторы риска ИБС, позволит выявить категорию людей с вероятностью большей степени повреждения миокарда и развития осложнений при возникновении первого ОИМ.
- У пациентов с ОИМ, получающих метопролол, при лечении депрессивных расстройств пароксетином рекомендуется проводить контроль ЧСС и оценивать необходимость коррекции дозы на 7й день совместного применения препаратов.
- При отсутствии патологии, изменяющей чувствительность к βАБ, у пациентов с ОИМ разного пола и возраста коррекция дозы метопролола не требуется
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Горячкина К.А. Некоторые клинические и фармакологические аспекты лечения депрессии в кардиологической медицинской практике [Текст] / К.А. Горячкина, А.Т. Бурбелло, С.А. Болдуева, О.В. Трофимова // Фарминдекс Практик. – 2005. – Вып. 9. – С. 30-34.
- Бабак С.В. Использование ABC/VEN и DDD анализов для оценки качества лечения кардиологических больных [Текст] / С.В. Бабак, А.Т. Бурбелло, К.А. Горячкина // Клинические исследования лекарств: материалы конференции. – М., 2005 – С. 17-18.
- Горячкина К.А. Безопасность применения метопролола и пароксетина у пациентов, перенесших инфаркт миокарда [Текст] / К.А. Горячкина, А.Т. Бурбелло, С.А. Болдуева // Клинические исследования лекарств: материалы конференции. – М., 2005. – С. 55-56.
- Boldueva S.A. Type D personality and distress in Russian acute myocardial infarction patients S.A. Boldueva, O.V. Trofimova, K.A. Goryachkina, Y.S. Lisenko [Текст] // Psychology and Health. – 2006. – Volume 21, supplement 1. – P. 21-22.
- Горячкина К.А. Изучение взаимодействия метопролола и пароксетина при их совместном применении у пациентов, перенесших инфаркт миокарда [Текст] / К.А. Горячкина, А.Т. Бурбелло, С.А. Болдуева // Человек и лекарство: материалы 13 Российского национального Конгресса. – М., 2006. - С. 109-110.
- Трофимова О.В. Влияние пароксетина на депрессивную симптоматику и вариабельность ритма сердца у пациентов после инфаркта миокарда [Текст] / О.В. Трофимова, С.А. Болдуева, А.Т. Бурбелло, К.А. Горячкина // Российский семейный врач. – 2007. – Том.11, вып. 1. – С.30-33.
- Горячкина К.А. Эффективность метопролола у пациентов с инфарктом миокарда – генетические аспекты [Текст] / К.А. Горячкина, А.Т. Бурбелло, С.А. Болдуева, Л. Бертилссон // Вестник СПбГМА им. И.И.Мечникова. – СПб, 2007. – С.25.
- Горячкина К.А. Зависимость дозы и фармакодинамики метопролола от генотипа CYP2D6 у пациентов с ишемической болезнью сердца [Текст] / К.А. Горячкина, А.Т. Бурбелло, С.А. Болдуева, С.В. Бабак [Текст] / Человек и лекарство: материалы 14 Российского национального Конгресса. – М., 2007. – С. 279.
- Бабак С.В. Определение полиморфизма CYP2D6 для снижения риска развития нежелательных эффектов у больных ишемической болезнью сердца [Текст] / С.В. Бабак, А.Т. Бурбелло, К.А. Горячкина, Е.Г. Виленская [Текст] / Человек и лекарство: материалы 14 Российского национального Конгресса. – М., 2007. – С. 52.
- Goryachkina K.A. Influence of CYP2D6 genotype on metoprolol (M) use in patients with acute myocardial infarction (AMI) in St Petersburg, Russia [Текст] / K.A. Goryachkina, A.T. Burbello, S.A. Boldueva, U. Bergman, L. Bertilsson // Basic and clinical pharmacology and toxicology. – 2007. – Volume 101, supplement 1. – Р. 77-78.
- Горячкина К.А. Фармакогенетические аспекты метаболизма метопролола у больных инфарктом миокарда [Текст] // К.А. Горячкина, А.Т. Бурбелло, С.А. Болдуева, С.В. Бабак, Л. Бертилссон // Психофармакология и биологическая наркология. – 2007. – Том 7, специальный выпуск, часть 1. – С. 1665.
- Горячкина К.А. Влияние пароксетина на концентрации и эффекты метопролола у пациентов, перенесших острый инфаркт миокарда [Текст] / К.А. Горячкина, А.Т. Бурбелло, С.А. Болдуева, С.В. Бабак, У. Бергман, Л. Бертилсон // Клинические исследования лекарственных средств: материалы VI международной конференции. – М., 2007. – С. 64-65.
- Горячкина К.А. Зависимое от генотипа CYP2D6 подавление метаболизма метопролола пароксетином у пациентов, перенесших острый инфаркт миокарда [Текст] / К.А. Горячкина, А.Т. Бурбелло, С.А. Болдуева, С.В. Бабак // Ведомости НЦЭСМП. – 2007. – Вып. 14. – С. 51-56.
- Goryachkina K.A. Inhibition of metoprolol metabolism and potentiation of its effects by paroxetine in routinely treated patients with acute myocardial infarction (AMI) [Текст] / K.A. Goryachkina, A.T. Burbello, S.A. Boldueva, S.V. Babak, U. Bergman, L. Bertilsson // European Journal of Clinical Pharmacology. – 2008. – Vol. 64, Issue 3. – P. 275-282.
- Goryachkina K.A. Observational and experimental studies of drug treatment of infection and myocardial infarction/depression in a hospital in St Petersburg [Текст]: theses for licentiate degree / K.A. Goryachkina, L. Bertilsson, U. Bergman, A.T. Burbello, S.A. Boldueva // Stockholm: Karolinska Institutet, 2008. – 58 p.
- Goryachkina K.A. CYP2D6 is a major determinant of metoprolol disposition and effects in hospitalized Russian patients treated for acute myocardial infarction (AMI) / K.A. Goryachkina, A.T. Burbello, S.A. Boldueva, S.V. Babak, U. Bergman, L. Bertilsson // European Journal of Clinical Pharmacology. – 2008: in press.
