Образовательный стандарт высшего профессионального образования Алтгту. Образовательный стандарт
| Вид материала | Образовательный стандарт |
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 498.42kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 370.41kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 475.64kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 478.33kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 228.36kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 368.96kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 272.82kb.
- Образовательный стандарт высшего профессионального образования Алтгту. Образовательный, 591.7kb.
- Образовательный стандарт высшего профессионального образования Алтгту образовательный, 252.98kb.
- Образовательный стандарт высшего профессионального образования Алтгту образовательный, 360.24kb.
Составил:____Холодова Н.Б. Утверждаю
Зав. кафедрой _____________ Маркин В.Б.
« ____ » ___________ 200_ года
1 Содержание дисциплины
В 3 семестре заканчивается изучение дисциплины «Органическая химия». Согласно учебному плану, аудиторная нагрузка в 3 семестре составляет: лекции – 17 часов, практические занятия – 17 часов.
Форма итоговой аттестации – зачет.
В теоретическом курсе будут рассмотрены следующие темы лекций:
Тема 1 Краткий исторический очерк развития органической химии, Теория Бутлерова.
Краткий исторический очерк развития органической химии. Теория Бутлерова. Атомные орбитали, нодальные плоскости. Типы МО, разрыхляющая и связывающая. Гибридизация.
Тема 2. Природа и виды химических связей. Октетная теория Льюиса и Косселя.
Природа и виды химических связей. Октетная теория Льюиса и Косселя. Простые углерод-углеродные связи. Конформации молекулы этана.
Двойные, тройные углерод-углеродные связи, их характеристики: длина, энергия связи. Способы изображения: метод валентных связей, метод МО. Способы изображения: метод валентных связей, метод МО.
Углерод-кислородные, углерод-азотные связи. Координативная связь. Водородная связь.
Тема 3. Сопряжение. Взаимное влияние атомов в молекуле.
Взаимное влияние атомов в молекуле, факторы, влияющие на доступность электронов в связях и отдельных атомах. Сопряжение. Индуктивный и мезомерный эффекты, их сходство и различия. Эффекты, изменяющиеся во времени. Стерические эффекты. Сверхсопряжение или гиперконьюгация.
Тема 4. Типы органических реакций. Гомолиз связи. Гетеролиз связи.
Типы органических реакций. Классификация реакций органических соединений по характеру химических превращений. Классификация в зависимости от характера атакующего реагента и природы связей в реагирующей молекуле. Гетеролиз связи Гомолиз связи. Свободные радикалы, время жизни.
Тема 5. Сила кислот и оснований. Кислоты Льюиса. Кислоты. Определение Аррениуса. Кислоты Льюиса. Константа кислотности. Влияние растворителя на диссоциацию кислот. Сольватация. Факторы, влияющие на кислотность органических соединений. Алифатические спирты, фенолы, незамещенные алифатические кислоты. Замещенные алифатические кислоты. Ароматические карбоновые кислоты. Дикарбоновые кислоты. Основания. Сила оснований. Константа основности, ее связь с константой кислотности. Алифатические основания. Ароматические основания.
Тема 6. Спектральные методы идентификации органических соединений.
Спектральные методы идентификации органических соединений. Применение оптической спектроскопии для установления строения органических соединений. ИК-, УФ- спектроскопия. Спектроскопия в видимой области. ЯМР, ПМР- спектры.
Практические занятия:
1. Номенклатура органических соединений.
Виды номенклатур: тривиальная, рациональная, современная. Правила каждой номенклатуры для составления названий основных классов органических соединений.
2. Предельные углеводороды (алканы).
Гомологический ряд и общая формула алканов. Изомерия и номенклатура алканов и алкинных радикалов. Свободное и заторможенное вращение, конформация. Природные источники предельных углеводородов. Способы генерирования (образования) алкинных групп: восстановление ненасыщенных связей взаимодействием алкилгалогенидов со щелочными металлами, декарбоксилирование, гидролиз магниорганических соединений. Химические свойства предельных углеводородов и алкильных групп. Радикальные реакции: галогенирование, нитрование по Кановалову, сульфирование, окисление. Механизм радикальной реакции на примере галогенирования. Влияние строения алканов на скорость реакций замещения. Их превращения при высоких температурах. Примеры применения алканов в качестве растворителей в производстве полимеров для композиционных материалов (КМ). Алканы - аналоги поведения насыщенных полимеров (полиэтилен, полипропилен) или различных алкилзамещенных гетероцепных полимеров для производства КМ.
3. Ненасыщенные углеводороды (алкены, алкины).
Гомологический ряд и общая формула алкенов. Структурная и геометрическая (цис-, транс-) изомерия. Номенклатура алкенов. Методы генерирования двойной связи: дигидрогалогенирование дигалогенпроизводных, дигидратацией спиртов (правило Зайцева), гидрирование алкинов. Способы получения: из моно- и дигалогеннопроизводных, из спиртов (правило Зайцева), из алкинов, дегидрирование алканов. Химические свойства. Каталитическое гидрирование, механизм реакции электрофильного присоединения и их механизм. Понятие о π-комплексе и карбокатионе. Правило Марковникова, электронная интерпретация этого правила. Радикальное присоединение бромистого водорода. Полимеризация алкенов и диенов и их функциональных производных. Способы образования тройной связи: дигидрогалогенирование дигалогенпроизводных, дигидрирование двойной связи.
Химические свойства алкинов: электрофильное присоединение водорода, галогенов, галогеноводородов. Нуклеофильное присоединение воды (реакция Кучерова), синильной кислоты, спиртов, карбоновых кислот. Реакции замещения метилового водорода.
4. Ароматические углеводороды ряда бензола и гетероциклы.
Химические свойства ароматических углеводородов. Электорфильное замещения атома водорода в бензольном ядре. Механизм реакции. Ориентирующее влияние заместителей в электрофильных реакциях. Объяснение ориентирующего влияния заместителей с точки зрения распределения электронной плотности в основном состоянии молекулы (с помощью предельных и мезомерной структур) и в реакционном состоянии (сравнение устойчивости промежуточных - комплексов).
2 Литература и учебно-методические материалы
1. Петров А.А., Бальян Х.В., Трощенко А.Т., Органическая химия. 4-е изд.-М.: Высшая школа, 1991 г. – с.592
2. Моррисон Р., Бойд Р., Органическая химия. –М.: Мир, 1974 г. – с.1132
3. Робертс Д., Касерио М., Основы органической химии: в 2-х томах т. – М.:
Мир, 1978 г.
4. Сайкс П., Механизмы реакций в органической химии. –М.: Химия, 1977г. с.126
Учебные пособия и методические указания.
1. Мозуленко Л.М., Севастьянова Т.К., Химические свойства ароматических соединений. Барнаул: Ротопринт АПИ, 1984 г. с.24
2. Люкшова Н.В., Нечаева О.Н., Особенности химических свойств аминов. Барнаул: Ротопринт АПИ, 1984 г. с.31
3. Люкшова Н.В., Нечаева О.Н., Качественный анализ органических соединений. Барнаул: Ротопринт АПИ, 1981 г. с.28
4. Мозуленко Л.М., Севастьянова Т.К., Применение ИК-, УФ- и ПМР-спектроскопии для установления строения органических соединений. Ротопринт АПИ, 1986 г. с.28
-
График контроля
| Тема | Контрольное испытание | Время проведения | Вес в итоговом рейтинге | Примечания |
| 1-3 | Контрольный опрос | 6 неделя | 0,2 | 2 вопроса |
| 4-5 | Контрольная работа | 12 неделя | 0,3 | 2 вопроса |
| Зачет (по темам 1-7) | сессия | 0,5 | 2 вопроса | |
Примечания:
1. Любая контрольная точка, выполненная после срока без уважительной причины, оценивается на 10% ниже. Максимальная оценка в этом случае 90 баллов.
2. «Автоматы» по органической химии не выставляются.
3. К зачету допускаются студенты, имеющие не более двух задолженностей по контрольным точкам. При наличии одной или двух задолженностей студенту на зачете выдаётся дополнительное задание.
4 Шкала оценок и правила вычисления рейтинга
В АлтГТУ принята 100-балльная шкала оценок. Именно эти оценки учитываются при подсчёте рейтингов, назначении стипендии и в других случаях. Традиционная шкала будет использоваться только в зачётных книжках. Соответствие оценок устанавливается следующим образом:
75 баллов и выше – «отлично», 50–74 балла – «хорошо», 25–49 баллов – «удовлетворительно», менее 25 баллов – «неудовлетворительно».
Успеваемость студента оценивается с помощью текущего рейтинга (во время каждой аттестации) и итогового рейтинга (после сессии). Во всех случаях рейтинг вычисляется по формуле:
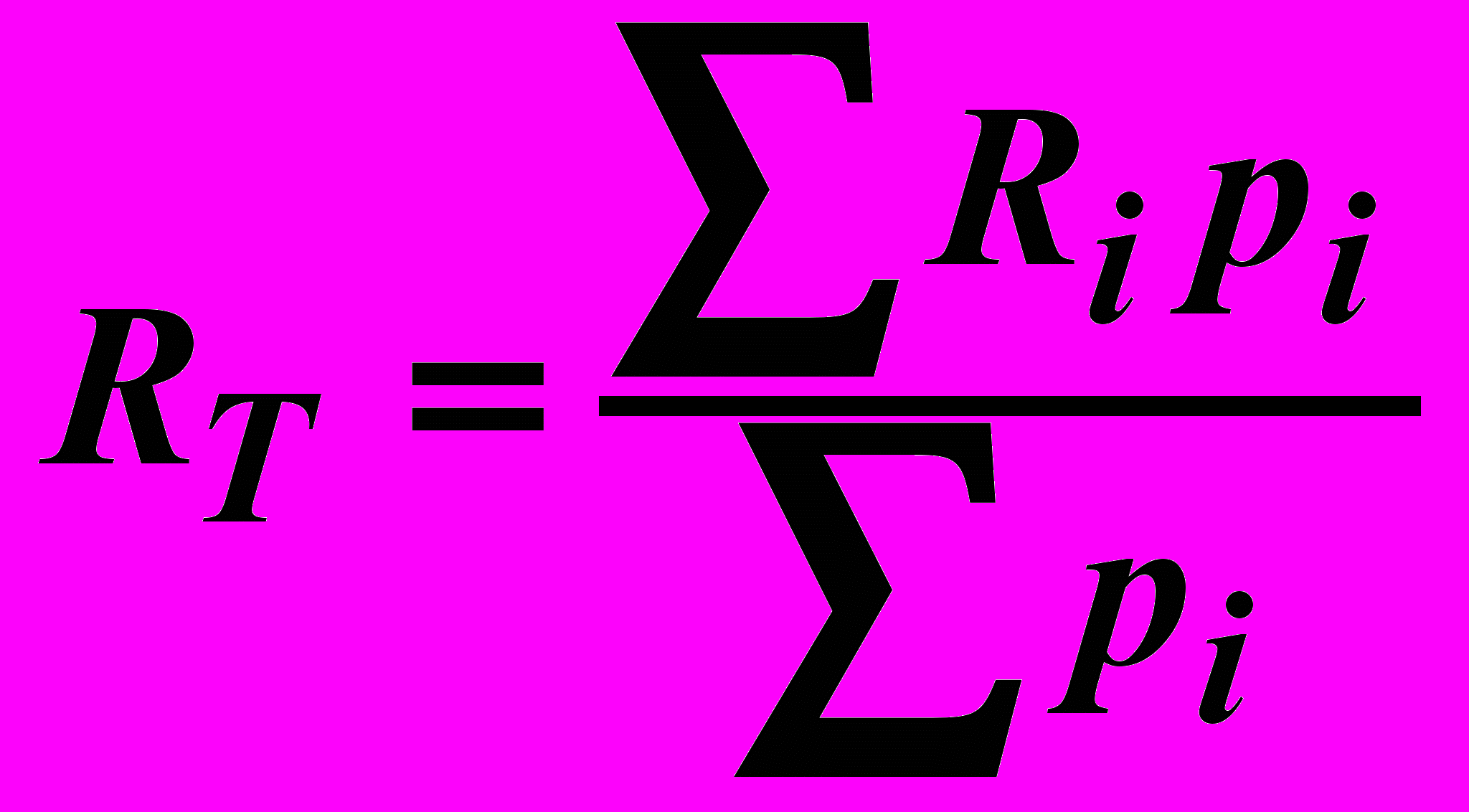 ,
,где Ri – оценка за i-ю контрольную точку, pi – вес этой контрольной точки. Суммирование проводится по всем контрольным точкам с начала семестра до момента вычисления рейтинга.
Пример вычисления текущего рейтинга:
1) студент присутствовал на четырех занятиях из шести, R1=100 баллов*4 лек./6 лек.=66 баллов;
2) получил за контрольный опрос 70 баллов.
Тогда текущий рейтинг на первую аттестацию будет вычисляться:
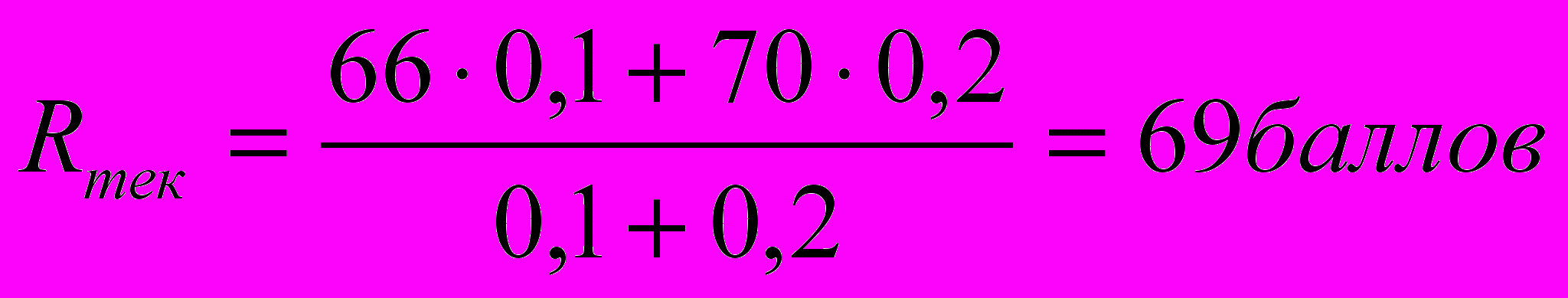
5 Возможности повышения рейтинга
Для студентов с высоким текущим рейтингом по их желанию может быть организовано углубленное изучение предмета, выдано дополнительное задание. В этом случае проводится дополнительный контроль: либо решение задач (контрольная работа, олимпиада), либо защита реферата. После проведения такого контроля (с оценкой R* ), текущий рейтинг пересчитывается:
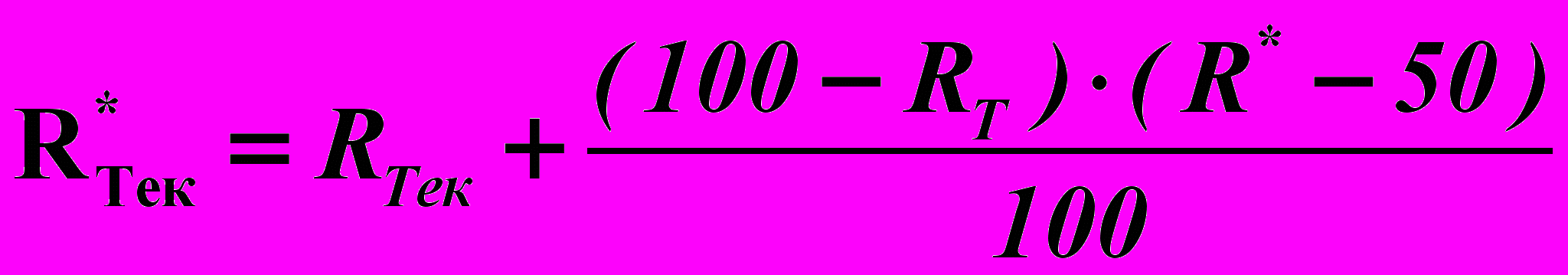 .
.Здесь
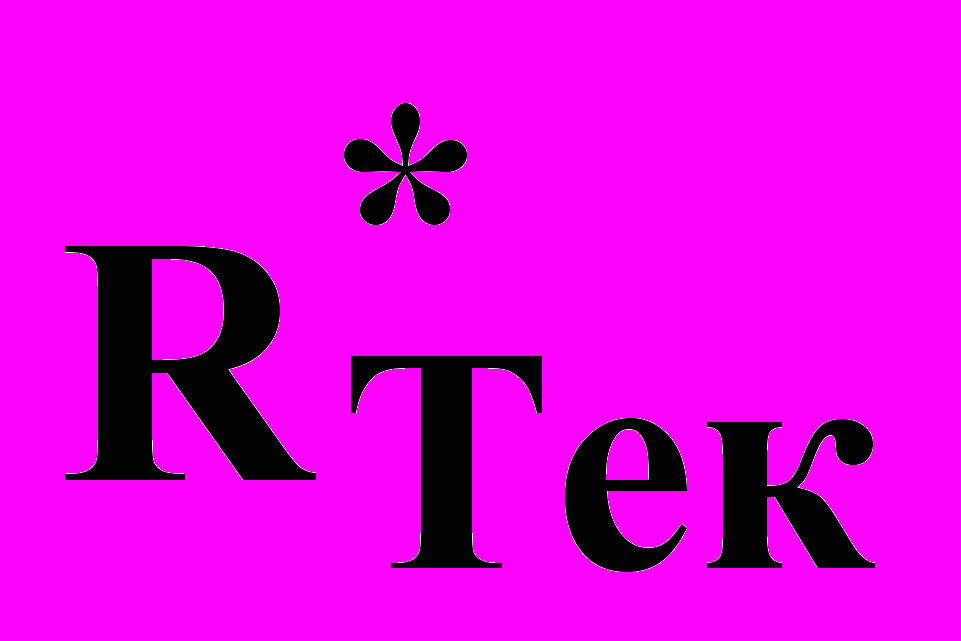 – новое, улучшенное значение рейтинга, RТек – текущий рейтинг по дисциплине, R* > 50 – оценка дополнительного задания. При R*<50 рейтинг не повышается.
– новое, улучшенное значение рейтинга, RТек – текущий рейтинг по дисциплине, R* > 50 – оценка дополнительного задания. При R*<50 рейтинг не повышается.Деканат, учитывая рейтинги студента по каждой дисциплине, вычисляет комплексные рейтинги, вывешивает рейтинг - листы специальности, курса, факультета.
Памятка для студентов групп ПКМ по изучению дисциплины
"Органическая химия" (3 семестр)
Составил: ________ Холодова Н.Б. Утверждаю
Зав. кафедрой ________ Маркин В.Б.
« ____ » ___________ 200_ года
1 Содержание дисциплины
В 3 семестре заканчивается изучение дисциплины «Органическая химия». Согласно учебному плану, аудиторная нагрузка в 3 семестре составляет: лекции – 17 часов, практические занятия – 17 часов.
Форма итоговой аттестации – экзамен.
В теоретическом курсе будут рассмотрены следующие темы:
Тема 7. Получение полимеров. Полимеризация, общее понятие. Цепные реакции. Получение полимеров. Полимеризация. Цепные реакции. Понятие мономера и активного центра.
Понятие "гомополимеризация", "сополимеризация". Основные стадии полимеризации. Влияние заместителя на активность мономера по отношению к свободному радикалу; на относительную скорость полимеризации диенов.
Тема 8. Радикальная полимеризация. Радикальная полимеризация. Кинетика процесса. Устойчивость радикалов, энергия образования.
Бирадикалы. Реакции свободных радикалов.
Способы получения свободных радикалов в полимеризационной среде. Использование инициаторов. Скорость процесса инициирования. Рост цепи. Скорость реакции роста полимерной цепи.
Стадия обрыва цепи. Скорость реакции обрыва цепи. Ингибиторы и замедлители. Реакция передачи цепи. Действие регулятора.
Скорость реакции передачи цепи. Реакция теломеризации. Общая скорость реакции радикальной полимеризации. Степень полимеризации. Влияние различных факторов на цепную радикальную полимеризацию.
Тема 9. Сополимеризация. Сополимеризация. Механизм, стадии процесса. Константы сополимеризации. Уравнение Майо. Использование процесса сополимеризации в производстве полимеров.
Тема 10. Ионная полимеризация. Ионная полимеризация. Особенности процесса, энергия активации.
Катионная полимеризация. Механизм, кинетика, факторы, влияющие на процесс. Анионная полимеризация. Механизм, стадии процесса. Факторы, определяющие анионную полимеризацию. Ступенчатая полимеризация. Механизм, особенности процесса.
Ионно-координационная полимеризация (стереоспецифическая).
Катализаторы Циглера-Натта.
Тема 11. Поликонденсация. Поликонденсация. Общее понятие.
Гомополиконденсация, гетерополиконденсация, сополиконденсация
Линейные и трехмерные полимеры. Стадии процесса поликонденсации.
Равновесная поликонденсация. Механизм процесса, степень полимеризации. Роль стабилизатора. Глубина превращения или конверсия. Неравновесная поликонденсация. Получение линейных термопластов, реактопластов. Преимущества и недостатки межфазной поликонденсации.
Трехмерная поликонденсация.
Тема 12. Химические превращения полимеров. Полимераналогичные превращения, макромолекулярные реакции. Деструкция полимеров. Основные виды деструкции. Стабилизация полимеров.
Тема 13. Отверждение.
Понятие отверждения, методы отверждения (полимеризационный, поликонденсационный и смешанный), типы механизмов, стадии отверждения. Роль отвердителей, инициаторов, катализаторов в процессе отверждения. Преимущества применения эпоксидных смол в качестве связующего. Роль процесса отверждения в формировании лакокрасочных покрытий.
Тема 14. Отдельные представители высокомолекулярных соединений и их применение в промышленности. Полиэтилен, полипропилен и полиизобутилен. Полистирол (поливинилбензол). Поливинилхлорид (полихлорвинил). Поливинилацетат (ПВА). Поливиниловый спирт. Полиметилметакрилат («орг. стекло» или плексиглаз). Эпоксидные полимеры, отверждение. Полиэфирные полимеры. Полиуретаны. Фенолоформальдегидные полимеры (полтметиленоксифенилены). Мочевиноформальдегидные (карбамидные) и меламинформальдегидные полимеры. Кремнийорганические полимеры (полиорганосилоксаны). Фурановые полимеры, полисульфидные каучуки (тиоколы), кумароно-инденовые полимеры, альтины. Полимерцементы, полимербетоны, газонаполненные пластмассы.Стеклопласты. Полимерные пленочные материалы. Клеи.
2 Литература и учебно-методические материалы
1. Петров А.А., Бальян Х.В., Трощенко А.Т., Органическая химия. 4-е изд.-М.: Высшая школа, 1991 г. – с.592
2. Моррисон Р., Бойд Р., Органическая химия. –М.: Мир, 1974 г. – с.1132
3. Робертс Д., Касерио М., Основы органической химии: в 2-х томах т. – М.:
Мир, 1978 г.
4. Сайкс П., Механизмы реакций в органической химии. –М.: Химия, 1977г. с.126
Учебные пособия и методические указания.
1. Мозуленко Л.М., Севастьянова Т.К., Химические свойства ароматических соединений. Барнаул: Ротопринт АПИ, 1984 г. с.24
2. Люкшова Н.В., Нечаева О.Н., Особенности химических свойств аминов. Барнаул: Ротопринт АПИ, 1984 г. с.31
3. Люкшова Н.В., Нечаева О.Н., Качественный анализ органических соединений. Барнаул: Ротопринт АПИ, 1981 г. с.28
4. Мозуленко Л.М., Севастьянова Т.К., Применение ИК-, УФ- и ПМР-спектроскопии для установления строения органических соединений. Ротопринт АПИ, 1986 г. с.28
-
График контроля
| Тема | Контрольное испытание | Время проведения | Вес в итоговом рейтинге | Примечания |
| 7-9 | Контрольный опрос | 6 неделя | 0,2 | 2 вопроса |
| 10-14 | Контрольная работа | 12 неделя | 0,3 | 2 вопроса |
| Экзамен (по темам 1-14) | сессия | 0,5 | 3 вопроса | |
Примечания:
1. Любая контрольная точка, выполненная после срока без уважительной причины, оценивается на 10% ниже. Максимальная оценка в этом случае 90 баллов.
2. «Автоматы» по органической химии не выставляются.
3. К экзамену допускаются студенты, имеющие не более двух задолженностей по контрольным точкам. При наличии одной или двух задолженностей студенту на экзамене выдаётся дополнительное задание.
4 Шкала оценок и правила вычисления рейтинга
В АлтГТУ принята 100-балльная шкала оценок. Именно эти оценки учитываются при подсчёте рейтингов, назначении стипендии и в других случаях. Традиционная шкала будет использоваться только в зачётных книжках. Соответствие оценок устанавливается следующим образом:
75 баллов и выше – «отлично», 50–74 балла – «хорошо», 25–49 баллов – «удовлетворительно», менее 25 баллов – «неудовлетворительно».
Успеваемость студента оценивается с помощью текущего рейтинга (во время каждой аттестации) и итогового рейтинга (после сессии). Во всех случаях рейтинг вычисляется по формуле:
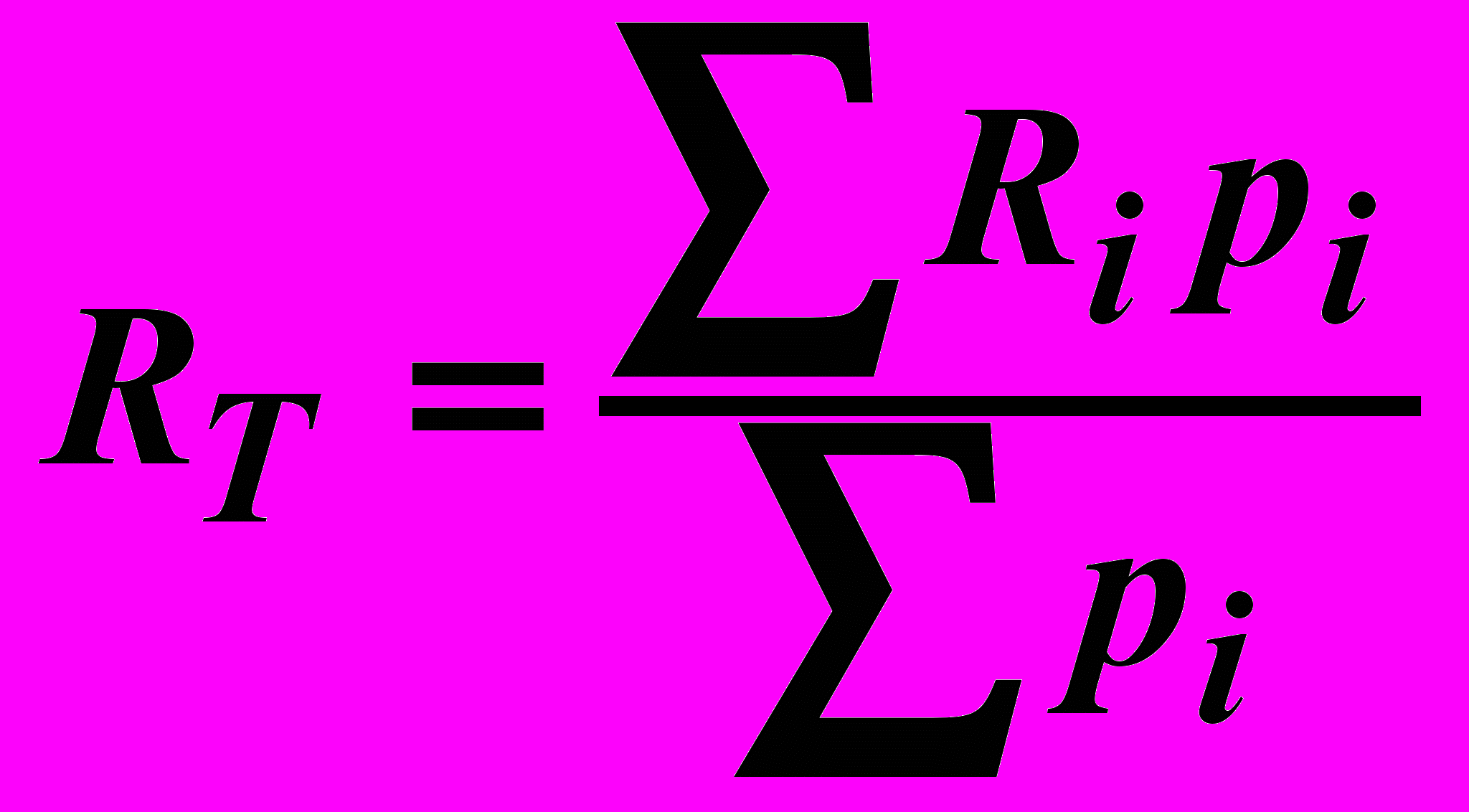 ,
,где Ri – оценка за i-ю контрольную точку, pi – вес этой контрольной точки. Суммирование проводится по всем контрольным точкам с начала семестра до момента вычисления рейтинга.
Пример вычисления текущего рейтинга:
1) студент присутствовал на четырех занятиях из шести, R1=100 баллов*4 лек./6 лек.=66 баллов;
2) получил за контрольный опрос 70 баллов.
Тогда текущий рейтинг на первую аттестацию будет вычисляться:
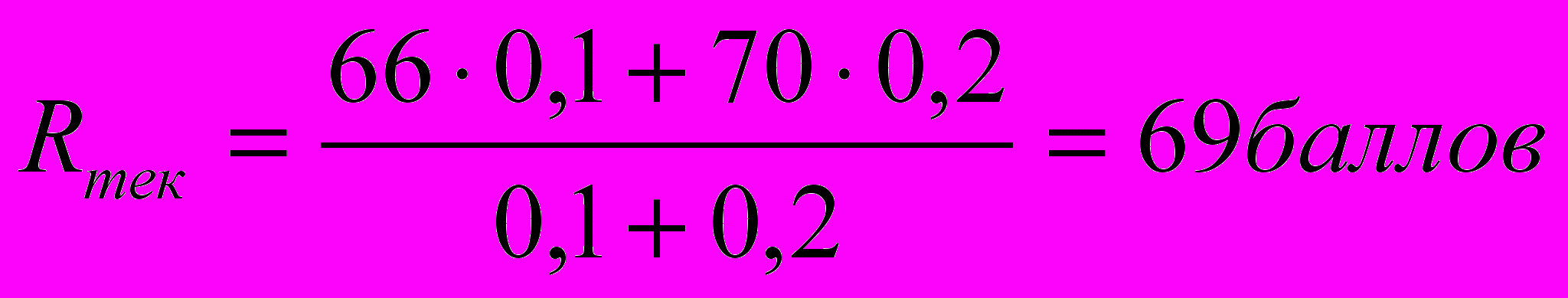
5 Возможности повышения рейтинга
Для студентов с высоким текущим рейтингом по их желанию может быть организовано углубленное изучение предмета, выдано дополнительное задание. В этом случае проводится дополнительный контроль: либо решение задач (контрольная работа, олимпиада), либо защита реферата. После проведения такого контроля (с оценкой R* ), текущий рейтинг пересчитывается:
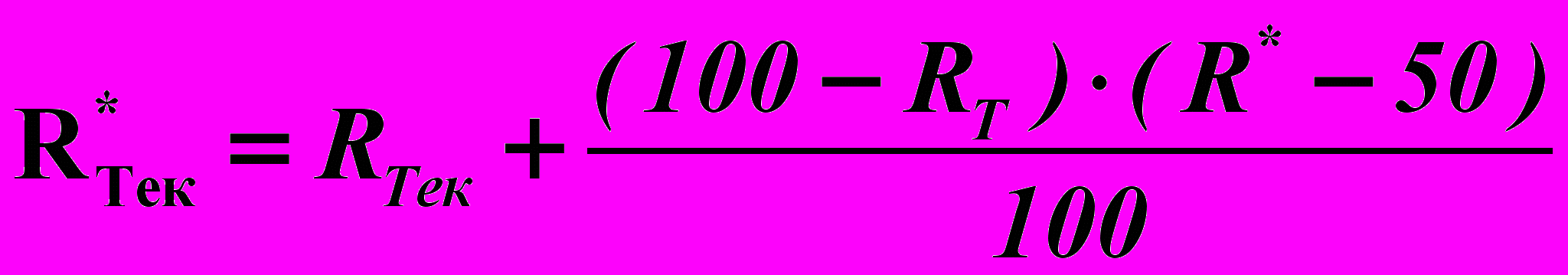 .
.Здесь
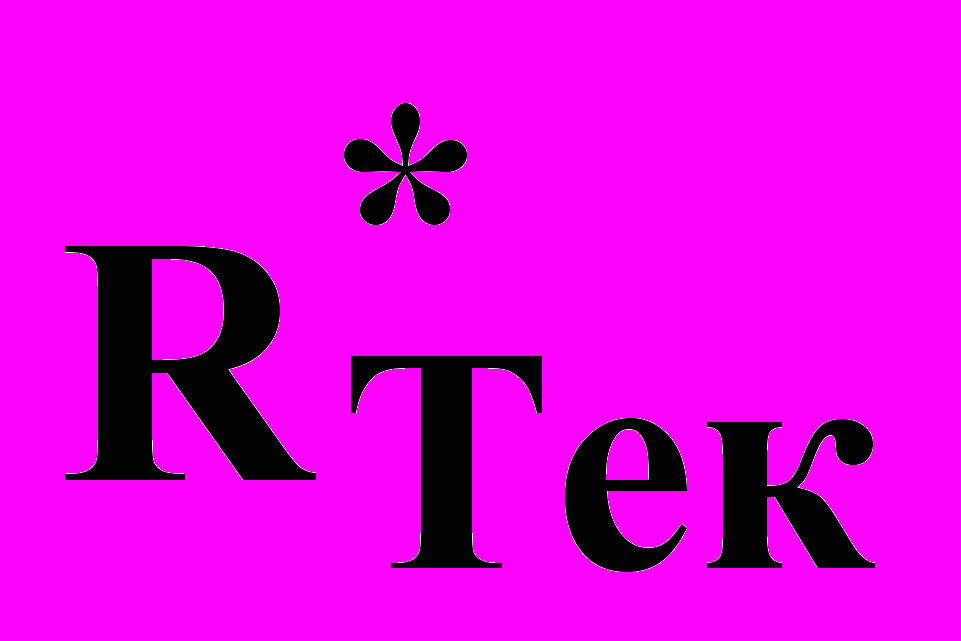 – новое, улучшенное значение рейтинга, RТек – текущий рейтинг по дисциплине, R* > 50 – оценка дополнительного задания. При R*<50 рейтинг не повышается.
– новое, улучшенное значение рейтинга, RТек – текущий рейтинг по дисциплине, R* > 50 – оценка дополнительного задания. При R*<50 рейтинг не повышается.Деканат, учитывая рейтинги студента по каждой дисциплине, вычисляет комплексные рейтинги, вывешивает рейтинг - листы специальности, курса, факультета.
