Эффективность различных терапевтических подходов при атопической бронхиальной астме среднетяжелого и тяжелого течения. 14. 03. 09. Клиническая иммунология, аллергология
| Вид материала | Автореферат |
- Программа Национальной конференции «клиническая иммунология и аллергология практическому, 72.87kb.
- На правах рукописи, 321.97kb.
- Расписание занятий на элективе для студентов 6 курса «Клиническая аллергология», 41.99kb.
- А. А. Баранов 2008 г, 939.73kb.
- Реферат Яблучанский Н. И., Пасько Е. Н., Бондаренко И. А., Н. В. Лысенко, Макиенко, 1673.67kb.
- Антибактериальные антитела при красной волчанке, склеродермии и ревматоидном артрите, 340.91kb.
- Новые биомаркеры среднелетучие метаболиты в конденсате выдыхаемого воздуха при бронхиальной, 412.15kb.
- Образовательный стандарт послевузовской профессиональной подготовки специалистов Специальность:, 1035.98kb.
- Генетические и иммунологические параллели у больных раком легкого и бронхиальной астмой, 396.78kb.
- Сэндвич-метод иммуноферментного определения hbsAg с помощью рн чувствительных сорбируемых, 291.42kb.
На правах рукописи
Фомина Дарья Сергеевна
Эффективность различных терапевтических подходов при атопической бронхиальной астме среднетяжелого и тяжелого течения.
14.03.09. — Клиническая иммунология,
аллергология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва-2010г.
Работа выполнена в ГОУ ДПО Российская медицинская академия последипломного образования
Научный руководитель:
Кандидат медицинских наук, профессор Горячкина Людмила Александровна
Официальные оппоненты:
Доктор медицинских наук, профессор Ильина Наталья Ивановна
Доктор медицинских наук, профессор Астафьева Наталья Григорьевна
Ведущая организация: ГОУ ДПО Казанская государственная медицинская академия.
Защита состоится « 24» ноября 2010г. В 10 часов на Заседании диссертационного совета Д.208.071.04
При ГОУ ДПО Российская медицинская академия последипломного образования
По адресу 123995, г. Москва, Баррикадная ул., д. 2/1
С диссертацией можно ознакомится в библиотеке ГОУ ДПО Российская медицинская академия последипломного образования (125445, г. Москва, ул Беломорская, д.19).
Автореферат разослан « 22 » октября 2010года
Ученый секретарь диссертационного
Совета, доктор медицинских наук Морозова В.Т.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. На протяжении последних лет продолжается неуклонный рост заболеваемости бронхиальной астмой. Особое беспокойство вызывают больные с тяжелыми формами. Независимо от степени тяжести в основе всех проявлений БА лежит хроническое воспаление. Последние два десятилетия мы были свидетелями многих научных достижений, которые расширили наши представления о патогенезе и механизмах развития БА, а также факторов усугубляющих течение заболевания. Целью лечения больных БА согласно отечественным и международным руководствам является достижение и последующее поддержание оптимального клинико-функционального контроля болезни. Одной из основных причин увеличения процента пациентов с неконтролируемым течением БА является неадекватная тяжести и процессам воспаления терапия. (GINA, updated 2009) Безусловно, идеальным исходом терапии БА является полный контроль заболевания, который предполагает не только купирование симптомов болезни, нормализацию функциональных показателей, но и отсутствие признаков воспаления в нижних дыхательных путях. Большинство существующих исследований выбирают конечные исходы избирательно, полагаясь на те или иные критерии контроля, не оценивая их в комплексе, что, конечно, снижает объективность таких подходов к анализу терапии. Помимо этого, нерешенным и актуальным остается вопрос адекватности назначенного лечения процессам воспаления, лежащего в основе болезни, и объективной оценки эффективности фармакотерапии. На современном этапе развивается целое научное направление - биофенотипирование, основанное на выявлении маркерных профилей, которые могли бы служить дополнительными ориентирами для оценки ответа на терапию, что может обеспечить дифференцированный подход к лечению и позволит разработать индивидуальные схемы назначения терапии и комплексно оценить ее эффективность. До сих пор открытым остается вопрос о роли нейтрофильного компонента воспаления в патогенезе атопической БА. По мнению Barnes и соавторов (Barnes P. J.2003), при многофакторном воспалении, которое наблюдается при персистирующем течении БА, особенно тяжелых форм, оправдано назначение комбинированной базисной терапии (ИГКС/ДДБА), по сравнению с увеличением дозы ИГКС в качестве монотерапии, однако некоторыми исследованиями было показана их сопоставимая эффективность.
Исходя из изложенного, представляется актуальным провести комплексный анализ эффективности с позиции возможного достижения контроля и его поддержания на фоне различных режимов лечения при неконтролируемом течении среднетяжелой и тяжелой форм атопической БА, с включением методов оценки воспаления.
Цель исследования. Изучить эффективность различных режимов противовоспалительной фармакотерапии АБА среднетяжелого и тяжелого течения, используя комплексную оценку с включением клинико-функциональных показателей и маркеров воспаления.
Задачи исследования:
Провести сравнительный анализ эффективности различных режимов фармакотерапии по клинико-функциональным показателям, уровню БГР, и опроснику АСТ при АБА тяжелого и среднетяжелого течения
- Охарактеризовать роль маркера воспаления - оксида азота в выдыхаемом воздухе в диагностике АБА и в оценке эффективности проводимой фармакотерапии.
- Проанализировать изменения маркеров воспаления, определяемых в сыворотке крови, у больных с тяжелой и среднетяжелой АБА, а также их информативность в оценке эффективности противовоспалительной терапии.
- Определить диагностическое значение маркера активности нейтрофильного воспаления - нейтрофильной эластазы у больных АБА и возможность его использования при оценке эффективности противовоспалительной фармакотерапии комбинированными препаратами ИГКС/ДДБА.
- Изучить взаимосвязь маркеров воспаления при атопической бронхиальной астме тяжелого и среднетяжелого неконтролируемого течения.
Научная новизна. Показана необходимость комплексного подхода к оценке эффективности различных режимов противовоспалительной терапии АБА, включающая оценку воспаления, в связи с различной продолжительностью терапии, требуемой для купирования отдельных параметров контроля.
Выявлено, что наряду с эозинофильным биотипом, при АБА среднетяжелого и тяжелого течения играет роль нейтрофильный компонент воспалительного процесса, характеризующийся повышением эластазной активности сыворотки крови, что может рассматриваться как один из факторов хронизации процесса и снижения ответа на терапию.
Впервые показано, что изменение уровня активности НЭ сыворотки крови у больных БА может служить дополнительным ориентиром для оценки эффективности проводимой противовоспалительной терапии.
Проиллюстрированы ситуации возможного применения измерения NOex на этапах динамического наблюдения на фоне противовоспалительной терапии ИГКС при АБА.
Показана взаимосвязь субъективной оценки степени контроля БА пациента по АСТ-тесту с объективными параметрами в динамике: клинической оценкой, функциональными показателями и оценкой качества жизни.
Практическая значимость. Доказана одинаковая эффективность и безопасность комбинированных препаратов ИГКС+ ДДβ2А, применяемых двумя различными режимами (стабильного дозирования и SMART) у больных среднетяжелой и тяжелой атопической БА, в отношении достижения клинико-функционального контроля болезни и улучшения качества жизни, но не контроля текущего воспаления.
Комплексное обследование, а также оценка состояния в динамике на фоне противовоспалительной терапии пациентов с тяжелой и среднетяжелой АБА должно дополняться оценкой воспаления, что обеспечит индивидуальный и более объективный подход к лечению , а также поможет избежать ошибок, связанных с преждевременным пересмотром объема и продолжительности терапии, что в последующем позволит достигнуть контролируемого течения у большего процента больных.
Показано, что измерение уровня оксида азота в выдыхаемом воздухе является дополнительным ориентиром для выявления нарушений соблюдения элиминационных мероприятий и нарушений комплайнса, что является залогом успеха фармакотерапии при атопической БА.
Доказана высокая информативность АСТ-теста, коррелирующего с клинической оценкой, функциональными показателями и оценкой качества жизни.
Внедрение в практику. Результаты исследований внедрены в практику работы аллергологического отделения ГКБ №52 и поликлинического консультативного аллергологического центра на базе ГКБ №52 г. Москвы, а также включены в материалы лекций, практических и семинарских занятий на кафедре клинической аллергологии РМАПО.
Личный вклад автора. Автором лично проводился отбор пациентов в исследование с АБА, согласно разработанным им критериям включения/исключения. Всего из 138 обследованных больных с АБА, было включено и завершили исследование 77 пациентов. Разработан дизайн исследования. Автором лично проводилось клиническое, функциональное, специфическое аллергологическое обследование, определение уровня NOex, а также анкетирование всех больных согласно разработанному протоколу процедур исследования. Автором проводился статистический, клинический и научный анализ полученных результатов.
Основные положения, выносимые на защиту
1. Анализ эффективности фармакотерапии атопической бронхиальной астмы среднетяжелого и тяжелого течения должен быть комплексным и включать клинико-функциональные показатели и оценку текущего воспаления нижних дыхательных путей.
2. Вне зависимости от режима терапии назначение ИГКС в комбинации с ДДβ2А является более эффективным для достижения и последующего поддержания клинико-функционального контроля АБА тяжелого и среднетяжелого течения, но не контроля воспаления.
3. При АБА наряду с эозинофильным воспалением выявляется нейтрофильный компонент, характеризующийся повышением активности нейтрофильной эластазы в сыворотке крови у больных с тяжелым и среднетяжелым течением заболевания.
Апробация диссертации. Апробация диссертационной работы проведена на совместной научной конференции кафедры клинической аллергологии ГОУ ДПО РМАПО и сотрудников Городской клинической больницы №52 г. Москвы (25.06.2010).
Основные положения диссертации доложены и обсуждены на научно-практической конференции: Форум РААКИ Санкт-Петербург сентябрь 2010; Национальный конгресс «Человек и лекарство» Москва, апрель 2010; «Современные аспекты диагностики и лечения аллергических заболеваний» Москва. 28 апреля 2010г.; Congress of the European Academy of Allergy Clinical Immunology, London June 2010; Congress of the European Academy of Allergy Clinical Immunology Warsaw.-2009; 7th EAACI-GA2LEN Immunology Winter School Basic Immunology Research in Allergy and Asthma, February 2009 Davos, Switzerland
Работа отмечена 3-мя грантами Европейского общества аллергологов и иммунологов(февраль 2009, июнь 2009, июнь 2010).
Публикации по теме диссертации. По материалам диссертации опубликовано 12 печатных работ, из них 6 работ в изданиях рекомендуемых ВАК РФ; 3 в журнале Allergy Европейского общества аллергологов и иммунологов.
Объем и структура диссертации. Диссертационная работа изложена на 146 страницах машинописного текста, содержит 17 таблиц, иллюстрирована 18 рисунками и состоит из введения, обзора литературы, материалов и методов исследования, результатов собственных исследований, обсуждения результатов, выводов, практических рекомендаций, списка литературы и приложения. Библиографический указатель содержит 218 источников литературы, из которых 50 – в Российской и 168 – в зарубежной печати.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клиническая характеристика больных.
Обследовано 138 пациентов с верифицированным диагнозом бронхиальной астмы. В настоящем простом рандомизированном исследовании проведена оценка эффективности и безопасности двух стратегий назначения комбинированных препаратов ИГКС/ДДБА и ИГКС в монотерапевтическом режиме при тяжелой и среднетяжелой атопической БА, неконтролируемого течения.
Критерии включения в исследование:
- Наличие атопической БА среднетяжелого и тяжелого течения с документированным подтверждением и длительностью не менее 6 месяцев; постоянная терапия ИГКС или ИГКС/ДДБА последние 6 месяцев до включения в исследование.
- Наличие признаков неконтролируемого течения БА. (GINA 2006)
- Мужчины и женщины в возрасте от 18 до 60 лет.
- Отсутствие обострений БА последние 4 недели до включения в исследование и во время недельного вводного периода.
- Информированное согласие на участие в исследовании
Критерии исключения из исследования:
- Атопическая БА легкого течения.
- Тяжелая и среднетяжелая АБА контролируемого течения
- Применение системных ГКС за последний месяц, предшествующий исследованию.
- Курение > 10 пачек/лет
- Обострение любых очагов хронической инфекции в течение 4-х недель, предшествующих исследованию и неделе вводного периода
- Перенесенные ОРВИ за последние 2 недели.
- Беременность или лактация.
- Наличие тяжелых сопутствующих заболеваний способных повлиять на результаты исследования
- Участие в других клинических исследованиях.
- Гиперчувствительность к исследуемым препаратам
- Неатопическая БА
Критериям включения/исключения соответствовали 77 пациентов с АБА среднетяжелого (n=49) и тяжелого (n=28) неконтролируемого течения. Среди включенных в исследование больных, 88.32% (68 больных) наблюдались амбулаторно, 11.68% (9 больных) находились на стационарном лечении по поводу обострения заболевания и были включены в исследование через месяц после выписки из стационара. Продолжительность предшествующей исследованию постоянной базисной терапии составила 3 (0.5÷7) лет. Группы больных, включенных в исследование были сопоставимы по основным характеристикам. Все пациенты, включенные в исследование, имели атопическую форму БА, у абсолютного большинства больных выявлялась полисенсибилизация к неинфекционным аэроаллергенам. Обращает на себя внимание высокий процент больных с аллергией к непатогенным плесневым грибам. Наследственный анамнез по БА и атопии был отягощен у 23(29.87%) и 14 (18.18%) больных соответственно.
План исследования предусматривал период включения в исследование (1неделя), рандомизационный визит, промежуточный визит 2 (через 12 недель) и заключительный контрольный визит 3 (через 24 недели), на котором проводилась заключительная оценка эффективности и безопасности лечения. На время вводного периода все пациенты были переведены на монотерапию ИГКС (беклометазона дипропионат 500 мкг дважды в день + сальбутамол «по требованию»). По окончанию вводного периода пациенты случайным образом были распределены в три лечебные группы в зависимости от режима фармакотерапии:
В 1-ю группу вошли 33 человека, получавшие комбинированную терапию БУД/ФОР в дозе 160/4.5 мкг и использовали один и тот же ингалятор в качестве базисной терапии и для купирования симптомов по методу SMART. Пациенты, страдающие БА средней степени тяжести, получали по 1 ингаляции утром и вечером, при тяжелом течении заболевания - 2 ингаляции БУД/ФОР дважды в день плюс тот же ингалятор по потребности. (режим 1). 2-ю группу составили 31 больной, получавшие ФП/САЛ в режиме стабильного дозирования 250/50мкг и 500/50мкг в сутки по 1 ингаляции дважды в день, соответственно тяжести течения плюс сальбутамол для купирования приступов удушья (режим 2). Пациенты третьей группы продолжали получать БДП в качестве монотерапии, симптомы купировали сальбутамолом. (режим 3)
В 3-ю группу вошли 15 больных, из них 13 больных средней степени тяжести , 2 пациенты с тяжелым течением заболевания были исключены из исследования ввиду отсутствия положительной динамики в состоянии через месяц наблюдения, и не учитывались в общей оценке эффективности режимов.
Отдельно была проанализирована эффективность противовоспалительной терапии у 8-ми пациентов (4 мужчины и 4 женщины), имеющих длительный стаж курения из них с тяжелым течением заболевания 3-е больных, со среднетяжелым течением 5 больных. Длительность БА в группе составила МЕ= 16.5 (7÷26) лет, средний возраст ME=36.50(31÷50.5) лет. Индекс курения у всей подгруппы на момент включения был ‹ 10 пачка\лет (в среднем 6.5±0.5 пачка/лет).
Ниже в таблицах приведены характеристики пациентов по группам.
Табл. 1 Краткая характеристика больных со среднетяжелой и тяжелой АБА, распределенных по 3-м лечебным группам.
| Группы больных | Число больных | Возраст (лет) Me 25%÷75%. | Пол М Ж | Степень тяжести АБА | АР | |||
| Средне-тяжелая | Тяжелая | Да | НЕТ | |||||
| 1 | 33 | 44 [32÷ 52] | 15 | 18 | 23 | 10 | 27 | 6 |
| 2 | 31 | 51 [44÷62] | 11 | 20 | 13 | 18 | 28 | 3 |
| 3 | 13 | 45 [28÷ 53] | 3 | 10 | 13 | 0 | 10 | 3 |
Табл. 2 Краткая характеристика больных со среднетяжелой и тяжелой АБА
| БОЛЬНЫЕ | N | Длительность БА (лет) | Возраст начала БА (лет) | Дебют БА до 18 лет | Дебют БА после 18 лет |
| Включенные в исследование | 77 | 15 (5÷21) | 35(20÷44) | 19 | 58 |
| Режим 1 | 33 | 14 (7÷23) | 30(10÷41) | 12 | 21 |
| Режим 2 | 31 | 10(10÷23) | 36(30÷42) | 5 | 26 |
| Режим 3 | 13 | 5(3÷11) | 40(24÷44) | 2 | 11 |
| Средней степени тяжести | 49 | 7(3÷18) | 36(23÷45) | 9 | 40 |
| С тяжелым течением | 28 | 20(13.5÷25) | 32(10.5÷41) | 10 | 18 |
Методы исследования.
Общеклиническое обследование включало оценку физикального статуса пациента, проведение стандартных лабораторно- инструментальных методов обследования.
- Специфическое аллергологическое обследование включало: аллергологический анамнез; кожные аллергические пробы с неинфекционными аллергенами.
- Оценка клинических симптомов.На протяжении всего периода лечения все пациенты вели дневник самоконтроля, где отмечали выраженность симптомов БА (приступы удушья в течение суток; ночные пробуждения, вызванные симптомами БА; потребность в симптоматических препаратах) и фиксировались измерения утренних и вечерних измерений ПСВ. Контроль ведения дневников осуществлялся на запланированных визитах к врачу. Степень выраженности симптомов оценивали по четырехбальной шкале, учитывая отдельно ночные и дневные симптомы.
Функциональные методы. Для изучения ФВД использовали спирометрию. Исследование проводили на аппарате фирмы «Jaeger» MasterScreenLab. Процедуру проводили согласно протоколу «Стандартизация легочных функциональных тестов» Европейского респираторного общества. Проба на обратимость бронхиальной обструкции выполнялась согласно тем же стандартам и считалась положительной в случае увеличения ОФВ1 более чем на 12%.
Определение ПСВ проводилось стандартными портативными пикфлоуметрами фирмы Clement Clarke Inernational. Вариабельность ПСВ оценивалась путем вычисления простого индекса вариабельности ПСВ, и регистрировалось в дневниках самоконтроля.
Для определения порога неспецифической БГР проводился тест с метахолином (Acetyl-β-methycholine chloride, SIGMA), применяли дозовый метод с помощью компрессорного небулайзера фирмы «Пари». Тест выполнялся в соответствии с рекомендациями Европейского респираторного общества с разными концентрациями раствора метахолина (0,03; 0,06; 0,12; 0,25; 0,5; 1,0; 2,0; 4,0; 8,0 мг/мл). Тест считался положительным при снижении ОФВ1на 20% от базового значения и концентрация раствора метахолина приведшая к такому снижению считался пороговой концентрацией (ПК20). Уровень БГР оценивали по следующим критериям: ПК20 метахолина равная 0,03-0,124мг/мл – высокая степень БГР, 0,125 – 1,99мг/мл – средняя степень БГР, а 2,00 – 7,99мг/мл – легкую степень БГР. ПК20>8,00мг/мл – норма.
4. Определение NOex. Измерения NOex производили с помощью портативного прибора NIOXMINO; AerocrineAB, производства Швеции. Прибор рекомендован к применению Европейским респираторным и Американским торакальным обществами. Прибор функционирует на основании электрохимического анализа выдыхаемого воздуха. Пределы измерения NOex данного прибора колеблется от 5 до 300 ppb, аналитическая и клиническая точность измерений составляет < 3 ppb при уровне NOex< 30 ppb и < 10%, при NOex ≥ 30 ppb. В качестве контрольной группы было обследовано 7 здоровых лиц (4 мужчин и 3 женщины). Уровень NO у них составил Ме=10; 5÷17 pрb. Для демонстрации клинической значимости определения данного маркера именно при атопической БА, также в качестве группы сравнения было обследовано 9 пациентов с неатопической формой БА, неконтролируемого течения (2 мужчины и 7 женщин), некурящих, уровень NO у них составил ME= 8 (5÷9) ppb.
5. Лабораторные методы. Уровень общего IgE в сыворотке крови определяли иммуноферментным методом с помощью диагностических наборов «IgE общий–ИФА–БЕСТ», производства компании Вектор-Бест в соответствии с инструкцией производителя. Нормальные показатели общего IgE в сыворотке крови у взрослых, по данным лаборатории, составляют от 15 до 140 МЕ/мл. Определение уровня IL-5 в сыворотке крови проводилось методом твердофазного иммуноферментного анализа с использованием наборов реактивов (Invitrogen, США). Анализ был проведен в парных сыворотках. Все процедуры по определению и звыделению сыворотки были проведены согласно рекомендациям и ограничениям производителя. В качестве контрольной группы уровень IL-5 определялся у 9 здоровых доноров МЕ=2.8(2.00÷3.2) пг/мл. Анализы производили в клинико-диагностической лаборатории ГКБ №52 г. Москвы. (руководитель Синявкин Д.О.). Определение содержания ECP в сыворотке крови проводили иммунохемилюминесцентным методом на приборе «UniCAP 100» (Phadia, Швеция) с применением реагентов для определения ECP в сыворотке крови, согласно инструкции производителя. Содержание ЕСР в сыворотке крови здоровых лиц, по данным лаборатории Фидес Лаб (руководитель д.б.н. Малышев В.С.), где проводилось исследование, составляет до 15 мкг/л. В качестве контрольной группы по данному показателю было обследовано 9 пациентов в возрасте от 19 до 31 лет с АБА интермиттирующего течения, получающие только Кдβ2А в режиме «по требованию», уровень ЕСР в данной группе составил МЕ=2.91(2.11÷3.33) мкг\л. Под руководством профессора, д.б.н. Яровой Г.А на базе лаборатории кафедры биохимии, РМАПО проводилось определение активности НЭ в плазме крови. В основе метода лежит способность биологических жидкостей расщеплять специфический субстрат BOC-Ala-ONp(N-тетр-бутокси-карбонил-аланин-нитрофениловый). Для работы используют двулучевой спектрометр с термостатированным кюветодержателем любого типа. Нормальный уровень активности НЭ у здоровых доноров составляет 200±34 мЕ\мл. В качестве контрольной группы по данному показателю было обследовано 9 пациентов в возрасте от 19 до 31 лет с АБА интермиттирующего течения, получающие только Кдβ2А в режиме «по требованию», уровень НЭ в сыворотке крови составил МЕ=347.7(327.17÷420.17)мЕ\мл. Определение активности α1-АТ в сыворотке крови выполнялось по унифицированному методу В.Ф. Нартиковой и Т.С. Пасхиной. Метод основан на определении активности присутствующего в плазме крови функционально свободного ингибитора, по его свойству подавлять активность трипсина. Для определения используется спектрофотометр любого типа.
6. Оценка контроля бронхиальной астмы и качества жизни.
Вопросник "АСТ" (Asthma Control Test) - тест по контролю БА. Тест состоит из 5 вопросов, ответы на которые представлены в виде пятибалльной оценочной шкалы. Результатом теста является сумма ответов в баллах. Оценка 25 баллов соответствует полному контролю, оценка в интервале 20-24 баллов соответствует хорошему контролю, сумма менее 20 баллов свидетельствует о неконтролируемом течении заболевания.
Изучение качества жизни у больных БА проводилось с помощью вопросника AQLQ («Asthma Quality of Life Questionnaire»). Вопросник заполнялся больными самостоятельно до проведения назначенного лечения, на промежуточном визите и после окончания курса лечения.
- Оценка безопасности терапии
Безопасность терапии определялась по выявлению нежелательных побочных явлений с помощью опроса пациентов на контрольных визитах, а также для исключения системных нежелательных эффектов по контролю уровня утреннего кортизола исходно и через 6 месяцев лечебного периода. Количественное определение концентрации кортизола в сыворотке крови проводилось методом твердофазного иммуноферментного анализа с использованием набора реагентов «Кортизол-ИФА-БЕСТ».
8.Методы статистической обработки. Данные обрабатывали с помощью компьютерной программы Statistica 6.0., производства StatSoft-Russia. В работе использовались непараметрические методы. Качественные переменные описывали абсолютными и относительными частотами, для количественных переменных определяли среднее арифметическое, стандартное отклонение (CO), медиану (Ме) и интерквартильный интервал (IQR, 25%÷75%). Сравнение средних в связанных группах проводились с помощью критерия Вилкоксона и Манна-Уитни. Анализ связей между группами проводили с помощью ранговой корреляции по Спирмену. Различия в группах считались значимыми при p≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Первым шагом была оценка эффективности терапевтических режимов по выраженности клинических симптомов, соответственно дневникам самоконтроля пациентов. Данные представлены в таблице 3. В процессе лечения можно отметить быструю положительную динамику ночных симптомов. Исключение составил третий режим, при котором значимые изменения произошли только к третьему визиту. Та же тенденция прослеживалась и на примере дневных симптомов, однако, при монотерапии БДП купировать их за шестимесячный период терапии не удалось. На фоне первого и второго режима достоверное улучшение исследуемых показателей отмечено уже через двенадцать недель лечения. В последующем показатели сохранялись без существенных изменений. При анализе динамики показателей, а соответственно, клинической эффективности получаемой терапии статистически значимых различий в подгруппах, получавших комбинированную терапию, не зафиксировано. Снижение бальной оценки ночных и дневных симптомов сопровождалось снижением потребности в симптоматической терапии по сравнению с исходными данными при лечении комбинированными препаратами. Наличие более поздней динамики клинических симптомов на фоне монотерапии, по сравнению с комбинированными препаратами, может быть обусловлено не только не купирующимся воспалением, но и «маскирующим» действием ß2-агонистов длительного действия, входящих в состав комбинированных препаратов.
Было выявлено наличие прямой зависимости индекса ночных и дневных симптомов и потребности в симптоматической терапии, что прослеживалось на всех контрольных визитах исследования.
Табл. 3 Динамика ночных, дневных симптомов, и потребность в ингаляциях для купирования симптомов бронхиальной астмы.
| Показатель Me(25%÷75%). | БУД/ФОР (1) (n= 33) | ФП/САЛ (2) (n=31) | БДП (3) (n= 13) | |
| Дневные симптомы за 1 неделю | Исходно | 6.5(3÷11) | 7 (5÷14) | 1.5 (0÷5) |
| 12 неделя | 1.5 (1÷9) | 2 (0÷3) | 2 (0÷7) | |
| 24неделя | 1.5 (0÷6) | 1 (0÷5) | 7.5 (7÷8) | |
| Р1-2;Р1-3 | 0.0015; 0.010 | 0.0098; 0.34 | 1.00; 0.47 | |
| Ночные симптомы за 1 неделю | Исходно | 1.5 (0÷6) | 0 (0÷4) | 1 (0÷6) |
| 12 неделя | 0.0 (0÷2) | 0 (0÷1) | 0 (0÷2) | |
| 24 неделя | 0.0 (0÷1.5) | 0 (0÷1) | 0.5 (0÷1) | |
| Р1-2;Р1-3 | 0.017;0.049 | 0.047; 0.048 | 0.61; 0.03 | |
| Потребность в симптоматической терапии за 1 неделю | Исходно | 6 (2÷12) | 10 (4÷14) | 2 (0÷4) |
| 12 неделя | 1 (0÷5) | 1 (0÷4) | 2 (0÷7) | |
| 24 неделя | 1 (0÷3) | 1 (0÷2) | 8 (7÷0) | |
| Р1-2;Р1-3 | 0.019; 0.029 | 0.026; 0.039 | 0.68; 0.47 | |
Р 1-3 по сравнению с исходными данными на 24 неделе
Р 1-2 по сравнению с исходными данными на 12 неделе
Р< 0.05 статистически достоверно
При проведении спирометрии основным показателем выбрали ОФВ1 (% от должного), как наиболее легко воспроизводимого и высокочувствительного параметра в случае БА. У больных со среднетяжелым течением установили, что ОФВ1 статистически значимо повысился на фоне всех режимов фармакотерапии уже ко второму контрольному визиту, однако, по сравнению с исходными данными положительная динамика к концу периода наблюдения сохранилась только у пациентов, получавших терапию комбинированными препаратами. Обращало на себя внимание, что у пациентов, имеющих стаж курения, независимо от степени тяжести БА, была выявлена более медленная положительная динамика показателей спирометрии, по сравнению с больными, которые не курили: исходно ОФВ1(% от должного) составил в данной подгруппе МЕ= 75.5(73÷94), на 12 неделе наблюдения произошло статистически недостоверное повышение показателя до МЕ=84(81÷108), и только к 24 неделе МЕ=91(90÷106), р<0.05. Установлено, что у курящих пациентов ОФВ1 достоверно (p<0.05) повышался только к третьему визиту по сравнению с исходным, тогда как у некурящих пациентов этот показатель достоверно возрастал уже ко 2-у визиту (через 12 недель).
Табл. 4 Динамика изменений спирометрии (ОФВ1) у больных в зависимости от режима фармакотерапии.
| | Исходно (% от должного) | Через 12 недель | Через 24 недели | Р |
| БУД/ФОР (n=33) | 76 (61-82) | 83 (71-104) * | 88 (71-107) * | Р12<0.001 Р13<0.001 Р23=0.58 |
| ФП/САЛ (n=31) | 60 (50-73) | 80 (65-91) * | 71 (63-81) * | Р12<0.001 Р13<0.001 Р23=0.30 |
| БДП (n=13) | 69 (51-79) | 86 (77-87) * | 78 (74-91) | Р12<0.001 Р13=0.15 Р23=0.75 |
Р< 0.05 статистически достоверно (*)
При прицельном анализе с делением групп на подгруппы в зависимости от степени тяжести БА, выявлено, что у больных с исходно тяжелым течением на фоне метода SMART статистически значимый прирост ОФВ1 наблюдался только к третьему контрольному визиту, а при стабильном дозировании ФП/САЛ, ОФВ1 статистически значимо вырос уже ко второму визиту и сохранялся на достигнутом уровне и через 24 недели наблюдения.
Табл. 5 Динамика ОФВ1 на фоне различных режимов терапии комбинированными препаратами при тяжелой АБА.
| | Исходно (% от должного) | Через 12 недель | Через 24 недели | Р |
| БУД/ФОР (n=10) | 68(55-77) | 68(62-83) | 71(70-85) * | Р12<0.34 Р13<0.0076 |
| ФП/САЛ (n=18) | 61(51-73) | 78.5(64-88)* | 71(60-91) * | Р12<0.0059 Р13<0.049 |
Р< 0.05 статистически достоверно (*)
Исследование неспецифической БГР по порогу чувствительности к метахолину в группах больных проводилось у ограниченного числа пациентов (n=39) в силу наличия у них противопоказаний или по этическим причинам. Исследование проводили в 2 этапа: непосредственно перед началом терапии и через 24 месяца от начала лечения. У большинства пациентов 33 (84,62%) из 39 человек, прошедших данное обследование, был изначально выявлен повышенный порог чувствительности бронхов к раствору метахолина, но с разной ее степенью. ( от 0,03до 7,99 мг\мл). У больных на терапии комбинированными препаратами произошло повышение порога БГР к раствору метахолина, но достоверных изменений зафиксировано не было. В группе пациентов, получающих БДП в монотерапии, изменений в БГР не произошло. Необходимо учитывать, что для коррекции такого феномена как БГР, лежащего в основе клинических проявлений БА, по-видимому, необходим более длительный период противовоспалительной терапии при адекватном дозировании. Таким образом, мониторинг БГР позволит избежать ошибок, связанных с преждевременным пересмотром терапии.
С целью уточнения степени гиперреактивности бронхов каждому пациенту был определен индекс вариабельности ПСВ, рассчитанный по данным пикфлоуметрии. Достоверности изменений индекса вариабельности ПСВ также получить не удалось.
Для более объективного анализа эффективности используемых режимов с позиции возможного достижения контроля БА была применена бальная оценка АСТ-теста. На фоне лечения общий балл АСТ статистически значимо вырос вне зависимости от режима терапии уже через 12 недель лечения. Исключение составляли пациенты с тяжелым течением. Исходно, у пациентов с тяжелым течением БА рандомизированных в группу, получающую терапию по методу SMART, бальная оценка АСТ составила 14,5 (10÷17). Ко второму визиту -19,5 (12 ÷22), р =0,11, достоверные изменения произошли только к третьему визиту ( р = 0,0076), и составили 22 (16÷23) балла. Подобная картина отмечалась в группе пациентов с тяжелым течением, получавших терапию ФЛ\САЛ в режиме стабильного дозирования. На первом визите бальная оценка составила 11 (10÷16);ко второму визиту 18 (15÷22), р=0,096. Достоверная положительная динамика (р=0,016) прослеживалась к третьему визиту -20,5 (16-22).
В группе пациентов, получавших лечение в режиме 1, ко второму визиту был достигнут отличный уровень контроля у 4 пациентов (≈12 %); хороший контроль достигли 17 человек (≈54,83%) и отсутствие контроля сохранялось у 12 пациентов(≈34,7%). К третьему визиту данные распределились следующим образом: «отличный» у 5 (≈16 % ); «хороший» - у 18 пациентов(≈58%); отсутствие контроля наблюдалось у 10(≈26 %) пациентов. В группе больных на 2-ом режиме терапии отличный эффект наблюдался у 4 пациентов, что составило ≈12 %(4 человека) из 31-го пациента в группе; хороший - ≈42%, (13человек) и отсутствие контроля имело место в ≈46,2% ( 14 человек) случаев. К третьему визиту у этих пациентов - отличный контроль отмечен у ≈12 % (4 пациента), хороший в ≈48 % ( 15 больных); отсутствие контроля в 40 %.( 12). На третьем режиме ко второму визиту пациенты имели следующие результаты по баллам АСТ: отличный контроль достигнут в 23 %, (3 пациента) хороший в 38,5 % (5 больных) случаев, не достигнут контроль был тоже в 38,5 % (5 больных) случаев. На 24 неделе наблюдения при данном режиме отличный контроль отмечен в 16 %,(2 пациента), хороший ≈43 (6 больных), отсутствие контроля в ≈41 %, (5 больных).
Являясь субъективной оценкой пациентов, результаты АСТ требовали объективизации, в связи с чем, был проведен корреляционный анализ для выявления взаимосвязей с более достоверными показателями контроля. На этапе неконтролируемого течения БА выявлены прямая зависимость между бальной оценкой АСТ и ОФВ1 (R=0,24,p=0,036); отрицательная взаимосвязь с индексом ПСВ, отражающим степень БГР (R=-0,58;p=0,004) , в дальнейшем они были утрачены. Это свидетельствует о том, что улучшение как клинических, так и функциональных параметров происходило в различные временные периоды и говорит о вариабельности затрат времени, необходимого для купирования воспаления и снижения БГР. Корреляции со степенью БГР, определяемой по результатам теста с метахолином выявлено не было, что возможно связано с малой выборкой пациентов, прошедших данное обследование. Существование обратной корреляции изменений АСТ (Δ АСТ) с изменениями в потребности в симптоматической терапии по дневникам пациентов (R=-0.55, p=0.00018),а также изменениями уровня качества жизни по AQLQ (R=0.68p=0.00), сохраняющегося на всех этапах наблюдения в динамике, говорит об информативности и объективности АСТ в случае оценки изменения клинической картины заболевания.
На момент включения в исследование, уровень NOex у больных с АБА неконтролируемого течения по клинико-функциональной оценке, составил 71(36÷92) ррb по сравнению с группой контроля 8(5-9)ррb (р‹ 0,000028 ), что может также указывать на исходно неконтролируемое течение воспаления у исследуемой группы больных, несмотря на предыдущий прием ИГКС терапии. Уровень NOex при неконтролируемом течении АБА также статистически значимо(р>0.05) отличался от показателей больных c НАБА(14(9÷16)ррb. У 8-ми пациентов, имеющих стаж курения, уровень NOех 32(18-42)ppb был ниже уровня некурящих пациентов 36(21-104) ррb, но статистически значимых различий зафиксировано не было (p=0.34), показатели в группе курящих больных с АБА были достоверно выше показателей контрольной группы здоровых(р=0.036). При анализе исходного уровня у пациентов со среднетяжелым 56(24-120)ppb и тяжелым течением 31(16-42)ppb, была выявлена статистически значимая разница между подгруппами (р=0.01), что от части объясняется не только неконтролируемым процессом воспаления, но и большим объемом предыдущей ИГКС терапии у пациентов с тяжелым течением заболевания, к которой маркер NOex высокочувствителен. У пациентов вне зависимости от получаемого режима фармакотерапии, произошло достоверное снижение NOex уже ко второму контрольному визиту.
Табл. 6 Изменение уровня NOex на фоне трех режимов терапии.
| | Исходно (ррb) | Через 12 недель (ррb) | Через 24 недели | Р |
| БУД/ФОР (n=33) | 34(21÷79) | 21(12÷28) * | 24(16÷48) * | Р1-2=0.00034 Р1-3=0.021 |
| ФП/САЛ (n=31) | 35(18.5÷88.5) | 25(19÷49)* | 27.5(18÷49) * | Р1-2=0.037 Р1-3=0.049 |
| Беклометазона дипропионат (n=13) | 64(32÷120) | 24(18÷33) * | 23(17÷41)* | Р1-2=0.02 Р1-3=0.049 |
Р< 0.05 статистически достоверно (*)
Отдельно были проанализированы пациенты с отрицательной динамикой NOex на фоне терапии. Отрицательная динамика данного показателя, наблюдалась у 16 пациентов, примерно в 20% случаев от общего числа, включенных в исследование больных. Отрицательной динамикой уровня NOех считалось его повышение, по сравнению с исходным уровнем, и превышение на финальном контрольном визите уровень 25 ppb, что соответствует нормальному колебанию данного показателя. При анализе возможных причин сохраняющегося, несмотря на ИГКС терапию высокого уровня NOex было отмечено, что у 6 пациентов наблюдалось персистирующее течение аллергичекого ринита, на фоне полисенсибилизации к аэроаллергенам. У пяти пациентов третий контрольный визит проводился в сезон палинации растений, на пыльцу которых у обследованных пациентов была выявлена сенсибилизация, хотя обострения сопутствующего аллергического ринита отмечено не было. При ретроспективной оценке причин отрицательной динамики, также было выявлено несоблюдение элиминационных мероприятий у двух пациентов (домашние животные) при наличии у этих пациентов эпидермальной аллергии. Один пациент нарушал прием препарата. У двух пациентов предположительные причины отрицательной динамики NOex не определены.
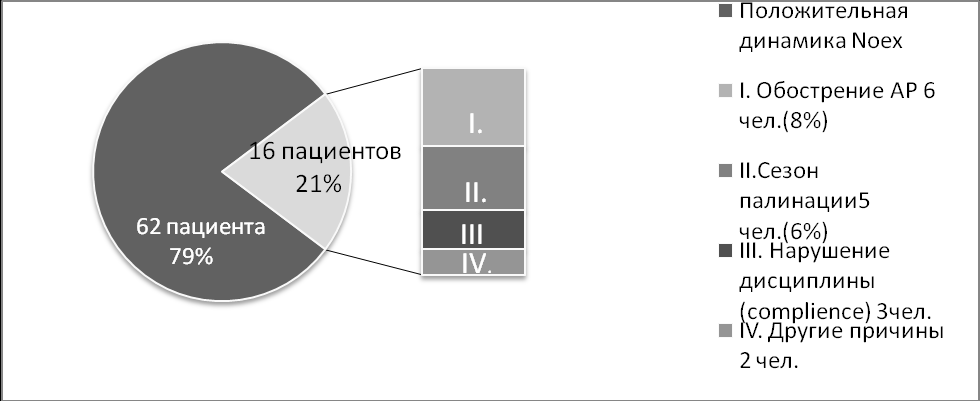
Рис. Изменение уровня NOex на фоне терапии и возможные причины его отрицательной динамики (уровень NOex исходно< уровня NOex после лечения>25ppb).
Таким образом, показано, что необходим комплексный подход в ведении данных больных, включающий, кроме фармакотерапии, самодисциплину пациента и высокую приверженность к лечению.
Изучение сывороточных маркеров воспаления проводилось до начала и после лечебного периода. Статистически значимых изменений на фоне терапии не произошло.
Табл. 7 Исходные показатели маркеров воспаления, ответственных за эозинофильный биотип, в сыворотке крови у больных с АБА тяжелого и среднетяжелого неконтролируемого течения
| | Уровень IL5 (пг/мл) (n=20) | Уровень ЕСР (мкг/мл) | Уровень Общего IgE(MЕ/мл) | |
| Тяжелая АБА | Среднетяжелая АБА | |||
| | 6.1(1.9÷6.5) | 3.15(3.0÷3.9) | 14(4÷26) | 315,17±72.5 |
| Контрольная группа | 2.8(2.0÷3.2) | 2.8(2.0÷3.2) | 2.91(2.11÷3.33) | До 100 MЕ/мл |
| P | р=0.048 * | р=0.11 | р=0.0013 * | Р=0.000 * |
Р< 0.05 статистически достоверно (*)
В подисследование влияния комбинированной ингаляционной ИГКС/ ДДБА терапии на НЭ было включено 25 пациентов. Исходный уровень НЭ у пациентов со среднетяжелым 463.6(391.2÷543.3) мЕ\мл и тяжелым 496.2(420.1÷557.5) мЕ\мл течением БА был значительно выше, чем в контрольной группе больных интермиттирующей БА (347,7 (327,17÷420,17) мЕ\мл и достоверно (р<0.05) превышал границы нормальных значений данного показателя у здоровых доноров (200±34 мE/мл). Значительное снижение активности НЭ произошло только у пациентов, получавших терапию фиксированными комбинациями ИГКС/ДДБА (ФП\САЛ) в режиме стабильного дозирования ( до начала терапии 498,8±163,5 мЕ\мл; через 6 месяцев лечения 379,9±56,9 мЕ\мл, р<0.05). У больных, получавших БУД\ФОР в режиме SMART активность НЭ не изменилась (до 472.6±119.8 мЕ\мл; через 6 месяцев лечения 462,3±151,4 мЕ\мл), и даже имела некоторую тенденцию к повышению.
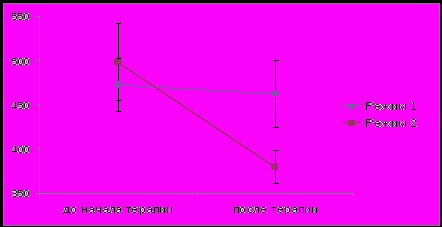
мЕ/мл
Рис 1. Изменение уровня активности НЭ ( мЕ/мл) у больных АБА на фоне применения разных режимов фармакотерапии фиксированными комбинациями ИГКС/ДДБА.
У всех, включенных в исследование пациентов, не было выявлено недостаточности α1-АТ, средний уровень активности составил 38.9(43.7÷ 31.4) ИЕ\мл.
Отдельно оценивалось влияние проводимой терапии на уровень НЭ у курящих пациентов. Исходный уровень НЭ в группе курящих составил 456,35(376.7÷543.3) мЕ\мл и достоверно не отличался от уровня НЭ у некурящих пациентов 474.5(398.4÷557.5) мЕ\мл. Уровень активности НЭ статистически значимо ( p<0.05) снизился только в группе некурящих пациентов, хотя и не достиг значений контрольной группы больных. В группе курящих больных активность НЭ имела даже некоторую тенденцию к повышению, что отражает особенности ответа на терапию ИГКС у курящих пациентов.
При тяжелой БА неконтролируемого течении был выявлен ряд взаимосвязей между такими иммунологическими показателями как уровень NOex и Il5 (R=0.83, p=0.03), NOex и ECP (R=0.88, p=0.0016), NOex и НЭ( R= -0.47;p=0.03). При среднетяжелой БА достоверных корреляций между исследованными маркерами воспаления получено не было. Ни один из маркеров воспаления не коррелировал с клинико-функциональными параметрами на этапах динамического наблюдения, что говорит о необходимости их включения как дополнительных ориентиров при оценке состояния пациентов.
Выявлено достоверное улучшение качества жизни пациентов по суммарному индексу AQLQ во всех трех группах уже ко 2-му визиту, статистически значимых изменений во время 2-го триместра не зафиксировано, исключением является режим 1, где сохранялась статистически значимая тенденция к улучшению показателя качества жизни за период со 2 –го к 3-му визиту, однако значимой разницы в общем индексе качества жизни через 24 недели лечебного периода не было.
Достоверных изменений сывороточного уровня утреннего кортизола зафиксировано не было.
За все время исследования нежелательные явления были зарегистрированы у 11 пациентов. Осиплость голоса развивалась у 4 и 6 человек в группах, получавших 2 и 1 режим терапии соответственно. Такое нежелательное явление относилось к легкой степени тяжести и не требовало исключения из исследования. У 1 пациентки, получавшей ФОР/БУД, был выявлен орофарингеальный кандидоз. Таким образом, статистически значимые различия в безопасности режимов отмечены не были. Частота побочных эффектов также статистически значимо не различалась у пациентов, получавших все три режима фармакотерапии.
Выводы:
- Для достижения клинико-функционального контроля тяжелой и среднетяжелой атопической БА более эффективно назначение фиксированных комбинаций ИГКС/ДДБА вне зависимости от режима проводимой терапии, по сравнению с монотерапией ИГКС.
- При тяжелом и среднетяжелом неконтролируемом течении атопической БА в сыворотке крови достоверно (р<0.05) повышены показатели активности эозинофильного и нейтрофильного воспаления:
ЕСР{МЕ=14(4÷26)мкг/мл} и НЭ{МЕ=474.5(398.4÷557.5)мЕ/мл}, которые сравнивались с таковыми у больных с легким течением заболевания ЕСР{МЕ=2.91(2.11÷3.33)мкг/мл},НЭ{МЕ=347.7(327.17÷420.17) мЕ/мл}.
- Назначение комбинации ФП/САЛ в оптимальных дозах в режиме стабильного дозирования при АБА среднетяжелого и тяжелого течения приводит к достоверному (р<0.05) снижению активности нейтрофильной эластазы в сыворотке крови (до начала терапии 498,8±163,5 мЕ\мл; через 6 месяцев лечения 379,9±56,9мЕ\мл). Исключение составляют курящие пациенты, у которых комбинированная терапия вне зависимости от режима терапии приводит к улучшению только клинико-функциональных показателей, но не влияет на сывороточную активность нейтрофильной эластазы.
- Уровень NOex достоверно повышен у пациентов с АБА неконтролируемого течения, по сравнению с уровнем NOex при неатопичекой БА (р<0.05); снижение данного показателя может служить маркером быстрого ответа на ИГКС - терапию вне зависимости от ее клинико-функциональной эффективности, но не является критерием контролируемого течения АБА на фоне терапии, т.к в динамике не было установлено корреляций с клинико-функциональными параметрами контроля заболевания. (p>0.05).
- При тяжелом неконтролируемом течении АБА оправдано мониторирование NOex, так как этот показатель положительно коррелирует со следующими сывороточными маркерами воспаления: ЕСР (R=0.088, p=0.0016), IL-5(R=0.083, р=0.03), и отрицательно с НЭ (R= -0.47; р=0.03); у пациентов со среднетяжелой АБА данные взаимосвязи не обнаруживаются.
- Снижение уровня сывороточных маркеров воспаления (IL5,ЕСР) и степени бронхиальной гипперреактивности при тяжелой и среднетяжелой атопической БА происходит позднее, чем улучшение клинико-функциональных показателей, и должно учитываться при решении вопроса о продолжительности терапии.
- АСТ-тест является простым, объективным инструментом клинико-функциональной оценки контроля БА и эффективности проводимого лечения, что подтверждается корреляциями между изменениями в балльной оценки АСТ и потребностью в симптоматической терапии ( R=-0.55, p=0.00018), оценкой качества жизни по опроснику AQLQ в динамике (R= 0.68, р=0.000), и функциональным показателем ОФВ1 (R=0,24; p=0,036).
Практические рекомендации
При выборе режима противовоспалительной терапии бронхиальной астмы, а также решения вопроса о ее продолжительности, рекомендован дифференцированный подход с учетом степени тяжести и «статуса курения».
Пациентам с БА, получавшим терапию ИГКС в высоких дозах, при достижении контролируемого течения заболевания (согласно комплексной оценки) необходимо снижать дозу ИГКС до минимально возможной с целью минимизировать риск развития побочных системных эффектов.
Для объективной оценки активности воспалительного процесса у больных с атопической БА тяжелого и среднетяжелого течения рекомендовано определение сывороточных маркеров (НЭ, ЕСР); маркером тяжелого течения АБА может служить повышенный уровень IL-5 в сыворотке крови больных.
Для контроля соблюдения элиминационных мероприятий и дисциплины приема противовоспалительной терапии при атопической БА целесообразно мониторирование уровня оксида азота в выдыхаемом воздухе; снижение NOex не является критерием достижения контролируемого течения АБА на фоне фармакотерапии.
При оценке эффективности противовоспалительной терапии АБА определение уровня общего IgE в сыворотке крови не информативно. Предложено использование оценки уровня контроля БА по результатам АСТ-теста, что позволит получить объективную оценку состояния пациента.
Список работ, опубликованных по теме диссертации
- Фомина Д.С. Роль комплексного подхода к оценке воспаления у пациентов с атопической бронхиальной астмой //Российский Аллергологический журнал.– 2010. - № 1. – вып. 1. С. 181,182
- Фомина Д.С. Уровень нейтрофильной эластазы и эозинофильного катионного протеина в сыворотке крови у больных с атопической бронхиальной астмой тяжелого и среднетяжелого течения //XVΙΙ Российский Национальный конгресс «Человек и лекарство» Сборник материалов конгресса. Тезисы докладов. – Москва. – 2010г. – 12-16 апреля. – С. 286.
- Горячкина Л.А., Ненашева Н.М., Фомина Д.C. Значение определения оксида азота в выдыхаемом воздухе у пациентов с атопической бронхиальной астмой // Российский иммунологический журнал. – 2008. - № 2. - Том 2(11). – С. 227.
- Горячкина Л.А.,Ненашева Н.М.,Тотикова М.Ч., Фомина Д.С. Диагностическое значение определения оксида азота в выдыхаемом воздухе при длительной ремиссии бронхиальной астмы//Российский аллергологический журнал. – 2 009г. - № 3. – вып. 1. – С. 77-78.
- Фомина Д.С.,Ненашева Н.М., Горячкина Л.А., Нешкова Е.А. Активность нейтрофильной эластазы сыворотки крови у больных атопической бронхиальной астмой// Пульмонология – 2010. - № 2. – С. 82-86
- Ненашева Н.М., Фомина Д.С., Буриев Б.Б. Оксид азота в выдыхаемом воздухе, как маркер бронхиальной астмы// Российский аллергологический журнал. – 2010. – №2. – С. 32-36.
- Фомина Д.С. Современные маркеры воспаления при бронхиальной астме// Сборник материалов научно-практической конференции: «Современные аспекты диагностики и лечения аллергических заболеваний» Москва. – 2010г. – 28 апреля. – С. 82-88.
- Горячкина Л.А., Фомина Д.С. Влияние ингаляционных глюкокортикосте-роидов в высоких дозах при бронхиальнй астме на уровень кортизола в сывортке крови.// XIX Национальный Конгресс по болезням органов дыхания. Сборник трудов конгресса. – Москва. – 2009г. – 10-13 ноября. – С. 36
- Fomina D., Goryachkina L., Nenasheva N., Neshkova E. Моnitoring of serum activity of neutrophilic elastase in patients with moderate and severe atopic bronchial asthma// Allergy.- Volume 65 (Suppl.92) XXIX Congress of the European Academy of Allergy Clinical Immunology Abstract Book.- London.-2010- 5-9 June.-p.150.- abstr.362
- Totikova, M; Goryachkina. L; Nenasheva.N, FominaD. Low-dose allergen challenge and its possible diagnostic role in patients with bronchial asthma in long-term remission// Allergy.- Volume 64 (Suppl.90) XXVIII Congress of the European Academy of Allergy Clinical Immunology.- Warsaw.-2009- 6-10 June.-p.114.- abstr.251
- Fomina D. Goryachkina L., Nenasheva N., Totikova M. The bronchial allergen challenge in combination with exhaled NO measurements can be used as an additional helpful tool for monitoring airway inflammation in patients with stable mild bronchial asthma// Allergy.- Volume 64 (Suppl.90) XXVIII Congress of the European Academy of Allergy Clinical Immunology Abstract Book.- Warsaw.-2009- 6-10 June.-p.302.- abstr.771
- Горячкина Л.А., Ненашева Н.М., Фомина Д.С. Результаты кожного теста с аутосывороткой у пациентов с бронхиальной астмой// Российский аллергологический журнал. – 2008. – №1(приложение). – С.68-69
Список сокращений:
- АСТ – тест по контролю астмы
- AQLQ- опросник по качеству жизни
- БА – бронхиальная астма
- AБА- атопическая бронхиальная астма
- БГР – бронхиальная гиперреактивность
- БДП- Беклометазона дипропионат
- БПТ – бронхопровокационный тест
- БУД/ФОР- комбинация будесонида с формотеролом
- ДДБА – длительно действующие β2 агонисты
- ИГКС – ингаляционные глюкокортикостероиды
- КДБА – короткодействующие β2 агонист
- НАБА- неатопическая бронхиальная астма
- ОФВ1 – объем форсированного выдоха за 1 секунду
- НЭ- нейтрофильная эластаза
- ПСВ – пиковая скорость выдоха
- ФВД- функция внешнего дыхания
- ФП/САЛ- комбинация флутиказона и сальматерола
- ЕСР- эозинофильный катионный протеин
- NOex – оксид азота в выдыхаемом воздухе
- IgE – иммуноглобулин E
- IL-5- интерлейкин 5
- Ppb – (part per billion) единица измерения концентрации газа в воздухе, отражающая число частиц газа на биллион частиц воздуха
- α1-АТ- альфа1-антитрипсин
