Патогенетические механизмы формирования наружного генитального эндометриоза и его стадий у пациенток репродуктивного возраста 14. 00. 01- акушерство и гинекология
| Вид материала | Автореферат |
- Современные методы лечения маточных кровотечений у пациенток репродуктивного возраста., 314kb.
- Клинико-морфологическая характеристика изменений эутопического и эктопического эндометрия, 417.6kb.
- Бесплодие у женщин позднего репродуктивного возраста: принципы диагностики и лечения, 587.77kb.
- Особенности клинического течения и диагностики урогенитальных инфекций, обусловленнных, 284.85kb.
- Механизмы формирования тромбоопасности при эндоскопических вмешательствах на органах, 460.72kb.
- Особенности репродуктивного здоровья девушек-подростков с ожирением различного генеза, 333.79kb.
- Значение аблации эндометрия в терапии гиперпластических процессов эндометрия пациенток, 411.8kb.
- Громова Алина Валерьевна Состояние репродуктивного здоровья девушек-подростков с вирусными, 354.32kb.
- Примерная программа наименование дисциплины «акушерство и гинекология» Рекомендуется, 499.66kb.
- Новые направления организации перинатальной помощи в охране и реализации репродуктивного, 838.72kb.
Гистологическое изучение очагов НГЭ показало, что они построены из желез с эпителием пролиферативного типа, цитогенной стромы с новообразованными сосудами капиллярного типа. Усиление процесса неоангиогенеза наблюдалось особенно в эндометриоидных кистах яичников. И главное, установленное нами при НГЭ резкое снижение апоптоза в гетеротопиях, обусловленное высокой продукцией антиапоптотических молекул: ИЛ-8, NO и ФСГ, и усиление ангиогенеза, согласуется с гистологическими результатами. Развитие морфологических изменений при НГЭ происходит за счет сниженного апоптоза и возрастания массы соединительнотканного компонента (фибробластов и внеклеточного матрикса), а также сохранение функциональной активности эпителиальных и стромальных компонентов даже в регрессирующих очагах, трансформированных в кисты.
Таблица 4.
Показатели регуляторов клеточного метаболизма у пациенток с НГЭ (перитонеальная жидкость)
| Показатель | Стадии НГЭ | Контроль | Р |
| | НГЭ | | |
| ФСГ (мМЕ/мл) | 4,4 [3,1 – 5,6 ] | 3,0 [1,8 – 4,4] | 0,019615 |
| Тестостерон (нмоль/л) | 2,65 [1,69 – 3,95] | 4,80 [2,5 – 7,22] | 0,030166 |
| ИЛ-8 (пг/мл) | 16,8 [11,8 – 55,7] | 8,3 [4,5 – 18,8] | 0,04064 |
| СЭФР-А-R (нг/мл) | 9,22 [0,508 – 12,8] | 1,15 [0,42 – 4,54] | 0,000406 |
| sFASL (нг/мл) | 0,196 [0,128 – 0,32] | 0,162 [0,087 – 0,214] | 0,041136 |
| NOx (мкмоль/л) | 38,8 [ 28,6 – 49,6] | 24,0 [18 - 27,5] | 0,059264 |
| | I-II стадия НГЭ | | |
| ЭФР-R (fмоль/мл) | 0,106 [0,102 – 0,115] | 0,02 [0,017- 0,102 | 0,002616 |
| ИЛ-8 (пг/мл) | 58,6 [19,80 – 67,80] | 8,3 [4,5 – 18,8] | 0,000368 |
| sFASL (нг/мл) | 0,198 [0,172 – 0,780] | 0,162 [0,087 – 0,214] | 0,004596 |
| cVCAM-1 (нг/мл) | 1320,50 [558,6 – 1562,5] | 547,5 [461,21 – 567] | 0,009470 |
| | III-IV стадия НГЭ | | |
| NOx (мкмоль/л) | 31,75 [23,00 – 51,50] | 24,0 [18 - 27,5] | 0,027301 |
| NOS (мкмоль/л) | 40,60 [31,40 – 50,8] | 28,6 [26,4 - 36,7] | 0,026270 |
| СЭФР-А-R (нг/мл) | 11,930 [9,010 – 13,38] | 1,15 [0,42 – 4,54] | 0,000001 |
| | Рецидив НГЭ | | |
| NOx (мкмоль/л) | 42,40 [28,50 – 44,50] | 24 [18 - 27,5] | 0,011992 |
| NOS (мкмоль/л) | 49,60 [33,00 – 60,40] | 28,6 [26,4 - 36,7] | 0,030850 |
| СЭФР-А-R (нг/мл) | 9,34 [1,327 – 11,4] | 1,15 [0,42 – 4,54] | 0,017065 |
| Активин (пг/мл) | 1,585 [1,120 – 2,73] | 0,89 [0,55 – 1,69] | 0,017031 |
| ЛГ (мМЕ/мл) | 1,45 [ 0,14 – 1,9] | 1,78 [1,48 – 3] | 0,034916 |
Примечание: результаты представлены как медиана и межквартильный интервал.
р<0,05 – достоверность различий по сравнению с контрольной группой.
Следует отметить, что в сыворотке крови пациенток с НГЭ столь выраженная степень изменений ангиогенных факторов роста, среди которых отмечен рост показателей комплекса оФРФ, ЭФР и ИФР-1 является, очевидно, следствием патологических процессов в организме женщины, активизирующих и запускающих синтез этих полипептидов (В.А.Бурлев, 2006). Анамнестические данные, приведенные ранее, позволяют считать, что высокий уровень продукции ЭФР, оФРФ и ИФР-1 на системном уровне может быть следствием выявленных заболеваний. Однако, наиболее высокие концентрации в сыворотке крови пациенток были характерны для ЭФР, что позволяет предложить его в качестве неинвазивного маркёра в диагностике НГЭ. Последнее будет способствовать, не только использованию специфических показателей в верификации НГЭ, но и разработке новых препаратов в лечении НГЭ, в частности, применение антиангиогенных средств.
Обобщая результаты соотношений гонадотропных и стероидных гормонов в сыворотке крови женщин с позиций их роли в репродуктивной функции, следует отметить следующее. Особенно значимые изменения молярных соотношений ФСГ, ЛГ, 17-β эстрадиола и прогестерона при НГЭ (рис. 10) подтверждают наличие дисфункции гипоталамо-гипофизарно-яичникового комплекса, что несомненно нарушает функцию яичников, характеризующуюся синдромом неовулирующего фолликула (Л.В.Адамян, В.И.Кулаков, 1998; Л.Н.Кузьмичев и соавт., 2001).
В нарушении гипоталамо-гипофизарной системы существенное значение имеет низкий уровень лептина, в результате чего резко снижается выделение ГнРГ, обусловливающее ослабление фолликулогенеза и раннюю атрези0ю фолликула (Н.Б.Чагай и соавт., 2008). Вышеизложенное позволяет считать, что при НГЭ наблюдается модификация контроля со стороны центральной регуляции продукции половых гормонов, которая лежит в основе нарушения репродуктивной функции у данного контингента больных.
Выявлено сочетанное воздействие модификации факторов роста при НГЭ, заключающееся в нарушении ауто-, интра- и паракринной клеточной регуляции ангиогенеза, степень и характер которой зависит также от стадии заболевания, что подтверждается результатами нашего исследования.
Анализ результатов изученных соединений, достоверное изменение которых установлено у больных при НГЭ I-II стадии по сравнению с данными контрольной группы, показал следующее (рисунок 4). На ранних стадиях развития НГЭ (таблица 3) на системном уровне в противовес высокой продукции ангиогенных факторов оФРФ и ИФР-1, активирующих пролиферативные процессы при ангиогенезе, создающих эндометриоидный потенциал, формируется антиангиогенный «экран» с участием ИЛ-10 и растворимого СЭФР-А-R.
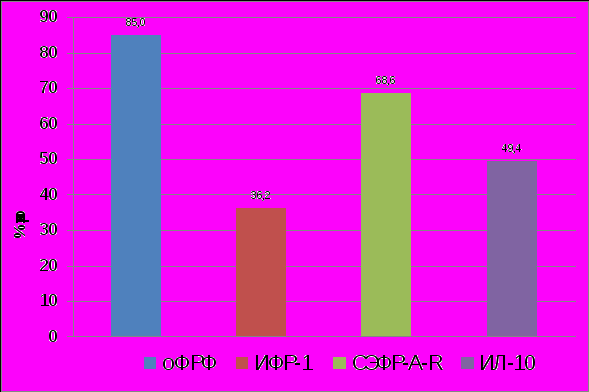 |
| Рисунок 4. Изменение содержания оФРФ, ИФР-1, СЭФР-A-R, ИЛ-10 в сыворотке крови у больных с НГЭ I – II стадии. (р<0,05). |
Можно полагать, что на начальных стадиях НГЭ существует серьезная метаболическая защита (развитие компенсаторных реакций). Прежде всего, ИЛ-10 участвует в снижении миграции делящихся эндотелиальных клеток в сторону гетеротопий (В.А.Бурлев, 2006), а растворимый СЭФР-А-R, связывающий СЭФР-А, предотвращает также чрезмерный рост кровеносных сосудов.
Наиболее значимое изменение при I-II стадии НГЭ оказалось для такого ангиогенного фактора роста как оФРФ (почти двухкратное увеличение содержания в сыворотке крови). Исходя из вышеизложенного, логично предположить возможность использования данного показателя для диагностики I-II стадии заболевания без хирургического вмешательства и контроля проводимого лечения.
На фоне выявленных на системном уровне нарушений и компенсаторных реакций внутри- и межклеточной регуляции метаболических процессов ангиогенеза при I-II стадиях НГЭ, на местном уровне (таблица 4) в развитии данного заболевания существенную роль играют ангиогенный и антиапоптотический фактор - ИЛ-8 и ЭФР-R. Значение молекул адгезии сVCAM1 и sFASL(r=0,4) в перитонеальной жидкости неоднозначно, поскольку они усиливают апоптоз не только клеток эндометриоидных гетеротопий, но и иммунокомпетентных клеток, в результате чего могут наблюдаться изменения в иммунной системе, вследствие этого возможно снижение контроля за эндометриоидными клетками, попадающими в перитонеальную полость (рисунок 5).
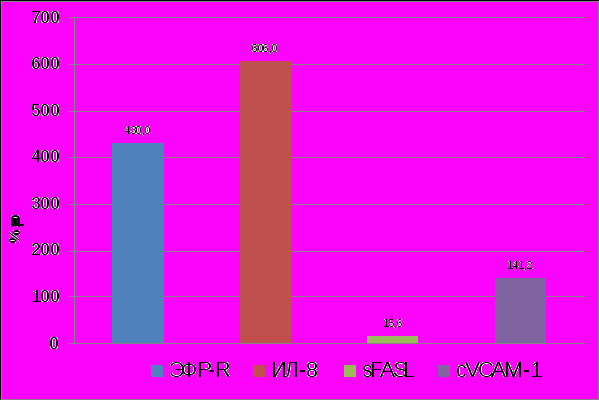 |
| Рисунок 5. Изменение содержания ЭФР-R, ИЛ-8, sFASL, cVCAM-1 в перитонеальной жидкости у больных с НГЭ I –П стадии. (р<0,05). |
При I-II стадии НГЭ (рисунок 10) в перитонеальной жидкости наблюдается снижение молярных соотношений прогестерона и тестостерона к эстрадиолу за счет резкого снижения продукции тестостерона и прогестерона. Корреляционный анализ обнаружил тесную корреляционную связь между 17β-эстрадиолом и тестостероном (r=0,77). В то время как в сыворотке крови (системный уровень) имеет место рост этих коэффицициентов, что свидетельствует о преобладании продукции прогестерона и тестостерона над 17β-эстрадиолом и, по-видимому, носит компенсаторный характер.
Обобщённые результаты, полученные при III-IV стадиях развития НГЭ, позволяют выделить специфические особенности в характере изменений клеточной и межклеточной регуляции при данной стадии заболевания (таблица 3). Прежде всего, в этом периоде наблюдается интенсивная экспрессия ЭФР и падение лептина, роль которых в процессах пролиферации противоположна. Патологическое действие высокого уровня ЭФР при III-IV стадиях НГЭ заключается в усилении ангиогенеза и создании, очевидно, ангиогенного потенциала на системном уровне (рисунок 6). Особенно значимая генерация оксида азота в перитонеальной жидкости несомненно реализуется в повышение синтеза пероксинитрита (ОNOO-), обусловливающего оксидантный стресс, сочетающийся с гипоксией.
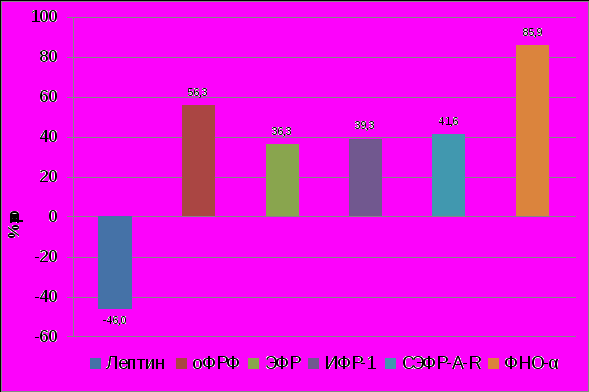 |
| Рисунок 6. Изменение содержания лептина, оФРФ, ЭФР, ИФР-1, СЭФР-A-R, ФНО-α в сыворотке крови у больных с НГЭ III –IV стадии. (р<0,05). |
При III-IV стадиях НГЭ на системном уровне выявленные изменения характеризовались более значимыми показателями, чем при I-II стадиях. На фоне обнаруженного увеличения продукции ангиогенных факторов оФРФ, ИФР-1 и растворимого СЭФР-А-R, а также ИЛ-10 при I-II стадиях НГЭ, при III-IV стадиях отмечено ещё повышение ФНО-α и снижение уровня лептина (рисунок 6). При этом в перитонеальной жидкости сохраняется особенно высокий уровень только СЭФР-А-R, как и при I-II стадиях заболевания, в то же время отмечен рост других ангиогенных факторов – NO и NOS (r=0,93) (рисунок 7). Можно констатировать, что обнаруженные нарушения продукции изученных соединений касаются в основном факторов, обеспечивающих клеточную регуляцию ангиогенеза. Становится очевидным усугубление при III-IV стадии НГЭ дисбаланса ангиогенных и антиангиогенных соединений, обусловливающих вовлечение в механизм развития данного заболевания большего количества ангиогенных факторов.
Что касается содержания прогестерона, тестостерона и эстрадиола в сыворотке крови у больных с III-IV стадиями НГЭ (рисунок 10), то коэффициенты Pr/E2 и Ts/E2 позволяют констатировать снижение молярной концентрации прогестерона в 40 раз, а тестостерона – в 2 раза относительно эстрадиола, в то время как у здоровых пациенток преобладание продукции прогестерона над эстрадиолом достигало стократной величины, а тестостерона – трёхкратной.
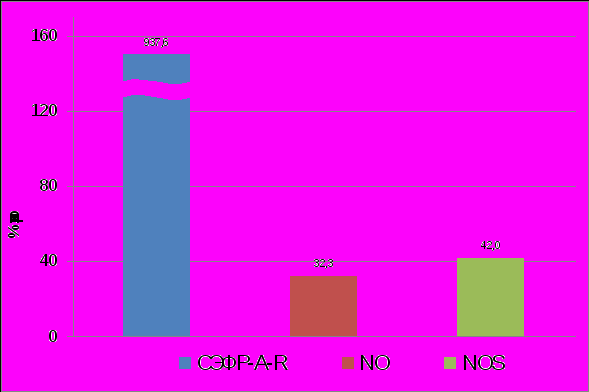 |
| Рисунок 7. Изменение содержания СЭФР-A-R, NO, NOS в перитонеальной жидкости у больных с НГЭ III –IV стадии. (р<0,05). |
В ПЖ по сравнению с эстрадиолом отмечается снижение молярного уровня прогестерона почти в 25 раз, а концентрации тестостерона в 6 раз. При этом у женщин контрольной группы преобладание молярного уровня прогестерона над эстрадиолом достигало 50-кратной величины, а тестостерона – 10-кратной (рисунок 10).
К биохимическим особенностям рецидивирования НГЭ следует отнести не наблюдаемое ни в одной из описанных стадий заболевания, увеличение на системном уровне продукции СЭФР-А (корреляционный анализ показал взаимосвязь СЭФР-А и рецептора СЭФР-А-R – r=0,3). Последнее свидетельствует об усилении дисбаланса ангиогенных и антиангиогенных факторов с преобладанием ангиогенных, приводящих к возобновлению заболевания.
Результаты полученных данных позволяют сделать заключение относительно молекулярных изменений на системном уровне, приводящих к рецидивированию НГЭ (таблица 3). Прежде всего, у всех пациенток, находящихся под наблюдением, выявлен одновременный рост продукции трех ангиогенных факторов у данных больных: ЭФР, СЭФР-А, оФРФ в то время как для ЭФР-R было характерно снижение его содержания. Поскольку ЭФР является стимулятором экспрессии гена СЭФР-А, его высокий уровень, несомненно, усиливает интенсивность продукции СЭФР-А (E.M.Paleolog, 2002) (рисунок 8). Особенность биохимических реакций с участием СЭФР-А при патологии обусловливается его высоким содержанием, которое усиливает пролиферацию эндотелиальных клеток, приводя к чрезмерному росту сосудов (N.Ferrara, 1999; H.M.Blau et al., 2001). Нами обнаружена тесная корреляционная связь между СЭФР-А и рецептором СЭФР-А (r=0,82).
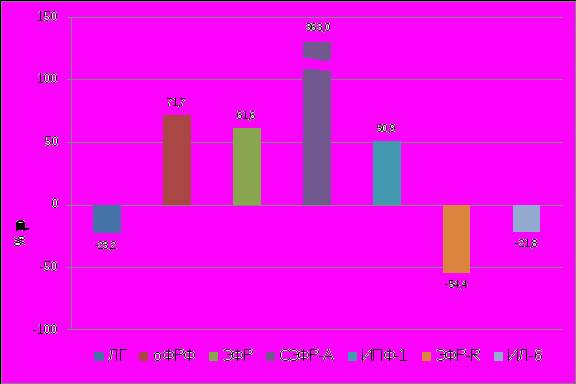 |
| Рисунок 8. Изменение содержания ЛГ, оФРФ, ЭФР, ИФР-1, СЭФР-A, ЭФР-R, ИЛ-6 в сыворотке крови у больных с рецидивом НГЭ. (р<0,05). |
Сопоставительный анализ полученных результатов, касающихся стероидов при рецидивировании НГЭ (рисунок 10), позволил обнаружить следующий характер молярных соотношений прогестерона, тестостерона и эстрадиола, которые свидетельствуют, что содержание прогестерона в сыворотке крови снижено в 3 раза, а тестостерона не изменено относительно эстрадиола в сравнении с контрольными данными. При рецидиве НГЭ в сыворотке крови обнаружен по сравнению с нормой выраженный дисбаланс прогестерона и эстрадиола, обусловленный почти трехкратным снижением содержания прогестерона. В ПЖ, напротив, имело место нарушение молярного соотношения тестостерона и эстрадиола.
Оценивая значение модификации факторов роста следует отметить известную роль ЭФР в процессе пролиферации тканей, которая заключается в том, что данный полипептид контролирует клеточный цикл. ЭФР необходим для выхода клетки из состояния покоя (GO), в результате чрезмерной его генерации у женщин при рецидиве НГЭ эта стадия клеточного цикла будет ускоренной, а, следовательно, и пролиферация. Метаболические особенности свидетельствуют о значительных изменениях ведущих ангиогенных факторов и их роли в рецидивировании НГЭ. На фоне высокой экспрессии ангиогенных факторов выявлено снижение ИЛ-6, одного из белков межклеточного взаимодействия. Он оказывает разнообразное и существенное влияние на многие органы и системы организма (S.C.Zin et al., 1997). Корреляционный анализ обнаружил, что между ИЛ-6 и оФРФ обнаружена определенная связь (r=0,5). Поскольку при рецидиве НГЭ имеет место достоверное снижение ИЛ-6, можно полагать, что в этих условиях на системном уровне первостепенное значение приобретает снижение индукции гипоталамо-гипофизарной системы, в которой данный цитокин участвует.
На местном уровне (ПЖ) выявленные изменения характеризовались высоким содержанием растворимого СЭФР-А-R (в 8 раз выше контроля), значительной продукцией NO и активностью NO-синтазы (рисунок 9). Увеличение в ПЖ растворимого СЭФР-А-R, который способен связывать и нейтрализовывать СЭФР-А (T.Veikkola, K.Alitalo, 1999), подавляя рост новых сосудов, и как следствие, - гетеротопий (R.Kerbel, I.Folkman, 2002), можно отнести к благоприятным факторам. Растворимый рецептор СЭФР-А относят к антиангиогенным маркерам (В.А.Бурлев, 2006; S.Ballara et al., 2001; E.M.Paleolog, 2002;), в связи с чем высокое содержание данного рецептора в ПЖ при рецидивировании НГЭ можно отнести к компенсаторным реакциям, развивающимся в паракринной регуляции ангиогенеза в эндометриоидных гетеротопиях. Это подтверждается менее значимыми образованиями последних, выявляемыми при данной стадии НГЭ во время лапароскопических операций.
Последствия выявленной модификации эндотелиальных факторов обусловливают неконтролируемый рост кровеносных сосудов и образование гетеротопий. Изменения в системе NO-NO-синтаза также обнаружены в данном исследовании в ПЖ при рецидиве НГЭ (таблица 4). При этом увеличенной оказалась генерация такого ангиогенного фактора как оксид азота и активность NO-синтазы (NOS). Высокая активность последней, обусловленная изменением соотношений при НГЭ половых стероидов с преобладанием 17β-эстрадиола, контролирующего NO-синтазу (D.A.Pelligrino et al., 2001), приводит к значительному синтезу оксида азота. Избыток NO сопровождается оксидантным стрессом (Е.М.Васильева, Н.И.Баканов,2005) и известный как антиапоптозный фактор в данных условиях способствует росту гетеротопий (А.Х.Коган и соавт.,2006; Адамян Л.В. и соавт., 2008; М.Dong et al., 2001). Исследованиями В.А.Бурлева и соавт. (2008) и D.Sharkey и соавт. (2000) доказана роль гипоксической стимуляции ангиогенеза при эндометриозе. По нашему мнению, в развитии гипоксии существенную роль может играть обнаруженная нами особенно высокая генерация NO в перитонеальной жидкости. В последнее время доказано, что в случае чрезмерного уровня NO наблюдается его взаимодействие с супероксиданионом (О2-) с образованием пероксинитрита (ОNОО-) (В.В.Зинчук и соавт., 2006), мощного окислителя, приводящего к снижению кислородсвязывающих свойств крови, а, следовательно, к гипоксии, обусловливающей реализацию нарушений клеточного метаболизма при формировании очагов эндометриоза (P.Taylor et al., 2000).
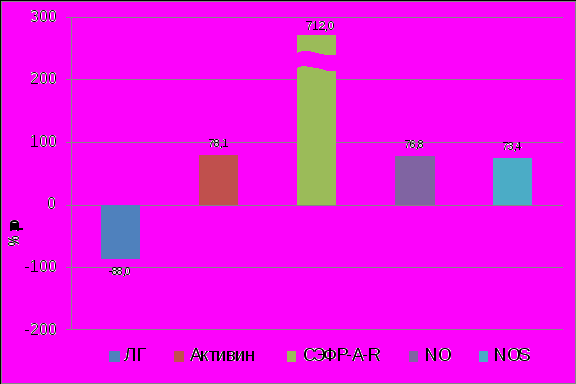 |
| Рисунок 9. Изменение содержания ЛГ, активина, СЭФР-A-R, NO, NOS в перитонеальной жидкости у больных с рецидивом НГЭ. (р<0,05). |
Развитие конкретной стадии НГЭ, в частности рецидивирующей, по-видимому, определяется специфическими клеточно-молекулярными изменениями на системном уровне: высокой продукцией основных ангиогенных факторов роста ЭФР, СЭФР-А, ИФР-1, оФРФ, и снижением его рецептора, а также уменьшением ИЛ-6, обусловливающим модификацию регуляторного влияния на гипоталамо-гипофизарно-яичниковую систему.
Сочетанное воздействие высокого содержания модуляторов роста сосудов на системном уровне создают условия для возникновения своеобразного ангиогенного потенциала и имплантации эутопического эндометрия при ретроградном попадании его в брюшную полость во время менструации. В рецидивировании НГЭ существенное значение приобретает, по нашему мнению, локальная гипоксия, способная стимулировать инициацию развития новых эктопических очагов.
Сравнительная характеристика данных, полученных на системном уровне, у пациенток с рецидивом НГЭ и без такового показало, что достоверные изменения изученных показателей обнаружены в уровне СЭФР-А, который оказался повышенным почти в 5 раз у женщин с рецидивом заболевания при снижении ЭФР-R и ИЛ-6. Отклонения в уровне ЭФР-R и ИЛ-6 выявлены от величин, которые достоверно отличаются от данных здоровых женщин, в то время как нарушений в продукции СЭФР у пациенток без рецидива НГЭ не наблюдалось. Можно полагать, что на системном уровне в данной ситуации выраженная степень роста СЭФР при рецидивировании НГЭ усиливает нарушение аутопаракринной клеточной регуляции ангиогенеза и способствует усилению ангиогенного потенциала, создающего условия для индукции имплантации эутопического эндометрия в брюшной полости (В.А.Бурлев, 2008). При этом, наряду с модифицирующими регуляцию клеточного метаболизма ЭФР, оФРФ как у больных без рецидива заболевания, так и при его наличии, в последнем случае выявляется существенная роль и СЭФР-А. Обобщенные результаты изучения динамики факторов роста, в том числе и СЭФР, при различных вариантах НГЭ показали, что изменение уровня данного полипептида наблюдалось только в случае рецидивирования НГЭ, причём, повышение его продукции имело место не только по сравнению с контрольными данными, но и относительно показателей у пациенток без рецидива заболевания. Последнее свидетельствует о роли СЭФР-А в механизме формирования рецидивирующей стадии НГЭ, когда необходимое для роста гетеротопий формирование кровеносных сосудов обеспечивается этим фактором роста, метаболическая функция которого заключается в индукции пролиферации эндотелиальных клеток.
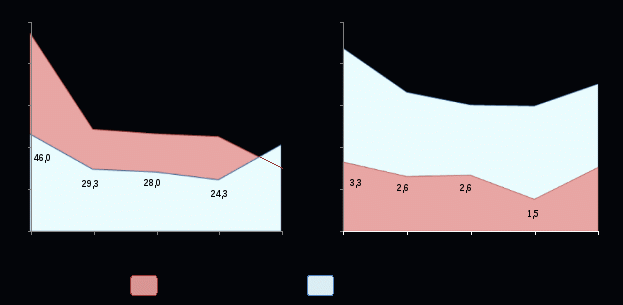 |
| Рисунок 10. Соотношение молярных уровней прогестерона и тестостерона к эстрадиолу у пациенток исследуемых групп |
В механизмах, патогенетически связанных с рецидивированием НГЭ, наряду с сохранением высокого уровня СЭФР-А и низкой экспрессии ЭФР-R, важную роль играет значительное снижение содержания ИЛ-6, приводящее к дисфункции гипоталамо-гипофизарной системы, и как следствие – снижению ГнРГ.
Данные о характере изменений регуляторных факторов на местном уровне при рецидивировании НГЭ (таблица 4) свидетельствуют о сохранении высокого содержания ИЛ-8, как и наблюдаемые нами на начальных стадиях (I-II стадия) развития данного заболевания. Кроме того, имеет место снижение СЭФР. В случае рецидивирования НГЭ особую информативность для суждения о механизме возврата формирования гетеротопий даёт высокая степень роста ИЛ-8, который усиливает адгезию эндометриоидных клеток и обеспечивает их имплантацию на органах брюшной полости. Наряду с участием этого фактора роста в регуляции пролиферации, одним из его метаболических эффектов, влияющих на процессы гемодинамики (кровоснабжение), является изменение обмена l- аргинина в результате модификации активности NO-синтазы и аргиназы (J.D.Shearer et al., 1997). Другим наиболее значимым фактом, обнаруженным нами в ПЖ является повышение уровня активина, одной из функций которого при высоких концентрациях является индукция гибели клеток по механизму апоптоза.
 |
| Рисунок 11. Схема регуляторных и функциональных нарушений метаболизма при наружном генитальном эндометриозе. |
Следует согласиться с мнением В.А.Бурлева (2008), который считает, что на различных стадиях развития эндометриоза, происходит переключение возникающих нарушений в аутопаракринных регуляторных процессах с одних факторов роста на другие. По нашему мнению, выявленная динамика продукции цитокинов, в том числе и ростовых факторов, при рецидивировании НГЭ, образующих сложную систему регуляторов клеточного роста и дифференцировки, позволяет заключить, что разнообразие морфологических и клинических проявлений указывает участие широкого спектра факторов роста в рецидивировании данного заболевания. Характер модификации продукции биоактивных компонентов в данном случае служит специфическим механизмом формирования рецидива НГЭ. Развитие этой формы эндометриоза является следствием отсутствия нормализации в клеточном метаболизме даже после проводимого стандартного лечения и служит теоретическим обоснованием для проведения дополнительных лечебных мероприятий, направленных на нормализацию метаболических процессов как на системном, так и локальном уровнях.
 |
| Рисунок 12. Особенности клеточной регуляции при наружном генитальном эндометриозе. |
Анализ результатов исследования с учётом стадии НГЭ и роли ангиогенных факторов в их развитии позволил выявить на системном уровне ряд особенностей, заключающихся в изменении спектра факторов роста, обусловливающих нарушение регуляции клеточного метаболизма. Очевидно, можно считать, что при различных стадиях НГЭ наблюдаются изменения в нарушении регуляторных процессов в результате переключения отрицательного действия одних факторов роста на другие. Так, при I-II стадии НГЭ нарушение регуляции клеточного метаболизма в период ангиогенеза из изученных соединений связано с увеличением уровня оФРФ и ИФР-1. НГЭ III-IV стадии характеризуется изменениями в регуляторных процессах с участием ещё одного мощного ангиогенного цитокина - ЭФР. В период рецидивирования НГЭ на системном уровне, наряду с модифицирующими регуляцию клеточного метаболизма ЭФР, оФРФ, ИФР-1 как при I-II, III-IV стадиях, выявляется существенная роль и СЭФР-А.
Наблюдаемые особенности являются, очевидно, результатом изменения при НГЭ регуляторной взаимосвязи между ЭФР и системой тироксин – тиреотропин и СЭФР-А – ИФР-1. Известно, что Т4 участвует в клеточной пролиферации и дифференциации путем индукции ЭФР (E.Odeblad, 1993; M.D.Kilby et al., 1998). Значительная продукция последнего при III-IV стадиях НГЭ на системном уровне является, несомненно, следствием усиленной активации высокой генерацией тироксина синтеза ЭФР. Для рецидивирующей стадии НГЭ измененной оказалась другая регуляторная связь, заключающаяся в контроле продукции СЭФР-А – ИФР-1 (Ю.А.Панков, 1999, 2007), а также действием ЭФР, обеспечивающего активацию гена СЭФР-А (G.E.Hofman et al., 1992; D.M.Copper et al., 1994). Наличие высокого содержания ИФР-1 и ЭФР относительно как I-II, так и III-IV стадий НГЭ в процессе рецидивирования НГЭ обусловливает усиление количества СЭФР-А, приводящего к изменениям в сосудистой системе организма.
Возникающая при НГЭ модификация продукции изученных ангиогенных факторов роста и гормона из системы тироксин-тиреотропин обусловливает нарушение конкретных регуляторных взаимоотношений Т4-ЭФР, ИФР-1 – СЭФР-А и изменение активации гипоталамо-гипофизарной системы.
Резюмируя полученные нами результаты можно заключить, что отклонения в физиологических соотношениях изученных биоактивных компонентов, а также гипофизарных и половых стероидов при НГЭ подтверждают факт нарушений в продукции регуляторов клеточного роста и дифференцировки как на системном, так и локальном уровнях. При различных стадиях НГЭ установлены особенности модификации продукции факторов роста, относящиеся к специфическим реакциям, позволяющим использовать выявленные значимые изменения биоактивных соединений в диагностике соответствующей стадии НГЭ неинвазивным методом (рисунок 11).
Существенным является то, что наши данные дают возможность оценить значение высокого уровня в ПЖ ИЛ-8, который усиливает адгезию эндометриоидных клеток и обеспечивает их имплантацию на органах брюшной полости. Этот процесс происходит на фоне активного неоангиогенеза, важным активирующим фактором которого является гипоксия (рисунок 12).
Другим наиболее значимым фактом полученных результатов является возможность выразить нашу позицию в отношении установления среди изученных компонентов роли тех из них, изменение продукции которых приводит к дисфункции гипоталамо-гипофизарной системы. Сочетанное действие низких уровней ИЛ-6 и лептина на системном уровне нарушает активацию гипоталамо-гипофизарной системы и снижает секрецию гонадотропин-рилизинг гормона. Последствием модификации данных регуляторных процессов является резкое ослабление фолликулогенеза и ранняя атрезия фолликулов, что несомненно является одним из механизмов развития бесплодия при НГЭ.
На основании результатов исследования факторов роста и эндотелиальных компонентов можно заключить, что при различных стадиях формирования НГЭ происходит переключение нарушения регуляторного контроля клеточного метаболизма с одних факторов роста на другие.
Выявленные особенности в продукции ангиогенных факторов роста на системном уровне позволяют использовать их количественные характеристики в качестве неинвазивного метода диагностики наличия НГЭ и его стадий, при:
- соотношении ЭФР/оФРФ в сыворотке крови равном 10 или более, осуществляют биохимическую верификацию НГЭ;
- увеличении в сыворотке крови содержания оФРФ в 2,5 раза относительно нормы диагностируют I-II стадию НГЭ;
- увеличении в сыворотке крови содержания ЭФР в 2 раза диагностируют III-IY стадию НГЭ.
- пятикратное повышение содержания СЭФР-А в сыворотке крови пациентки позволяет диагностировать редивирующую стадию НГЭ.
ВЫВОДЫ:
1. Клинические особенности у пациенток с НГЭ, свидетельствуют, что тяжесть клинического течения НГЭ зависит от раннего наступления менархе, ранее перенесенных оперативных вмешательств, в большей степени проведенных на придатках матки, ранее перенесенных ЗППП и ВЗОМТ, экстрагенитальной патологии и не зависит от возраста пациенток, длительности менструаций, продолжительности менструального цикла. Альгодисменорея имеет место у 50% пациенток с НГЭ, причем чаще (85,1%) с I-II стадией НГЭ. У больных с НГЭ преобладает первичное бесплодие (53%).
2. Тяжесть клинического течения НГЭ при III-IV стадии патологического процесса коррелирует с распространенностью эндометриоза в малом тазу: наблюдается сочетание 2-3 симптомов, причем формирование эндометриоидных кист яичников усугубляет тяжесть клинических проявлений; рецидивирование, а также III-IV стадия развития НГЭ сочетаются с количеством и объемом ранее перенесенных оперативных вмешательств.
3. На системном уровне при наличии НГЭ характерной чертой факторов роста является высокий уровень ЭФР, оФРФ, ИФР-1, обладающих выраженной митогенной, пролиферативной и ангиогенной активностью, и низкий – лептина. Повышение продукции ИФР-1 и, напротив, падение лептина, контролирующих альтернативные пути синтеза эстрогенов, изменяют соотношение тестостерона и 17β-эстрадиола, прогестерона и 17β-эстрадиола при нормальной экспрессии CYP19. Нулевой аллель гена GSTT1 и аллель PLA2 гена GPШα не предрасполагают к развитию эндометриоза, но могут обусловливать более тяжелое течение заболевания.
4. На местном уровне изменения регуляторных соединений пролиферации относительно здоровых пациенток характеризуется увеличением содержания в перитонеальной жидкости ангиогенного и антиапоптотического фактора – ИЛ-8, повышением уровня антиапоптотических веществ – NO, ФСГ, апоптотического sFASL и антиангиогенного растворимого СЭФР-R. Соотношение апоптотических и антиапоптотических, ангиогенных и антиангиогенных факторов увеличивается, обеспечивая адгезию эндометриоидных клеток на органах брюшной полости и рост гетеротопий.
5. Начальные стадии (I-II) НГЭ сопровождаются усилением на системном уровне продукции оФРФ и ИФР-1, активирующих пролиферативные процессы при ангиогенезе, и антиангиогенных – ИЛ-10 и растворимого СЭФР-R. Наиболее выраженное увеличение содержания имело место для оФРФ и растворимого СЭФР-R. НГЭ I-II стадии характеризуется наличием значительной антиангиогенной метаболической защитой, предотвращающей чрезмерный рост кровеносных сосудов. На местном уровне на раннем этапе НГЭ в процессе формирования гетеротопий существенная роль принадлежит высокому уровню ангиогенного и антиапоптотического фактора – ИЛ-8, молекулам адгезии sVCAM1, и как следствие сочетанное действие снижения контроля за эндометриоидными клетками, попадающими в перитонеальную жидкость, и, обеспечивающих адгезию на органах малого таза.
6. Специфические особенности в характере изменений клеточной регуляции пролиферации при III-IV стадиях НГЭ на системном уровне заключаются в интенсивной экспрессии ЭФР, ФНО-α и падении содержания лептина на фоне увеличенной продукции, как и при I-II стадии, оФРФ, ИФР-1, растворимого СЭФР-R. Показатели ангиогенных и вазоактивных соединений в перитонеальной жидкости отличаются ростом других ангиогенных факторов NO и NOS, и сдвигом соотношений ангиогенных и антиангиогенных в сторону снижения содержания последних. Выявленные изменения аутопаракринной клеточной регуляции ангиогенеза при III-IV стадиях НГЭ обусловливаются участием в механизме развития данного заболевания большего количества ангиогенных факторов.
7. Развитие рецидивирующей стадии НГЭ определяется на системном уровне не только высокой продукцией наблюдаемой при I-II , III-IV стадиях ангиогенных факторов ЭФР, оФРФ, ИФР-1, снижением ЭФР-R и ИЛ-6, но и особенно значительным ростом СЭФР-А, не отмеченным ни при одной из изученных стадий НГЭ. Высокий уровень продукции СЭФР-А, низкой экспрессии ЭФР-R и ИЛ-6 сохраняются также относительно НГЭ без рецидива. В перитонеальной жидкости (местный уровень) относительно данных здоровых женщин увеличение генерации оксида азота с участием NO-синтазы, обусловливающее локальную гипоксию, способствует инициации развития новых гетеротопий. По сравнению с результатами при НГЭ без рецидива заболевания в данной стадии НГЭ принимает участие широкий спектр биоактивных компонентов и служит специфическим механизмом для формирования рецидива НГЭ.
8. Фактором, усиливающим неоангиогенез внутри и вокруг очагов эндометриоза является гипоксия, развивающаяся вследствие высокого уровня в перитонеальной жидкости NO, обусловливающего рост пероксинитрита, нарушающего кислородный баланс.
9. В процессе развития НГЭ наблюдается изменение контроля функции гипоталамо-гипофизарной системы, обусловленное низким уровнем лептина и ИЛ-6, с последующим падением секреции ГнРГ, приводящего к ослаблению фолликулогенеза и ранней атрезии фолликулов, обусловливая бесплодие при НГЭ.
10. При I-II стадии НГЭ на местном уровне наблюдается снижение молярных соотношений прогестерона и тестостерона к 17β-эстрадиолу за счет снижения продукции тестостерона и прогестерона. Системный уровень характеризуется ростом коэффициентов Pr/E2 и Ts/E2, свидетельствующим о преобладании продукции прогестерона и тестостерона над 17β- эстрадиолом и обеспечивающим компенсаторные реакции. При III-IV стадиях НГЭ на системном уровне снижена молярная концентрация прогестерона и тестостерона относительно 17β- эстрадиола, в то время как у здоровых пациенток преобладание прогестерона и тестостерона над 17β- эстрадиолом более значительно выражено. Аналогичная тенденция наблюдается и на местном уровне.
11. Высокая интенсивность продукции наиболее мощного антиангиогенного фактора - растворимого СЭФР-R, влияющего на ограничение роста сосудов и отражающего степень компенсаторных возможностей организма при НГЭ отмечена на начальных этапах (I-II стадия заболевания) на системном уровне и не обнаружена на местном, свидетельствует об отсутствии в перитонеальной жидкости метаболического механизма, снижающего активность ангиогенеза. В случае прогрессирования заболевания (III-IV стадия) наблюдается сохранение содержания на системном уровне растворимого СЭФР-R, соответствующего показателям при I-II стадии, но в этот период имеет место особенно значимый рост растворимого СЭФР-R в перитонеальной жидкости, указывающий на формирование механизма антиангиогенной защиты. Рецидивирующая стадия НГЭ на системном уровне характеризуется снижением роста растворимого СЭФР-R относительно I-II, III-IV стадий НГЭ, а также на местном уровне, отражающего истощение компенсаторных резервов организма.
12. Содержание факторов роста, интерлейкинов и вазоактивных соединений – сложной системы регуляторов клеточного роста и дифференцировки, в сыворотке крови отражают характер регуляторных нарушений при наличии НГЭ, а также при различных стадиях его развития и может быть использовано в качестве неинвазивных тестов их диагностики.
