Разработка и внедрение технологии промышленного производства и системы управления качеством ассоциированной паротитно-коревой вакцины 03. 01. 06 биотехнология (в том числе бионанотехнологии)
| Вид материала | Автореферат |
- Программа кандидатского экзамена послевузовского профессионального образования (аспирантура), 424.16kb.
- Разработка идентификации bordetella bronchiseptica на основе иммунохимических и молекулярно-генетических, 373.19kb.
- Наночастицы металлов в растворах: биохимический синтез, свойства и применение 03. 01., 843.88kb.
- Курс семестр Всего зачетных единиц Трудоемкость дисциплины в часах, 26.33kb.
- Рекомендации по внутришкольному управлению качеством образования, 2175.02kb.
- Типовой план проекта «Разработка стратегии и внедрение системы стратегического управления», 117.19kb.
- Реферат отчета о научно-исследовательской работе по теме: «Разработка и внедрение ресурсосберегающей, 76.5kb.
- Для управления качеством ремонтных работ широко применяются технологические методы, 453.24kb.
- Программа по дисциплине «Управление качеством», 44.79kb.
- Характеристика новых свойств пробиотических препаратов серии «экофрэнд» 03. 01., 302.88kb.
На правах рукописи
Колышкин Владимир Михайлович
Разработка и внедрение технологии промышленного производства и системы управления качеством ассоциированной паротитно-коревой вакцины
03.01.06 – биотехнология (в том числе бионанотехнологии)
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора биологических наук
Москва - 2010
Работа выполнена в Федеральном государственном образовательном учреждении высшего профессионального образования «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И.Скрябина» (ФГОУ ВПО МГАВМиБ) и в Московском подразделении по производству бактерийных препаратов (МПБП) ФГУП научно-производственного объединения «МИКРОГЕН» Министерства здравоохранения Российской Федерации.
Научный консультант: Доктор биологических наук, доцент
Васильев Алексей Васильевич
Официальные оппоненты:
1. Доктор ветеринарных наук, профессор Белоусова Раиса Васильевна;
2. Доктор биологических наук, профессор Еремец Владимир Иванович;
3. Доктор биологических наук, профессор Тихонова Нина Тимофеевна.
Ведущая организация: Государственное Учреждение НИИ вакцин и сывороток им. И.И. Мечникова РАМН
Защита состоится « » __________ 2010 года в ____ часов на заседании Диссертационного совета Д.220.042.01 при ФГОУ ВПО «Московская государственная академия ветеринарной медицины и биотехнологии имени К.И. Скрябина» по адресу: 109472, Москва, ул. Академика Скрябина, 23; тел. (495) 377-93-83
С диссертацией можно ознакомиться в библиотеке ФГОУ ВПО МГАВМиБ имени К.И.Скрябина.
Автореферат разослан «____ » _______ 2010 года.
Ученый секретарь
диссертационного совета,
профессор Грязнева Т.Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Борьба с инфекционными болезнями, составляющими 60-70% общей патологии человека, является важнейшей задачей современной медицины. Система мер профилактики и борьбы с инфекционными заболеваниями многообразна, но ведущее место в ней принадлежит вакцинации (В.Ф. Учайкин, 2001, Н.В. Медуницын, 2004). Именно с прививками связаны достигнутые в борьбе с инфекциями успехи, на них строятся и перспективы ликвидации некоторых из них. Иммунопрофилактика получила широкое распространение в мировой медицинской и ветеринарной практике. Так, ежегодно в мире вакцинируется около 1,5 млрд. человек, что составляет около 1/4 населения планеты (Г.Г. Онищенко, 2006) и до 70 % поголовья животных (И.А. Бакулов, 1998). В РФ вакцинация взята под контроль Государства (Федеральный Закон от 17 сентября 1998г. № 157-ФЗ "Об иммунопрофилактике инфекционных болезней", Приказ от 27.06.2001 № 229 МЗ РФ).
Стратегия и тактика вакцинопрофилактики вирусных инфекций затруднена в ряде случаев из-за перегруженности календаря прививок. Одним из радикальных решений данной проблемы является разработка и рациональное использование вместо моно препаратов ассоциированных вакцин, применение которых имеет несомненные преимущества в плане сокращения количества инъекций, снижения уровня аллергизации населения, создания напряженного иммунитета одновременно к нескольким инфекциям (Б.Ф.Семенов 2003, В.В.Зверев, 2005).
При разработке и апробации ассоциированных вакцин предварительно оцениваются совместимость и оптимальное соотношение исходных антигенов, дозы и схемы вакцинации и ревакцинации, а также клинико-иммунологическое обоснование возможности и эффективности применения препаратов. Каждая новая разработка ассоциированных вакцин оценивается с учетом указанных требований (Попов В.Ф., 2002).
Важность проблемы стабильного производства иммунобиологических препаратов, используемых для выполнения Национального календаря профилактических прививок, связана с тем, что Всемирная Организация Здравоохранения поставила перед национальными органами здравоохранения задачу ликвидации заболеваемости корью и резкого снижения заболеваемости эпидемическим паротитом в мире к 2010 году (Бектемиров Т.А., 2002).
В настоящей работе приведены материалы исследований по разработке технологии производства ассоциированной вакцины против кори и эпидемического паротита (АПКВ), созданию и внедрению системы управления качеством, включая анализ стабильности производства вакцинных препаратов с помощью статистических методов управления качеством.
Цель и задачи исследований:
Целью настоящей работы явилась разработка технологии промышленного производства ассоциированной паротитно-коревой вакцины, изучение безопасности и эффективности нового вакцинного препарата и внедрение его в практику. Для достижения поставленной цели необходимо было решить следующие задачи:
1. Определить пригодность вакцинного штамма эпидемического паротита Ленинград-3 (Л-3) для включения его в АПКВ.
2. Создать систему управления качеством и проведения анализа технологических процессов производства препаратов, изготавливаемых на предприятии в соответствии с требованиями стандартов надлежащей производственной практики GMP.
3. Провести оценку стабильности промышленного производства моновакцин для создания ассоциированного препарата.
4. Разработать методы контроля и мониторинга, позволяющие получить доказательства стабильности производства монопрепаратов.
5. Создать промышленную технологию производства АПКВ, провести производственные испытания в соответствии с требованиями программы, утвержденной ГИСК им. Л.А. Тарасевича (ГИСК).
6. Провести оценку стабильности производства АПКВ с использованием современных специализированных программных пакетов по статистической обработке и анализу данных производственно-технологических процессов.
7. Разработать и утвердить нормативную документацию на производство АПКВ.
8. Оценить эпидемиологическую эффективность применения АПКВ по разработанной технологии в медицинской практике.
9. Оценить экономическую эффективность внедрения новой технологии производства АПКВ.
Научная новизна:
1. Впервые на основе существующей аппаратурно-технологической базы создано промышленное производство АПКВ, для обеспечения потребности РФ в средствах защиты от кори и эпидемического паротита.
2. На основе созданной производственной базы осуществляется выпуск АПКВ для обеспечения национального календаря профилактических прививок (Приказ от 27.06.2001 № 229 МЗ РФ).
3. Разработаны методы контроля клеточных линий, используемых для производства АПКВ. Внедрена система управления качеством при производстве монопрепаратов и АПКВ.
4. Проведена оценка эпидемиологической эффективности АПКВ в условиях массового применения (более 20 млн. доз, 2001-2009 г.г.)
Научно – практическая новизна результатов работы подтверждена получением патентов:
- Патент РФ на изобретение № 2158134 от 27.10.2000г. «Способ получения ассоциированной паротитно-коревой вакцины». Зайцев И.З., Колышкин В.М., Сидоренко Е.С., Попов В.Ф., Юминова Н.В., Красильников И.В., Дорофеева Л.В.
- Евразийский патент № 002387 от 25.04.02г. «Способ получения ассоциированной паротитно-коревой вакцины». Зайцев И.З., Колышкин В.М., Сидоренко Е.С., Попов В.Ф., Юминова Н.В., Красильников И.В., Дорофеева Л.В.
Практическая значимость и внедрение результатов научных исследований в производство:
1. Ассоциированная вакцина, производимая по разработанной технологии, используется для профилактики кори и паротита у детей соответствующих возрастов.
2. Разработана и утверждена в установленном порядке нормативная документация (НД) на производство АПКВ.
3. Вакцина АПКВ включена в Национальный календарь профилактических прививок РФ.
4. На предприятии-изготовителе действует система управления качеством в соответствии с требованиями ГОСТ Р 52249-2004.
5. Результаты научных исследований по разработке технологии приготовления АПКВ используются в учебном процессе по дисциплине «Биотехнология» в ФГОУ ВПО МГАВМиБ.
Апробация результатов диссертации. Основные результаты работы доложены и обсуждены на:
- Международном конгрессе «Ликвидация и элиминация инфекционных болезней – прогресс и проблемы». (СПб., 2003 г);
- I-ом Международном ветеринарном конгрессе по птицеводству. (Москва, 2005 г.);
- IX - XV Международных конференциях «Новые информационные технологии в медицине, биологии, фармакологии и экологии» (Гурзуф 2001-2007);
- VIII, IX съездах Всероссийского научно-практического общества эпидемиологов, микробиологов и паразитологов. (Москва, 2006,2007 г.г.);
- Российском симпозиуме с международным участием «БИОФАРМА-2009». (Анталия, 2009 г.).
Объем и структура диссертации
Диссертационная работа изложена на 296 страницах и состоит из введения, обзора литературы, описания использованных материалов и методов, собственных исследований, обсуждения, выводов, списка цитируемой литературы, включающего 155 источника (83 отечественных и 72 зарубежных) авторов и приложения на 25 листах. Работа иллюстрирована 197 рисунками и содержит 57 таблиц.
Публикации
Основные научные результаты по материалам, изложенным в диссертации, опубликованы в 62 работах, из них в рецензируемых научных изданиях и журналах, рекомендованных ВАК, опубликовано 15 работ, получено 2 патента.
Основные положения и результаты, выносимые на защиту:
1. Впервые созданная технология промышленного производства АПКВ на основе аттенуированных вакцинных штаммов вируса эпидемического паротита Л-3 и кори Л-16, позволяет обеспечить выпуск препарата в требуемых объемах для проведения профилактических мероприятий.
2. Критерии оценки пригодности клеточных систем культивирования и контроля, позволяющие осуществлять стабильное промышленное производство вакцин надлежащего качества с полноценными иммунобиологическими свойствами, обеспечивающее безопасное и эффективное применение.
3. Разработанная система управления качеством, включающая контроль сырья, материалов, полуфабрикатов, готовой продукции, мониторинг показателей технологических процессов при производстве АПКВ позволяет получить объективную оценку качества продукции.
4. В результате созданной технологии производства и системы управления качеством в период с 2001 года по настоящее время выпущено более 20 млн. доз АПКВ.
СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ
Материалы и методы исследований
Для создания ассоциированной паротитно-коревой вакцины использовали вакцинные штаммы, применяемые для изготовления моновакцин: Ленинград -16 (Л-16) вируса кори; Ленинград - 3 (Л-3) вируса эпидемического паротита. Их культивировали в первично-трипсинизированных фибробластах эмбрионов японского перепела. Перепелиные яйца и перепелиные эмбрионы соответствовали требованиям ФСП 42-01450431- 00 «Эмбрионы японского перепела для производства вирусных вакцин».
Процесс изготовления АПКВ включает получение вируссодержащей жидкости (ВСЖ) кори и эпидемического паротита, сведение их с защитной средой (получение жидкого полуфабриката), с последующим объединением жидких полуфабрикатов. Стабильный выпуск моновакцин против кори и эпидемического паротита надлежащего качества позволил разработать новую оригинальную технологию производства ассоциированной паротитно-коревой вакцины.
Из эмбрионов перепелов за один производственный цикл готовят клетки для засева 24 роллерных культуральных флаконов, 20 из которых заражают вакцинным вирусом кори, штамм Л-16, в дозе от 0.01 до 0.001 ТЦД50 на клетку и инкубируют при температуре 36±0,2о С, 4 флакона оставляют контрольными. Из 20 зараженных роллерных флаконов получают около 6 литров вируссодержащей жидкости 1-4 сливов. Каждый полученный слив в объеме около 0,3 л контролируют на отсутствие контаминантов и определяют величину специфической активности титрованием в культуре клеток Vero.
Состояние перевиваемых линий клеток контролировали с помощью проточной цитометрии с использованием проточного цитофлуориметра EPICS-5 (Coulter Electronics, США). Учет специфической активности вируса проводили по цитопатическому действию вируса и рассчитывали по методу Reed L.J., Muench H.A., (1938).
Не содержащие контаминантов жидкие полуфабрикаты, полученные за один технологический цикл, со специфической активностью более 4,2 lg ТЦД50/0,5 мл хранят при температуре минус 50-56оС в течение необходимого времени, затем размораживают, повторно титруют, сводят в один пул и используют для сведения с полуфабрикатом вакцины против эпидемического паротита.
Технология производства паротитной моновакцины очень близка к технологии производства коревой вакцины и различается в деталях. В соответствии с регламентом и ФС 42-0038-00 «Вакцина паротитная культуральная живая сухая» производится из отечественного штамма Л – 3. Отличия в технологии изготовления паротитной вакцины касаются дозы заражения, времени съема и количества сливов. Контроль над качеством титрования вирусных сборов проводится с помощью отраслевого стандартного образца (ОСО) вакцинного вируса эпидемического паротита.
Главным достижением в технологии производства ассоциированной паротитно-коревой вакцины является разработка способа сведения полуфабрикатов кори и эпидемического паротита, обеспечивающего в сухом препарате преобладание паротитного компонента над коревым приблизительно на 1 lg.
Жидкие полуфабрикаты кори и эпидемического паротита, являющиеся полуфабрикатами для моновакцин, сводят в определенном соотношении, как указано в патенте, тщательно перемешивают, разливают в ампулы и лиофилизируют.
Одна прививочная доза АПКВ содержит:
- не менее 1000 ТЦД50 - 3 lg тканевых цитопатогенных доз (ТЦД50/0.5 мл) вируса кори;
- не менее 20 000 ТЦД50 - 4. 3 lg ТЦД50/0.5 мл вируса эпидемического паротита;
- антибиотик - гентамицина сульфат не более 25 мкг;
- стабилизатор – смесь ЛС-18 - 0,08 мл., и 0,002 г. желатина.
С целью стандартизации процесса титрования обоих вирусов на предприятии создан банк перевиваемых культур клеток, который аттестован ГИСК им. Л. А. Тарасевича.
С целью управления производством с использованием процессного подхода на основе реальной информации, на предприятии создана система обеспечения качества в соответствии с требованиями стандартов ИСО серии 9000 (Колышкин В.М., 2004).
Стабильность производства компонентов и готового продукта АПКВ изучали с использованием статистических методов (Митрохин И.Н., Орлов А.И., 2007; Орлов А.И., 1997). Анализу подвергали записи маршрутных листов технологического процесса получения коревой и паротитной вакцин, имеющиеся на предприятии в электронном виде.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ.
Учитывая, что технология создания суммирует технологии создания коревой и паротитной моновакцин, нами рассмотрены вопросы создания моновакцин, а затем приведены данные по готовому продукту - ассоциированной паротитно-коревой вакцине.
Характеристика универсального субстрата для промышленного производства полуфабрикатов коревой и паротитной вакцин.
Фибробласты перепелов являются единым субстратом для производства вакцин против кори и эпидемического паротита. Все операции по получению культуры регистрировали в разработанных маршрутных картах. Эффективность и стабильность процесса трипсинизации оценивали по выходу клеток на 1 г. ткани. В табл. № 1, 2 приведены результаты оценки выхода клеток в период с 2002 по 2005 годы на участках по производству коревой и паротитной вакцин.
Таблица № 1
Анализ данных по выходу клеток на участке по производству коревой вакцины за 2002-2005 г.г.
| Год | Количество колб | Выход клеток ×106/г. | ||||
| M±σ | Мин. | Макс. | Размах | С v % | ||
| 2002 | 19 | 65,3±5,0 | 55,7 | 72,2 | 16,5 | 7.66 |
| 2003 | 26 | 63,9±4,3 | 53,6 | 70,1 | 16,5 | 6.72 |
| 2004 | 36 | 60,7±4,0 | 51,5 | 71,8 | 20,3 | 6.59 |
| 2005 | 50 | 60,7±5,5 | 46,6 | 82,9 | 36,4 | 9.06 |
Как видно из приведенных данных выход клеток составил ~ 61-65 млн. на 1 грамм ткани. Аналогичные данные были получены по оценке процесса получения клеток на участке по производству паротитной вакцины.
Таблица № 2
Анализ данных по выходу клеток на участке по производству паротитной вакцины за 2003-2005 г.г.
| Год | Количество колб | Выход клеток ×106/г. | ||||
| M±σ | Мин. | Макс. | Размах | С v % | ||
| 2003 | 32 | 76,6±4,3 | 68,0 | 83,4 | 15,4 | 5.61 |
| 2004 | 39 | 74,7±3,6 | 67,0 | 80,2 | 13,2 | 4.82 |
| 2005 | 23 | 75,1±3,1 | 71,4 | 85,3 | 13,9 | 4.13 |
Как видно из приведенных в табл. 1,2 данных, процесс трипсинизации и на паротитном и на коревом участках проходит в стабильном режиме. Однако судя по выходу клеток, эффективность трипсинизации на участке по производству паротитной вакцины выше (на 20%), а коэффициент вариации ниже.
Низкие и близкие по значению показатели размаха и коэффициента вариации в период 2002-2008 гг. свидетельствуют о стабильности процесса промышленного получения культур клеток. В 2005 г. в связи с увеличением необходимого объема получения клеток для производства коревой вакцины, вариабельность процесса трипсинизации возросла в среднем на 2%, что хорошо согласуется со случайным характером воздействий, ответственных за разброс. Более наглядные выводы были получены после обработки всего массива данных с использованием программного продукта компании Stat Soft Статистика-5.5.
В качестве примера приведены результаты за 2004 г. на участке по производству коревой вакцины (Рис. 1).
Контрольная Х- карта Шухарта по выходу клеток на грамм ткани на коревом участке за 2004 год (по порциям при n=2)
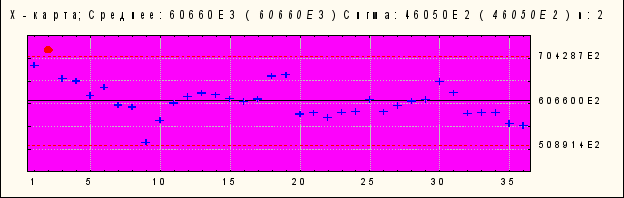
Среднее 6,06 х 107, Ϭ = 4,6 х 106 n: 2
7,04 х 107
6,06 х 107
5,09 х 107
Рисунок № 1. Х-карта выхода клеток на коревом участке
Анализ контрольной карты свидетельствует о стабильности процесса трипсинизации в коревом подразделении, так как колебания показателей укладываются в рамки ± 3 σ. Сходные данные получены и при анализе стадии получения фибробластов эмбриона перепела в паротитном подразделении. Полученные результаты демонстрируют стабильность приготовления клеток для производства вакцин как в паротитном, так и в коревом подразделениях, а повышенный выход клеток при производстве паротитной вакцины обосновывает необходимость создания единого подразделения для трипсинизации клеток, что и было реализовано с 2006 г.
Анализ поствакцинальных осложнений при использовании вакцинных штаммов вирусов эпидемического паротита и кори.
По данным ВОЗ, ретроспективный анализ остаточной нейровирулентности, проведенный Galazka A.M., et all., 1999 указывает на наличие высокой частоты возникновения поствакцинальных асептических менингитов, 20-100 случаев на 100.000 доз вакцины, произведенной с использованием штамма Л-3 Загреб.
Эти данные расходятся с результатами, наблюдаемыми при массовой вакцинации против эпидемического паротита в РФ вакциной произведенной с использованием отечественного штамма Л-3, 0-4 случая на 100.000 доз вакцины.
Только при анализе многолетних накопленных данных можно получить статистически значимые результаты. Мы изучили совместно с проф. С.М. Харит (НИИ детских инфекций, г. С-Петербург) частоту серозного менингита, возникающего при массовой вакцинации штаммом Л-3 вируса паротита. Расчет частоты подтвержденных вакциноассоциированных серозных менингитов на число доз использованной вакцины в г. Санкт-Петербурге показал, что в 2001 г. был 1 случай на 97.178 доз (показатель 1,03 на 100.000), а в 2002 г. – 3 случая на 114391 дозу (2,6 на 100.000). Полученные результаты практически совпадают с представленной в литературе частотой менингитов при использовании штамма «Jeryl Lynn» и свидетельствуют о высокой безопасности отечественного вакцинного штамма Л-3.
По эффективности штамм Л-3, по нашим совместным с проф. С.М. Харит исследованиям, не уступает японскому штамму «Urabe», а по степени реактогенности (из-за отсутствия куриного белка) штамм Л-3 находится на более низком уровне, чем другие вакцинные штаммы вируса эпидемического паротита. Учитывая, что у всех вакцинных штаммов вируса паротита, за исключением швейцарского штамма «Rubini», определена последовательность нуклеотидов полного генома, мы смогли провести сравнение всех опубликованных полных геномов вирусов паротита в сравнении с вакцинными штаммами Л-3 и Л-3-Загреб.
Построенное дерево родственных взаимоотношений указывает, что штаммы Л-3, Л-3-Загреб, Jeryl Lynn, Urabe значительно различаются.
Исследования, проводимые согласно регламенту с периодичностью 3-5 лет на обезьянах, при использовании внутримозгового инфицирования, свидетельствуют об отсутствии нейровирулентности штамма Л-3 в сравнении с другими вакцинными штаммами.
Коревой вакцинный штамм Л-16, как и другие используемые для производства противокоревых вакцин, принадлежат к генотипу А.
Сравнение вакцинных штаммов вирусов кори, используемых при производстве за рубежом, и штамма Л-16, применяемого для производства коревой вакцины в России, позволило нам вместе с сотрудниками ГИСК им. Л.А. Тарасевича выявить, что вакцина на основе штамма Л-16 не уступает по эффективности и безопасности вакцинам, применяемым в развитых странах, и характеризуется меньшей реактогенностью по сравнению с ними. В табл. 3 приведены обобщенные данные.
Таблица № 3
Сравнительная характеристика вакцин против кори, произведенных за рубежом и в РФ.
| Страна, фирма | Штамм | Кол-во наблюдений | Номер серии | Специфическая активность, lg ЦПД50 / 0,5 мл | Кол-во реакций, % |
| Франция, Пастер-Мерье | Шварц | 62 | 631 1054 | 3,80 3,97 | 15 |
| Япония, Eisai | Кам-70 | 68 | 352 353 | 4,52 4,27 | 18 |
| Россия, МПБП | Л-16 | 51 | 310 347 | 3,95 4,32 | 3 |
| Контроль | Без вакцинации | 52 | - | - | 3 |
Проведенный нами анализ показывает, что применяемые в РФ вакцинные штаммы Л-16 вируса кори и Л-3 вируса эпидемического паротита отвечают всем требованиям, предъявляемым к вакцинным штаммам.
