Статус и перспективы развития ядерой медицины и лучевой терапии в россии на фоне мировых тенденций (аналитическая справка) москва
| Вид материала | Документы |
- Учебная программа дополнительной переподготовки (клиническая ординатура) согласовано, 700.57kb.
- Тематический план лекций по лучевой диагностике и лучевой терапии для студентов 3 курса, 196.63kb.
- Эффективность локальной лучевой терапии костных метастазов, 42.57kb.
- Календарно-тематический план лекций по лучевой диагностике и лучевой терапии для студентов, 165.91kb.
- Использование радиопротекторов в лучевой терапии онкологических больных, 99.16kb.
- Информационно-аналитическая справка, 123.95kb.
- России Москва Россия 11: 00 11: 40 Перспективы исследования маркеров повреждения мозга, 30.01kb.
- Пояснительная записка, 332.93kb.
- Пояснительная записка, 279.81kb.
- История отечественной медицины, 121.51kb.
5. Ядерно-медицинская аппаратура.
В зависимости от способа и типа регистрации излучений всю ядерно-медицинскую аппаратуру делят на шесть групп:
► медицинские радиометры - для регистрации относительной радиоактивности в органе или в пробах биологических сред (радиометрия щитовидной железы, радиометрия гормонов в крови и др.);
► медицинские радиографы - для регистрации динамики перемещения РФП в организме с представлением информации в виде кривых (ренография, гепатография, кардиография и др.);
► дозкалибраторы - для измерения абсолютной величины активности РФП, вводимой пациенту;
► счетчики всего тела - для измерения общей активности РФП в теле пациента (определение эффективного периода полураспада нуклида, оценка тканевого этапа йодного обмена и др.)
► сканнеры, профильные сканнеры - для регистрации распределения РФП в органе или теле больного с представлением данных в виде рисунка (сканнограм) или кривых (определение участка повышенного накопления РФП при профильном сканировании);
► сцинтилляционная γ-камера, оснащенная ЭВМ - для регистрации динамики перемещения и распределения РФП с одновременным получением на дисплее ЭВМ изображения органа и кривых, отражающих его функцию. По своим функциональным возможностям заменяет радиограф и сканер.
Принципиальная схема устройства всех типов ядерно-медицинских приборов одинакова и позволяет выделить три части:
► детектор - воспринимающая часть прибора, обращенная непосредственно к источнику излучения - пациенту, которому введен РФП. Сцинтилляционный детектор в качестве основных элементов имеет коллиматор, кристалл йодида натрия (сцинтиллятор), фотоэлектронный умножитель (ФЭУ). g-кванты РФП, попадая на детектор, вызывают в кристалле образование световых вспышек (сцинтилляций) низкой интенсивности. Преобразование слабого светового сигнала в электрический осуществляется ФЭУ;
► электронная схема усиления сигналов от детектора;
► регистрирующее устройство позволяет получить информацию на фотобумаге, цифровую или графическую запись на бумаге или дисплее ЭВМ.
Основными инструментами современной радионуклидной диагностики остаются гамма-камера и многодетекторный гамма-томограф для однофотонной эмиссионной компьютерной томографии (ОФЭКТ), позитронный эмиссионный томограф (ПЭТ). Спрос на эту аппаратуру остается стабильным, в частности, этот сектор рынка США составляет около 300 млн. долларов в год.
- Гамма-камера и однофотонный эмиссионный компьютерный томограф (ОФЭКТ).
Полное переоснащение отечественной радионуклидной диагностики импортной аппаратурой практически невозможно из-за ее дороговизны (например, стоимость гамма- томографа в зависимости от комплектации составляет около 1,0 млн. долл.). Кроме того, покупка импортных установок неизбежно приводит к жесткой экономической зависимости от фирменного обслуживания, в том числе ремонта, сервиса и обеспечения расходными материалами.
Таким образом, необходима разработка и организация серийного выпуска отечественных гамма-томографов с одним и двумя блоками детектирования, отвечающих всем современным требованиям и обладающих всеми необходимыми функциональными возможностями аппаратуры данного класса. При этом стоимость серийных гамма-томографов не должна превышать стоимости самых дешевых импортных аппаратов при существенно более низких затратах на сервисное обслуживание.
Современные гамма-томографы содержат один или два блока детектирования прямоугольной формы с полем чувствительности не менее 350х510 см с системой автоматической настройки; штативно-поворотное устройство (гантри), обеспечивающее режим томографии и сканирования всего тела; цифровую систему формирования и обработки сигналов; компьютерную систему обработки результатов измерений с развитыми возможностями формирования, трансформации и анализа изображений, а также пакетом клинических программ.
В радионуклидной диагностике и терапии источники получения радионуклидов медицинского назначения играют важную, но далеко не единственную роль. Например, насыщать отечественный рынок современными циклотронами имеет смысл только тогда, когда радиологические лаборатории больниц и клиник будут оснащены современными гамма-камерами и позитронными эмиссионными томографами.
Но ситуация на отечественном рынке медицинского радиологического оборудования может и должна измениться. Росатом в рамках программы «Ядерная медицина» выделил НИИЭФА 25 миллионов рублей на разработку и производство гамма-камеры. Ее правильное название – однофотонный эмиссионный компьютерный томограф. В 2006 году выпущен опытный образец (рис.19).
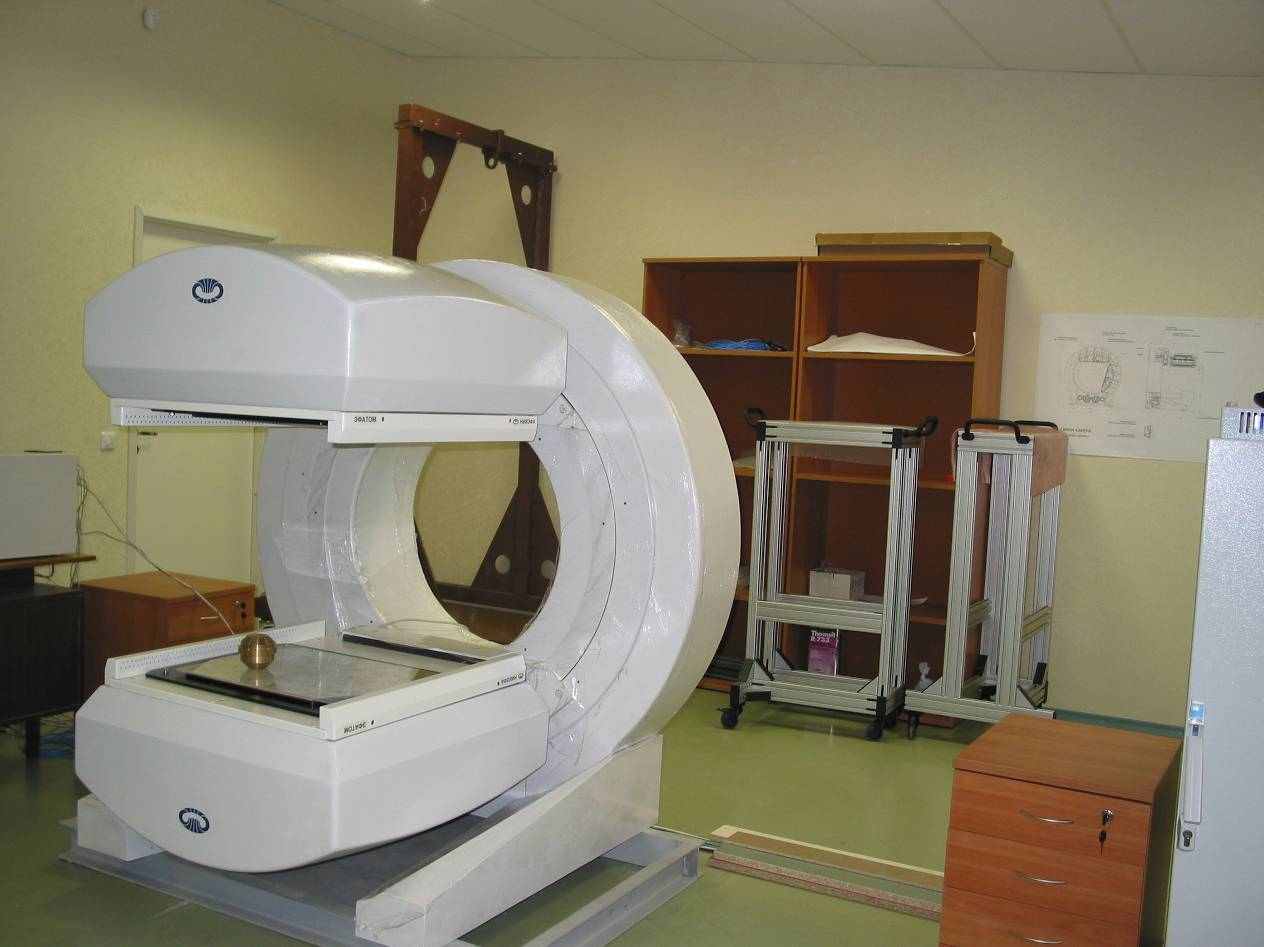
Рис.19. Опытный образец отечественного однофотонного эмиссионного
компьютерного томографа (2006 г.).
Логическим продолжением работы над гамма-томографом должна разработка аппарата, совмещающего в себе функции гамма-камеры и рентгеновского томографа, а также отечественного позитронного эмиссионного томографа.
Проблемы с разработкой позитронного эмиссионного томографа были подробно проанализированы в разделе 3.1.2.
5.2. Радиометрическая аппаратура.
Помимо визуализирующей аппаратуры, в современной ядерной медицине используются существенно менее дорогие клинические радиометры различного назначения. Из них наиболее широко применяются автоматизированные радиометрические установки для радиоиммунологического анализа, установки для радиометрии проб крови, особенно с целью определения объема циркулирующей крови, а также установки для измерения активности фасовок РФП (так называемые «дозкалибраторы»), без наличия и сертификации которых органы Госсанэпиднадзора не разрешают клиническую работу подразделений радионуклидной диагностики.
Импортная аппаратура аналогичного назначения отличается не только высокими рабочими характеристиками, но и чрезмерно высокой стоимостью. При оснащении такой аппаратурой российский пользователь испытывает серьезные финансовые затруднения, обусловленные необходимостью дорогостоящего сервисного обслуживания и закупки только фирменных расходуемых материалов.
В России имеются достаточная материальная база и квалифицированные кадры для разработки и производства отечественных клинических радиометров, не уступающих по своим рабочим характеристикам и функциональным возможностям лучшим зарубежным образцам, но существенно меньшей стоимости. Организация серийного выпуска отечественных клинических радиометров различного назначения позволит полностью избавиться от импорта аналогичной аппаратуры, оснастить все подразделения радионуклидной диагностики высокоэффективными радиометрическими приборами и организовать их экспорт в страны СНГ и развивающиеся страны Азии и Африки.
В частности, запланированы опытно-конструкторские работы и организация серийного выпуска измерителя объема циркулирующей крови на основе метода радионуклидного разведения. Установка содержат блок детектирования, систему обработки данных и базовое программное обеспечение. Универсальное электропитание, в том числе и от бортсети автомобиля, позволяет использовать прибор в медицине катастроф.
Весьма актуальны разработки и организация серийного производства автоматизированной установки «Политест» для радиоиммунологического анализа. Данная установка необходима для клинической диагностики и массовых скрининговых обследований различных групп населения в таких областях медицины, как онкология, кардиология, эндокринология, наркология, педиатрия, акушерство и гинекология и т.д.
Радиометр позволяет определять содержание различных биологически активных веществ, меченных 125I, одновременно в 12 пробах с погрешностью менее 2% и имеет современное программное обеспечение для проведения всех видов радиоиммуного анализа, процедур контроля качества и ведения архива с результатами анализа. Установка может комплектоваться также фотометрическим блоком для проведения иммуноферментного анализа.
В последние годы ведущие мировые онкологические клиники широко используют установки для интраоперационной радиометрии на основе игловидных зондов с малоразмерными полупроводниковыми детекторами. При перитуморальном введении 99mTc – наноколлоида (т.е. в ткани около опухоли) у больных меланомой кожи и раком молочной железы подобные установки позволяют оценить распространенность опухолевого процесса путем выявления так называемых «сторожевых» лимфатических узлов. По результатам измерений решается вопрос о необходимости хирургического удаления, пораженных опухолевым процессам лимфоузлов или проведения их прицельной пункционной биопсии.
Не имеет зарубежных аналогов установка для рентгенофлюоресцентной радиометрии щитовидной железы, предназначенная для неинвазивного определения содержания нативного (нерадиоактивного) йода в щитовидной железе путем регистрации характеристического излучения йода, возбуждаемого потоком расположенного снаружи источника гамма-излучения 241Am. Данная установка необходима для массовых скрининговых исследований с целью доклинического выявления различных заболеваний щитовидной железы и организации проведения йодной профилактики.
Для подобных массовых скрининговых исследований гастроинтестинальных заболеваний предназначены установки, позволяющие измерять содержание 13С или 14С в выдыхаемом пациентом воздухе после перорального приема меченной ими мочевины. Их концентрация является показателем инфицируемости желудка пациента бактериями Helicobacter pylori, вызывающими хронический гастрит и язвенную болезнь желудка и двенадцатиперстной кишки. По результатам подобных исследований отбираются пациенты для проведения более дорогостоящей гастроскопии или рентгенографии желудка.
6. Нуклидная продукция медицинского назначения.
Основные научные исследования и промышленные мощности по производству нуклидной продукции, в том числе и медицинского назначения, были проведены и созданы в 1950-1970 годах. Россия является одним из крупнейших производителей этой продукции и поставляет около 2000 изделий на основе более 350 нуклидов. Доля в общемировом объеме поставок российской нуклидной продукции невелика и составляет приблизительно 10%. При этом, например, мощности российских ядерных центров по производству реакторных осколочных радионуклидов существенно больше, чем в Европе и ряде других регионов мира.
В настоящее время около 50 стран мира имеют производство радионуклидов медицинского назначения, с применением которых ежегодно в мире проводят более 30 млн. медицинских процедур. 8200 отделений ядерной медицины в мире оборудованы 17 000 гамма-камер для проведения процедур по диагностике и получению изображений различных частей и органов человека. Для проведения диагностики с использованием ПЭТ предназначены более 500 центров ПЭТ.
В мире имеется 3000 специализированных онкологических центров, в которых ежегодно проводят до 50 000 процедур внутритканевого облучения злокачественных новообразований (брахитерапия) с помощью гранульных имплантируемых источников гамма-излучения на основе йода-125 и палладия-103. В 1300 таких центров работают 1500 установок на основе кобальта-60 для лучевой терапии. Применение радиоиммунологического анализа позволяет проводить диагностику заболеваний без введения пациенту радиоактивного препарата.
Производство нейтроно-избыточных радионуклидов базируется на ядерных реакторах. В Азии, где спрос на радионуклиды растет, строят и вводят в эксплуатацию новые ядерные реакторы. В Северной Америке одновременно с закрытием старых ядерных реакторов строят новые промышленные реакторы, например, как в Канаде, для производства молибдена-99. В то же время в Западной Европе до сих пор нет ясности, будут ли старые реакторы, которые предполагается закрыть в ближайшее время, заменены на новые. В России треть реакторов, производящих в настоящее время радионуклиды, вероятно, будут выведены из эксплуатации и не ясно, будут ли построены для указанных целей новые.
Ключевым фактором для инвесторов производства радионуклидов для медицины на базе циклотронов является размер внутреннего спроса на них. Во многих странах мира, где ядерная медицина включена в систему обязательного медицинского страхования, спрос на радионуклиды возрастает устойчиво, и поэтому строительство циклотронов может быть профинансировано на коммерческой основе частными предприятиями. В других странах, например, в России строительство новых циклотронов сильно зависит от правительственных программ здравоохранения, которые финансирует государство, и которые предполагают использование РФП в системе государственного здравоохранения.
Позитронная эмиссионная томография и радионуклидная терапия с использованием РФП являются областями медицины, где ожидается самый высокий рост спроса на них.
В настоящее время большинство установок по производству радионуклидов работают в странах Европейского Сообщества, которые и являются их основными потребителями (таблица 9).
Таблица 9. Основные установки в мире по производству радионуклидов.
-
Типы установок
Число установок
Ядерные реакторы:
Исследовательские реакторы
Высокопоточные реакторы
Быстрые реакторы
Атомные станции
75
6
2
10
Ускорители заряженных частиц:
Специализированные циклотроны для производства
медицинских радионуклидов
Циклотроны для ПЭТ
Другие ускорители
188
48
130
10
Установки по разделению
21
Установки по производству обогащенных стабильных
нуклидов тяжелых химических элементов
9
Число стран-производителей радионуклидов:
Западная Европа
Восточная Европа и республики бывшего СССР
Северная Америка
Азия и Средний Восток
Остальной мир
50
17
8
3
12
10
Для отклика на рост спроса на радионуклиды промышленности требуется, как правило, несколько лет на строительство и получение разрешения на работу большинства установок по производству радионуклидов. Некоторые установки по производству радионуклидов для медицины, например, производственные циклотроны, являются, как правило, коммерческими, и цены на такие радионуклиды должны обеспечить полный возврат затрат на их строительство.
Для исследовательских ядерных реакторов и ускорителей частиц высокой энергии, которые не специализируются на производстве радионуклидов, их производство оценивается как побочный продукт. Во многих случаях такие установки частично финансирует правительство, реализуя научные и социальные программы.
Приоритетными видами нуклидной продукции медицинского назначения, призванными обеспечить реализацию проблемы развития ядерной медицины в России, являются:
- источники бета-, гамма - и нейтронного излучения для лучевой терапии на основе прометия-147, рутения-106, кобальта-60, иридия-192, цезия-137, иода-125, калифорния-252 и др.;
- генераторы рубидия-82, технеция-99m, индия-113m, рения-188 и других радионуклидов и неактивные наборы к ним для получения диагностических и терапевтических радиофармпрепаратов на их основе;
- радиофармпрепараты широкой номенклатуры на основе реакторных и ускорительных радионуклидов для радионуклидной диагностики и терапии;
- альфа-излучающие радионуклиды и меченные ими моно - и поликлональные антитела, синтетические полипептиды для радиоиммуной терапии;
- кислород-18 и мишени для получения фтора-18 и меченных им соединений для радионуклидной диагностики методом позитронной эмиссионной томографии;
- углерод-13, 14 и меченные ими соединения для диагностики заболеваний методом проб выдыхаемого воздуха (breath tests);
- терапевтические радионуклиды нового поколения - стронций-89, палладий-103, гольмий-166 и других и источники на их основе;
- технологии и опытно-промышленные производства кислорода-18, углерода-13, азота-15, бора-10.
6.1. Производство обогащенных стабильных нуклидов.
Обогащенные стабильные нуклиды в медицине применяются для диагностики и терапии как в элементарном виде, так и виде химических соединений их содержащих. В таблице 10 перечислены основные обогащенные стабильные нуклиды и области их применения при медико-биологических исследованиях.
| Таблица 10. | Обогащенные стабильные нуклиды, наиболее применимые для биомедицинских исследований. |
| № | Наименование обогащенных стабильных нуклидов | Применение |
| 1 | Азот-15 |
|
| 2 | Бор-10 |
|
| 3 | Ванадий-51 |
|
| 4 | Гелий-3 |
|
| 5 | Дейтерий |
|
| 6 | Железо -54, -57, -58 |
|
| 7 | Кальций -42, -44, -46, -48 |
|
| 8 | Криптон -78, -80, -82, -84, -86 |
|
| 9 | Кислород-17 |
|
| 10 | Кислород-18 |
|
| 11 | Ксенон-129 |
|
| 12 | Литий-6 |
|
| 13 | Магний -25, -26 |
|
| 14 | Медь -63, -65 |
|
| 15 | |
|
| 16 | Никель -58, -60, -61, -64 |
|
| 17 | Рубидий -85, -87 |
|
| 18 | Свинец -204, -206, -207 |
|
| 19 | Селен -74, -76, -77, -78, -80, -82 |
|
| 20 | Сера -33, -34 |
|
| 21 | Углерод-13 |
|
| 22 | Хлор -35, -37 |
|
| 23 | Хром -53, -54 |
|
| 24 | Цинк -64, -67, -68, -70 |
|
