Химия
CТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
Сложность строения атомов.
В конце XIX в. изучение электрических разрядов в газах положило конец представлению об атоме как простейшей неделимой частице элемента.
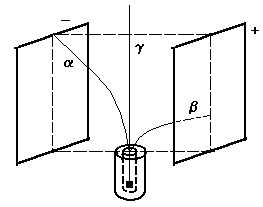
Было обнаружено, что если из стеклянной трубки, в оба конца которой впаяны металлические электроды, откачать воздух до давления менее 0,01 мм рт. ст. и подвести к электродам напряжение несколько тысяч вольт, то стекло трубки начинает светиться слабым зеленоватым светом. Свечение трубки вызывается невидимыми для глаза лучами, исходящими от отрицательно заряженного электрода - катода - и получившими вследствие этого название катодные лучи. Изучение свойств этих лучей показало, что они действуют на фотографическую пластинку, вызывают свечение стекла и других материалов, способны вращать вертушку. В магнитном и электрическом полях катодные лучи отклоняются от прямолинейного направления, причём в электрическом поле - в сторону положительно заряженного электрода (рис. 1). Твёрдое тело под действием катодных лучей приобретает отрицательный электрический заряд. Всестороннее изучение свойств этих лучей показало, что катодные лучи представляют собой поток быстродвижущихся отрицательно заряженных частиц. Масса этих частиц примерно в 1840 раз меньше массы атома водорода и составляет 0,55 а. е. м. Определение величины заряда показало, что каждая частица имеет отрицательный заряд, равный 4,810<-10бсолютной электростатической единицы или 1,6010<-1Кл. Эти частицы получили название электроны. Следовательно, электроны представляют собой мельчайшие частицы, несущие отрицательный заряд.

Рис. 2. Схема катодной трубки: К - катод, А - анод с зким отверстием в центре; Е - две металлические пластины, между которыми создано электрическое поле.
Возникновение катодных лучей наблюдается в газоразрядных трубках с катодом, изготовленным из самых разнообразных материалов. Это свидетельствует о том, что электроны входят в состав различных атомов.
Электроны излучаются из веществ (эмитируют) не только в разрядных трубках. Многие вещества испускают электроны под действием льтрафиолетовых, или рентгеновских, лучей. Щелочные металлы испускают электроны же при воздействии на них видимого света. Испускание электронв наблюдается также при нагревании многих металлов.
Если поток быстрых электронов встречает препятствие, то в результате столкновения возникает излучение, называемое рентгеновским.
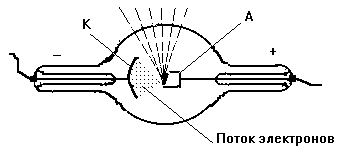
Рис. 2. Схема рентгеновской трубки.
На рис. 2 схематически показана рентгеновская трубка. Катод К трубки при нагревании испускает электроны, которые под действием приложенного к электродам высокого напряжения с громадной скоростью стремляются к аноду А. При даре электронов об анод и возникают рентгеновские лучи. Эти лучи не отклоняются ни в электрическом, ни в магнитном поле и представляют собой электромагнитные волны очень малой длины. Самая длинная рентгеновская волна почти в 200 раз короче самой короткой волны видимого света.
Рентгеновские лучи обладают способностью ионизировать газы. Под действием рентгеновских лучей часть электронейтральных молекул газов теряет электроны, превращаясь в положительно заряженные ионы, часть присоединяет электроны, превращаясь в отрицательно заряженные ионы. Вызываемая рентгеновскими лучами ионизация газов свидетельствует о сложности строения атомов.
Способность электролитов в растворённом или расплавленном состоянии проводить электрический ток также свидетельствует об их ионизации и, следовательно, о сложности атомов.
Очень важным для дальнейшего развития чения о строении атома было открытие явления радиоктивности. Французский чёный А. Беккерель обнаружил, что соединения урана являются источником излучения, которое действует на фотографическую пластинку, ионизирует воздух, проникает через непрозрачные тела.
Исследования Беккереля продолжили М. Склодовская-Кюри и П. Кюри. Эти чёные открыли в урановой руде два новых элемента - радий и полоний, обладающие высокой активностью излучения. Способность к излучению была обнаружена также у тория, актиния и ряда других элементов. Это свойство получило название радиоктивность. Было доказано, что интенсивность излучения пропорциональна количеству радиоктивного элемента независимо от того, входит ли он в состав соединений или находится в виде простого вещества. Следовательно, радиоктивность является общим свойством атомов элементов.
Исследование лучей радия показало, что они имеют сложный характер. В электрическом и магнитном полях пучок лучей радия расщепляется на три пучка, которые были названы Рис. 3. Расщепление радиоктивного луча в электрическом поле. b<-Лучи,
подобно катодным в электрическом поле, отклоняются в направлении положительно заряженной пластинки. Было становлено, что g<-Лучи,
как и рентгеновские лучи, не изменяют своего направления ни в электрическом, ни в магнитном поле. Подобно видимому свету и рентгеновским лучам, Обстоятельное изучение свойств радия показало, что во время радиоктивного излучения он распадается, образуя два новых элемента: гелий и радон. Происходит превращение атомов одного элемента в атомы других элементов. Таким образом, ионизация идкостей и газов и особенно явление радиоктивности бедительно доказывают, что атомы не являются неделимыми, состоят из более простых частиц. Планетарная модель атома Резерфорда. Принимая во внимание изложенное выше, также электронейтральность атома, следует заключить, что в нём должна находиться положительно заряженная составная часть,
заряд которой равновешивает отрицательные заряды электронов. Эта положительно заряжнная часть атома, открытая в 1911 г. английским физиком Э. Резерфордом, была названа ядром атома. Резерфорд изучал траектории полёта Рис. 4. Рассеяние Проходя через фольгу, Если предположить, что атом, ядро и электрон имеют форму шара, то диаметр атома будет равен примерно 10<-8 см, диаметр ядра - 10<-13 см, т. е. ядро занимает примерно 1/1015 часть объёма атома. Если для наглядности представить себе атом величенным до размеров шара диаметром 100 м (высота тридцатиэтажного дома), то ядро атома в этом случае имело бы диаметр не более 1 мм. В то же время масса атома фактически сосредоточена в ядре. Следовательно, плотность атомных ядер очень велика. Если бы можно было собрать 1 см3томных ядер,
то их масса оказалась бы равной приблизительно 116 млн. т. Э. Резерфорд предложил планетарную модель атома,
согласно которой ядро находится в центре атома, электроны вращаются вокруг ядра подобно планетам, вращающимся вокруг Солнца. Заряды электронов уравновешиваются положительным зарядом ядра, и атом в целом остаётся электронейтральным. Возникающая вследствие вращения электронов центробежная сила равновешивается электростатическим притяжением электронов к противоположно заряженному ядру. Опыты по рассеянию Создание Резерфордом планетарной, или ядерной, модели атома было крупным шагом вперёд в познании строения атома. Но в некоторых случаях эта теория вступала в противоречие с твёрдо становленными фактами. Так,
планетарная модель не могла объяснить стойчивости атома. Вращаясь вокруг ядра,
электрон должен часть своей энергии испускать в виде электромагнитных колебаний, что должно привести к нарушению равновесия между электростатическим притяжением электрона к ядру и центробежной силой, обусловленной вращением электрона вокруг ядра. Для восстановления равновесия электрон должен переместиться ближе к ядру. Следовательно, непрерывно излучая электромагнитную энергию, электрон должен постепенно приближаться к ядру и в конце концов пасть на него - существование атома должно прекратиться. В действительности атом очень стойчив и может существовать бесконечно долго. Модель Резерфорда не могла объяснить также характер атомного спектра. Известно, что солнечный свет, проходя через стеклянную призму, образует спектр - цветную полосу, содержащую все цвета радуги. Это явление объясняется тем, что солнечный свет состоит из электромагнитных волн различных частот. Волны различных частот неодинаково преломляются призмой, что приводит к образованию сплошного спектра. Аналогично ведёт себя свет, излучаемый раскалёнными жидкостями и твёрдыми телами. Спектр раскалённых газов и паров представляет собой отдельные цветные линии, разделённые тёмными промежутками, - линейчатый спектр.
При этом атомы одного элемента дают вполне определённый спектр, отличающийся от спектра другого элемента. На рис. 5 показана видимая часть атомного спектра водорода. Рис. 5. Атомный спектр водорода в видимой области. Линейчатый характер спектра водорода не согласуется с теорией Резерфорда, так как излучающий энергию электрон должен приближаться к ядру непрерывно, и его спектр должен быть непрерывным, сплошным. Следовательно,
планетарная модель атома не могла объяснить ни стойчивости атомов, ни линейчатый характер спектра газов и паров. Строение атома по Бору. Следующим шагом в развитии представлений о строении атома явилась теория, созданная в 1913 г. датским физиком Н.
Бором. Эта теория объединила ядерную модель атома с квантовой теорией света.
Согласно квантовой теории света, лучистая энергия испускается или поглощается телами отдельными порциями - квантами,
а излучение представляет собой поток фотонов,
энергия которых тем больше, чем выше частот излучения. Принимая во внимание линейчатый характер атомных спектров и положение квантовой теории света о прерывистом характере излучения, Бор в основу своей теории положил представление о дискретном, прерывном изменении энергии электрона в атоме. Согласно теории Бора, электроны могут обращаться вокруг ядра атома только по строго определённым, разрешённым круговым орбитам, причём, двигаясь по таким орбитам, электроны не излучают электромагнитную энергию. То, какую именно разрешённую орбиту будет занимать электрон, зависит от энергии атома. В основном,
невозбуждённом состоянии атом обладает минимальной энергией, и электрон вращается по наиболее близкой к ядру орбите. В этом случае связь электрона с ядром наиболее прочная. Если атом получает дополнительную порцию энергии, он переходит в возбуждённое состояние. При этом электрон перемещается на одну из наиболее далённых от ядра орбит. Таким образом,
энергия электрона в возбуждённом атоме больше, чем энергия электрона в атоме в основном, невозбуждённом состоянии. Возбуждённое состояние атома очень непродолжительно: оно длится лишь стомиллионные доли секунды, после чего электрон возвращается на исходную орбиту. Он может перейти с отдалённой орбиты на исходную непосредственно либо через находящиеся между ними другие разрешённые орбиты. Этот переход электрона сопровождается меньшением энергии атома и выделением её в виде электромагнитного излучения. По Бору, излучение энергии атома происходит только при переходе электрона с более отдалённых орбит на орбиты, расположенные ближе к ядру. Электрон, движущийся по одной и той же орбите, не излучает энергию.
В атоме, находящемся в основном состоянии, электрон может вращаться бесконечно долго, т. е. такой атом является очень стойчивой системой. При переходе электрона с более отдалённой от ядра орбиты на орбиту, более близкую к ядру,
энергия излучения изменяется не непрерывно, порциями - квантами. Величина кванта энергии связана с частотой излучения E = EЦ E1а<= h где E1аи EЧ энергия атома в состояниях 1 и 2; h - постоянная Планка, равная 6,625103Дж/с; c - скорость света, равная 2,998108ам/с. В классической механике вращение тела вокруг центра определяется моментом количества движения
mvr, где m - масса тела; v - скорость его движения; r - радиус окружности, по которому оно вращается. По Бору момент количества движения электрона в атоме водорода может быть равен только целому числу квантов действия nh/2
m Принимая во внимание равенство центробежной силы (f1а<= m m Cочетая уравнения (1) и (2), находим: r = h2 Полученные равнения позволяют рассчитать радиусы разрешённых орбит в атоме водорода и скорости движения по ним электрона. Например, для основного состояния атома водорода (n
= 1): r = (6,62510<-27)2
u = 23,14(4,810<-10)2
Радиус следующей орбиты (n = 2) равен 0,212 нм, скорость движения электрона на этой орбите составляет 1/2 его скорости на первой орбите, т. е. примерно 1100 км/с.
Это очень высокая скорость (для сравнения можно казать, что скорость космического корабля "Восток" составляла около 8 км/с). Теория Бора находилась в резком противоречии с положениями классической механики, которая допускает вращение электрона по любой орбите и считает невозможным движение заряженной частицы по круговой орбите без излучения энергии. Однако рассчитанные Бором атомные спектры хорошо совпадали со спектрами, полученными экспериментально. Так, в атомном спектре водорода линии в льтрафиолетовой части оказались связанными с переходами электрона с более далённых разрешённых орбит на ближайшую к ядру. Линии в видимой части спектра (см. рис. 5)
соответствовали переходам электрона с третьей (H Таким образом,
теория Бора не только объяснила физическую природу линейчатого характера атомных спектров как результат перехода электрона с одной разрешённой орбиты атома на другую, но и позволила рассчитать положение линий в спектре. В дальнейшем в теорию Бора были внесены дополнения, допускавшие возможность движения электрона в атоме не только по круговым, но и по эллиптическим орбитам, расположенным в различных плоскостях. Несмотря на эти дополенния и совершенствования, теория Бора не смогла объяснить некоторые свойства многоэлектронных атомов. Современные представления о строении атома. Подтверждённая экспериментально в 1927 г.
двойственная природа электрона, обладающего свойствами не только частицы, но и волны, побудила чёных к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику. Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определённую массу покоя), с другой - его движение напоминает волну и может быть описано определённой амплитудой, длиной волны,
частотой колебаний и др. Поэтому нельзя говорить о какой-либо определённой траектории движения электрона - можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства. Cледовательно,
под электронной орбитой следует понимать не определённую линию перемещения электрона, некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами, электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определённом расстоянии от ядра.
В связи с этим электрон представляют не в виде материальной точки, как бы
"размазанным" по всему объёму атома в виде так называемого электронного облака, имеющего области сгущения и разрежения электрического заряда. Представление об электроне как о некотором облаке электрического заряда добно; оно довольно точно передаёт особенности поведения электрона. Однако следует иметь в виду, что электронное облако не имеет резко очерченных границ, и даже на большом расстоянии от ядра существует вероятность пребывания электрона. Для характеристики формы электронного облака понятие орбиталь вместо понятия орбита было введено именно для того, чтобы не смешивать движение электрона с движением тела в классической физике. Однако при прощённом рассмотрении строения атома иногда сохраняют термин орбита, помня тем не менее об особом характере движения электрона в атоме. По современным представлениям состояние элетрона в атоме описывается четырьмя квантовыми числами. Главное квантовое число n характеризует величину энергии электрона и может принимать только положительные целочисленные значения: 1, 2, 3 и т. д. С величением главного квантового числа энергия электрона возрастает. Состояние электрона,
отвечающее определённому значению главного квантового числа, называют энергетическим ровнем электрона в атоме. Помимо энергии электрона главное квантовое число определяет размеры электронного облака: чем выше значение главного квантового числа, тем больше электронное облако. Электроны, характеризующиеся одним и тем же квантовым числом, имеют электронные облака приблизительно одинаковых размеров. Поэтому говорят о существовании в атоме электронных слоёв. Электронные слои обозначают большими буквами латинского алфавита K,
L, M, N, O, причём K-слой является первым от ядра атома, ему соответствует главное квантовое число n = 1, L-слой - вторым, M-слой - третьим и т. д.
Электроны, образующие данный слой, могут обладать несколько отличающейся друг от друга энергией и иметь орбитали различных форм. Из квантовомеханической теории следует, что с величением главного квантового числа n изменяются число и характер электронных орбиталей в пределах данного электронного слоя.
Количество орбиталей для каждого значения n равно квадрату главного квантового числа (n2). Второе квантовое число l, описывающее форму электронного облака, называется орбитальным квантовым числом. При данном главном вантовом числе n орбитальное квантовое число l может принимать любые целочисленные значения от 0 до nЦ1. Соответствующие орбитали обозначаются строчными буквами латинского алфавита: s (l
= 0), p (l = 1), d (l = 2), f (l = 3). Орбитальное квантовое число отображает энергию электрона на подуровне. Электроны с различными орбитальными квантовыми числами несколько отличаются друг от друга: их энергия тем выше, чем больше число l. Число возможных подуровней в каждом энергетическом ровне совпадает с порядковым номером электронного слоя, но фактически ни один энергетический ровень не содержит больше четырёх подуровней. Это справедливо для стационарного состояния атомов всех элементов. Так, первому энергетическому ровню соответствует
s-подуровень; второму ровню - два подуровня: s и p; третьему ровню - три подуровня: s, p и d; четвёртому и следующим ровням Ччетыре подуровня: s, p, d
и f. Ориентацию орбиталей в пространстве определяет третье квантовое число, называемое магнитным квантовым числом и обозначаемое m. При данном орбитальном квантовом числе l магнитное квантовое число m может принимать любые целочисленные значения от Цl до +l, в том числе нулевое значение. Оно определяет число орбиталей в одном и том же электронном слое: одна s-орбиталь
(m = 0), три p-орбитали (m равно Ц1, 0, +1), пять d-орбиталей (m равно Ц3, Ц2,
Ц1, 0, +1, +2, +3). Орбитали с различными магнитными квантовыми числами, но с одинаковым главным и орбитальным квантовыми числами характеризуются одной и той же энергией. Магнитное квантовое число есть вектор, следовательно, ему соответствует не только определённое числовое значение, но и определённое направление, что выражается в знаках "+" и "Ц". Четвёртое квантовое число, называемое спином и обозначаемое m Форма электронных облаков. Электронное облако не имеет резко очерченных границ в пространстве, поэтому представления о размерах и форме электронного облака требуют специального пояснения. Обратимся к рис. 7, на котором изображено электронное облако атома водорода. В этом облаке можно провести поверхности, на которых электронная плотность будет иметь одинаковое значение. В случае атома водорода это сферические поверхности,
внутри которых заключена большая или меньшая часть электронного облака. Если проведённая поверхность охватывает 90 % заряда и массы электрона, её называют граничной поверхностью. Размер и форму граничной поверхности отождествляют с размером и формой электронного облака. Рис. 6. Электронное облако Рис. 7. Зависимость вероятности пребывания 1s- 1s-электрона. электрона в данной точке
пространства от её отдалённости от ядра. Рассмотрим зависимость вероятности W*апребывания электрона в данной точке пространства от её отдалённости от ядра r на примере 1s-электрона атома водорода. Цифра 1 показывает, что главное квантовое число n = 1, буква s Ч равенство нулю его орбитального квантового числа: l = 0. Из рис. 7 следует, что вероятность обнаружения электрона на малых расстояниях от ядра, так же, как и на больших, близка к нулю. На некотором расстоянии от ядра r0авероятность нахождения электрона максимальна. Для атома водорода это расстояние точно совпадает с радиусом первой боровской орбиты и равно 0,053 нм. Однако следует иметь в виду, что, по Бору, эта величина показывает, на каком расстоянии от ядра электрон находится,
а по представлениям квантовой механики это расстояние отвечает максимальной вероятности обнаружения электрона. Следовательно, в отличие от модели атома по Бору, электрон может находиться и на других расстояниях от ядра - как меньших,
так и больших 0,053 нм. Характер зависимости W от r для 1s-электрона свидетельствует о том, что электронное облако 1s-электрона обладает сферической симметрией, т. е. имеет форму шара с ядром в центре. s-Электроны с главным квантовым числом n, равным 2, 3, 4... также обладают сферической симметрией.
По мере того, как главное квантовое число возрастает, расстояние наиболее вероятного пребывания электрона от ядра также величивается, и электронное облако становится более размытым. На рис. 8 схематически показано электронное облако 2s-орбитали (2s-электрона). Рис. 8. Электронное облако Рис. 9. Зависимость вероятности пребывания 2s-электрона. 2p-электрона в данной точке пространства от её
отдалённости от ядра. Для
2p-электронов (главное квантовое число n = 2, орбитальное квантовое число l = 1) кривая зависимости вероятности обнаружения электрона W от расстояния r имеет максимум (рис. 9). Такому распределению вероятности обнаружения 2p-электрона соответствует форма электронного облака, напоминающая двойную грушу или восьмёрку. Магнитное квантовое число 2p-электронов может иметь три значения: Ц1, 0 и +1, что соответствует ориентации восьмёрки вдоль трёх координатных осей: x, y, z. Иными словами, три p-электронных облака ориентированы в пространстве во взаимно перпендикулярных направлениях. Поэтому три 2p-электронных облака обозначают так: 2p Для
3d-электронов (главное квантовое число n = 3, орбитальное квантовое число l = 2) возможны пять вариантов пространственного расположения электронного облака, отвечающие пяти значениям магнитного квантового числа m: Ц2, Ц1, 0, +1, +2. Все электроны 3d-орбиталей имеют одинаковую энергию. Структура электронной оболочки многоэлектронного атома. В атоме водорода на электрон действует только сила притяжения положительно заряженного ядра. В многоэлектронном атоме к этому взаимодействию прибавляется взаимное отталкивание электронов. Электроны внутренних слоёв атома ослабляют притяжение внешнего электрона ядром, как бы экранируют внешний электрон от ядра. При этом экранирование оказывается различным для электронов с неодинаковой формой электронного облака. Поэтому в многоэлектронных атомах энергия электрона зависит не только от главного квантового числа n, но и от орбитального квантового числа l, определяющего форму электронного облака. Самой низкой энергией обладают электроны s-орбитали, составляющие первый электронный слой.
Энергия электронов второго слоя намного больше энергии электронов первого;
между энергиями 2s- и 2p-электронов, составляющих второй электронный слой, есть небольшое различие. Энергетические ровни всех орбиталей третьего электронного уровня ещё выше. Однако при переходе к четвёртому электронному слою и далее это правило нарушается: отдельные орбитали следующего слоя обладают меньшей энергией, чем наиболее высокие орбитали предыдущего слоя. Например, 4s-орбиталь имеет меньшую энергию, чем 3d-орбиталь предыдущего слоя. В общем случае энергия электронов (nЦ1)d-орбитали всегда больше энергии электронов ns-орбитали и меньше энергии электронов np-орбитали. Энергия 4f-электронов оказывается выше энергии 5s-, 5p- и 6s-электронов. При заполнении электронных слоёв атома в стационарном (невозбуждённом) состоянии выдерживается принцип наименьшей энергии электрона,
в соответствии с которым наиболее стойчивому состоянию электрона в атоме отвечает минимальная из возможных энергия этого электрона. Поэтому заполнение электронных слоёв начинается с ровней, характеризующихся самой низкой энергией. Русский чёный В. М. Клечковский становил, что энергия электрона возрастает по мере увеличения суммы главного и орбитального квантовых чисел (n + l). В соответствии с правилом Клечковского заполнение электронных слоёв происходит в порядке увеличения сумм главного и орбитального квантовых чисел (n + l). Так, сумма (n + l) для электронов 3d-орбитали равна 5 (3
+ 2), для электронов 4s-орбитали - 4 (4 + 0). Поэтому вначале электронами заполняется 4s-орбиталь, затем 3d-орбиталь. Сумма (n + l) для электронов 4f-орбитали равна 7 (4 + 3), что также больше суммы (n + l) для электронов 5s-, 5p-
и 6s-орбиталей. Если для двух орбиталей суммы (n + l) имеют одинаковые значения, то вначале электронами заполняется орбиталь с меньшим значением главного квантового числа. Например, для электронов 3d- и 4p-орбиталей сумма n + l
= 5 (соответственно 3 + 2 и 4 + 1). Но так как для электронов 3d-орбитали главное квантовое число n = 3, для электронов 4p-орбитали n = 4, в первую очередь заполняются 3d-орбитали. Лишь после того как заполнены орбитали меньших энергий, начинается заполнение орбиталей бóльших энергий. При заполнении электронных слоёв кроме принципа наименьшей энергии выполняется принцип (запрет) Паули, согласно которому в атоме не может быть двух электронов с одинаковым значением всех квантовых чисел. Из этого следует, что на каждой орбитали, характеризующейся определёнными значениями главного n, орбитального l и магнитного m Принцип Паули позволяет рассчитать максимальное число электронов на каждом энергетическом ровне и подуровне в атоме. Максимальное число электронов на подуровне с орбитальным квантовым числом l равно 2(2l + 1). При l = 0 (s-подуровень) магнитное квантовое число тоже равно нулю.
Следовательно, на s-подуровне имеется всего одна орбиталь, и максимальное число электронов на s-подуровне каждого электронного слоя равно двум. При l = 1 (p-подуровень) магнитное квантовое число m Строение каждого электронного слоя зависит от значения главного квантового числа. Так,
K-слой (n = 1) состоит лишь из одной s-орбитали; L-слой (n = 2) содержит одну
2s-орбиталь и три 2p-орбитали; M-слой (n = 3) состоит из одной 3s-орбитали,
трёх 3p-орбиталей и пяти 3d-орбиталей и т. д. Электронная ёмкость слоя,
определяемая максимальным количеством электронов N в данном электронном слое,
описывается формулой: N = 2n2, где n - главное квантовое число. Рассчитанное по этой формуле максимальное количество электронов в каждом слое оказывается равным: для K-слоя - 2, для L-слоя - 8, для M-слоя - 18, для
N-слоя - 32 электронам. Расположение электронов по слоям и орбиталям называется электронной конфигурацией. При записи электронной конфигурации казывают значение главного квантового числа, затем - буквами s, p, d, f - значение орбитального квантового числа, вверху справа над буквой - число электронов на данной орбитали. Например, запись 2p4аозначает, что во втором электронном слое на p-орбиталях находится четыре электрона. Последовательность заполнения электронами орбиталей различных электронных слоёв можно представить себе следующим образом: 1s22s22p63s23p64s23d104p65s24d105p66s2а... В сокращённых формулах, выражающих распределение электронов в атомах, часто казывают лишь число электронов в каждом электронном слое. В качестве примера рассмотрим распределение по орбиталям электронов атомов хлора. Порядковый номер хлора в периодической системе элементов - 17. Это значит, что положительный заряд ядра атома равновешивается 17 электронами. На заполнение K-слоя идёт 2 электрона,
второй электронный слой, L-слой, может вместить 8 электронов. Остальные 7 электронов располагаются в третьем слое - M-слое. Ёмкость этого слоя - 18 электронов Ч вполне достаточна, чтобы принять 7 электронов. Электронную конфигурацию атома хлора можно записать так: 17Cl - 2, 8, 7. Периодический закон Д. И. Менделеева. По мере накопления сведений о свойствах химических элементов возникла настоятельная необходимость их классификации. Ко времени открытия Д. И. Менделеевым периодического закона было известно же более 60 элементов. Многие химики пытались разрабатывать систематику элементов. Этим занимались А. Э. Б. Шанкурту во Франции, Л. Ю.
Мейер и И. В. Деберейнер в Германии, Дж. А. К. Ньюлендс в Англии и др. Так,
Ньюлендс, размещая элементы в порядке возрастания их атомных масс, заметил, что химические свойства восьмого элемента подобны свойствам первого. Этой закономерности он дал название закон октав. Деберейнер составлял триады из сходных по химическим свойствам элементов и казывал, что в триадах атомная масса среднего элемента приблизительно равна среднему арифметическому атомных масс двух крайних элементов. Шанкурту разместил элементы в порядке возрастания их атомных масс по винтовой линии, описанной вокруг цилиндра. Сходные элементы при этом располагались друг под другом. Мейер, разместив элементы в порядке величения их атомных масс, получил шесть групп подобных элементов. Однако никто из названных исследователей не сумел за этими отдельными аналогиями видеть один из основных законов хим. Задача была решена в 1869 г. великим русским учёным Дмитрием Ивановичем Менделеевым. Открытый им периодический закон и созданная на его основе периодическая система элементов стали фундаментом современной химии. Изучая свойства химических элементов, Д. И. Менделеев пришёл к выводу, что многие свойства определяются атомной массой элементов. Поэтому в основу систематики элементов он положил атомную массу как "точное, измеримое и никакому сомнению не подлежащее" свойство. По мнению Менделеева, "масса вещества есть именно свойство его, от которого должны находиться в зависимости все остальные свойства. Поэтому ближе или естественнее всего искать зависимость между свойствами и сходствами элементов, с одной стороны, и атомными весами их,
с другой стороны". Менделеев разместил все известные в то время элементы в порядке возрастания их атомных масс и обнаружил, что в полученном ряду наблюдается периодичность изменеия свойств элементов. Например, в ряду от Li к F по мере величения атомной массы наблюдалось закономерное изменение химических свойств элементов и их соединений. Литий является типичным металлом, у следующего за ним элемента Ч бериллия - металлические свойства выражены же значительно слабее. По величине атомной массы за бериллием идёт бор - элемент с неметаллическими свойствами. В ряду элементов от глерода до фтора происходит силение неметаллических свойств, и фтор же выступает как типичный неметалл. Следующий за фтором элемент - натрий - резко отличается по свойствам от фтора, но проявляет большое сходство с литием. При переходе от натрия к хлору вновь наблюдается постепенное ослабление металлических и нарастание неметаллических свойств. Периодически повторяются не только химические свойства элементов, но и формулы их соединений. Например, литий образует с кислородом соединение состава Li2O; аналогичную формулу имеет соединение натрия с кислородом - Na2O. Д. И. Менделеев сформулировал открытый им закон так: свойства простых тел, также формулы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов. Первый вариант периодической системы элементов Менделеев опубликовал в 1869 г. Все элементы он разместил в порядке величения их атомных масс, однако с таким расчётом, чтобы подобные по свойствам элементы оказались друг над другом. Сходные элементы,
вошедшие в один вертикальны ряд, Менделеев объединил в группы.
Последовательность элементов, в пределах которой закономерно изменяются свойства элементов от типичного металла до типичного неметалла, была названа периодом. При составлении периодической системы Менделеев, беря за основу атомные массы элементов,
не оставлял без внимания и их химические свойства. Так, в некоторых случаях в таблице нарушен принцип расположения элементов по возрастанию их атомных масс.
Например, теллур, атомная масса которого больше атомной массы иода, стоид перед иодом. В противном случае иод находился бы в одной группе с серой, не с хлором, с которым он проявляет большое сходство. Так же поступил чёный с парой элементов калий - аргон. Атомная масса калия меньше атомной массы аргона,
однако в таблице калий был помещён после аргона и оказался в одной группе с другими щелочными металлами. При составлении периодической системы Д. И. Менделееву пришлось преодолеть немало трудностей, связанных с тем, что одни элементы в то время ещё не были открыты,
свойства других были мало изучены, атомные массы третьих были определены неправильно. чёный глубоко верил в правильность открытого им закона, был твёрдо беждён в том, что периодический закон отражает объективную реальность.
На основании периодической системы он исправил атомные массы ряда элементов,
предсказал существование в природе нескольких ещё не открытых элементов и даже описал свойства этих элементов и их соединений. Эти элементы были открыты в течение последующих пятнадцати лет: в 1875 г. П. Э. Лекок де Буабодран открыл элемент номер 31, назвав его галлием; в 1879
г. Л. Ф. Нильсон открыл элемент номер 21 и назвал его скандием; в 1886 году К. А. Винклер открыл элемент 32, который был назван германием. Менделеев предсказал физические и химические свойства этих трёх элементов на основании свойств окружающих их в таблице элементов. Например, атомную массу и плотность элемента номер 21 он рассчитал как среднее арифметическое атомных масс и плотностей бора, иттрия, кальция и титана. Ниже в качестве примера приведены свойства элемента с порядковым номером 32 Ч германия, которые были предсказаны Менделеевым и впоследствии экспериментально подтверждены Винклером. Свойства элемента № 32, Свойства германия, становленные предсказанные Менделеевым в 1871 г.: опытным путём в 1886 г.: томная масса - 72; атомная масса - 72,6; серый тугоплавкий металл; серый тугоплавкий металл; плотность - 5,5 г/см3; плотность - 5,35 г/см3; должен получаться восстановлением получается восстановлением оксида оксида водородом; водородом; формула оксида - ЭО2; формула оксида - GeO2; плотность оксида - 4,7 г/см3; плотность оксида - 4,7 г/см3; хлорид ЭClЧ жидкость; хлорид
GeClЧ жидкость; плотность ЭClЧ 1,9 г/см3; плотность
GeClЧ 1,887 г/см3; температура кипения ЭClЧ 90 оС. температура кипения GeClЧ 90 оС. Открытие предвиденных Менделеевым элементов и блестящее совпадение предсказанных им свойств с становленными опытным путём привело к всеобщему признанию периодического закона. Следует отметить, что Менделеев сомневался в возможности резкого перехода от таких активных неметаллов, какими являются галогены, к щелочным металлам. Он полагал,
что этот переход должен быть более плавным. Вскоре это научное предвидение оправдалось: были открыты инертные газы. В периодической системе не было свободных мест для этих элементов, и они были выделены в самостоятельную группу. С целью подчеркнуть большую химическую инертность этих элементов группа была названа нулевой. В настоящее время известно много вариантов периодической системы элементов, однако наиболее удобной остаётся таблица, предложенная Д. И. Менделеевым. В первоначальный вариант таблицы позже были внесены некоторые дополнения. Часть из них была сделана самим чёным. К настоящему времени получен ряд соединений тяжёлых благородных газов, в которых степень окисления составляет +6 и +8 (XeF6, XeO3, XeO4аи др.). В связи с этим инертные газы включены в восьмую группу периодической системы, в которой они составляют главную подгруппу. Периодическая система элементов Д. И. Менделеева. Современная периодическая система элементов имеет семь периодов, из которых I, II и
называются малыми периодами, IV, V,
VI и VI - большими периодами. I, II и
периоды содержат по одному ряду элементов,
IV, V и VI - по два ряда, VII период незаконченный. Все периоды, за исключением I, содержащего лишь два элемента, начинаются щелочным металлом и заканчиваются благородным газом. В больших периодах изменение свойств при переходе от активного металла к благородному газу происходит более плавно, чем в малых периодах. Большие периоды состоят из чётных и нечётных рядов. В этих периодах наблюдается двойная периодичность:
помимо характерного для всех периодов изменения свойств от щелочного металла до благородного газа наблюдается также изменение свойств в пределах чётного ряда и отдельно - в пределах нечётного ряда. Например, в чётном ряду IV периода валентность изменяется от 1 у калия до 7 у марганца; после триады железо - кобальт - никель происходит такое же изменение валентности в нечётном ряду: от
1 у меди до 7 у брома. Подобная двойная периодичность наблюдается и в других больших периодах. У элементов чётных рядов преобладают металлические свойства, и их ослабление справа налево замедленно. В нечётных рядах происходит заметное ослабление металлических свойств и силение неметаллических. Особое положение в периодической системе занимают элемент номер 57 - лантан - и следующие за ним 14 элементов, объединённых под названием лантаноиды. Эти элементы по химическим свойствам похожи на лантан и очень сходны между собой.
Поэтому в периодической системе лантану и лантаноидам отведена одна клетка.
Аналогичным образом в одну клетку VII периода помещены элемент номер 89 Ч актиний - и следующие за ним 14 элементов - так называемые актиноиды. Элементы
II и периодов Менделеев назвал типическими.
Подгруппы, содержащие типические элементы, называются главными. Элементы чётных рядов (для I и II групп - нечётных) составляют побочные подгруппы. Элементы главных подгрупп по химическим свойствам значительно отличаются от элементов побочных подгрупп. Особенно наглядно это различие в VII и V группах периодической системы элементов. Например, главную подгруппу в V группе составляют благородные газы He, Ne, Ar, Kr, Xe, Rn, побочная подгруппа представлена триадами элементов: Fe, Co, Ni - в IV периоде, Ru, Rh, Pd - в V
периоде, Os, Ir, Pt - в VI периоде. В отличие от благородных газов названные элементы имеют ярко выраженные металлические свойства. Номер группы,
как правило, показывает высшую валентность элемента по кислороду. Ряд исключений существует для элементов подгруппы меди, VII иа
V групп. Так, медь, серебро и золото образуют соединения, в которых валентность этих элементов достигает 3. Элемент VII группы - фтор - имеет только валентность 1, высшая валентность других элементов по кислороду равна
7. В V группе валентность 8 проявляют только осмий, рутений и ксенон. Элементы главных подгрупп характеризуются также валентностью по водороду. Летучие водородные соединения образуют элементы IV, V, VI и VII групп. Валентность по водороду при переходе от элементов IV группы к элементам VII группы меньшается от 4 до 1. Напротив, валентность этих элементов по кислороду в том же направлении возрастает от 4 до 7.