Читайте данную работу прямо на сайте или скачайте
Аминокислоты
Нацональний Унверситет Ки
во-Могилянська Академя
Реферат
тема: №36 Амнокислоти: одержання, властивост, роль у бологÿ
виконав студент ФПН-1
Коваль Сергй
Кривий Рг 2008
АМ
НОКИСЛОТИ
Органчн сполуки, що мстять в молекул карбоксильну та амно групи, називають- амнокислотами. Амнокислоти мають надзвичайно велике значення в органчному свт, тому що з них побудован блков речовини клтин, що виконують ряд нших важливих функцй в живому органзм: структурн блки, ферменти, гормони, транспортн блки, захисн, запасаюч, скорочувальн, токсини.
ЗОМЕР
Я. НОМЕНКЛАТУРА.
мнокислоти називають звичайно як замсники вдповдних карбонових кислот, позначаючи положення амно групи буквами латинського алфавта. Застосову
ться також систематична номенклатура, для найпростших- мпричн назви:
CN2NH2-COOHа амнооцтова кислота, амноетанова кислота, глкол, глцин.
CH3-CHNH2-COOHа a-амнопропонова кислота, 2-амнопропонова кислота, аланн.
CH3-CH2-CH-CHNH2-COOHа 2-амно-3-метилпентанова кислота
/ золейцин.
CH3
CH3-CHOH-CHNH2-COOH a-амно-b-оксимасляна, 2-амино-3-оксибутанова кислота, треонн.
зомеря амнокислот аналогчна зомерÿ оксикислот.Вона може бути повТязана з положенням функцональних груп та будовою вуглицевого скелета. Молекула амнокислоти може вмщувати як одну так деклька карбоксильних груп вдповдно до цього амнокислоти вдрзняються по основност.В молекул амнокислоти може вмщувати також деклька амногруп.
Гомологчний ряд одноосновних амнокислот необхдно б було починати з амномурашини
Оцтова кислот ма
одну похдну амнокислоту H2N-CH2-COOH. Пролнова -дв: CH3-CHNH2-COOH a-амнопропонова кислота, (a-аланн), CH2NH2-CH2-COOH b-амнопропонова кислот (b-аланн)
Вд масляно
CH3-CH2-CHNH2-COOH a-амномасляна кислота
CH3-CHNH2-CH2-COOH b-амномаслянакислота
CH2NH2-CH2-CH2-COOH g-амномасляна кислота
Вд зомасляно
a-амнозомасляна кислота
b-амнозомасляна кислот H2N-CH2-CH-COOH
/
CH 3
ШЛЯХИ ОТРИМАННЯ АМ
НОКИСЛОТ.
Розроблено багато шляхв отримання a-амнокислот. Найважливш з них три:
1.Дя амака на сол хлорзамсних кислот:
NH2-H+CL-CH2-COONH4------HCL---оNH2-CH2COOHNH4
2. Дúю амака та цаново
CH3-C=O ----+HN3-----H2O--оCH3-CH=NH--+HCN-оCH3-CH-CºN--+HOH: [H2]---NH3о
/ /
H NH2
оCH3-CH-COOH
/
NH 2
3.a-Амнокислоти також можна синтезувати з амномалинового ефра за наступною схемою:
NO-CH(COOR)2
CH2(COOR)2ЧR*ONO---R*OHон¯ --+H2-[Ni]оNH2-CH(COOR)2ЧC6H5OCL--HCLо
HON=C(COOR)2а
ÞC6H5CO-NH-CH(COOHR)2--+RONa---ROH-о[C6H5CO-NH-C(COOR)2]Na+--R*I---NaI--оC6H5CONH-CR*(COOR)2ЧH+, HOHЧC6H5COOH-оNH-CR*(COOH)2 ----CO2-оNH2-CHR*-COOH
4. При гдролз блкв отримано близько 25 рзномантних амнокислот. Роздлення тако
Шляхи отримання b-амнокислот. Найбльш важливими
наступн два способи отримання цих кислот:
1. При
днання амака до вдповдних кислот. Амак до олефнв без каталзаторв не при
дну
ться. При
днання тут проходить так як нш реакцÿ a,b-ненасичених кислот, ане заправилом Марковникова:
CH2=CH-COOH --+2NH3оNH2-CH2-CH2-COONH4
2.Велика кльксть амнокслот була синтезована В.М.Родоновим з малиново
Ця реакця схожа з реакцúю отримання b-оксикислот з альдегидв. Можливо, що промжними продуктами тут
оксисполуки, проте механзм ц㺿 реакцÿ до кнця ще не зТясовано.
Шляхи отримання нших амнокислот. Амнокислоти з бльш вддаленими одна вд одно

 H2C CH2 H2C CH2
H2C CH2 H2C CH2
 |
 |
 |
 |
||||
H2C C=O ЦH2N-OH--HOHо H2C C=N-OH--[H2SO4]о
 |
 |
 |
 |
||||

 H2C CH2 H2C CH2
H2C CH2 H2C CH2
циклогексанон циклогексаноноксим

 H2C CH2а OH
H2C CH2
H2C CH2а OH
H2C CH2




 CO
CO


 H2C С=Nа о м H2C NH
H2C С=Nа о м H2C NH
 |

 H2C CH2 H2C CH2
H2C CH2 H2C CH2
капролактам
Капролактам при гдролз творю
w- або e-амнокапронову кислоту, при нтруванн з подальшим вдновленням- лактам 2,6-диамнокапронову кислотую(лзин).
Фзичн властивост.
мнокислоти-безбарвн кристалчн речовини з високими температурами плавлення, як мало вдрзняються для цих кислот тому не характерн. Плавлення супроводжу
ться розкладом речовини. У вод амнокислоти
добрерозчинними. Водн розчини одноосновних амнокислот майже завжди мають майже нейтральну реакцю.
Висок температури плавлення, вдсутнсть в спектр нй, характерних для карбоксильно
В зоелектричнй точц, коли концентраця катонв та анонв рвн, конценотраця бполярного она максимальна рух його в електричному пол не вдбува
ться. Положення рвноваги залежить вд pH середовища.
Бльшсть природнх амнокислот оптичноктивн вналлдок наявност асемитричного атома карбону. В пирод розповсюджена кислоти L-ряду.
Х
М
ЧН
ВЛАСТИВОСТ
.
Подбно до нших сполук з змшаними функцональними групами амнокислоти проявляють властивост як кислот так амнв. Проте в ланцюз перетворень сильно вплива
наявнсть двох груп.
1. 
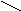

 Амнокислоти творюють сол з лугами. Сол a-амнокислот з тяжкими металами можуть мати комплексний характер. Таку будову мають наприклад нтенсивно син сол мд: CH2-NH2а O
CO
Амнокислоти творюють сол з лугами. Сол a-амнокислот з тяжкими металами можуть мати комплексний характер. Таку будову мають наприклад нтенсивно син сол мд: CH2-NH2а O
CO
 Cu
Cu
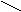

 CO
аO NH2-CH2
CO
аO NH2-CH2
2.Подбно до нших кислот амнокислоти творюють складн ефри, хлорангдриди, амди т. д.
3.Амнокислоти творюють сол з неорганчними кислотами наприклад(H3N+-CH2-COOH)-CL.Ц сол звичайно добре кристалзуються.
4.При дÿ азотисто
H2N-CH2COOHЧHNO2 оN2+H2O+HOCH2-COOH
Ефри амнокислот творюють при цьому досить стйк дазосполуки:
CH2-CH2-COOC2H5ЧHNO2---2H2OоN2CH-COOC2H5
Дазооцтовий (етиловий) ефр ма
наступну будову:
NºN+--CH-COOC2H5л-N=N+=CH-COOC2H5
Вн використову
ться при органчному синтез.
5.Амногрупа в амнокислотах легко ацлю
ться при дÿ ангдридв або галогенангдридв кислот:
CH2NH2 CH2-NH-COCH3
/ +(CH3CO)O2о / +CH3COOH
COOH COOH
6.При алкруванн амногрупи творюються вторинн, третинн амнокислоти та зрештою чотирьохзамсн амонйн луги. Внутршн сол таких лугв називають бетанами.
7. В залежност вд положення амногрупи по вдношенню до карбоксилу амнокислоти поводять себе порзному:
1) a-амнокислоти творюють дикетопперазини:


 CH3-CH-CO---OH CH3-HC-CO
CH3-CH-CO---OH CH3-HC-CO
 |
|

 H-NH+NHЧH о NH NH+2H2O
H-NH+NHЧH о NH NH+2H2O
 |
|
НOЧCO-CH-CH3 OC-CH-CH3
2) b-амнокислоти вдщеплюють амак дають амонйну сль ненасичено
CH2-CH-COOH
 а
а
а | о CH2=CH-CNH4
NH2 H
3)g-,d-амнокислоти ворюють при нагрванн внутршн амди -лактами:

 H2C CH2
H2C CH2
H2C CH2
H2C CH2
 |
 |
 |
 |
||||


 H2C COа -H2Oо H2C CO
H2C COа -H2Oо H2C CO
 |
HN---H OH NH
Цим корис
туються при визначенн будови амнокислот: визначають в якому положен знаходиться амногрупа вдносно карбоксильно
8. В реакцях замщення a-амнокислот, повязаних з змною до асимме-тричного атома карбону, частопроходить вальденвське обертання. Прикладом може бути вза
моперетворення d- та l-бромпропонових кислот та d- l-аланна по наступнй схем:
d-бромпропонова кислота---NH3оd-Аланн
н NOBr ¯а NOBr
l-Аланн мNH3- l-Бромпропонова кислота
нверся або збереження конфгурацÿ пд час реакцÿ замщення залежить вд механзма по якому дана реакця проходить.
9. В сучаснй хмÿ та бологÿ амнокислот та блкв важливу роль вдгра
реакця з змною кольору(змна забарвлення на син
).
Комплексони. Комплексонами називають групу a-амнокислот, що вмщують два або три залишки, звязаних з азотом. Найбльш простими з цих амнополкарбонових кислот
мнодиоцтова та нитрилтриоцтова кислоти:

 CH2-COOH CH2-COOHа нтрилтриоцтов
CH2-COOH CH2-COOHа нтрилтриоцтов

 H-N HOCO-CH2-N кислота
H-N HOCO-CH2-N кислота
CH2-COOH CH2-COONа
мнодиоцтова кислота
â&ãBy Shestopal Ruslan 1998
ТАБЛИЦЯ.L-амнокислоти знайден в блках
|
(CH3)2CH-CH2-CH-COOH | NH2 |
Leu |
|
|
(CH3)2CH-CH-COOH | NH2 |
al |
|
|
CH3-CH-COOH |а NH2 |
Ala |
|
|
H2N-CH2-COOH |
Gly |
|
|
CH3-CH2-CH-CH-COOH | | CH3 NH2 |
Ile |
|
|
-CH2-CH-COOH | NH2 |
Phe |
|
|
H2N-CO-CH2-CH-COOH | NH2 |
Asn |
|
|
H2NCOCH2CH2CH-COOH | NH2 |
Gin |
|
|
CH2-CH-COOH | NH NH2 |
Trp |
|
|
-COOH NH |
Pro |
|
|
HO-CH2-CH-COOH | NH2 |
Ser |
|
|
CH3-CH-CH-COOH | | OH NH2 |
Thr |
|
|
HO- -CH2-CH-COOH | NH2 |
Tyr |
|
|
HO -COOH NH |
Opr |
|
|
NH2 | NS-CH2-CH-COOH |
Cys |
|
|
NH2 | S-CH2-CH-COOH | S-CH2-CH-COOH | NH2а |
Cys-Cys |
|
|
CH3-S-CH2-CH-COOH | NH2 HOOC-CH2-CH-COOH | NH2 |
Met |
|
|
HOOC-CH2-CH2-CH-COOH | NH2 |
Glu |
|
|
H2N-CH2CH2CH2CH2CH-COOH | NH2
|
Lys |
|
|
H2N-C-NH-CH2CH2CH2-CH-COOH || | NH NH2 а |
Arg |
|
|
N -CH2-CH-COOH NH | NH2 |
His |
ЗВТЯЗКИ
мнокислоти здатн творювати ряд хмчних звязкв з рзними реакцйноздатними групами.
Пептидний звязок. Цей звязок утворю
ться в результат видлення води при вза
модÿ амногрупи одн㺿 амнокислот з карбоксильною ншо
онний звязок. При схожому значенн pH онзована амногрупа може вза
модяти з онзованою карбоксильною.в результат чого утворю
ться онний звязок. У водному розчин онн звязки значно слабкш ковалентних; вони можуть розриватися при змн pH середовища.
Дисульфдний звязок. Коли дв молекули цисте
Водневий звязок. Електропозитивн воднев атоми, сполучен з азотом чи киснем в групах -OH або -NH, намагаються загальнити електрони з наййближчими електронегативними атоиами кисню, наприклад з киснем в груп =СО. творений таким чином водневий звязок
слабим, але так звязки виникають досить часто сумарний вплив н на стабльнсть в молекул значний( наприклад структура шовку).
Босинтез амнокислот- це процес утворення амнокислот в органзм. Вн може здйснюватись клькома шляхами: прямим амнуванням ненасичених кислот, вдновним амнуваням кетокислотпереамвнування амнокислот зкетокислотами, завдяки реакцям за мсцем радикалв амнокислот(процеси ферментативного вза
моперетворення).
В органзм людини здйсню
ться синтез лише замнних проте
Оксалоцетат+Глутаматоспарагнова кислота+2-Оксоглутарат;
спарагнова кислота+NH3+АФоспарагн+H3PO4.
з 2-оксоглутарату творю
ться глутамнова кислота, глутамн, пролн, оксипролн. З промвжних продуктв обмну вуглеводв джерилом творення амнокислот
пруват, 3-фосфоглцерат рибозо-5*-фосфат.
ланн з прувату творю
ться двома шляхами: переамнуванням вдновним амнуванням.
з 3-фосфоглцерату синтезу
ться серин, з серину -глцин, з рибозо-5*-фосфату можливе творення гстидину. Важливим шляхом синтезу замнних амнокислот
процеси вза
моперетворень
Синтез незамнних амнокислот здйсню
ться в тканинах рослин бактеральних клтинах. В органзм людини цей процес не здйсню
ться, оскльки там не творюються кетокислоти, як могли б бути використан для
ВИКОРИСТАНА Л
ТЕРАТУРА:
1. Ф.Ф.Бо
чко, Л.О.Бо
чко.Основн Бохмчн поняття, визначення термни
2..А.Петров, Х.В. Бальян, А.Г. Трощенко. Органчна Хмя.
3. Н.Грн, У.Стаут, Д.Тейлор. Биология. Москва: Мир. 1996 рк.

